がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
465) 進行乳がんの代替医療(その5):イミキモド+α

①イミキモドはトル様受容体TLR7を刺激して未熟樹状細胞の成熟・活性化を促進する。②ピドチモドは樹状細胞の成熟とIL-12産生を促進して1型ヘルパーT細胞(Th1)を増やし、ナチュラルキラー細胞(NK細胞)を活性化する。③放射線治療や抗がん剤治療でがん細胞が死滅してがん抗原が放出されると樹状細胞に捕捉される。④腫瘍関連抗原を取込んで活性化した樹状細胞は、がん組織の周囲のリンパ節に移動し、そこでまだ抗原刺激を受けていないナイーブがん抗原特異T細胞を活性化する。⑤活性化した腫瘍抗原特異キラーT細胞(CTL)は増殖し、⑥がん抗原特異的にがん細胞を攻撃する。⑦骨髄由来抑制細胞(MDSC)や制御性T細胞(Treg)やプロスタグランジンE2(PGE2)やインターロイキン10(IL10)はキラーT細胞(CTL)を抑制している。⑧シクロオキシゲナーゼ-2(COX-2)阻害剤のセレコキシブと抗がん剤のシクロフォスファミドはMDSCとTregの作用やPGE2とIL10の産生を抑制することによってCTLの抗腫瘍活性を高める。
465) 進行乳がんの代替医療(その5):イミキモド+α
【イミキモドクリームで乳がんの皮膚転移が縮小する】
イミキモドクリームは外用(塗布)で、基底細胞がんや尖圭コンジローマなどの皮膚の腫瘍に対して高い縮小効果が示されています。 メラノーマや乳がんの皮膚転移に使用して効果を認めた症例報告があり、臨床試験が実施されています。以下のような報告があります。
Topical TLR7 agonist imiquimod can induce immune-mediated rejection of skin metastases in patients with breast cancer.(Toll様受容体TLR7のアゴニストのimiquimodの局所投与は乳がん患者の皮膚転移の免疫的排除を誘導する)Clin Cancer Res. 8(24): 6748–6757.2012年
【要旨】
研究の目的:乳がんの皮膚転移は治療が困難である。Toll様受容体の一種のTLR7のアゴニストのイミキモド(Imiquimod)は免疫応答修飾物質であり、原発性の皮膚がんに対して局所投与によって免疫的機序で縮小する効果が認められている。本研究では、イミキモドの局所投与が抗腫瘍免疫を活性化し、乳がんの皮膚転移を縮小できるかどうかを検討した。
方法:乳がんの皮膚転移部位にイミキモド・クリームを8週間(週5回)の塗布による治療を行い、前向き試験でその臨床効果(奏功率)を検討した。安全性と免疫学的変化についても検討した。
結果:10例の乳がん患者を対象に臨床試験を行った。免疫調整作用によるグレード1~2の一過性の皮膚症状および全身症状による副作用を認めたのみで大きな副作用は認めず、安全に8週間の治療が終了した。 2例において部分奏功を認めた。皮膚転移が縮小した症例では、組織学的に腫瘍組織内へのリンパ球浸潤やサイトカインの産生に変化を認めた。
結論:乳がんの皮膚転移や胸壁浸潤に対してイミキモドの局所投与は安全で有効な治療手段となりうる。イミキモドは乳がん組織内において免疫的排除が起こりやすい環境に誘導する。 我々の研究グループで行った前臨床研究では、放射線治療とイミキモドを併用すると相乗的な抗腫瘍効果を認めている。この組合せが抗腫瘍免疫の増強や臨床効果を高めるかどうかの臨床試験が進行中である。
この研究では、寝る前に皮膚100cm2当たり250mgのクリームを薄く延ばして塗布し、起床時に洗っています。 イミキモドクリームの投与の前後でがん組織の生検を行い、病理検査でがん組織内の免疫細胞の状況を検討し、腫瘍組織にリンパ球の浸潤が増えると、がんが縮小することが示されています。
【乳がん皮膚転移の放射線治療とイミキモドの相乗効果】
乳がんの放射線治療にイミキモドクリームの塗布を併用すると抗腫瘍免疫を高めることができます。以下のような報告があります。
The TLR7 agonist imiquimod as an adjuvant for radiotherapy-elicited in situ vaccination against breast cancer.(乳がんに対する放射線治療誘発性の局所ワクチン療法の補助療法としてのトル様受容体7のアゴニストのイミキモド)Oncoimmunology. 2013 Oct 1;2(10):e25997. Epub 2013 Sep 24.
【要旨】
放射線治療は、がん細胞を死滅させることによって照射局所におけるがんワクチンと同様の効果が期待できる。しかしながら、自然免疫や獲得免疫を十分に活性化する免疫応答を得られないことも多い。局所投与のイミキモドは表在性の皮膚がんに対する有効性が証明されている強力な炎症誘発性物質である。放射線治療とイミキモドの2つの治療法は相乗的に作用して局所および全身の腫瘍の制御に有用であることが示唆される。
米国のニューヨーク医科大学の病理学と放射線腫瘍学とがん研究所の研究グループからの報告です。短い総説論文なので、本文の内容を抜粋(ほぼ全て)して紹介します。
【本文】
進行した乳がんは全身に多数の転移を形成する。乳がんの皮膚転移自体は乳がん患者の死亡原因になることはないが、生活の質を著しく悪化させるので、有効な治療法が求められている。
皮膚転移は目で見えるため、局所に適用した治療薬の効果を簡単に評価できる。
乳がんの皮膚転移に対する局所療法として放射線治療が行われる。放射線照射はがん細胞のDNAに傷害を与えることによって分裂中の細胞を死滅させる。
しかしながら、放射線照射は直接的な細胞死誘導作用だけでなく、免疫学的な抗腫瘍効果を示すことが多くの研究で明らかになっている。そのため、放射線治療の主要な目標をがん細胞を局所のがんワクチンに変換するというアイデアが成り立つ。
免疫原性細胞死を誘導することによって、放射線照射は樹状細胞を活性化し、がん抗原特異的なCD8+キラーTリンパ球を活性化することによって獲得免疫を誘導する。
がん抗原に応答するキラーT細胞はサイトカインの働きで照射部位に集積し、生き残ったがん細胞を認識して排除する。
このような放射線照射によって誘導されるがん抗原特異的なT細胞が、放射線治療による腫瘍制御にどの程度の効果があるかは不明である。
しかしながら、通常の多くのがんワクチンと同様に、放射線照射によるがんワクチンの抗腫瘍効果は、全身の腫瘍制御を達成できるほど十分な効果が得られることは少ない。
ワクチンによって誘導された免疫応答を増強する最も有効な方法は、効果の高い免疫増強剤(アジュバント)を見つけることである。
トル様受容体(Toll-like receptors)は、危険を察知するセンサーのようなものであり、様々な病原体由来のリガンドあるいは内因性リガンドによる刺激に応答して、自然免疫を活性化し、さらに獲得免疫を誘導する。
したがって、トル様受容体の合成アゴニストが免疫増強剤(アジュバント)として盛んに研究されている。 トル様受容体7のアゴニストであるイミキモドは、多くの皮膚腫瘍の治療に塗布薬として使われている。 乳がんの皮膚転移や胸壁に浸潤した再発乳がんの治療にも使用されている。
我々は以前の研究にて、イミキモドの局所投与を併用することによって、腫瘍関連抗原を投与する免疫療法の免疫応答を増強することを確認している。
さらに最近の研究では、イミキモドの単独の投与が、がん組織の微小環境における免疫学的な性状を変化させることによって抗腫瘍効果を示し、乳がんの皮膚転移の患者の20%において部分奏功を示したことを報告している。
皮膚に乳がん細胞を移植するマウスの動物実験のモデルで、局所の放射線照射とイミキモドの併用によって抗腫瘍免疫が増強することを示した。
マウスの乳がんを用いた実験で、イミキモドの局所投与は抗腫瘍効果を示し、プラセボ群に比べて腫瘍の増殖を抑制した。
イミキモドを投与した乳がん患者では、この免疫療法で腫瘍増殖の抑制を認めたがん組織ではTリンパ球と樹状細胞の増加を認めた。
同様に、マウスの実験でも、イミキモドの投与によって腫瘍組織内に集積したT細胞と樹状細胞の数が増えた。
マウスの実験では、局所の放射線照射を受けたがん組織の部分にイミキモドを局所投与すると、多くのマウスにおいて完全な腫瘍の消失を認めた。一方、放射線照射のみの場合は、腫瘍増大の遅延は認めたが、腫瘍の完全な消滅は認めなかった。 放射線照射とイミキモドの局所投与の併用治療を受けたマウスでは、腫瘍組織の周囲のリンパ節において、抗原刺激に応答してインターフェロンγを産生する腫瘍抗原特異的なエフェクターCD8+T細胞が検出された。
このように、イミキモドと放射線治療は相乗的な抗腫瘍効果を発揮し、局所再発の腫瘍の制御に有効性が認められた。
乳がんの切除後の皮膚転移は、手術創の瘢痕部に沿って多発性の結節として認められることが多く、さらに胸壁や背中や腹部や腕の方まで浸潤性に広がっていく。 多発する皮膚転移の一カ所(この部位がワクチン部位になる)に放射線照射とイミキモド投与を行うと放射線照射をしていない転移巣にも抗腫瘍効果を示すという遠隔効果(abscopal effect)が得られるかどうかを検討するために、マウスを使った実験を行った。
すなわち、マウスの皮下の2カ所に乳がん細胞を移植し、腫瘍が触知できる大きさに成った時点で、一つの腫瘍にのみイミキモド投与と放射線照射を行った。
予想通りに遠隔効果を認め、放射線照射を行わなかった腫瘍も顕著な縮小を認めた。
イミキモドは腫瘍細胞のMHCクラスI抗原とICAM1の発現を亢進し、抗腫瘍免疫を増強し、照射していない腫瘍組織を排除した。
我々は現在、これらの動物実験や臨床経験の結果を検証する目的で、皮膚転移のある乳がん患者を対象に、放射線治療とイミキモドの併用療法を第I/II相臨床試験で検討している。 この臨床試験では、皮膚転移の限られた部分にのみ放射線照射を受け、イミキモドの局所投与を行った。 この併用療法の実施可能性を評価し、照射した部分と照射していない部分の皮膚転移と、遠隔転移の部分の腫瘍の縮小について検討している。
さらに、腫瘍組織の免疫細胞だけでなく、血中のリンパ球やサイトカインの検討も行っている。
注目すべき点は、マウスの移植腫瘍のモデルでイミキモドは強力な炎症促進活性を有するので、インターロイキン-10を主体とする免疫抑制系のフィードバックが作動して、抗腫瘍性のTリンパ球の応答を顕著に抑制するメカニズムが作動する。
IL-10の作用を阻止するモノクローナル抗体の使用や、免疫調整作用を示す量のシクロフォスファミドの単回投与はIL-10の作用を抑制することによって、抗腫瘍性に働くT細胞の免疫応答を維持できる。
しかし、今までの臨床例での検討ではIL-10の血中濃度の上昇は認められていないので、イミキモドを投与された患者におけるIL-10の正確な役割についてはまだ不明である。
現在進行中の臨床試験の結果が、イミキモドと放射線治療の併用の臨床的有用性を明らかにしてくると思われ、さらに、この併用療法の効果を高める追加の治療法が明らかになる可能性がある。
最も重要な点は、遠隔転移の腫瘍の応答を観察することによって、この免疫治療が全身の抗腫瘍免疫を誘導し、局所の腫瘍の制御だけでなく、患者の生存期間の延長にもつながるかもしれない。
がんの放射線治療を行うと放射線を照射していないがん組織も縮小することがあります。 これをアブスコパル効果(abscopal effect)と言います。遠隔効果や遠達作用などと日本語訳されています。
従来、放射線照射の抗腫瘍効果は、細胞分裂中のがん細胞のDNAにダメージを与えてがん細胞を死滅させる局所的な作用のみと考えられていました。
しかし、最近の研究で、放射線治療が全身の抗腫瘍免疫の活性化の引き金になりうることが明らかになっています。 局所のがん組織を放射線で照射して、がん細胞が死滅すると、がん抗原が放出されてがん抗原特異的な抗腫瘍免疫が誘導され、照射した部位以外の腫瘍が縮小することが示されています。(447話参照)
イミキモド(Imiquimod)は合成イミダノキノリン(imidazoquinoline)で、樹状細胞やマクロファージなどに発現しているトル様受容体7(Toll-like receptor 7:TLR7)にリガンドとして直接結合し、シグナルを伝えることによって、I型インターフェロンを誘導し自然免疫を活性化します。未熟な樹状細胞を成熟させ活性化する作用があります。
欧米では塗布薬(5% imiquimodクリーム)として販売され、基底細胞がんや尖圭コンジローマに対して使用され、さらに日光角化症、ボーエン病など表在性の皮膚悪性腫瘍でも有効性が認められています。(451話参照)
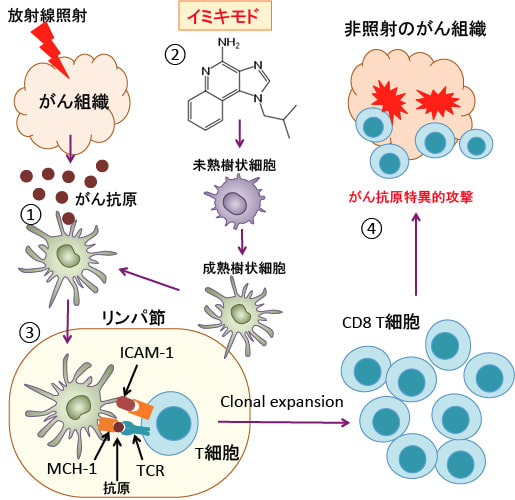
図: ①放射線照射によってがん組織からがん抗原(腫瘍関連抗原)が放出され、そのがん抗原は樹状細胞に捕捉される。②イミキモドは樹状細胞を成熟させ、がん組織内に誘導し集積させる作用がある。③腫瘍関連抗原を取込んで活性化した樹状細胞は、がん組織の周囲のリンパ節に移動し、そこでまだ抗原刺激を受けていないナイーブがん抗原特異T細胞を活性化する。④活性化した腫瘍抗原特異T細胞は増殖し、放射線照射されたがん組織の他に、照射を受けていない腫瘍組織にも移動し、がん抗原特異的にがん細胞を攻撃する。イミキモドおよび放射線照射はがん細胞の表面のMHCクラスI分子とintercellular adhesion molecule 1 (ICAM1)の発現を亢進し、細胞傷害性T細胞の細胞傷害活性は、MHCクラスI分子とICAM1の発現が亢進しているがん細胞に対して、細胞傷害活性を強く示す。このように、放射線照射とトル様受容体7のアゴニストのイミキモドは相乗的に作用して、がん細胞を局所のがんワクチンに変える作用がある。
【低用量シクロフォスファミドやCOX-2阻害剤は抗腫瘍免疫を増強する】
前述の論文で「IL-10の作用を阻止するモノクローナル抗体の使用や、免疫調整作用を示す量のシクロフォスファミドの単回投与はIL-10の作用を抑制することによって、抗腫瘍性に働くT細胞の免疫応答を維持できる」という記述があります。
がん細胞に対する免疫応答を強めると、その免疫応答を抑制するメカニズムが作用するので、通常は免疫療法はあまり効果が出ないと言うことになっています。そこで、免疫を抑制する方法が重要になってきます。
放射線治療とイミキモドの効果を低用量のシクロフォスファミドが増強するという報告があります。次のような論文があります。
Synergy of topical toll-like receptor 7 agonist with radiation and low-dose cyclophosphamide in a mouse model of cutaneous breast cancer.(皮膚の乳がんのマウスの実験系におけるToll様受容体7のアゴニストの局所投与と放射線治療と低用量シクロフォスファミドの相乗効果)Clin CancerRes. 18(24):6668-78. 2012年
【要旨】
研究の目的:、マウスの皮膚浸潤の乳がんの実験モデルを用いて、Toll様受容体(TLR)7のアゴニストのイミキモド(imiquimod)が抗腫瘍免疫を増強し、他の治療法の抗腫瘍効果を高めるかどうかを検討した。
実験法:TSA系統のマウスの乳がん細胞を、同系マウスの皮下に注入した。5%イミキモド・クリームまたは偽薬クリームを腫瘍の上の毛を剃った皮膚に週3回塗布した。
別の実験では、腫瘍部への放射線照射(8Gy, 3日間)、あるいはシクロフォスファミド投与(2mgの腹腔内投与)を行った。腫瘍の増殖とマウスの生存期間を指標に効果を評価した。
結果:イミキモドの局所投与は腫瘍の増殖を有意に抑制した。腫瘍組織にはCD11c(+)細胞、 CD4(+)細胞、 CD8(+) 細胞が多く集積していた。CD8(+)細胞を除去する処置によりイミキモドの抗腫瘍効果は消失した。
放射線照射とイミキモド投与を併用すると、それぞれを単独で行った場合に比べて顕著な腫瘍縮小効果を認め、腫瘍の完全消滅率は11%~66%であった。放射線照射した部分の外への2次的な腫瘍の増殖もイミキモドは抑制した。イミキモドと放射線照射の前に低用量のシクロフォスファミドを投与すると、腫瘍縮小効果が増強し、再発率も減少した。
腫瘍が消失したマウスに再度TSA乳がん細胞を移植すると、その腫瘍は拒絶され、長期に及ぶ免疫的記憶が成立していることが示された。
結論:イミキモドの局所投与は放射線照射と相乗的に腫瘍の増大を抑制した。シクロフォスファミドの投与はさらに腫瘍縮小効果を増強し、腫瘍を拒絶する免疫的記憶を成立させた。これらの結果から、これらの3つの治療法の組合せは、乳がんの皮膚転移に治療手段として有望であることが示唆された。
この実験で使用している8Gy3日間の照射では腫瘍の完全消滅は見られませんが、イミキモド投与を併用すると11~66%のマウスで腫瘍の完全消滅を認めています。11~66%という違いは実験系によるばらつきですが、長期にイミキモドを投与すると腫瘍の完全消滅の率が高くなるようです。
シクロオキシゲナーゼ-2(COX-2)阻害剤のcelecoxib(商品名:セレコックス)も、免疫抑制性に作用するプロスタグランジンE2(PGE2)やIL10の産生抑制などのメカニズムで抗腫瘍免疫を高めます。
IL-10とPGE2は抗腫瘍免疫を抑制します。Celecoxibはマクロファージなどの炎症細胞からのIL10とPGE2の両方の産生を抑制する作用があります。
従って、放射線照射とイミキモドを使った治療にcelecoxibを追加すると抗腫瘍免疫を増強できます。さらに、樹状細胞の成熟を促進するピドチモドを併用すると、抗腫瘍免疫をさらに増強できます。(452話参照)
【イミキモドは皮膚からの投与の方が効果が高い】
以下のような論文があります。
Topical rather than intradermal application of the TLR7 ligand imiquimod leads to human dermal dendritic cell maturation and CD8+ T-cell cross-priming.(TLR7リガンドのイミキモドは皮内投与より局所投与の方が、ヒト皮膚樹状細胞の成熟とCD8陽性T細胞の活性化を誘導する)Eur J Immunol. 44(8):2415-24.2014年
【要旨】
Toll様受容体(TLR)のリガンドは樹状細胞の活性化を介して免疫応答を刺激する作用を持つので、がんワクチン療法の補助療法として注目されている。
ヒトの皮膚には樹状細胞の密なネットワークが存在するので、がんワクチンを皮内に投与すると樹状細胞に容易に取り込ませることができる。したがって、皮膚はがんワクチンの投与部位として活発に研究されている。
本研究では、ヒトの皮膚外移植モデル(human skin explant model)を用いて、複雑な微小環境における樹状細胞活性化に対するアジュバント(補強剤)としてのTLRリガンドの可能性を検討した。
実験の結果、TLR7/8リガンドのR848やイミキモドの溶解液を皮内に注射で投与するよりも、TLR7リガンドのイミキモドを5%の割合で含有するAldaraスキンクリームを外用(塗布)で投与する方が、樹状細胞の移動を顕著に亢進した。さらに、Aldaraで活性化された樹状細胞はT細胞の活性化に必要な分子(CD86, CD83, CD40, and CD70)の発現レベルが最も高かった。皮膚の生検でAldaraの局所塗布投与は皮膚の炎症性サイトカインの産生が最も高かった。
ペプチド抗原の皮内投与によるワクチン療法と併用すると、Aldaraで活性化された樹状細胞はメラノーマ抗原のMART-1の抗原提示を促進し、MART-1特異的なCD8陽性T細胞の活性化を亢進した。
以上の結果から、がんワクチンとAldaraの局所塗布投与の併用は有用であることが示された。
イミキモドクリームを皮膚に外用塗布すると、肺組織の免疫活性が増強することが報告されています。
皮膚転移だけでなく、他の部位に転移がある場合でも、抗がん剤治療や放射線治療を行うときにイミキモドクリーム、ピドチモド、セレコックス、シクロフォスファミドなどを併用すると抗腫瘍効果を高めることができます。
この治療法は乳がん以外のがんにも有効です。
★ トリプル・ネガティブ乳がんで死なないためには、治療の早い段階から、エビデンスに基づいた補完・代替医療を利用することが重要です。トリプル・ネガティブ乳がんの補完代替医療については以下のサイトでまとめています。
http://www.f-gtc.or.jp/TNBC/Triple_Negative_Breast_Cancer.html
| « 464)進行乳が... | 466)加工肉と... » |






