がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
714)NAD前駆体補充療法(その2):メトホルミンとレスベラトロールとの相乗効果
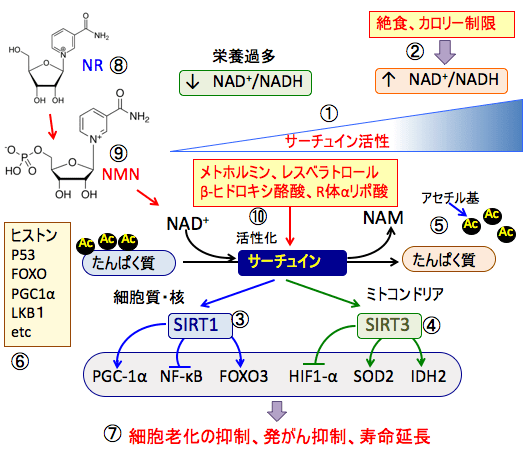
図:サーチュインはNAD+/NADHの比率の変動を感知することによって、細胞内の栄養素の供給状況や物質代謝の状況を把握している(①)。絶食やカロリー制限などによって栄養素、特に糖が減少すると、NAD+が増え、サーチュイン(SIRT)が活性化する(②)。サーチュインは細胞質や核に存在するSIRT1(③)やミトコンドリアに存在するSIRT3(④)など7種類が知られている。サーチュインはタンパク質の脱アセチル化(アセチル基を除去する)によって様々な転写因子や酵素などの活性を調整する(⑤)。サーチュインによって機能や活性が制御されているタンパク質としてヒストン、P53、FOXO、PGC1α、LKB1などがあり、細胞周期、代謝、抗酸化システム、オートファジーなどの細胞機能に影響する(⑥)。その結果、細胞老化や発がんを抑制し、寿命を延長する効果を発揮する(⑦)。ニコチンアミド・アデニン・ジヌクレオチド(NAD+)の前駆物質のニコチンアミド・リボシド(NR ⑧)やニコチンアミド・モノヌクレオチド(NMN ⑨)をサプリメントとして補充すると体内のNAD+を増やすことができる。メトホルミン、レスベラトロール、ケトン体のβ-ヒドロキシ酪酸、R体αリポ酸はサーチュインを活性化する。これらを組み合わせる老化を遅らせ、寿命を延ばす効果が期待できる。
714)NAD前駆体補充療法(その2):メトホルミンとレスベラトロールとの相乗効果
【寿命は人為的に延ばせるが、限界がある】
人間が生まれてから死ぬまでの時間を寿命と言います。
その長さには非常に個人差がありますが、不慮の事故やがんなどの生命に関わる病気に罹らなければ、現在の日本では80歳以上の寿命が期待できる状況です。
2018年の日本人の平均寿命は女性が87.32歳で、男性が81.25歳というデータが発表されています。
個体の寿命は生活環境や病気などによって影響を受けます。自然界に生活する生物は,他の生物に捕食されたり、感染症や怪我によって生命を奪われることがあります。このように、その生物が実際に生活している場で見られる寿命を生態的寿命といいます。
一方、条件を整えてやった場合に実現する寿命を生理的寿命といいます。天寿を全うして老衰によって死亡する場合の寿命です。生理的寿命は最大寿命や限界寿命とも言います。
動物園の動物の寿命が長いのは、生活環境や餌や医療によって、寿命を延ばす条件が整っているためです。生態的寿命の平均が5年くらいの動物でも、条件を良くすれば、20年以上生きることもできます。
人間も、開発途上国よりも先進国の方が寿命が長いのは、豊富な食糧や衛生的な生活環境や進歩した医療の恩恵によるものと思われます。
過去1世紀において、工業先進国では経済の発展に伴い、医療の進歩と、栄養状態や生活環境や公衆衛生の改善によって寿命は顕著に延長しました。
このように寿命は人為的にある程度は延ばすことができます。しかし、諸々の理由で寿命には限界があると考えられています。
細胞には分裂の回数に限界を設けるテロメアが存在します。
染色体DNAの末端部分にはTTAGGGという配列が多数繰り返された構造がみつかりテロメアと名付けられました。この6塩基のリピート部分には遺伝情報が入っていないので、なくなっても遺伝子の発現には問題ない部分です。
しかし、テロメアが無くなると細胞はDNAの複製ができなくなります。
DNAは2本の鎖状で、それぞれの鎖を鋳型にして新しいDNA鎖を合成します。新しい鎖を作るとき、DNAポリメラーゼという酵素が鋳型のDNA上を移動しながら、新生DNAを作ります。
この酵素が鋳型のDNAに結合するためには、まずプライマーとよばれるRNAが鋳型のDNAの末端に結合する必要があります。
DNAポリメラーゼはRNAプライマーに結合し、そこから新生DNAの合成を開始します。その際、プライマーが結合した鋳型DNAの末端部は複製されません。そのため、細胞分裂でDNAを複製するたびに、染色体のDNA末端は少しづつ切れて短くなっていきます。
短くなっても問題ないように、最初から遺伝情報とは関係なく必要のないDNA配列(TTAGGGの繰り返し配列)がテロメアとして存在しているのです。しかし、テロメアの長さに限界があるので、いずれはテロメアが無くなると、もはや細胞分裂ができなくなります。

図:染色体の末端にはテロメアという構造があり(①)、この部分のDNAはTTAGGGという配列が多数繰り返されている(②)。細胞分裂するたびに、このテロメア部分のDNAは短くなり(③)、テロメアが無くなった時点で、細胞はそれ以上に分裂することができなくなる(④)。
テロメアの長さには限りがあるのでやがて使い尽くされると、細胞老化のシグナルが発動してしまいます。
ヒトの細胞の分裂回数は約50回が限界と言われています。
1960年代にアメリカの生物学者レオナルド・ヘイフリック(Leonard Hayflick)は、培養した正常の細胞には寿命があることを発見しました。
人間の胎児から取り出した線維芽細胞を培養すると次第に分裂の速度が落ちて、約50回の分裂回数が限界で、いくら栄養物質や増殖を促進する物質を加えても分裂することはできずに最後は死んでしまいます。
一方、成人の人間から取り出した線維芽細胞の分裂できる回数はその年齢に応じて減少していることも明らかになっています。すなわち、細胞の中には細胞の分裂した回数をきちんと数える装置があって、ある回数を過ぎると細胞は死を向かえるプログラムが働き出すのです。
このように、正常な細胞が分裂できる回数には限界があることを「ヘイフリックの限界(Hayflick Limit)」と言います。ヒトの正常細胞の分裂回数は約50回が限界ということで、それ以上は分裂できないので、寿命があるということになります。
つまり、テロメアとは「命の回数券」のようなものであり、分裂する度に回数券を一枚づつちぎって使い、やがて使い切ってしまうと細胞の寿命がくるというわけです。
体の新陳代謝のためには細胞の若返りが必要ですが、それが次第にできなくなることが老化の原因となるのです。
ちなみに生殖細胞や幹細胞(骨髄細胞や消化管粘膜上皮細胞のように細胞回転が早い細胞を供給している細胞)やがん細胞のように無限に分裂できる細胞もありますが、これはテロメアを延ばすことができるテロメラーゼという酵素が働いて、テロメアの長さを維持しているからです。普通の細胞にはテロメラーゼ活性はほとんどありません。

図:ヘイフリックの実験。赤ん坊や成人や老人の皮膚から線維芽細胞を採取してシャーレで培養すると、年齢が若い個体から採取した細胞ほど多く分裂できる。赤ん坊の細胞の方が老人より多く分裂できるが、赤ん坊の細胞もやがて細胞分裂を停止して死滅する。細胞の分裂回数はヒトの場合は約50回が限界で、これ以上は分裂できない。これをヘイフリック限界という。
酸素呼吸をすることにより発生する活性酸素が遺伝子や脂質や蛋白質を酸化し、がんや動脈硬化の原因となります。
老化を促進する要因として「老化のフリーラジカル説」あるいは「障害蓄積説」というのがあります。1956年、デナム・ハーマン(Denham Harman)が生体内で生じる活性酸素などのフリーラジカルが老化に関与するという考えを提唱しています。
フリーラジカルは他の原子や分子と反応して、相手から電子を奪い取り、相手の物質を酸化する力が強い分子です。DNA・蛋白質・脂質など細胞を構成する成分の活性酸素による障害の蓄積が老化を促進する原因として重要であるというのが「老化のフリーラジカル説(エラー蓄積説)」です。
認知症の原因である脳細胞の変性疾患(アルツハイマー病など)の発病には、活性酸素による神経細胞の障害が重要な役割を果たしています。私達の脳は高度不飽和脂肪酸を多く含み、非常に酸化されやすい組織です。
老化した動物の脳を潰してみると、老化のパラメーターになる過酸化脂質の量が増加している、つまり活性酸素による酸化が進んでいることが知られています。
多くの成人病や老化性疾患の原因にフリーラジカルの害が存在します。がん・心筋梗塞・脳血管疾患は日本人の3大死因といわれ、死亡原因の3分の2以上を占めていますが、いずれもフリーラジカルの害が関連しています。
フリーラジカルを消去する体内の防御機能は歳とともに低下し、がん年令といわれる40歳台にはピーク時(20歳前後)の半分以下に減っているといわれています。生体成分の酸化障害が進行すると免疫組織を初めとする多くの臓器や組織の働きが悪くなり、血液循環が低下すると新陳代謝も低下して、ますます病気をおこしやすい体になります。
フリーラジカルの害を抑えることができれば、老化のスピードを遅くして、いろんな病気の発生を防ぐことができることが明らかになってきました。
つまり、寿命はある程度は人為的に延ばすことができますが、年令とともに老化が進み、がんや心臓病などの病気に罹らなくても、多くは90~100歳で老衰によって亡くなる運命にあります。
【人類は老化を抑え寿命を延ばすことを夢見てきた】
不老長寿は、人類永遠の願望であり見果てぬ夢です。
人類が不老不死の望みを抱いた一つの現れとして、古代中国では神仙思想という民間信仰が発達しました。東洋の歴史の中には「仙人」と呼ばれるような人たちが現れます。山奥に住み、白髪白髯で、霞を食べて生きている不老不死の超越者、といったイメージで表現されています。
神仙思想は、仙人のように不老不死になりたいという現世利益の実現を追求する点が多くの民衆にも受け入れられ、二千年以上前の中国の戦国時代末期から秦・漢代にかけて広まりました。
紀元前217年に中国を始めて統一した秦の始皇帝も、不老不死の薬(仙薬)を求めて奔走した一人です。始皇帝の命を受けた徐福が、数千人をつれて不老不死の仙薬を求めて航海に出たという話しが『史記』や『漢書』に記載されています。
始皇帝は49歳で死亡していますが、皮肉にも仙薬として飲んでいた水銀の中毒だったと言われています。
西洋でも16〜18世紀には錬金術師が不老不死の秘薬を盛んに作っていました。
近代医学においても、老化を抑える研究は極めて重要な位置を占めています。
老化というのは生命を脅かす多くの病気の最大のリスク要因だからです。
このような老化関連の疾患の患者数は今後20年間で2倍になるとWHOは推定しています。
老化過程を遅くできる薬や方法は、一般の人々のみならず、科学者や医療関係者も多くの興味を持っています。
「健康寿命や寿命を延長する」という効果が少なくとも3種類以上の種(線虫、ショウジョウバエ、マウス、サルなど)で確認され、少なくとも3カ所以上の研究グループで確認されているという基準を満たす抗加齢法として、断食、カロリー制限、運動、スペルミジン、メトホルミン、レスベラトロール、ラパマイシンなどが報告されています。
これらの分子メカニズムとして、遺伝子発現のエピジェネシス制御(ヒストンのアセチル化やメチル化)、インスリン/TOR経路、Rasシグナル伝達系、ミトコンドリア機能、たんぱく質恒常性、オートファジー、ストレス抵抗性などが指摘されています。
近代医学は、老化のメカニズムを明らかにし、抗加齢医療の実現を目指しています。
つまり、古代から続く不老不死の願いをかなえるために医学や医療を発展させているといっても過言ではないと言えます。
【断食すると寿命が延びる】
栄養障害を引き起こさない間歇的な断食が寿命を延ばすことが多くの動物実験で証明されています。
そのメカニズムは極めて複雑で専門的になりますが、生物が「飢餓によって寿命が延びる」ようなメカニズムを進化の過程で獲得したであろうことは容易に理解できます。このメカニズムを獲得したものが過酷な環境において淘汰に生き残ったと考えられるからです。
全ての生物において、最も優先されるのは種の保存と繁栄です。この種の繁栄に有利な性質が進化の過程で淘汰を生き残ることになります。食糧が乏しくなるとすぐ死ぬような生き物は進化の過程で簡単に淘汰されます。栄養やエネルギーの不足に対して抵抗性を持つようなメカニズムを獲得したものが生き残ります。
食糧が乏しい時には、栄養飢餓に対する抵抗性を高め、代謝を抑制して寿命を延ばし、食糧が十分に入手できるようになったときに生殖活動が行えるように、食糧が乏しい条件(カロリー摂取が不足するとき)では寿命を延ばすメカニズムやストレスに対する抵抗性を高めるメカニズムが進化したと言えます。
例えば、栄養飢餓時にFOXO(Forkhead box O)という転写因子が活性化されます。
FOXOはストレス応答、代謝制御、細胞周期、アポトーシス、DNA修復などに関連する多くの遺伝子の発現誘導を促し、様々なストレスに対する抵抗性を高めます。つまり、FOXOは酸化ストレスや飢餓ストレスに対する抵抗力を高める作用があり、栄養飢餓を乗り越えるために進化の過程で獲得したメカニズムです。
FOXOの転写因子活性は、成長ホルモン/インスリン/インスリン様成長因子-1(IGF-1)のシグナル伝達系によって抑制されます。絶食はこの成長ホルモン/インスリン/IGF-1シグナル伝達系を抑制し、FOXOの転写因子活性を高めることによって、ストレスに対する抵抗性を高めます。
食糧が少なくなったとき単に寿命を延ばすだけでなく、食糧が得られるとき生殖活動を再開することが目的であるため、若々しく保つ(老化を抑制する)ことも重要です。すなわち、間歇的な断食は寿命を延ばすだけでなく、体を若々しくする効果もあることになります。
一般的に多くの生物において食糧が絶えず不足ない状態というのは、近代の人類以外にはあり得ません。人類は1万年前に農耕を始めることによって、食物を安定的に手に入れることができるようになりました。
しかし、気候の変化によっては飢饉を経験します。人類が飢饉を経験しなくなるのは、産業革命後に、農業の機械化によって農産物の生産性が向上し、食物の貯蔵技術の進歩によって長期間の食物の貯蔵が可能になったからです。
食物の豊富な熱帯地方の森林に住んでいれば、食物は豊富に入手できますが、多くの生物は食糧が十分に入手できなくなるリスクの中で生きてきました。
このような状況で、食物の摂取が少なくなったときに種を保存するためにはどうすれば良いか、食事が不十分なときには、生殖を先延ばしするために寿命を伸ばす方法が生体内で進化したということです。食物が入手できるようになったときに生殖を開始します。
したがって、カロリーが十分取れないときは、寿命を伸ばすと同時に老化を抑制して、若々しい状態を保つ必要があるのです。これが、栄養不足を引き起こさないで間歇的な断食を行うと、寿命が延び、老化を遅らせることができる理由です。
【カロリー制限で寿命が延びる】
食事を自由に摂取させた場合の摂取カロリー、あるいは通常の食生活で摂取されている摂取カロリーを基準にして、その摂取カロリーより30〜40%程度少ないカロリーを摂取する食事を「カロリー制限食」と言います。
タンパク質や必須脂肪酸やビタミンやミネラルの不足などの栄養失調を起こさずに、食事からの摂取カロリーを30~40%程度減らすと、老化速度が遅くなり、寿命が延びることが、酵母、線虫、昆虫、魚、げっ歯類、霊長類(アカゲザル)など多くの生物で確認されています。
マウスやアカゲザルの場合は寿命が30〜40%程度延びるくらいの顕著な効果が報告されていますが、人間ではそのような顕著な寿命延長効果が得られる可能性は低く、せいぜい10%までと言われています。
人間は医学の進歩や生活環境の改善によって、この50年の間に平均寿命が50歳代から80歳代まで延びており、寿命が延びる余地があまり無いというのが一つの理由です。寿命の延びは少ないのですが、体を若い状態に維持する効果はかなり期待できると言われています。つまり、カロリー制限は健康寿命を延ばす効果が高いと言えます。
カロリー制限で寿命が延びることが最初に報告されたのは、1935年のことです。ラットに与えるエサのカロリーを30%減らすと寿命が40%延びたという結果が報告されています。
霊長類では、米国のウィスコンシン大学の実験で、成体から開始した30%のカロリー制限ががんの発生率や死亡率を約半分に減らすことが報告されています。この研究では、7~14歳のアカゲザルを、食事摂取量を70%に制限した「カロリー制限群」と食事を制限なく自由に摂取させる「コントロール群」の2群に無作為に分けて20年間観察しています。
アカゲザルの寿命は25~30歳程度で,最長でも40歳程度と考えられています。2009年の段階で、コントロール群の生存率は50%であったのに対して、カロリー制限食群では80%が生存していました。さらに、カロリー制限食群では、糖尿病やがん、心臓血管系の疾患、脳の萎縮などの老化性疾患の発生率が3分の1程度に低下していたことが報告され、カロリー制限が老化を遅くするという結論が出されています。(Science 325:201-204, 2009年)
このカロリー制限のときに活性化されて寿命延長と抗老化作用に関与するのがサーチュイン遺伝子です。つまり、サーチュイン遺伝子が活性化されると老化が抑制されることになります。
サーチュイン(sirtuin)は長寿遺伝子として、酵母からヒトまで進化的によく保存された遺伝子であり、ヒトでは 7 個のサーチュイン遺伝子およびタンパク質(Sirt1〜Sirt7)が同定されています。
これらのサーチュインは NAD(nicotinamide adenine dinucleotide)依存性の脱アセチル化酵素としての活性をもっています。
ニコチンアミド・アデニン・ジヌクレオチド(NAD+) は酸化還元反応をになうさまざまな酵素の補酵素としてよく知られています。
生体内での NADの合成経路における中間体である ニコチンアミド・リボシド(NR)やニコチンアミド・モノヌクレオチド(NMN)をサプリメントで補うと、体内のNAD+の量を増やし、がサーチュイン群を活性化することにより、糖尿病などの老化関連疾患の病態を軽減するとともに、老化遅延や寿命延長にも関与しているらしいということが明らかになっています。(713話参照)
【サーチュイン1はPGC-1αを活性化してミトコンドリア新生を亢進する】
サーチュインによるNAD+からニコチンアミド(nicotinamide:NAM)への分解反応は、それと共役するサーチュインによるリシン残基脱アセチル化反応を促進することで、健康や長寿に関わるさまざまな生命現象に関与していることが注目されています。
サーチュイン(サーチュインファミリー)は食物不足(飢餓状態)の時に活性化される遺伝子群で、NAD依存性脱アセチル化酵素です。哺乳類では七つのサーチュイン(SIRT1~7)が存在し、SIRT1、 6、7は核内、SIRT3、4、5はミトコンドリア、SIRT2は細胞質に局在します。

図:サーチュインはNAD+/NADHの比率の変動を感知することによって、細胞内の栄養素の供給状況や物質代謝の状況を把握している(①)。絶食やカロリー制限などによって栄養素、特に糖が減少すると、NAD+が増え、サーチュイン(SIRT)が活性化する(②)。サーチュインは細胞質や核に存在するSIRT1(③)やミトコンドリアに存在するSIRT3(④)など7種類が知られている。サーチュインはタンパク質の脱アセチル化(アセチル基を除去する)によって様々な転写因子や酵素などの活性を調整する(⑤)。サーチュインによって活性が制御されているタンパク質としてヒストン、P53、FOXO、PGC1α、LKB1などがあり、細胞周期、代謝、抗酸化システム、オートファジーなどの細胞機能に影響する(⑥)。その結果、細胞老化や発がんを抑制し、寿命を延長する効果を発揮する(⑦)。
カロリー制限(栄養不良を伴わない低カロリー食事療法)で、霊長類を含む多岐にわたる生物種において老化を遅延させ、寿命を延長させることが知られていますが、このカロリー制限のときに活性化されて寿命延長と抗老化作用に関与するのがサーチュイン遺伝子です。
サーチュイン1はPGC-1αを脱アセチル化することによって活性化します。活性化したPGC-1αはミトコンドリア新生を亢進します。
サーチュイン1によるPGC-1αの活性化において、メトホルミンやレスベラトロールやレスベラトロール類縁体のプテロスチルベンやR体αリポ酸やケトン食(βヒドロキシ酪酸)は相乗的に作用して、サーチュイン1による寿命延長効果を増強する可能性が示唆されています。
このメカニズムを理解するためには、LKB1やAMP活性化プロテインキナーゼ(AMPK)とサーチュイン1の相互作用を知る必要があります。
【LKB1はがん抑制遺伝子】
がん細胞は、細胞の増殖や分化や死を調節する「がん遺伝子」や「がん抑制遺伝子」に変異が生じて発生します。このような遺伝子変異が、活性酸素や発がん物質などによって後天的に蓄積することによってがん細胞を発生させるのですが、これらのがん化に関連する遺伝子が生まれつき異常を持っている場合は、そのがんは遺伝することになります。
たとえば、家族性大腸腺腫症という遺伝病ではAPCというがん抑制遺伝子の変異を持ち、大腸や胃にポリープやがんが多数発生します。
BRCA1やBRCA2というがん抑制遺伝子に変異があると、乳がんや卵巣がんを若い年齢で発症します。
ポイツ・ジェガース症候群(Peutz-Jeghers syndrome)という遺伝性疾患があります。食道を除く消化管に多数のポリープを生じ、口唇、口腔粘膜、手掌、足底に特有な色素斑をみとめます。ポリープの分布は小腸に多く、大腸には少なく、小腸ポリープが腸重積症の原因となり、イレウスや腹痛をきっかけに診断されることがしばしばあります。
長期的にみると、この病気はがんの危険性が高く、特に大腸がんの発生が多くみられます。肺や卵巣や子宮など他の臓器のがんも認められます。
10万人に一人くらいの発症率で、常染色体性優性の遺伝形式をとり、原因遺伝子は19番染色体短腕にあるLKB1遺伝子です。LKB1はがん発生を抑制する作用があるがん抑制遺伝子です。LKB1遺伝子が変異して働きが阻害されるとがんが発生するのです。
【LKB1はAMP活性化プロテインキナーゼ(AMPK)を活性化する】
LKB1(Liver Kinase B1)はセリン・スレオニンキナーゼで、AMP活性化プロテインキナーゼ(AMPK)をリン酸化して活性化します。
AMP活性化プロテインキナーゼ(AMP-activated protein kinase:AMPK)は人から酵母まで真核細胞に高度に保存されているセリン/スレオニンキナーゼ(セリン/スレオニンリン酸化酵素)の一種です。
AMPKは細胞内のエネルギーのセンサーとして重要な役割を担っています。
AMPKは低グルコースや低酸素や虚血など細胞のATP供給が枯渇する状況に応答して活性化されます。
AMPKは触媒作用を持つαサブユニットと、調節作用を持つβサブユットとγサブユニットから構成されるヘテロ三量体として存在します。
γサブユニットにはATPが結合していますが、ATPが枯渇してAMP/ATP比が上昇すると、γサブユニットに結合していたATPがAMPに置き換わります。
その結果、アロステリック効果(酵素の立体構造が変化すること)によってこの複合体は中等度(2~10倍程度)に活性化され、上流に位置する主要なAMPKキナーゼであるLKB1に対して親和性が高くなり、LKB1によってαサブユニットのスレオニン-172(Thr-172)がリン酸化されると、酵素活性は最大に活性化されます。
リン酸化されたAMPKはmTORC1を抑制し、タンパク質や脂肪酸の合成を抑制して、がん細胞の増殖を抑制します。また、転写因子のFOXO3Aを活性化して抗酸化力やストレスに対する抵抗力を高め、抗老化や寿命延長効果を発揮します(318話参照)。
つまり、LKB1はAMPKを活性化する作用によってがん細胞の増殖を抑制する作用があるがん抑制遺伝子になります。
AMP/ATP比を上昇させてAMPKを活性化するメトホルミンががん予防効果や抗がん作用を示す主要なメカニズムがAMPKの活性化です。(下図)

図:AMP活性化プロテインキナーゼ(AMPK)は細胞のエネルギー代謝を調節する因子として重要な役割を担っている。AMPKは低グルコースや低酸素や虚血など細胞のATP供給が枯渇させるようなストレスに応答して活性化される(①)。AMPKは触媒作用を持つαサブユニットと、調節作用を持つβサブユットとγサブユニットから構成されるヘテロ三量体として存在する(②)。γサブユニットにはATPが結合しているが、ATPが枯渇してAMP/ATP比が上昇すると、γサブユニットに結合していたATPがAMPに置き換わる(③)。その結果、アロステリック効果(酵素の立体構造が変化すること)によってこの複合体は中等度(2~10倍程度)に活性化され、上流に位置する主要なAMPKキナーゼであるLKB1に対して親和性が高くなり、LKB1によってαサブユニットのスレオニン-172(Thr-172)がリン酸化されると、酵素活性は最大に活性化される(④)。インスリン/IGF-1シグナル伝達系で活性化されるmTORC1(哺乳類ラパマイシン標的タンパク質複合体1)は細胞分裂・増殖、細胞生存、血管新生、栄養素取込み、エネルギー産生を促進する(⑤)。 活性化されたAMPKはmTORC1を抑制し、タンパク質や脂肪酸の合成を抑制して、がん細胞の増殖を抑制する(⑥)。メトホルミンはミトコンドリアの呼吸酵素複合体Iを阻害してATP産生を低下させ、AMP/ATP比を高める作用とLKB1を活性化する作用によってAMPKを活性化して抗がん作用を発揮する(⑦)。
【カロリー制限模倣薬としてのレスベラトロール】
ケトン食(超低糖質+高脂肪食)もカロリー制限と類似のメカニズムで寿命延長効果があります。(467話参照)

図:超低糖質ケトン食(低糖質食+高脂肪食)は抗老化作用や寿命延長作用が確認されている。そのメカニズムとして、糖質摂取量が少ないと、タンパク質の糖化が減少し、インスリン/インスリン様成長因子-1(IGF-1)シグナル伝達系が抑制され、オートファジーが促進され、老化が抑制される(①)。低糖質・高脂肪食はケトン体の産生を増やす(②)。ケトン体のβヒドロキシ酪酸はヒストン脱アセチル化酵素を阻害してヒストンアセチル化を亢進し、転写因子のFOXOが活性化され、酸化ストレスに対する抵抗性が亢進し、アディポネクチン産生を亢進する(③)。これらの作用は老化を抑制し寿命を延ばす作用がある。
しかし、カロリー制限もケトン側も長期に実施するのは大変です。ケトン食は慣れると楽しい食事になりますが、カロリー制限で空腹を自覚する生活は抵抗がある人は多いと思います。
そこで「カロリー制限模倣薬」と言われるカロリー制限と類似の生体応答を引き起こす薬やサプリメントを摂取すれば、カロリー制限と同じ効果が得られ、食事制限せずに寿命延長やがん予防効果を得ることができます。
カロリー制限と同じ効果(抗老化や寿命延長効果)を示す薬をCalorie restriction mimetics (CRM:カロリー制限模倣化合物)と言います。
CRMには抗糖尿病薬のメトホルミン、赤ワインに含まれるレスベラトロール、ポリアミンの一種のスペルミジン、グルコース類縁体の2-デオキシ-D-グルコース(2-Deoxy-D-glucose)などが知られています
この中で、食品成分由来で安全性が高く、サプリメントとして人気があるのがレスベラトロールです。
レスベラトロールはカロリー制限と同様の作用を示す他に様々な健康作用が報告されています。しかし、がん予防に本当に有用かどうかはまだ議論があり、結論は出ていません。その議論を理解した上で、レスベラトロールを摂取するかどうかは個人の判断になります。(つまり、まだ十分なエビデンスは無いけど、可能性があるかもしれないというレベルです)
【レスベラトロールは植物の生体防御物質】
植物は、外敵(病原菌など)や過酷な外的環境(紫外線や熱や重金属など)に打ち勝つために、様々な生体防御物質を合成しています。
植物体に病原菌や寄生菌が侵入したときに植物細胞が合成する抗菌性物質(生体防御物質)をフィトアレキシン(phytoalexin)と言います。
レスベラトロールはフィトアレキシンの一つです。
レスベラトロール(Resveratrol)はスチルベン合成酵素(stilbene synthase)によって合成されるスチルベノイド(スチルベン誘導体)ポリフェノールの一種で、気候変動やオゾン、日光、重金属、病原菌による感染などによる環境ストレスに反応して合成されます。
赤ぶどうの果皮や赤ワインに多く含まれています。その他、ラズベリー、ブルーベリー、マルベリー(桑の実)、イタドリなどにも含まれます。

図:レスベラトロールは気候変動やオゾン、日光、重金属、病原菌による感染などによる環境ストレスに反応して合成されるポリフェノールの一種。赤ぶどうの果皮や赤ワインに多く含まれている。その他、ラズベリー、ブルーベリー、マルベリー(桑の実)、イタドリなどにも含まれている。
レスベラトロールはアンチエイジング(抗老化)とがん治療の両方の領域で最も注目されている物質です。
レスベラトロールがサーチュイン1を活性化して抗老化作用や寿命延長作用を発揮することが報告されています。

図:レスベラトロールは、カロリー制限や運動と同様にサーチュイン遺伝子(SIRT1)を活性化する機序で、ミトコンドリア機能を亢進し、ストレス抵抗性を高め、抗老化とがん予防の効果を発揮する。
マウスに高脂肪・高カロリー食を与えると寿命が短くなりますが、このときレスベラトロールを摂取させると寿命の短縮が防げるという報告が2006年のNatureにハーバード大学の研究グループから発表されています。
Resveratrol improves health and survival of mice on a high-calorie diet.(レスベラトロールは高カロリー食におけるマウスの健康と寿命を改善する)Nature. 2006 Nov 16;444(7117):337-42.
マウスをカロリー制限で飼育すると寿命が延び、高カロリー食で飼育すると寿命が短縮します。この論文では、レスベラトロールは高カロリー食による寿命短縮をキャンセルするという実験結果を報告しています。
レスベラトロールはインスリン感受性を高め、インスリン様成長因子-1(IGF-1)を減少させ、AMP活性化プロテインキナーゼ(AMPK)とペルオキシソーム増殖因子活性化受容体γコアクチベーター1α(PGC-1α)の活性を高め、ミトコンドリアの数を増やし、運動機能を高める作用があることを報告しています。
メトホルミンとレスベラトロールはミトコンドリアの呼吸酵素複合体-Iを阻害してエネルギー産生を低下させ、AMPKとサーチュインを活性化し、カロリー制限と類似の作用を発揮することが明らかになっています。

図:メトホルミンとレスベラトロールはミトコンドリアの呼吸酵素複合体-Iを阻害し(①)、エネルギー産生を低下させ、カロリー制限と類似の作用を発揮する(②)。すなわち、NAD+/NADH比 (③)とAMP/ATP比(④)を高め、サーチュインとAMP活性化プロテインキナーゼ(AMPK)を活性化する。サーチュインはLKB1を活性化してAMPKを活性化し(⑤)、AMPKはサーチュインを活性化する(⑥)。サーチュインはFoxO3aやPGC1α(ペルオキシソーム増殖因子活性化受容体γコアクチベーター1α)などの活性を高め(⑦)、抗酸化酵素酵素や解毒酵素の発現を高め、ストレス抵抗性を高めて、がんを含めて加齢関連疾患の発症を抑制し、寿命を延ばす(⑧)。
【αリポ酸はサーチュイン1の発現誘導とAMP活性化プロテインキナーゼの活性化によって脂肪酸の酸化を促進する】
以下のような研究結果が報告されています。αリポ酸がAMPKを活性化しますが、これはLKB1を介しているようです。
α-Lipoic acid regulates lipid metabolism through induction of sirtuin 1 (SIRT1) and activation of AMP-activated protein kinase.(αリポ酸はsirtuin1(SIRT1)の発現誘導とAMP活性化プロテインキナーゼの活性化を介して脂肪代謝を調節する)Diabetologia 55(6): 1824-35, 2012年
【要旨】
目的と仮説:サーチュイン1(Sirtuin 1; SIRT1)は、栄養枯渇に応答してエネルギー産生と寿命を調節する長寿関連タンパク質である。肥満やメタボリック症候群の治療薬開発のターゲットとして注目されている。この研究では、C2C12筋管細胞(C2C12myotubes)において、αリポ酸がSIRT1の活性化や発現誘導を介して脂質低下作用を示すかどうかを検討した。
方法:培養したC2C12筋管細胞の培養液にαリポ酸を投与して、SIRT1阻害剤(ニコチンアミド)、SIRT1低分子干渉RNA(siRNA)、AMPK阻害剤(compound C)の存在下あるいは非存在下において、AMP活性化プロテインキナーゼ(AMPK)、アセチル-CoAカルボキシラーゼ(ACC)、脂肪組織のトリアシルグリセロール・リパーゼ(ATGL)、脂肪酸合成酵素(FAS)の発現量、細胞内のトリアシルグリセロールの量、脂肪酸のβ酸化の変化を解析した。
生体内でのαリポ酸の脂質低下作用は、高脂肪食で飼育したストレプトゾトシン/ニコチンアミド誘発糖尿病マウスと遺伝性肥満マウス(db/db mice)を用いて検討した。
結果:C2C12筋管細胞(myotubes)においてαリポ酸はNAD+/NADH比を増加させ、SIRT1活性と発現量を高めた。その結果、αリポ酸はAMPKとACCのリン酸化を亢進し、パルミチン酸のβ酸化を亢進し、細胞内トリアシルグルセロール量を減少させた。
ニコチンアミドあるいはSIRT1siRNAで処理した細胞では、αリポ酸によって誘導されるAMPKとACCのリン酸化、細胞内トリアシルグリセロール量、パルミチン酸のβ酸化は抑制された。これはシグナル伝達においてSIRT1がAMPKの上流に位置することを示している。
αリポ酸は脂肪組織トリアシルグリセロール・リパーゼ(ATGL)の発現を増やし、脂肪酸合成酵素(FAS)の発現を抑制した。
高脂肪食で飼育した糖尿病マウスとdb/dbマウスにαリポ酸を経口投与すると、体重と内臓脂肪の量が著明に減少した。
結論:培養細胞とマウスを使った実験で、αリポ酸はSIRT1とAMPKの両方を活性化し、脂質を低下させる効果を示した。これらの結果は脂質代謝異常や肥満の治療においてαリポ酸が有用な作用を示すことを示唆している。
前述のように寿命を延ばす確実な方法としてカロリー制限があります。カロリー制限は、栄養不良を伴わない低カロリー食事療法で、霊長類を含む多岐にわたる生物種において老化を遅延させ、寿命を延長させることが知られています。
このカロリー制限のときに活性化されて寿命延長と抗老化作用に関与するのがサーチュイン遺伝子です。つまり、サーチュイン遺伝子が活性化されると老化が抑制されることになります。
サーチュインはAMPKの上流に位置するリン酸化酵素であるLKB1を脱アセチル化し、AMPKを活性化します。AMPKが活性化すると、AMPKは細胞内NAD+を増加させることでさらにサーチュイン活性が促進し、自ら活性が増強するループを形成しているという報告があります。
AMP活性化プロテインキナーゼの活性化はがん細胞の増殖を抑制する作用を持ちます。
AMPKの活性化は、細胞内の脂肪酸のβ酸化を亢進し、脂質合成に関与するアセチル-CoAカルボキシラーゼ(ACC)と脂肪酸合成酵素(FAS)の活性を阻害します。脂肪酸の合成が阻害され、β酸化が亢進するとがん細胞は増殖が阻害されます。
αリポ酸は抗酸化作用やグルコース代謝を促進する(αリポ酸はピルビン酸をアセチルCoAに変換するピルビン酸脱水素酵素の補酵素)作用が主体ですが、さらにSIRT1とAMPKを活性化して、脂肪酸のβ酸化を亢進して脂肪酸合成を阻害する作用もαリポ酸の抗腫瘍作用のメカニズムになっていると思われます。
αリポ酸はAMPKシグナル系を亢進し、抗酸化力を高め、線維化を抑制するという報告があります。
Alpha-lipoic acid attenuates cardiac fibrosis in Otsuka Long-Evans Tokushima Fatty rats.(αリポ酸は大塚Long-Evans徳島肥満ラットにおける心臓線維化を軽減する)Cardiovasc Diabetol 2012 Sep 19;11:111. doi: 10.1186/1475-2840-11-111.
【要旨】
研究の背景:高血糖は心筋の酸化ストレスを高め、グルコースの恒常性のバランスを乱す。糖尿病性心筋症は心臓に肥大と線維化を特徴とする。しかしながら、糖尿病性心筋症の発症メカニズムは十分に解明されていない。
この研究は、大塚Long-Evans徳島肥満ラットにおける、心筋のエネルギー代謝、抗酸化作用、心臓の線維化に対するαリポ酸の作用を検討する目的で行った。
方法:非糖尿病のLong-Evans Tokushima Otsuka (LETO)ラットと、糖尿病を発症するOtsuka Long-Evans Tokushima Fatty (OLETF)ラットに、αリポ酸投与群(200mg/kg/日)と非投与群に分けて16週間飼育した。
糖尿病性心筋症はSirius Redによる染色で評価した。OLETFラットの心臓におけるAMPKシグナル系、抗酸化酵素、線維化関連遺伝子発現に対するαリポ酸の作用はウェスタンブロット法や組織染色で評価した。
結果:糖尿病を発症するOLETFでは、LETOラットに比べて心臓のAMPKシグナル系の活性の低下が認められ、αリポ酸の投与によってOLETFラットにおけるAMPKシグナル系の活性は亢進した。さらに、OLETFラットにおける抗酸化活性の低下はαリポ酸投与によって亢進した。OLETFラットの心臓ではLETOラットの心臓に比べて、より多くの結合組織の増加を認め、トランスフォーミング増殖因子β1(TGF-β1)と結合組織増殖因子(CTGF)の発現亢進を認めた。そして、これらの増加はαリポ酸の投与によって減少した。
結論:αリポ酸はAMPKシグナル系、抗酸化活性、線維化抑制効果を亢進した。これらの結果はαリポ酸が糖尿病性心筋症の治療において有益な効果を示すことが示唆された。
以上の2つの論文から、αリポ酸はサーチュイン1とAMPKを活性化する効果が期待できそうです。
以上から、運動、メトホルミン、レスベラトロール、αリポ酸、NAD+前駆体のニコチンアミド・リボシドやニコチンアミド・モノヌクレオチドなどを併用すると、サーチュイン1とAMPKを活性化して、老化性疾患の発症を予防し、寿命を延ばせるかもしれません。
ただし、これは基礎研究から推定される仮説のレベルであり、人間で本当に寿命が延ばせるかはまだエビデンスはありません。
ただ、私の場合はすでに高齢者に分類されている状況で、毎日毎日時間は確実に過ぎているので、エビデンスが出るまで待つ時間的余裕はないので、以上のことを実践しています。
私が実践しているのは、運動と糖質制限(マイルドなケトン食)に加えて、メトホルミン、ビタミンD3、R体αリポ酸、ニコチンアミド・リボシド、ニコチンアミド・モノヌクレオチドの補充です。
抗老化の効果は年単位でないと評価できないし、寿命延長の効果は自分が死亡するまで分からないので、あくまでも自己責任での実践です。

図:運動やカロリー制限はATPが減少してAMP/ATP比が上昇することによってATP活性化プロテインキナーゼを活性化する(①)。メトホルミンとレスベラトロールもミトコンドリアでのATP産生を阻害し、AMP/ATP比を上昇してAMPKを活性化する(②)。ビタミンD3はカルモジュリンキナーゼキナーゼβ (CaMKKβ)を活性化してAMPKを活性化する(③)。αリポ酸はサーチュイン1の発現を誘導し(④)、サーチュイン1はLKB1を活性化してAMPKを活性化する(⑤)。ケトン体のβヒドロキシ酪酸はアディポネクチンを増やしてAMPKを活性化する(⑥)。NAD+の体内前駆物質のニコチンアミド・リボシド(NR)とニコチンアミド・モノヌクレオチド(NMN)はNAD+を増やすことによってサーチュイン1の活性を高める(⑦)。活性化したAMPKはmTORC1を阻害し(⑧)、FOXO3Aを活性化する(⑨)効果などのよって、がん細胞の増殖抑制、抗老化・寿命延長などの効果を発揮する(⑩)。
| « 713)NAD前駆体... | 715)レスベラ... » |



