がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
509) 代謝をターゲットにしたがん治療(その4):抗酸化システムを阻害するオーラノフィンとジスルフィラム
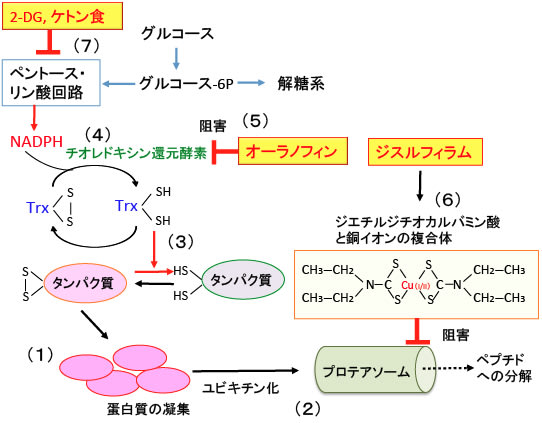
図:スルフヒドリル基(-SH)が酸化されたタンパク質は凝集し(1)、ユビキチン化されてプロテアソームで分解される(2)。チオレドキシン(Trx)は酸化したタンパク質を還元作用によって元に戻す(3)。酸化されたチオレドキシン(Trx)はチオレドキシン還元酵素によってNADPHを使って還元型に戻される(4)。オーラノフィンはチオレドキシン還元酵素を阻害する(5)。ジスルフィラムの代謝物質(ジエチルジチオカルバミン酸)と銅イオンの複合体はプロテアソームの働きを阻害する(6)。2-デオキシグルコース(2-DG)とケトン食はペントース・リン酸回路を阻害してNADPHの産生を減少させる(7)。チオレドキシン還元酵素とプロテアソームとNADPH産生系が阻害されると、酸化したタンパク質凝集物が細胞内に蓄積して細胞は死滅する。
509) 代謝をターゲットにしたがん治療(その4):抗酸化システムを阻害するオーラノフィンとジスルフィラム
【オーラノフィンは関節リュウマチの治療薬】
オーラノフィン(Auranofin)は、関節リュウマチにおける炎症反応や免疫異常を抑制して、寛解へと導く経口金製剤として1985年以降臨床で使用されています。
炎症細胞の機能抑制や、免疫細胞に作用して自己抗体の産生を抑制して、関節における炎症を抑制します。
主な副作用は下痢や腹痛や口内炎などの消化器症状が1~5%程度、発疹や掻痒などの皮膚症状が2~3%程度、その他1%以下の頻度で蛋白尿、貧血、浮腫、肝障害などが報告されていますが、比較的副作用の少ない安全性の高い薬です。(ただし、稀に間質性肺炎や腎臓障害などの重い副作用が発生することがありますので、注意して使用します。)
最近、オーラノフィンの抗腫瘍効果が注目されています。米国ではがん治療へのオーラノフィンの効果を検討する第2相臨床試験の実施がFDA(食品医薬品局)から承認されています。
今まで報告されたオーラノフィンの抗がん作用のメカニズムは多様です。DNAやRNAやタンパク質の合成阻害、ミトコンドリアのチオレドキシン還元酵素やグルタチオン-S-トランスフェラーゼやプロテアソームの機能阻害、抗炎症作用(IL-6/STAT3経路の阻害、NF-κB活性化の阻害など)、ヒストン・アセチル化亢進など多くの作用機序が報告されています。
【オーラノフィンはチオレドキシン還元酵素を阻害する】
チオレドキシン(Thioredoxin: Trx)とは、分子内に酸化還元活性を有するSH基を持つ抗酸化酵素で、活性酸素から細胞を保護する作用を示すほか、細胞内シグナル伝達にも関与する多機能タンパク質です。細胞内における主要な抗酸化機構の一つであり、細菌からヒトに至るまで普遍的に存在しています。チオレドキシン・システムは、チオレドキシン、チオレドキシン還元酵素、NADPHより構成されます。
還元型チオレドキシンは、酸化された標的タンパク質に結合し、標的タンパク質のジスルフィド結合(S-S)をチオール基(-SH)に還元し、チオレドキシン自身のチオール基は酸化されます。
酸化型チオレドキシンは、NADPHの存在下でチオレドキシン還元酵素の作用により還元され、 再び還元型に戻ります。NADPHはペントースリン酸回路で産生されます。オーラノフィンはチオレドキシン還元酵素を阻害します。(下図)

図:チオレドキシンは活性部位の2つのシステイン基の間でジスルフィド(S-S)結合を作る酸化型とジチオール(-SH-SH)を作る還元型が存在する。還元型チオレドキシンは酸化された標的タンパク質に結合してタンパク質のジスルフィド結合(S-S)をチオール基(-SH)に還元し、チオレドキシン自身のチオール基(-SH)は酸化されてジスルフィド(S-S)になる。酸化型チオレドキシンはNADPHの存在下でチオレドキシン還元酵素の作用により還元され、再び還元型に戻る。NADPHはペントースリン酸回路で産生される。オーラノフィンはチオレドキシン還元酵素を阻害する。
放射線や抗がん剤はがん細胞に活性酸素の産生を高めて酸化傷害を引き起こして死滅させます。これに対してがん細胞はチオレドキシン・システムを使って酸化傷害を軽減してアポトーシスに抵抗性を示します。
したがって、オーラノフィンはチオレドキシン(Trx)還元酵素を阻害してがん細胞の抗酸化力と低下させることによって、放射線治療や抗がん剤治療の効果を高めることができます。
【オーラノフィンはSTAT3を阻害する】
がん治療のターゲットとしてSTAT3(Signal Tranducer and Activator of Transcription 3:シグナル伝達兼転写活性化因子3)が注目されています。
STAT3はさまざまなサイトカインや成長因子からのシグナルを統合して免疫や炎症を制御する転写因子であり、また、炎症に起因した発がんに重要な働きをすることが明らかになっています。
STAT3は「シグナル伝達兼転写活性化因子」という名前の通り、「シグナル伝達」と「遺伝子転写活性化」の両方において働きます。
STAT3は非活性化状態においては細胞質に存在しますが、ヤーヌスキナーゼ(Janus Kinase; JAK)が活性化されることによってリン酸化を受け、核内へ移行して目的遺伝子を活性化する転写因子として機能します。
JAKはサイトカイン受容体のサブユニットとして存在し、チロシンをリン酸化する酵素(チロシンキナーゼ)の一種です。
IL-6ファミリーのサイトカインあるいは上皮成長因子(EGF)等の成長因子がそれらの受容体に結合することによりヤーヌスキナーゼ(JAK)が活性化されると、活性化されたJAKがSTAT3のチロシン705をリン酸化します。
チロシン705がリン酸化されたSTAT3二分子のSH2ドメインがそれぞれ他方の分子のリン酸化チロシンと相互作用することにより二量体を形成して核内に移行し、核内に移行したSTAT3二量体は標的となるDNAに結合する事で転写を活性化します。これをJAK-STAT経路と言います。
STAT3のリン酸化はJAKを介する以外に、増殖因子や成長因子の受容体が直接リン酸化する場合や、Srcなどの非受容体性チロシン・キナーゼによっても起こります。つまり、様々な細胞刺激に応答してSTAT3がリン酸化されて、増殖や生存を促進する作用を発揮します。
STAT3は細胞をアポトーシス抵抗性にするBcl-2やBcl-XL、細胞周期を促進するサイクリンD1(Cyclin D1)などの遺伝子発現を誘導することによってがん細胞の増殖や転移を促進します。
オーラノフィンがSTAT3の活性化を阻害する作用が報告されています。チオール基(-SH)をもつタンパク質がJAK/STAT3の活性化に関与しており、オーラノフィンのJAK/STAT3活性化阻害作用はチオレドキシン還元酵素阻害作用が関与していることが報告されています。これはチオール基をもつ抗酸化剤(N-アセチルシステインやグルタチオン)を添加するとオーラノフィンのJAK1/STAT3活性化阻害作用が阻止されたことから示されています。

図:JAK(ヤーヌスキナーゼ)はサイトカイン受容体のサブユニットとして存在し、チロシンをリン酸化するチロシンキナーゼ活性を持つ。
IL-6や上皮成長因子(EGF)などの受容体が刺激されるとJAKが活性化されてSTAT3がリン酸化される。STAT3のリン酸化は受容体性チロシンキナーゼや非受容体性チロシンキナーゼ(Srcなど)でも起こる。
STAT3は不活性な状態では細胞質に存在し、JAKなどでチロシン705がリン酸化されると、STAT3二分子のSH2ドメインが、それぞれ他方の分子のリン酸化チロシンと相互作用することにより二量体を形成して核内に移行する。核内に移行したSTAT3二量体は、標的となるDNAに結合する事で転写を活性化する。
STAT3は細胞をアポトーシス抵抗性にするBcl-2やBcl-XL、細胞周期を促進するサイクリンD1などの遺伝子発現を誘導することによってがん細胞の増殖や転移を促進する。
オーラノフィンは炎症細胞からのサイトカインの産生やSTAT3の活性化を阻害する。
【オーラノフィンはIκBキナーゼ(IKK)を阻害する】
炎症性疾患やがんの治療のターゲットの一つにNF-κB(エヌエフ・カッパー・ビー、Nuclear Factor-kappa B、核内因子-κB)という遺伝子の転写を調節するタンパク質複合体があります。
転写因子はDNA上のプロモーターやエンハンサーといった転写を制御する部分に特異的に結合し、DNAの遺伝情報をmRNAに転写する過程を促進、あるいは逆に抑制する働きを持つタンパク質です。
NF-κBは炎症反応や免疫応答や細胞増殖に関連する多くの遺伝子の発現を調節しており、NF-κBの活性化は様々な炎症性疾患やがんを増悪させることが明らかになっています。
がん細胞ではNF-κBが活性化すると死ににくくなるので抗がん剤に抵抗性になり、増殖や転移が促進されます。がん細胞や炎症細胞のNF-κB活性が高まると、内皮細胞増殖因子(VEGF)や単球走化因子-1(monocyte chemoattractant factor-1)やインターロイキン-8(IL-8)やシクロオキシゲナーゼ-2(COX-2)など、腫瘍血管の新生に関与する蛋白質の産生が増加します。
炎症細胞やがん細胞に、炎症性サイトカン(IL-1, TNF-αなど)や酸化ストレス(放射線や活性酸素など)が作用すると、細胞内でNF-κBが活性化されます。このNF-κBを活性化するタンパク質がIκBキナーゼ(IKK)です。
NF-κBは細胞質に存在し、IκB(Inhibitor of κB)と呼ばれる制御蛋白質と複合体を形成し、不活性型で細胞質に局在しています。
炎症性刺激や酸化ストレスやプロテインキナーゼCなどによりIκBのセリン基をリン酸化するIκBキナーゼ(IKK)が活性化されてIκBをリン酸化し、さらに蛋白分解の目印となるユビキチンが結合し、プロテアソームで分解されます。IκB が外れるとIκBでマスクされていた核内移行シグナルが露出して、NF-κBは核に移行できるようになります。NF-κBはDNA上のκBモチーフ (GGGACTTTCC) と呼ばれる配列に結合し、目的遺伝子の転写活性化を行います。
NF-κBの活性化を阻止することは、炎症性疾患やがんの治療に有効と考えられています。
オーラノフィンはIκBキナーゼ(IKK)の活性を阻害する作用が報告されています。IKKの活性部位にはシステインのスルフヒドリル基が存在し、これがIKKの活性に必須であることから、チオレドキシン還元酵素を阻害するオーラノフィンがIKKの活性化を阻害してNF-κBの活性化を阻害すると考えられています。

①NF-κB(Nuclear FactorκB)は細胞質に存在し、IκB(Inhibitor of κB)と呼ばれる制御蛋白質と複合体を形成している。②炎症性サイトカイン(IL-1やTNF-αなど)や細菌由来のリポ多糖や酸化ストレス(放射線や活性酸素など)はIκBキナーゼを活性化してIκBをリン酸化する。③さらにユビキチンが結合してIκBはプロテアソームで分解される。④IκBが外れるとNF-κB分子内の核内移行シグナルが露出してNF-κBは核に移行し、目的遺伝子の転写を行う。⑤NF-κBで活性化される遺伝子は炎症やがんの進展と関連するものが多い。
⑥その結果、がん細胞の増殖は亢進し、アポトーシスが起こりにくくなって抗がん剤耐性となり、腫瘍血管の新生が促進される。オーラノフィンはIKKの活性化を阻害するので、NF-κBの活性化も阻害する。
【オーラノフィンはFoxO3aの活性を高める】
転写因子FoxO3a(Forkhead Box O3a)はDNA結合ドメインFox(Forkhead box)を持つForkheadファミリーに属する転写因子です。FoxO3aはストレス応答、代謝制御、細胞周期、アポトーシス、細胞分化、DNA修復、免疫機能、炎症などに関連する多くの遺伝子の発現を促します。
がん抑制遺伝子としての性格も持っており、FoxO3aの活性化は抗がん作用を示します。
FoxO3はインスリン/インスリン様成長因子-1(IGF-1)シグナル伝達系の下流に位置しています。インスリン/インスリン様成長因子-1(IGF-1)はPI3K/Aktシグナル伝達系を亢進し、活性化されたAktは転写因子FoxO3aをリン酸化します。この場合、リン酸化されたFoxO3aは核外(細胞質)へ移行して分解されるので、FoxO3aの転写活性は抑制されます。これが、インスリンやIGF-1の活性化ががんの発生や増殖を促進するメカニズムの一つになっています。(下図)

図:インスリン/インスリン様成長因子-1(IGF-1)はPI3K/Aktシグナル伝達系を亢進し、活性化されたAktは転写因子FoxO3aをリン酸化する。リン酸化されたFoxO3aは核外(細胞質)へ移行するので、FoxO3aの転写活性は抑制される。FoxO3aの標的遺伝子は細胞増殖を停止させ、アポトーシスを誘導してがん抑制的に作用するので、FoxO3aの核外への移行(不活性化)はがん細胞の増殖を促進することになる。
FoxO3aは細胞周期の進行を阻害するタンパク質p27Kip1の発現を促進します。p27Kip1は細胞周期のG0/G1停止を引き起こすサイクリン依存性キナーゼ阻害因子です。
また、FoxO3aはがん細胞のミトコンドリアに作用してアポトーシスを誘導するタンパク質のBimの発現を亢進することが報告されています。つまり、FoxO3aの転写活性を高めることはがん細胞をG0/G1期で細胞周期を止め、アポトーシスを誘導することになります。

図:増殖因子や成長因子はPI3K/Aktシグナル伝達系を活性化し、AktはFoxO3aをリン酸化して核外に移行させて転写活性を阻害する。FoxO3aはサイクリン依存性キナーゼの阻害因子であるp27Kip1やアポトーシスを誘導するBimの発現を亢進してがん細胞をG0/G1期で停止させ、アポトーシスを誘導する。
IκBキナーゼがFoxO3aをリン酸化して核外へ移行させて不活性化することが報告されています。オーラノフィンはIκBキナーゼ(IKK)を阻害する作用があります。つまり、オーラノフィンはIKKを阻害してFoxO3aを活性化して抗がん作用を示すことになります。

図:IκBキナーゼβ(IKKβ)はFoxO3aの核内移行を阻止することによってFoxO3aの転写活性を阻害する。FoxO3aはアポトーシス誘導性のBcl-2の発現を阻害し、アポトーシスを誘導するタンパク質(Bax, Bim, Caspase-3など)の発現や活性を高めアポトーシスを誘導する。オーラノフィンはIKKβの活性を阻害する作用によってFoxO3aの転写活性を高めて、がん細胞のアポトーシスを誘導する。
IκBキナーゼ(IKK)はIKKαとIKKβとIKKγ(またはNEMO)と呼ばれる調節サブユニットから構成される複合体を形成しています。様々な炎症性シグナルや増殖シグナルに応答してIKK-αとIKK-βはリン酸されて活性化されます。
IKK複合体のうちIKKβのリン酸化は炎症性シグナルに応答して起こり、NF-κBの活性化やFoxO3の不活性化に関与しています。
NF-κBの活性化もFoxO3の不活性化も、ともに増殖を促進しアポトーシスを起こしにくくする作用があります。したがって、IKKβのリン酸化を阻害することは、がん細胞の増殖抑制とアポトーシス誘導に作用することになります。

①NF-κBはIκBと複合体を形成して細胞質に存在している。②様々な炎症シグナルや増殖シグナルはIκBキナーゼ(IKK)を活性化してIκBをリン酸化する。③リン酸化されたIκBは分解され、フリーになったNF-κBは核内に移行し目的遺伝子の転写を行う。④FoxO3aはIKKによってリン酸化されると核の外に移行する。⑤核外に移行するとFoxO3aによって転写される遺伝子の発現は阻害される。NF-κBで転写が促進される遺伝子は炎症やがんの進展と関連するものが多い。FoxO3aによって転写が促進される遺伝子は細胞周期停止やアポトーシス誘導に関連するものが多い、したがって、IκBキナーゼ(IKK)を抑制することは、がん細胞の増殖を抑制し、アポトーシスを誘導する方向で作用する。
【オーラノフィンはヒストン・アセチル化を亢進する】
幾つかの腫瘍では、ビタミンD3とレチノイドはがん細胞を分化させて増殖を止め、アポトーシス(細胞死)を誘導する作用があります。しかし、多くの固形がんでは、分化誘導作用が認められません。それはがん細胞では、遺伝子にエピジェネティックな制御が起こっているからです。
特に細胞増殖を抑制したり細胞死や分化を誘導するようながん抑制遺伝子には、DNAのアセチル化やヒストンの脱アセチル化によって転写因子がアクセスできにくくなっていることが明らかになっています。
つまり、レチノイドやビタミンD3が思うように効かないのは、これらの遺伝子にレチノイド受容体やビタミンD受容体がアクセスできないためで、アクセスできるようにすればレチノイドやビタミンD3の抗がん作用が出てくる可能性があります。
オーラノフィンがヒストンアセチル化を促進してレチノイドやビタミンD3の分化誘導作用を促進することが報告されています。
【ジスルフィラムはアルデヒド脱水素酵素を阻害する】
ジスルフィラム(Disulfiram)はアルデヒド脱水素酵素を阻害する作用があり、断酒薬としてアルコール中毒の治療薬として60年以上前から処方薬として使用されています。アルコールを飲むと強い副作用が出ますが、アルコールさえ飲まなければ、ジスルフィラムは極めて副作用の少ない薬です。
アルデヒド脱水素酵素の阻害剤であるジスルフィラムはアルコールの代謝でできるアセトアルデヒドの分解を阻害することによって、アセトアルデヒドの有害な症状がでるので、アルコールを飲めなくするのです。

図:エチルアルコール(エタノール)はアルデヒド脱水素酵素でアセトアルデヒドに代謝され、アセトルデヒドはアルデヒド脱水素酵素によって酢酸に代謝される。ジスルフィラムはアルデヒド脱水素酵素を阻害する。アセトアルデヒドは毒性が強いので、細胞や組織にダメージを与える。
【がん幹細胞はアルデヒド脱水素酵素の活性が高い】
アルデヒド脱水素酵素(ALDH)はアルデヒド(CHO)を酸化してカルボン酸(COOH)にする反応を触媒する酵素です。
アルデヒト脱水素酵素はがん幹細胞のマーカーとしても知られています。がん幹細胞はアルデヒト脱水素酵素を過剰に発現し、その生存や増殖や自己複製に何らかの重要な働きを行っていることが指摘されています。細胞にとってアルデヒドは毒性があるので、アルデヒドを早く代謝するために必要と考えられています。
多くのがん種においてALDH活性の高いがん細胞は増殖や転移を促進することが報告されています。
ALDH活性の高い腫瘍は生存期間も短く予後が悪いことが報告されています。
ALDH活性を阻害するとがん細胞の増殖や転移を抑制でき、抗がん剤の効き目を高めることができます。
したがって、ジスルフィラムはアルデヒド脱水素酵素の阻害作用によって抗腫瘍効果を発揮します。
【ジスルフィラムはプロテアソームの働きを阻害する】
ジスルフィラムと銅の組合せ(複合体)はプロテアソーム(proteasome)におけるタンパク質の分解機能を強力に阻害する作用があります。
プロテアソームはタンパク質分解活性を持った巨大な酵素複合体で、ユビキチンにより標識されたタンパク質をプロテアソームで分解する系はユビキチン-プロテアソーム・システムと呼ばれ、細胞周期やシグナル伝達やアポトーシスなど細胞内の様々な機能の制御に関わっています。プロテオソームの働きが阻害されると細胞内タンパク質の恒常性に異常が起こり、ユビキチン化されたタンパク質が細胞内に増え、毒性の強い凝集したタンパク質によってがん細胞に対して致死的に作用します。
すでに、プロテアソーム阻害剤は抗がん剤としても使用されています。
つまり、ジスルフィラムはプロテアソーム阻害作用による抗がん作用もあるということです。

図:スルフヒドリル基(-SH)が酸化されたタンパク質は凝集しプロテアソームで分解される。ジエチルジチオカルバミン酸と銅の複合体はプロテアソームでのタンパク質の分解を阻害する。
【ジスルフィラムはがん細胞の酸化ストレスを高める】
ジスルフィラムはタンパク質のシステインに反応して活性を阻害する機序によって、プロテインキナーゼCやP糖蛋白質やDNAメチルトランスフェラーゼなど様々ながん促進性のタンパク質を阻害します。
ジスルフィラムの代謝物は銅イオンや亜鉛イオンと複合体を形成するため、細胞内の重金属イオンの貯蔵量を減らし、その結果、スーパーオキシド・ディスムターゼ(酸化ストレスから細胞を保護する)やマトリックス・メタロプロテイナーゼ(がん細胞の浸潤や転移を促進する)のような酵素活性に亜鉛や銅が必須の酵素の活性を阻害する作用があります。
ジスルフィラムの抗腫瘍効果は二価重金属の存在下で強く現れます。がん細胞内には正常細胞よりもこのような二価の重金属(銅や亜鉛)が多く存在するので、ジスルフィラムの毒性はがん細胞に強くでます。
ジスルフィラムと銅イオンの複合体内における一価の銅イオンCu(I)と二価の銅イオンCu(II)の酸化還元サイクルは、グルタチオンの酸化と過酸化水素の産生を引き起こし、細胞内の酸化ストレスを高めることになります。

図:ジスルフィラムの代謝産物のジエチルジチオカルバミン酸は二価の重金属(銅や亜鉛)と複合体を形成する。その結果、細胞内の重金属イオンの貯蔵量を減らし、酵素活性に亜鉛や銅が必須の酵素の活性を阻害する作用がある。また、ジスルフィラムと銅イオンの複合体内における一価の銅イオンCu(I)と二価の銅イオンCu(II)の酸化還元サイクルは、グルタチオン(GSH)の酸化と過酸化水素(H2O2)の産生を引き起こし、細胞内の酸化ストレスを高める。がん細胞内には正常細胞よりもこのような二価の重金属が多く存在するので、ジスルフィラムの毒性はがん細胞に強く出る。
【ジスルフィラムが炎症性乳がんに抗腫瘍効果を発揮する】
ジスルフィラムはアルコール中毒の治療薬でオーラノフィンは抗リュウマチ薬です。この2つは様々なメカニズムで抗腫瘍効果を発揮します。それらのメカニズムの一つとして、抗酸化システムの阻害が指摘されています。
ジスルフィラムの抗腫瘍効果のメカニズムとして最近以下のような報告があります。
Disulfiram (DSF) acts as a copper ionophore to induce copper-dependent oxidative stress and mediate anti-tumor efficacy in inflammatory breast cancer.(ジスルフィラムは銅依存性の酸化ストレスを誘導する銅イオノフォアとして作用し、炎症性乳がんの抗腫瘍効果を発揮する)Mol Oncol. 2015 Jun;9(6):1155-68. doi: 10.1016/j.molonc.2015.02.007. Epub 2015 Feb 21.
【要旨】
がん細胞内には活性酸素種の量が増えているが、抗酸化システムの活性を高めることによって酸化ストレスによる細胞死を防ぐように適応している。
炎症性乳がんは乳がんの中でも特殊なタイプで、治療に抵抗性で再発しやすい特徴を持っている。
炎症性乳がんの細胞モデルを用いて、活性酸素の産生を高める薬剤を投与した後に炎症性乳がん細胞が生存するためにどのような酸化ストレス応答を行うかを検討した。
人間の乳がん組織の遺伝子解析の結果、正常組織や通常の乳がん組織に比べて、炎症性乳がんの組織では酸化ストレス応答のスコアが顕著に高くなっていた。放射線治療や抗がん剤治療はがん細胞に酸化ストレスを高めて死滅させるので、炎症性乳がんの組織で酸化ストレス応答の亢進は、放射線治療や抗がん剤治療に対する炎症性乳がんの抵抗性と関連していることが示唆される。
炎症性乳がん細胞におけるこの適応反応を阻止するために、FDA認可の低分子薬剤のジスルフィラムを、単独あるいは銅との併用で使用した。
ジスルフィラムは銅と複合体を形成し、細胞膜のトランスポーターを使わずに、細胞内の銅の濃度を高めることが、培養細胞と動物の腫瘍の両方の実験系で確かめられた。
ジスルフィラムと銅の複合体(DSF-Cu)はNF-κBシグナル伝達系とアルデヒド脱水素酵素の活性を阻害し、抗酸化力を低下させ、炎症性乳がんの複数の実験系で酸化ストレスによるアポトーシスを誘導した。
動物を使った生体内の実験系では、DSF-Cuは生体に毒性を示すことなく、がん細胞にのみアポトーシスを誘導して腫瘍の増殖を顕著に阻害した。
これらの実験結果は、炎症性乳がんは酸化ストレスに高度に適応性が高くなっており、この性質が活性酸素を発生させるがん治療に対する抵抗性の原因になっている。
治療に抵抗性を示す進行性の炎症性乳がんに対して、ジスルフィラムは酸化還元の制御を介して、抗がん剤治療と放射線治療の感受性を高める効果が期待できる。
イオノフォア(ionophore)は、生体膜において、特定のイオンの透過性を増加させる能力を持つ脂溶性分子の総称です。特定のイオンと結合し、生体膜を通過することでイオンを通過させます。この論文では、ジスルフィラムが銅イオンを細胞内に運搬するイオノフォアとしての作用を持っていると報告しています。

炎症性乳がんは治療に抵抗性を示しますが、ジスルフィラムを併用する価値はあります。実際に抗がん剤治療と併用して、抗腫瘍効果の増強を認めています。
注意:ジスルフィラムはアルコールの代謝を阻害するので、服用中と服用後2週間くらいは飲酒は厳禁です。アルコールの入った食べ物(奈良漬けなど)も食べれません。抗がん剤の中にはアルコールで溶解して投与するもの(例:パクリタキセル)があります。抗がん剤点滴などでアルコールを使っていないことを確認しておきます。
【ジスルフィラムとオーラノフィンの相乗効果】
酸化ストレスの亢進に対して細胞は内因性の抗酸化物質の量を増やすことによって細胞を守ろうとします。このような抗酸化物質は、フリーラジカルを直接消去するようなものであったり、酸化したジスルフィド結合(S-S)に水素を与えて還元する(-SH)作用を持つもの(NADPHのようなもの)になります。
細胞内の酸化還元常状態の恒常性維持には2つのシステムが主要な貢献を行っています。その2つというのはグルタチオンとチオレドキシン・システムです。
この2つの抗酸化システムはがん細胞において過剰に発現しています。その理由は、がん細胞ではその特徴的な代謝によって活性酸素の産生が亢進しており、それに対抗して細胞を守るためです。
がん細胞の抗酸化システムを阻害するような他の薬をジスルフィラムと併用すると、ジスルフィラムの抗腫瘍活性を高めることができると予測できます。
リュウマチ治療薬のオーラノフィン(Auranofin)はチオレドキシン還元酵素(thioredoxin reductase)の活性を阻害する作用を有するので、ジスルフィラムの抗腫瘍効果を増強する効果が期待できます。
実際に、卵巣がん細胞を用いた実験系で、がん細胞を死滅させるジスルイフィラムの効果をオーラノフィンが増強する結果が得られています。

図:チオレドキシン(Trx)は酸化したタンパク質を還元作用によって元に戻そうとする。酸化したチオレドキシンをNADPHを使って還元型に戻すチオレドキシン還元酵素をオーラノフィンは阻害する。チオレドキシンの作用が阻害されると、酸化したタンパク質は活性を失い、正常な構造を保てずに凝集が起こる。このような異常細胞はプロテアソームで分解されるが、ジスルフィラムの代謝物質(ジエチルジチオカルバミン酸)と銅イオンの複合体はプロテアソームの働きを阻害する。その結果、毒性の強いタンパク質凝集物が細胞内に蓄積して細胞は死滅する。
以上のように、ジスルフィラムとオーラオフィンは極めて多彩なメカニズムで抗腫瘍作用を発揮します。そのメカニズムは難解で理解困難かもしれませんが、要点はがん細胞に酸化ストレスを高めて死滅させる治療(ケトン食、ジクロロ酢酸ナトリウム、2-デオキシグルコース、メトホルミン、アルテスネイトなど)において、極めて有用だと言うことです。
実際に、がん細胞の酸化ストレスを徹底的に高めてがん細胞を死滅する治療を行うとき、オーラノフィンとジスルフィラムの併用は役立ちます。
オーラノフィンとジスルフィラムの相乗効果のメカニズムを以下にまとめています。

図:①ジスルフィラムを経口摂取すると、消化管内および血液内で1分子のジスルフィラムは2分子のジエチルジチオカルバミン酸に変換され、さらにジエチルチオカルバミン酸メチルエステル・スルホキシドに代謝される。
②ジエチルチオカルバミン酸メチルエステル・スルホキシドは、アルデヒド脱水素酵素の酵素活性部位のシステインのスルフヒドリル基(-SH)と反応して結合し、酵素活性を阻害する。同様なメカニズム(タンパク質のシステインに反応して活性を阻害する機序)によって、プロテインキナーゼCやP糖蛋白質やDNAメチルトランスフェラーゼを含む、様々ながん促進性のタンパク質を阻害する。
③ジエチルジチオカルバミン酸は二価の重金属(銅や亜鉛)と複合体を形成する。
④複合体内における一価の銅イオンCu(I)と二価の銅イオンCu(II)の酸化還元サイクルは、グルタチオン(GSH)の酸化と過酸化水素(H2O2)の産生を引き起こし、細胞内の酸化ストレスを高める。
⑤スルフヒドリル基(-SH)が酸化されたタンパク質は凝集しプロテアソームで分解される。ジエチルジチオカルバミン酸と銅の複合体はプロテアソームにおけるタンパク質の分解機能を強力に阻害する。プロテオソームの働きが阻害されるとユビキチン化されたタンパク質が細胞内に増え、毒性の強い凝集したタンパク質によって致死的に作用する。
⑥チオレドキシン(Trx)は酸化したタンパク質を還元作用によって元に戻そうとする。酸化したチオレドキシンをNADPHを使って還元型に戻すチオレドキシン還元酵素をオウラノフィンは阻害する。酸化したタンパク質は活性を失い、正常な構造を保てずに凝集が起こる。このような異常細胞はプロテアソームで分解されるが、ジエチルジチオカルバミン酸と銅イオンの複合体はプロテアソームの働きを阻害する。その結果、毒性の強いタンパク質凝集物が細胞内に蓄積して細胞は死滅する。(参考: Cell Cycle. 13(10):1513-4.2014の図を改変)
| « 508)代謝をタ... | 510)代謝をタ... » |



