がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
803)がん細胞のフェロトーシス誘導(その2):アルテスネイトと高濃度ビタミンC点滴との相乗効果
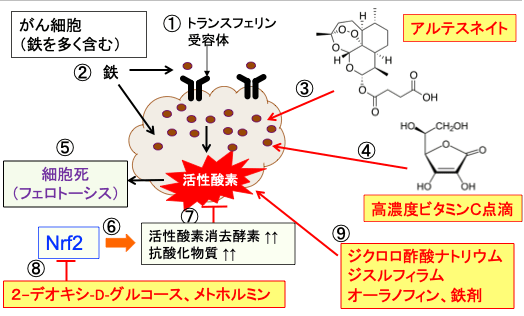
図:がん細胞はトランスフェリン受容体の発現が多く(①)、細胞内に鉄を多く取り込んでいる(②)。抗マラリア薬のアルテスネイトは分子内にエンドペルオキシド・ブリッジ(endoperoxide bridge)を有し、これは鉄イオンやヘムと反応してフリーラジカルを発生する(③)。高濃度ビタミンC点滴はがん組織やがん細胞内において過酸化水素を発生し、過酸化水素は鉄イオンと反応すると酸化作用の強いヒドロキシル・ラジカルを発生する(④)。鉄イオンを介してがん細胞内で多量に発生した活性酸素は、細胞膜や細胞内小器官の膜の脂質を酸化して傷害し、細胞死(フェロトーシス)を誘導する(⑤)。がん細胞は転写因子のNrf2の活性を亢進し(⑥)、活性酸素消去酵素や抗酸化物質の産生を増やすことによって活性酸素種を消去する(⑦)。2-デオキシ-D-グルコースとメトホルミンはNrf2の活性を阻害する作用が報告されている(⑧)。ジクロロ酢酸ナトリウム、ジスルフィラム、オーラノフィン、鉄剤はがん細胞内の活性酸素の量を増やす(⑨)。これらは相乗効果で、がん細胞に比較的特異的にフェロトーシスによる細胞死を誘導する。
803)がん細胞のフェロトーシス誘導(その2):アルテスネイトと高濃度ビタミンC点滴との相乗効果
【高濃度ビタミンC点滴はアルテスネイトの抗腫瘍効果を増強する】
フェロトーシスは細胞内の鉄に依存して活性酸素種が発生し、酸化ストレスが亢進して細胞死を引き起こします。したがって、がん細胞に酸化ストレスを高める治療はアルテスネイトの抗がん作用を増強する可能性があります。
高濃度ビタミンC点滴はがん細胞内の活性酸素の産生を高め、グルタチオンの量を減らす効果によってアルテスネイトの抗腫瘍効果(フェロトーシス誘導)を高めます。
高濃度ビタミンC点滴は、1回に25〜100グラムという大量のビタミンCを1〜3時間かけて点滴する治療法です。がん細胞に取込まれたビタミンCが過酸化水素を発生することでDNAやミトコンドリアにダメージを与え、解糖系を阻害してATP産生を阻害することによって抗がん作用を発揮します。
ビタミンCはグルコースと構造が似ており、同じ糖輸送担体(グルコーストランスポーター)によって細胞内に取込まれます。がん細胞はグルコーストランスポーターの発現量が増え、グルコースの取込みが亢進しているので、大量のビタミンCががん細胞に取込まれ、がん細胞が選択的に死滅させることができます。

図:がん細胞はトランスフェリン受容体の発現が多く、細胞内に鉄を多く取り込んでいる(①)。抗マラリア薬のアルテスネイトは分子内にエンドペルオキシド・ブリッジ(endoperoxide bridge)を有し、これは鉄イオンやヘムと反応してフリーラジカルを発生する(②)。高濃度ビタミンC点滴はがん組織やがん細胞内において過酸化水素を発生し、過酸化水素は鉄イオンと反応すると酸化作用の強いヒドロキシルラジカルを発生する(③)。鉄イオンを介してがん細胞内で多量に発生した活性酸素は、細胞膜や細胞内小器官の膜の脂質を酸化して傷害し、細胞死(フェロトーシス)を誘導する(④)。正常細胞は鉄の含有量が少ないのでアルテスネイトと高濃度ビタミンC点滴による酸化傷害を受けない(⑤)。その結果、この2つの治療法は相乗効果で、がん細胞に比較的特異的に細胞障害作用を発揮する。
提唱されている作用機序として、ビタミンCによって発生した過酸化水素がDNAにダメージを与えると、ポリADPリボース合成酵素(PARP)が活性化されNADが枯渇し、解糖系もTCA回路も進まなくなります。活性酸素はミトコンドリアにもダメージを与えます。これらの作用で、エネルギーが枯渇して細胞が死滅することになります。この作用機序を下図にまとめています。

図:ビタミンCはグルコーストランスポーターから細胞内に取込まれる。がん細胞はグルコーストランスポーターの発現量が増えているので、がん細胞に高濃度のビタミンCが取込まれる。取込まれたビタミンCはがん細胞内で過酸化水素(H2O2)を発生させて、DNAとミトコンドリアにダメージを与える。DNAのダメージはポリADPリボース合成酵素(PARP)の活性を亢進してNAD+(ニコチンアミドアデニンジヌクレオチド)が減少すると解糖系が阻害される。ミトコンドリアのダメージは酸化的リン酸化でのATP産生を減少させる。この結果、がん細胞内のATPが枯渇してがん細胞は死滅する。
正常細胞はGLUTの発現が少ないのでビタミンCの取込みが少なく、過酸化水素を消去するカタラーゼの活性が高いので、高濃度ビタミンC点滴による細胞傷害は起こりにくいと考えられています。
高濃度ビタミンC点滴はがん細胞内の酸化ストレスを高めるメカニズムでがん細胞を死滅させる治療法です。高濃度ビタミンC点滴で治療中に抗酸化性のサプリメントを摂取している人がいますが、これは高濃度ビタミンC点滴の抗腫瘍効果を弱めます。
酸化ストレスを高めるメトホルミン、ジスルフィラム、オーラノフィン、ジクロロ酢酸ナトリウム、半枝蓮、アルテスネイトなどを併用すれば高濃度ビタミンC点滴の抗腫瘍効果を高めることができます。
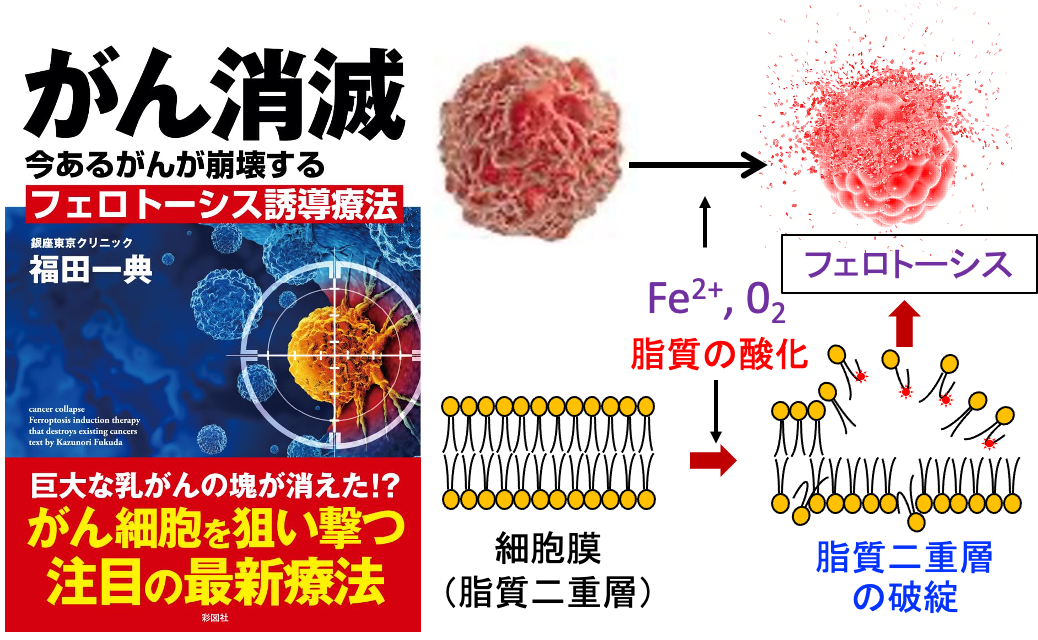
つまり、アルテスネイトや高濃度ビタミンC点滴やジクロロ酢酸ナトリウムなどは、それぞれ単独では抗腫瘍効果が弱いのですが、これらを組み合せれば、がん細胞内の酸化ストレスを高め、フェロトーシスの機序でがん細胞を死滅できます(トップの図)。
【Nrf2はがん細胞のストレス抵抗性獲得に重要な働きを担っている】
細胞には、抗酸化酵素や解毒酵素の発現を誘導することによって、活性酸素や有毒物質による害から細胞自身を守る手段や仕組みが備わっています。
例えば、細胞内で活性酸素の発生量が増えると、細胞は活性酸素を消去する酵素(スーパーオキシド・ディスムターゼ、カタラーゼ、グルタチオン・ペルオキシダーゼなど)の発現や活性を高めたり、フリーラジカルを消去するグルタチオンやチオレドキシンなどの抗酸化物質の合成を高めたりして、活性酸素の害(酸化ストレス)を軽減しようとします。
放射線治療も抗がん剤治療も活性酸素の産生を高めます。しかし、がん細胞は細胞に備わった抗酸化システムを利用して酸化ストレスを軽減し、酸化還元バランスを維持し、細胞死から免れようとします。
また、グルタチオンSトランスフェラーゼ(GST)などのフェースII(第2相) 解毒酵素と言われる代謝酵素は、様々な発がん物質や有害物質を無毒化する作用があります。
細胞が活性酸素や発がん物質や有害な成分(抗がん剤や放射線も含む)によって攻撃を受けると、これらの活性酸素消去酵素や抗酸化物質(グルタチオンやチオレドキシン)やフェースII解毒酵素が細胞内に誘導され(遺伝子発現が増えたり産生量が増える)、細胞を守るシステムが働きます。
このような細胞内の防御システムの活性化に中心的な働きを行っているのがNrf2(Nuclear factor erythroid 2-related factor 2)という転写因子です。
転写因子というのは特定の遺伝子の発現(DNAの情報を蛋白質に変換すること)を調節している蛋白質です。
抗酸化酵素やグルタチオンの産生に関する酵素やフェース2解毒酵素の遺伝子の発現調節領域には、抗酸化反応エレメント(antioxidant response element:ARE)という領域があって、この部分にNrf2が結合するとこれらの遺伝子の転写が促進されるのです。
(下図)。

図:Keap1-Nrf2システムは酸化ストレスや有害物質に対する防御機構において重要な役割を担っている。転写因子のNrf2は細胞質でKeap1によって分解が促進されることによって活性が抑制されている(①)。酸化ストレスが加わると、Keap1の構造が変化してNrf2から離れ、フリーになったNrf2が核内に移行して(②)、抗酸化酵素や解毒酵素の遺伝子の上流に存在する抗酸化剤応答配列ARE(antioxidant response element)に結合し(③)、これらの遺伝子の発現を亢進する(④)。その結果、放射線や抗がん剤に対する抵抗性が亢進する(⑤)。放射線や抗がん剤は、活性酸素の産生を高め(⑥)、細胞の酸化傷害を引き起こして、細胞増殖を抑制し、細胞死を誘導する(⑦)。がん細胞は酸化ストレスを軽減するために転写因子のNrf2の活性を亢進し、スーパーオキシド・ディスムターゼ(SOD)やカタラーゼやグルタチオン・ペルオキシダーゼなどの活性酸素消去酵素やグルタチオンやチオレドキシンなどの抗酸化物質の産生を高め(⑧)、活性酸素による害(酸化ストレス)を軽減している(⑨)。この抗酸化システムの亢進によって、がん細胞は放射線や抗がん剤に抵抗性になる。
【2-デオキシ-D-グルコースとメトホルミンはがん細胞特異的にNrf2活性を阻害する】
活性酸素種の発生はミトコンドリアが主です。がん細胞ではミトコンドリアでの酸化的リン酸化を抑制することによって活性酸素種の産生を抑えています。そのため、がん細胞はグルコースの取込みを亢進し、解糖系が亢進しています。これをワールブルグ効果と言います。
NRF2の活性がワールブルグ効果と関連することが知られています。つまり、NRF2の活性亢進はワールブルグ効果を亢進します。
また、NRF2活性はがん幹細胞で亢進しています。NRF2は活性酸素のレベルを低下させ、ワールブルグ効果を促進して、がん幹細胞の自己複製能などの幹細胞の性状の維持に重要な働きを担っているということです。
したがって、解糖系の阻害やNRF2の活性阻害はがん幹細胞の増殖を阻止できます。
実際、解糖系とNRF2活性を阻害する2-デオキシグルコース(2-DG)はがん幹細胞の性状のマーカー(OCT4とCD44)の発現を抑制します。
Nrf2の転写活性を介した抗酸化酵素や解毒酵素の発現にはグルコースの供給が必要であるという報告があります。
Glucose availability is a decisive factor for Nrf2-mediated gene expression.(グルコースの供給がNrf2を介した遺伝子発現のための決定的な要因である)Redox Biol. 2013 Jun 21;1(1):359-65.
この論文では、スルフォラファンでNrf2を活性化する方法や、Nrf2を阻害するKeap1遺伝子を機能欠損させる方法(遺伝子ノックアウト)でNrf2の活性を亢進する方法で実験しています。
Nrf2を活性化するとグルコースの取込みが増え、ペントースリン酸経路でのNADPHの産生が増えることが示されています。
そして、グルコースの供給や取込みを阻害するか、あるいはペントースリン酸経路を阻害してNADPHの産生を阻害すると、Nrf2を介した遺伝子発現が抑制され、抗酸化酵素や解毒酵素の発現が抑制されることが示されています。
つまり、ケトン食や2−デオキシグルコースなどで、がん細胞におけるグルコースの取込みやペントースリン酸経路を抑制する方法は、グルコースの取込みが亢進しているがん細胞に選択的にNrf2の活性を阻害できる可能性があります。
メトホルミンががん細胞のNrf2活性を抑制して抗腫瘍作用を示すことが明らかになっています。以下のような報告があります。
Metformin inhibits heme oxygenase-1 expression in cancer cells through inactivation of Raf-ERK-Nrf2 signaling and AMPK-independent pathways.(メトホルミンはRaf-ERK-Nrf2 シグナル伝達系とAMPK非依存的経路の阻害によってがん細胞のヘムオキシゲナーゼ-1を阻害する)Toxicol Appl Pharmacol. 2013 Sep 1;271(2):229-38.
ヘムオキシゲナーゼ-1は、ヘム(heme)をビリベルジン(biriverdin)と一酸化炭素(CO)と遊離鉄(Fe)に分解する酵素です。ビリベルジン(緑色の色素)は、ビリベルジン・リダクターゼ(biriverdin reductase)により、ビリルビン(bilirubin:黄疸の時の黄色の色素)に分解されます。このヘム分解により産生れるビリベルジンとビリルビンには強力な抗酸化作用があり、酸化ストレスによる細胞傷害を抑制します。
メトホルミンはRaf-ERKシグナル伝達系を抑制しNrf2の発現量を減らす効果があることを報告しています。
五環系トリペルペノイドのウルソール酸(Ursolic acid)は白花蛇舌草や夏枯草などの抗がん作用のある生薬に含まれています。このウルソール酸がNrf2を阻害するという報告があります。
Ursolic acid sensitizes cisplatin-resistant HepG2/DDP cells to cisplatin via inhibiting Nrf2/ARE pathway(ウルソール酸はNrf2/ARE経路を阻害することによってシスプラチン耐性HepG2/DDP細胞をシスプラチン感受性にする)Drug Des Devel Ther. 2016 Oct 25;10:3471-3481.
この論文では、ウルソール酸が肝臓がん細胞のシスプラチン耐性を阻止して、シスプラチンに対する感受性を高めることを報告しています。
ウルソール酸とシスプラチンの併用は、肝臓がん細胞の活性酸素の産生を高め、細胞周期をG0/G1で停止し、ミトコンドリア膜電位を低下させ、アポトーシスを誘導しました。
さらに、Nrf2の発現を抑制し、Nrf2によって転写が促進される遺伝子の発現低下が認められました。
以上の結果から、ウルソール酸はNrf2/ARE(/antioxidant response element)経路を阻害するメカニズムで、肝臓がん細胞のシスプラチン耐性を阻止するという結論です。
ウルソール酸は白花蛇舌草(フタバムグラの全草)、夏枯草(シソ科ウツボグサの花穂)、大棗(クロウメモドキ科ナツメの果実)、女貞子(モクセイ科トウネズミモチの果実)、連翹(モクセイ科レンギョウの果実)、枇杷葉(バラ科ビワの葉)、柿蔕(柿のヘタ)などに多く含まれます。
つまり、2-デオキシグルコースやメトホルミンやウルソール酸を含む生薬を使った漢方薬はNrf2の阻害によって、がん細胞のストレス抵抗性を阻止できるかもしれません

図:放射線照射や抗がん剤はがん細胞の活性酸素の産生を高め(①)、細胞増殖抑制や細胞死誘導を引き起こす(②)。がん細胞はNrf2の活性を亢進し(③)、活性酸素消去酵素や抗酸化物質の産生を増やすことによって活性酸素種を消去し、酸化ストレスを軽減している(④)。2-デオキシ-D-グルコース(2-DG)とメトホルミンとウルソール酸はNrf2の活性を阻害する作用が報告されている(⑤)。
【酸化的リン酸化を活性化するとアルテスネイトの抗がん作用が増強する】
アルテスネイトは、非常に低濃度で体内のマラリア原虫を死滅します。マラリア原虫は赤血球内に感染します。マラリア原虫が感染した赤血球中では、マラリア原虫によって赤血球中のヘモグロビンが分解してフリーの鉄が蓄積し、その鉄とアルテスネイトが反応してフリーラジカルが発生してマラリア原虫を死滅させると考えられています。つまり、赤血球中のマラリア原虫の周りにはフリーの鉄やヘムが多く存在するので、アルテスネイトの効果が出やすいのです。
がん細胞内の鉄やヘムの濃度は、マラリア原虫が感染した赤血球ほど高くはありません。したがって、マラリアの治療に比べて、がん細胞に対するアルテスネイトの効果はあまり強くありません。
しかし、アルテスネイトの抗腫瘍効果を高める方法が幾つか報告されていますので、それらを組み合せれば、強い抗がん作用が期待できます。以下のような報告があります。
The Role of Heme and the Mitochondrion in the Chemical and Molecular Mechanisms of Mammalian Cell Death Induced by the Artemisinin Antimalarials(アルテミシニン抗マラリア薬による哺乳類細胞死の化学的および分子的メカニズムにおけるヘムおよびミトコンドリアの役割)J Biol Chem. 2011 Jan 14; 286(2): 987–996.
この研究ではヒトがん細胞株のHeLa細胞と、HeLa細胞のミトコンドリアDNAを欠損させた細胞(HeLa ρ0)の2種類のがん細胞株を用いてアルテスネイトの抗腫瘍活性を比較しています。
ミトコンドリアは固有のDNA(ミトコンドリアDNA)を持ち、このミトコンドリアDNAには呼吸酵素複合体IからVを構成する85種類のサブユニットのうち13種類のたんぱく質を作成する遺伝子が存在します。
従って、ミトコンドリアDNAを欠失させるとミトコンドリアでの酸化的リン酸化によるATP産生が起こらなくなります。
ミトコンドリアDNAが欠損しても、酸化的リン酸化以外のミトコンドリアの機能は維持できます。がん細胞はミトコンドリアでの酸素を使ったATP産生を行わなくても、解糖系でATPを賄うことができるので、酸化的リン酸化が障害されても生存はできます。
アルテスネイト存在下で48時間培養した場合の50%細胞致死量はHeLa細胞が6 ± 3 μMで、ミトコンドリアDNAを欠損したHeLa ρ0細胞では34 ± 5 μMでした。
つまり、ミトコンドリアでの酸化的リン酸化が低下しているとアルテスネイトの殺細胞作用が減弱するという結果です。
また、アルテスネイトの殺細胞作用は、細胞のヘムの合成を亢進すると増強し、ヘムの合成を阻害すると減弱することを示しています。つまり、アルテスネイトの殺細胞作用の活性化にはヘムの存在が重要であることを示しています。
ヘムの合成を亢進するとアルテスネイトの抗腫瘍活性が亢進することに関しては以下のような報告があります。
Mechanistic Investigation of the Specific Anticancer Property of Artemisinin and Its Combination with Aminolevulinic Acid for Enhanced Anticolorectal Cancer Activity.(アルテミシニンの特異的抗がん特性とアミノレブリン酸との併用による抗結腸がん活性の増強に関するメカニズムの検討。)ACS Cent Sci. 2017 Jul 26;3(7):743-750.
アルテミシニンの殺細胞作用が正常細胞に比べてがん細胞に強く発現するのは、がん細胞ではヘムの合成が亢進していることを指摘しています。
そこで、ヘム合成の前駆物質のアミノレブリン酸(aminolevulinic acid)を添加してがん細胞のヘム合成を亢進するとアルテミシンの抗腫瘍活性が亢進することを示しています。
マウスの移植腫瘍を用いた実験でも、アルテミシン単独よりもアルテミシン+アミノレブリン酸の併用の方が高くなることを示しています。つまり、アルテミシンとアミノレブリン酸の併用によるがん治療の可能性を示唆しています。
5-アミノレブリン酸(5-aminolevulinic acid、5-ALA)は、ポルフィリン合成経路の最初の生成物です。動物においてはグリシンおよびスクシニルCoAからアミノレブリン酸合成酵素の作用で合成されます。
5-アミノレブリン酸は最終的にプロトポルフィリンIXとなり、鉄イオンを配位することで、血液中のヘモグロビンや薬物代謝酵素であるP450を構成するヘムとなります。
5-ALAはエイジングケア、食後高血糖対策、脂質減少などの目的でサプリメントとして市販されています。
【がん細胞の抗酸化システムを阻害するとアルテスネイトの抗腫瘍効果は増強する】
アルテスネイトは細胞内の活性酸素の産生を高めて、細胞死を誘導します。増殖の速いがん細胞ほど、酸化ストレスを高める治療に感受性が高いと言えます。
がん細胞は還元型グルタチオン(GSH)の合成を促進することで、酸化ストレス抵抗性を高め、増殖や転移や治療抵抗性を高めていることが知られています。
シスチン・トランスポーター(xCT)はシスチン/グルタミン酸交換輸送体とも呼ばれ、哺乳類細胞形質膜上に発現するアミノ酸トランスポーターの一種で、細胞内のグルタミン酸との交換により細胞外のシスチンを細胞内に輸送する機能を有します。
シスチンはグルタチオンの構成成分であるシステインが2個結合したアミノ酸で、シスチンが細胞内に取り込まれると、システインに代わってグルタチオンを合成する材料になります。このトランスポーターの発現が亢進すると、細胞内グルタチオンレベルが上昇し、これによって、活性酸素などの酸化ストレスに対する防御能が高まると考えられます。
スルファサラジン(別名:サラゾスルファピリジン:商品名はサラゾピリンなど)という潰瘍性大腸炎の治療に使われている既存薬にシスチン・トランスポーターを特異的に阻害する作用があることが報告されています。
シスチントランスポーターの阻害剤であるスルファサラジンを投与すれば、がん細胞内のグルタチオンの濃度が低下し、酸化ストレスに対する抵抗性が低下するので、抗がん剤や放射線治療が効きやすくなると推測されます。
シスチン・トランスポーター(xCT)の発現を亢進するのがNrf2という転写因子です。Nrf2の発現や活性を抑制する治療法を併用するとアルテスネイトや高濃度ビタミンC点滴の抗がん作用が増強できます。
◉ がんのフェロトーシス誘導療法については以下のサイトで解説しています。
http://www.f-gtc.or.jp/ferroptosis-induction/ferroptosis.html
| « 802)がん細胞... | 804)がん細胞... » |