がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
522)膵臓がんとアルデヒド脱水素酵素とヘッジホッグとmTORC1
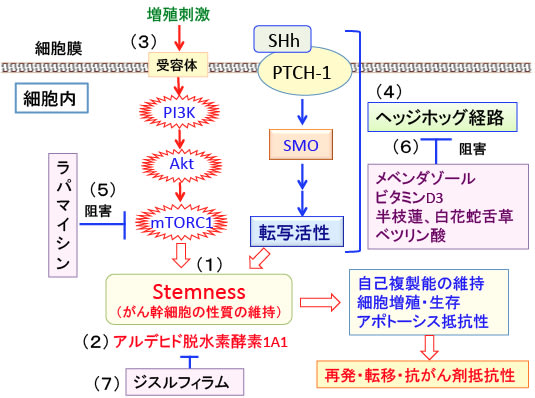
図: (1)PI3K/Akt/mTOR経路とヘッジホッグ(Hedgehog)経路は、自己複製能や不均等分裂などのがん幹細胞の性質を維持する上で重要な役割を果たしている。(2)アルデヒド脱水素酵素1A1はがん幹細胞で過剰に発現し、幹細胞の性質の維持に重要な働きを担っている。(3)PI3K/Akt/mTOR経路は増殖因子や栄養によって活性化され、セリン・スレオニンキナーゼのmTORを活性化して様々なタンパク質をリン酸化して活性化することによって細胞の増殖を促進する。(4)ソニック・ヘッジホッグ・シグナル伝達系は細胞膜にある受容体のPatched-1 (PTCH-1)にソニック・ヘッジホッグ(SHh)が結合することによって開始され、smoothened(SMO)を介してシグナルが伝達され、転写因子の活性化によって細胞の増殖や分化を制御する。これらの経路を阻害するとがん幹細胞の増殖を抑え、抗がん剤感受性を高めることができる。(5)mTORの阻害剤としてラパマイシンやラパマイシン誘導体がある。(6)ヘッジホッグ経路の阻害剤としては駆虫薬のメベンダゾール、ビタミンD3、抗がん生薬の半枝蓮や白花蛇舌草や植物に含まれるベツリン酸などのトリテルペノイド類などがある。(7)アルデヒド脱水素酵素1A1の阻害剤として断酒薬のジスルフィラムがある。これらを併用すると膵臓がんを含めて多くのがん細胞の抗がん剤感受性を高めることができる。
522)膵臓がんとアルデヒド脱水素酵素とヘッジホッグとmTORC1
【膵臓がんの5年生存率は10%以下】
日本も米国も最近のデータでは、がん全体の5年生存率は65%程度です。全ての臨床病期を合わせた平均の5年生存率は、前立腺がんや乳がんや甲状腺がんは90%を超えており、胃がんや大腸がんや子宮頚がんは70%程度、食道がんや肺がんや肝臓がんは30~40%程度、胆のう胆道がんは20%台、膵臓がんは9%程度となっています。(参考:全がん協部位別臨床病期別5年相対生存率;2004-2007年診断症例)
現在日本で膵臓がんで亡くなる人の数は年間3万人を超えています。2012年のデータでは、膵臓がんによる死亡は男性では16,411人、女性は15,305人となっています。
男性では肺がん、胃がん、大腸がん、肝臓がんについで5番目に死亡数の多いがんです。
女性では4番目(大腸がん、肺がん、胃がん、膵臓がん、乳房の順)です。
男女を合わせると、肺がん、大腸がん、胃がんについで4番目です。
膵臓がんの罹患者数も死亡者数も年々増加していますが、ある年の死亡者数は3〜4年前の罹患数とほとんど同じです。これは、膵臓がんと診断された人のほとんどが数年以内に死亡していることを意味しています。
(下図)
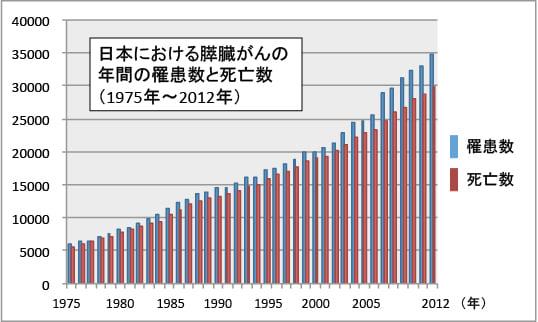
図:膵臓がんの年間罹患数は年々増加しており、1975年から2012年までの37年間で年間罹患数は約7倍に増えている。1年間の膵臓がんの死亡数はその年の罹患数の85%を超えており、3〜4年前の罹患数と同じ状況が続いている。これは診断された膵臓がん患者の多くが数年以内に亡くなっていることを示唆している。
実際に、膵臓がんの生存期間中央値は局所進行癌では 8―12 ヵ月、転移癌では 3―6 ヵ月といわれており、他のがんに比較して非常に治療成績の悪いがんです。
15~20% の膵臓がん患者が根治可能ということで手術がなされていますが、残りの大半は局所で進行しているかあるいは転移している症例です。
切除できない場合は抗がん剤治療が行なわれますが、多くは2年以内に亡くなり、切除できても5年生存率は約10%と極めて低く、予後は極めて不良の「難治性がんの中の難治がん」と言われています。
ステージI(がんが2cm以内で膵臓内にとどまり、リンパ節転移の無いもの)のように早期の段階で偶然に見つかって手術を受けた場合は、50%前後の5年生存率が報告されていますが、このような早期の症例は膵臓がん全体の1割以下です。
膵臓がんの多くは、がんが近くの重要な血管や他臓器にも浸潤し、遠くのリンパ節や肝臓や腹膜に転移を認める進行した段階で見つかっており、このような場合は、5年生存率は5%以下と極めて悪い成績が報告されています。
乳がんの治癒率が高いのは、乳房の解剖学的特性から、自分で気づくことも多く、マンモグラフィーなど早期診断のために有効な検査法があるからです。 さらに、切除手術は比較的簡単で、ホルモン療法や分子標的薬や、奏功率の高い抗がん剤、放射線治療など、有効な治療法が多く用意されていることも、治癒率を高める要因になっています。
膵臓がんは全くその逆です。すなわち、解剖学的特徴によって早期診断と手術が極めて困難です。膵臓は胃の裏側にあって背骨に巻き付くように横たわり、小腸や大腸に近接して隠れているために、検診などで早期に見つけようとしても、超音波やCT検査などの画像検査による早期発見が困難です。
膵頭部癌では黄疸で発症するため腫瘍が比較的小さい段階で見つかる場合もありますが、膵体部や尾部では、かなり大きくなるまで症状がでないため発見が遅れます。
症状として腰痛や腹痛が自覚されるときには、かなり進行した段階であり、症状が出て見つかった場合は、余命1年以内というのがほとんどです。
さらに、大きな血管や神経や胆管と接しているため、切除するためには、複雑で高度な手術技術が要求されます。
がん細胞の性質としては、浸潤傾向が高いがんで、神経に沿って浸潤性に広がります。
胃腸管の場合は、粘膜層、固有筋層、奨膜と行った組織が、がん細胞が他の臓器や腹膜へ直接浸潤する際のバリアになっていますが、膵臓にはこのような臓器壁のバリアがないため、発生した膵臓がんはすみやかに連続性に膵臓内および周囲組織に進展・浸潤しています。
したがって、根治手術を行なったつもりでも、術後に高率に局所・肝・腹膜などに再発転移を起こします。
膵臓がんは抗がん剤や放射線の感受性が低い(効果が弱い)ので、根治手術ができなければ、予後は極めて厳しくなります。
以上のような多くの理由で、膵臓がんは治療成績が極めて悪く、今後も改善する余地は少なく、発生数が増えれば、そのまま死亡率の増加に繋がります。
米国では2013年の膵臓がんの発生数は約45000人で死亡数は約38500人です。2030年には膵臓がんの死亡数は88000人を超えることが予想されています。
膵臓がんの罹患数は最近急激に増えています。肥満や2型糖尿病やフルクトース(果糖)摂取の増加などの関連が示唆されています。(350話参照)

図:膵臓の解剖学的特徴から、膵臓がんは早期に見つかりにくく、周囲組織(肝臓、腹膜、大動脈、門脈など)への浸潤や転移を起こしやすい。
【抗がん剤が効きやすくする工夫が必要】
手術不能の膵臓がんに対しては抗がん剤治療が主体になります。数種類の抗がん剤が使用されていますが、劇的な効果は期待できません。膵臓がんは抗がん剤治療が効きにくいがんです。
そこで、抗がん剤が効きやすくする工夫が必要です。
がん細胞のグルコース利用を阻止する2-デオキシ-D-グルコースやケトン食、ミトコンドリアを活性化するジクロロ酢酸ナトリウムの併用は、がん細胞のワールブルグ効果を正常化して、抗がん剤が効きやすくします。(517話参照)
抗がん剤は酸化ストレスを高める方法と併用すると効果を増強できます。酸化ストレスを高める目的ではオーラノフィン、ジスルフィラム、メトホルミンなどが有効です。(516話参照)
フルクトースやグルコースの摂取を減らすだけでも効果があります。フルクトース(果糖)はペントース・リン酸経路のトランスケトラーゼの活性を亢進し、核酸合成を亢進して膵臓がん細胞の増殖を亢進する作用が報告されています。(521話参照)
ω3系不飽和脂肪酸の摂取は膵臓がんの抗がん剤感受性を高める可能性が報告されています。ω3系不飽和脂肪酸は魚油(DHA, EPA)や亜麻仁油やエゴマ油(αリノレン酸)に多く含まれています。
Inhibition of proliferation by omega-3 fatty acids in chemoresistant pancreatic cancer cells.(抗がん剤抵抗性の膵臓がん細胞におけるオメガ3系脂肪酸による増殖阻害作用)Ann Surg Oncol. 2007 Dec;14(12):3620-8.
この論文では、膵臓がん細胞にゲムシタビンを投与すると、NF-κBが活性化され、抗がん剤抵抗性になることを示しています。
オメガ3系脂肪酸はNF-κBの活性化を阻害し、アポトーシスによる細胞死を促進することが知られています。
そこで、NF-κBの基礎活性やGRM感受性の異なる4種類の膵臓がん細胞株を用いて、GEMに対する感受性に対するオメガ3系脂肪酸とオメガ6系脂肪酸の作用を比較しています。
その結果、4種類の膵臓がん細胞全てにおいて、オメガ3系脂肪酸は時間依存性および用量依存性に増殖を阻害しました。
オメガ6系脂肪酸を投与した場合に比較して、オメガ3系脂肪酸はI-κBのリン酸化とNF-κB活性化を抑制し、Stat3リン酸化を顕著に低下し、アポトーシスを誘導しました。
GEMに対する耐性とは関係なく、オメガ3系脂肪酸は膵臓がん細胞の増殖を抑制し、オメガ3系脂肪酸とGEMの併用は、GEM誘導性のNF-κB活性化を阻止することによって、GEM耐性を阻止することを明らかにしています。
つまり、オメガ3系脂肪酸を多く摂取すると、膵臓がんのゲムシタビン耐性を抑制できる可能性があります。
【アルデヒド脱水素酵素阻害剤のジスルフィラムはゲムシタビン耐性を阻止する】
アルコール中毒の治療薬のジスルフィラムが膵臓がんのゲムシタビン治療の効果を高める可能性が報告されています。以下のような報告があります。
Aldehyde dehydrogenase 1A1 confers intrinsic and acquired resistance to gemcitabine in human pancreatic adenocarcinoma MIA PaCa-2 cells(アルデヒド脱水素酵素1A1はヒト膵臓腺がん細胞MIA PaCa-2細胞のゲムシタビンに対する内在性に備わった耐性および獲得した耐性に関与する)Int J Oncol. 2012 Sep; 41(3): 855–861.
【要旨】
ゲムシタビン(Gemcitabine)は膵臓がんの抗がん剤治療に標準的に使用されているが、ゲムシタビンに対する耐性が治療の有効性を妨げている。
多くの種類のがんにおいて、アルデヒド脱水素酵素1A1の発現レベルと活性の亢進ががん幹細胞(Cancer stem cells)の重要な特性として知られている。
がん幹細胞の特徴の一つとして抗がん剤に対する耐性がある。本研究では、アルデヒド脱水素酵素1A1(ALDH1A1)の発現と活性の高いヒト膵臓がん細胞株(MIA PaCa-2細胞)における内因性のALDH1A1の発現レベルおよび活性とゲムシタビン(GEM)に対する抵抗性の関連について検討した。
低分子干渉RNA(small interfering RNA: siRNA)を用いてALDH1A1の活性を消失させ、GEM耐性におけるALDH1A1の関与を検討した。
低分子干渉RNAによってALDH1A1の発現と活性は顕著に低下し、細胞増殖が阻害された。
さらに、低分子干渉RNAによるALDH1A1のノックダウンとGEMの併用は、がん細胞の生存率を顕著に低下させ、アポトーシスによる細胞死を増やし、S期で細胞周期を停止した細胞を増加した。
GEN耐性でないMIA PaCa-2細胞株に比べて、GEM耐性のMIA PaCa-2細胞株では、ALDH1A1の発現量と活性が有意に亢進していた。
GEM耐性のMIA PaCa-2細胞株において、ALDH1A1のノックダウンとGEMの併用は細胞の生存率を顕著に低下させ、アポトーシス(細胞死)を増やした。この結果は、細胞に本来備わった固有(intrinsic)のGEM耐性と獲得した(acquired)GEM耐性の両方においてALDH1A1の関与が重要であることを示唆している。
膵臓がんにGEM治療において、低分子干渉RNAによるALDH1A1のノックダウンとGEMの併用は、GEM耐性を克服する有効な治療法として、さらに研究を深める必要がある。
アルデヒド脱水素酵素(ALDH)はアルデヒド(CHO)を酸化してカルボン酸(COOH)にする反応を触媒する酵素です。
アルデヒト脱水素酵素はがん幹細胞のマーカーとしても知られています。つまり、アルデヒト脱水素酵素はがん幹細胞に過剰に発現し、その生存や増殖や自己複製に何らかの重要な働きを行っていることが指摘されています。細胞にとってアルデヒドは毒性があるので、アルデヒドを早く代謝するために必要なのです。
多くのがん種においてALDH活性の高いがん細胞は増殖や転移を促進することが報告されています。
ALDH活性の高い腫瘍は生存期間も短く予後が悪いことが報告されています。
ALDH活性を阻害するとがん細胞の増殖や転移を抑制でき、抗がん剤の効き目を高めることができます。
ジスルフィラム(Disulfiram)はアルデヒド脱水素酵素を阻害する作用があり、断酒薬としてアルコール中毒の治療薬として60年以上前から処方薬として使用されています。アルコールを飲むと強い副作用が出ますが、アルコールさえ飲まなければ、ジスルフィラムは副作用の極めて少ない薬です。
アルデヒド脱水素酵素の阻害剤であるジスルフィラムはアルコールの代謝でできるアセトアルデヒドの分解を阻害することによって、アセトアルデヒドの有害な症状がでるので、アルコールを飲めなくするのです。

図:エチルアルコール(エタノール)はアルコール脱水素酵素でアセトアルデヒドに代謝され、アセトルデヒドはアルデヒド脱水素酵素によって酢酸に代謝される。ジスルフィラムはアルデヒド脱水素酵素を阻害する。アセトアルデヒドは毒性が強いので、細胞や組織にダメージを与える。
ジスルフィラムはALDH1A1を阻害します。その他、ジスルフィラムはプロテアソーム(proteasome)におけるタンパク質の分解機能を強力に阻害する作用があります。酸化ストレスを高める作用もあります。したがって、抗がん剤治療と併用して抗腫瘍効果を高める方法として、ジスルフィラムは極めて有用です。(419話参照)

図:①ジスルフィラムを経口摂取すると、消化管内および血液内で1分子のジスルフィラムは2分子のジエチルジチオカルバミン酸に変換され、さらにジエチルチオカルバミン酸メチルエステル・スルホキシドに代謝される。
②ジエチルチオカルバミン酸メチルエステル・スルホキシドは、アルデヒド脱水素酵素の酵素活性部位のシステインのスルフヒドリル基(-SH)と反応して結合し、酵素活性を阻害する。同様なメカニズム(タンパク質のシステインに反応して活性を阻害する機序)によって、プロテインキナーゼCやP糖蛋白質やDNAメチルトランスフェラーゼを含む、様々ながん促進性のタンパク質を阻害する。
注:ジスルフィラム服用中は飲酒はできません。奈良漬けのようなアルコールの入った食品も食べれません。抗がん剤のパクリタキセルは溶解剤としてエタノールを用いていますので、パクリタキセル治療中はジスルフィラムは使用できません。点滴による抗がん剤治療を受けているときには、溶解剤などでエタノールを使用していないことを確認する必要があります。
ゲムシタビン(Gemcitabine: GEM)はピリミジン代謝を阻害することによって抗がん作用を発揮します。
GEMは細胞内でゲムシタビン3リン酸(gemcitabine triphosphate: dFdCTP)に代謝されてDNAに取り込まれてDNA合成を阻害し、細胞死(アポトーシス)を誘導します。
進行した膵臓がんの抗がん剤治療でファーストラインの抗がん剤として単独あるいは他の抗がん剤と併用して使用されています。
しかし、膵臓がん細胞は内因性(intrinsic)あるいは獲得性(acquired)にGEMに耐性を持つことが治療効果を妨げています。
したがって、このような抗がん剤耐性を阻止できれば、膵臓がんに対する抗がん剤治療の有効性を高めることができます。
耐性獲得のメカニズムとしては、薬物の取込みや代謝、細胞死や増殖に関する遺伝子の変化(死滅しにくくなる)などがあります。
さらに、がん幹細胞はGEM耐性を有し、アルデヒド脱水素酵素1A1(ALDH1A1)活性が亢進しており、ALDH1A1活性を阻害すると、GEM耐性が阻止できることが報告されています。
ALDH1A1は、乳がん、大腸がん、膵臓がん、肺がん、肝臓がん、卵巣がんなど多くの種類のがんにおいて、がん幹細胞のマーカーとして認められており、がん幹細胞において発現が亢進しています。そして、アポトーシス抵抗性や抗がん剤耐性の原因となっています。
ALDHには17種類のアイソフォームがあり、ALDH1A1はその一つです。
ALDH1A1は細胞内のアルデヒドを酸化することによって酸化ストレスを軽減します。
低分子干渉RNAや薬剤などでALDH1A1の発現や活性を阻害すると、がん細胞の抗がん剤感受性が亢進することが報告されています。
ゲムシタビン耐性だけでなく、白金製剤やタキサン系の抗がん剤に耐性の卵巣がん、多剤耐性の胃がん細胞、シクロフォスファミド耐性のヒトがん細胞などでALDH1A1の発現亢進が報告されており、ALDH1A1は多くの種類のがん細胞における薬剤耐性の原因となっている可能性が示唆されています。
膵臓がん細胞をGEM存在下で長期間培養するとALDH1A1陽性の膵臓がん幹細胞が誘導されてくることが報告されています。
GEMは細胞内で活性酸素種を増やしアポトーシスを促進します。したがって、活性酸素を消去するとGEMによる増殖抑制効果は低下します。
GEMの抗腫瘍効果に活性酸素種の産生亢進が関与しており、ALDH1A1は活性酸素の産生を減らすので、GEMの抗腫瘍効果を低下させることになります。
つまり、ALDH1A1の発現亢進は、GEMによって産生される活性酸素種を消去することによって、GEMの細胞毒性を低下させるというメカニズムが報告されています。
膵臓がんだけでなく、抗がん剤治療一般において、ALDH1A1の阻害は、抗腫瘍効果を高める効果が期待できます。したがって、抗がん剤治療にALDH1A1の阻害剤であるジスルフィラムの併用は試してみる価値があります。
数年前までは、抗がん剤治療中の抗酸化剤の使用についての賛否は半々でした。活性酸素は遺伝子変異を誘導してがん細胞の悪性化を促進し、正常細胞のダメージを亢進するので、抗酸化剤の使用は有用だという意見がかなりありました。
しかし、最近の考え方は、がん治療中の抗酸化剤は良くないという意見が主流です。がん細胞の酸化ストレスを高めることが、がん治療に役立つと考えられています。
ALDH1A1の阻害も、抗がん剤による酸化ストレスを高めて、がん細胞を死滅させる治療法です。
【ヘッジホッグ・シグナルの阻害は膵臓がんの抗がん剤感受性を高める】
膵臓がんの抗がん剤感受性を高める方法としてヘッジホッグ・シグナルの阻害が注目されています。以下のような報告があります。
An orally bioavailable small-molecule inhibitor of Hedgehog signaling inhibits tumor initiation and metastasis in pancreatic cancer(経口摂取で有効なヘッジホッグシグナル系の低分子阻害剤は、膵臓がんの発がんや転移を阻害する)Mol Cancer Ther. 2008 Sep; 7(9): 2725–2735.
【要旨】
近年の研究によって、膵臓がん細胞ではヘッジホッグ・シグナル伝達系の異常を来しており、治療のターゲットとして注目されている。
ヘッジホッグ・シグナルの低分子量アンタゴニストであるシクロパミン(cyclopamine)を用いた過去の我々の研究は、膵臓がんの同所性移植の実験モデルにおいて、ヘッジホッグの阻害ががん細胞の全身転移を顕著に阻止することを明らかにした。
シクロパミンは天然の成分であるが、その薬物動態などから臨床応用には問題が残っている。
本研究では、in vitro(試験管内)とin vivo(生体内)の実験モデルを用いて、新規で経口摂取によって有効性を示す低分子量のヘッジホッグ阻害剤のIPI-269609の効果を検討した。
In vitroの実験系において、膵臓がん細胞にIPI-269609を投与すると、シクロパミンと同様の効果(Gli応答性リポーター遺伝子の発現阻止、ヘッジホッグのターゲット遺伝子であるGli1とPtchの発現抑制、ソフト寒天での細胞移動とコロニー形成の消失)を認めた。
ヒト膵臓がん細胞株を用いた同所性移植の実験モデルで、IPI-269609の単独投与は、原発巣の腫瘍の体積にはほとんど影響を示さなかったが、全身性の転移を顕著に抑制した。
IPI-269609の投与によって原発巣に認められた唯一の変化は、膵臓がんのがん幹細胞に発現が認められているアルデヒド脱水素酵素を発現しているがん細胞の顕著な減少であった。
IPI-269609によってアルデヒド脱水素酵素発現細胞を選択的に枯渇させると、無胸腺マウスにおける腫瘍移植率は顕著に低下した。
異常なヘッジホッグ・シグナル伝達系の薬物での阻害は、がん幹細胞をターゲットにして膵臓がんの全身転移を阻止する治療法として有効である可能性が高い。
膵臓がんを含めた消化器系のがんにおいて、ヘッジホッグ・シグナル伝達系が活性化しており、ヘッジホッグシグナルの阻害が、増殖や浸潤・転移を抑制することが報告されています。
膵臓がんのがん幹細胞においてソニック・ヘッジホッグ・リンガンドの発現が亢進していることが報告されています。
抗がん剤治療を行っても、がん幹細胞が生き残ると再発します。したがって、がん幹細胞の抗がん剤感受性を高めることが、治療効果を高める上で大切です。この目的で、ヘッジホッグ・シグナル伝達系の阻害が有用だということです。
実験でよく使用されているシクロパミン(cyclopamine)はバイオアベイラビリティ(生体利用率)が悪く、体内での半減期も短いなどの欠点があって、臨床応用は困難です。そこで、ヘッジホッグシグナルの阻害剤の開発が行われています。
この論文では IPI-269609というヘッジホッグシグナルの阻害剤の作用を検討しています。その結果、IPI-269609は膵臓がん細胞の転移や増殖を抑制する結果を報告しています。
この論文で注目すべき点は、IPI-269609でヘッジホッグシグナルを阻害すると、アルデヒド脱水素酵素(ALDH)を高発現する膵臓がん細胞が顕著に減少するという結果です。
ALDHを過剰発現している細胞はがん幹細胞と考えられます。つまり、ヘッジホッグシグナルの阻害はALDHを発現しているがん幹細胞をターゲットにしていることを示唆しています。
したがって、ALDHの阻害剤とヘッジホッグ・シグナル伝達系の阻害の両方を併用すると、膵臓がんのがん幹細胞の抗がん剤感受性をさらに高めることができる可能性が示唆されます。
膵臓がん細胞におけるヘッジホッグシグナルの活性化は2003年に2つの研究グループが報告してから研究が進んでいます。
膵臓がん細胞におけるリガンドの過剰発現が報告されています。
膵臓がんのがん幹細胞はソニック・ヘッジホッグリガンドとアルデヒド脱水素酵素(ALDH)が過剰発現しており、これが増殖や浸潤や転移の亢進と、抗がん剤抵抗性に関連している可能性が指摘されています。この2つを同時に阻害することは膵臓がんの抗がん剤治療に有効と言えます。
膵臓がんの抗がん剤治療の効果を高めるためには、ヘッジホッグシグナルとその阻害剤について、さらに理解する必要があります。
【多くのがん細胞でヘッジホッグ・シグナル伝達系が活性化している】
胚発生や成長の過程に関与する遺伝子やシグナル伝達系は、細胞の増殖や移動や分化の制御に重要な役割を果たしています。したがって、このような遺伝子やシグナル伝達系の異常は、がん細胞の発生や進行にも関与しています。つまり、がん遺伝子やがん抑制遺伝子の候補になります。
このような胎生期とがん発生過程に共通に関わっているシグナル伝達系の一つにヘッジホッグ・シグナル伝達系があります。
ヘッジホッグ・シグナル伝達系は、ショウジョウバエからヒトに至るまで進化的に保存されており、胎生期における組織や臓器の発生や成長において、細胞の増殖や分化や組織形成など多くの過程に重要な働きを行っています。
成長した組織においては、組織幹細胞の維持や、傷害を受けた組織の修復や再生に重要な役割を担っています。
ソニック・ヘッジホッグは細胞内で合成されてから分泌され、その細胞自身(オートクリン)あるいは近くの細胞(パラクリン)の細胞膜にあるPatched-1 (PTCH-1)に結合することによってこのシグナル伝達系が活性化されて、細胞の増殖や移動や分化などの調節を行います。
ヘッジホッグ(Hedgehog)というのはハリネズミのことで、ヘッジホッグ遺伝子の機能を失ったショウジョウバエの胚が小さな歯のような突起物が密集しており、ハリネズミに似ていることからこのような名前になっています。
哺乳類のヘッジホッグにはソニック・ヘッジホッグ(Sonic Hedgehog)、インディアン・ヘッジホッグ(Indian Hegdehog)、デザート・ヘッジホッグ(Desert Hedgehog)の3種類がありますが、最も研究されているのは全身に発現が見られるソニック・ヘッジホッグ・シグナル伝達系です。
インディアン・ヘッジホッグ(インドはりねずみ)とデザート・ヘッジホッゴグ(エチオピアはりねずみ)は実在するハリネズミの種類から命名されていますが、ソニック・ヘッジホッグはセガ・ジェネシスのキャラクターのソニック・ザ・ヘッジホッグから名付けられています(下図)。つまり、ソニックヘッジホッグタンパク質は研究者の洒落で命名されたタンパク質です。

ソニック・ヘッジホッグ・シグナル伝達系は細胞膜にある12回膜貫通型の受容体のPatched-1 (PTCH-1)にソニック・ヘッジホッグが結合することによって開始されます。
PTCH-1は7回膜貫通型のGiタンパク質共役型受容体のSmoothened (SMO)を阻害する作用がありますが、PTCH-1にソニック・ヘッジホッグが結合するとPTCH-1のSMOを阻害する作用が失われます。その結果、SMOが活性化され、活性化したSMOによって転写因子のGLIが活性化されてヘッジホッグ標的遺伝子の発現が活性化されることになります。(下図)

図:ソニック・ヘッジホッグ(SHh)が無いときは、PTCH-1(Patched-1)がSMO(Smoothened)を阻害しているので、このシグナル伝達系は作動しない。ソニック・ヘッジホッグ(SHh)が存在すると(産生されると)、SHhがPTCH-1に結合し、SMOの阻害は解除され、SMOは下流のシグナル伝達系を介して転写因子のGLIを活性化し、ヘッジホッグ標的遺伝子を活性化する。
基底細胞がん、髄芽腫、悪性リンパ腫、白血病、卵巣がん、乳がん、膵臓がん、肺がん、肝臓がん、胃がん、結腸直腸がん、前立腺がん、膀胱がんなど多くのがん細胞種において、ヘッジホッグ・シグナル伝達系の異常な活性化が観察されています。
人間のがんの30%以上にヘッジホッグシグナル系の亢進が認められるという報告もあります。
基底細胞がんや髄芽腫ではほぼ100%の腫瘍にヘッジホッグ系に異常が認められ、膵臓がんでは70%以上に異常が認められると報告されています。
ヘッジホッグシグナル伝達系の活性亢進は、がんの発生過程だけでなく、より浸潤性の高いがん細胞への変化や抗がん剤治療への抵抗性を引き起こしています。
したがって、この経路を阻害すると、がん細胞の増殖や転移を抑制し、抗がん剤治療が効きやすくなることが予想できます。
特にmTORC1(哺乳類ラパマイシン標的タンパク質複合体1)の活性とヘッジホッグ・シグナル伝達系の2つの経路を同時に阻害すると、抗腫瘍効果が相乗的に高まることが多くの研究で示されています。
【膵臓がんのがん幹細胞ではmTORとヘッジホッグ経路が活性化している】
がん幹細胞はがん組織中に少数(数%程度)存在しています。そして、がん幹細胞は正常な組織幹細胞と同様、特別な微小環境中に存在し、周りの細胞から分泌される液性因子などによって、多分化能の維持や分裂増殖が制御されていると考えられています。
がん幹細胞の自己複製や増殖を制御しているシグナル伝達系としてヘッジホッグ(Hedgehog)、mTOR、Notch、Wnt-β-Cateninなどがあります。
膵臓がんのがん幹細胞ではmTORの活性とヘッジホッグシグナル伝達系の活性が非常に亢進しており、これらの経路を阻害すると抗がん剤治療の効果が高まるという報告があります。
Combined targeted treatment to eliminate tumorigenic cancer stem cells in human pancreatic cancer.(ヒト膵臓がんの腫瘍形成性がん幹細胞を消滅させる標的治療の組合せ)Gastroenterology. 137(3):1102-13. 2009年
【要旨】
研究の背景と目的:膵臓がんは、腫瘍形成性のがん幹細胞の存在により、抗がん剤治療に対して非常に強い抵抗性を示し、ジェムザール治療中もがん幹細胞は生き延び、数を増やしている。ソニック・ヘッジホッグ・シグナル伝達系と哺乳類ラパマイシン標的タンパク質(mTOR)は、いずれもがん幹細胞の自己複製に必須であるため、膵臓がん治療の新たなターゲットとして期待できる。
方法:膵臓がんの培養細胞を使った実験系と動物移植腫瘍を使った実験系を用いて、腫瘍形成性がん幹細胞に対するソニック・ヘッジホッグ阻害剤(cyclopamine/CUR199691)とmTOR阻害剤(ラパマイシン)の効果を検討した。
結果:ソニック・ヘッジホッグ阻害剤のシクロパミン(cyclopamine)もラパマイシン(rapamycin)もそれぞれ単独ではがん幹細胞の数を減らすことはできなかった。また、それぞれを単独で抗がん剤治療と併用した場合もがん幹細胞の数を減らすことはできなかった。ソニック・ヘッジホッグ阻害とmTOR阻害と抗がん剤の3つを同時に併用した場合にのみ、がん幹細胞の数が検出できないレベルまで減少することが、培養細胞を使ったin vitroの実験と移植腫瘍を用いた動物実験(in vivo)の両方で認められた。これら3種類を組み合わせた治療によって、ヒト由来の膵臓がん細胞を移植されたマウスは生存期間が顕著に延長した。
結論:ソニック・ヘッジホッグとmTORの両方のシグナル伝達系の阻害を通常の抗がん剤治療と併用することによって膵臓がんのがん幹細胞を消滅させることが可能になる。この治療法をさらに検討することは、治療が困難で予後が極めて不良な膵臓がんの新たな治療法の開発につながる。
この実験で使用されているシクロパミン(cyclopamine)は米国に自生するバイケイソウという植物からみつかった天然有機化合物で、ヘッジホッグシグナル伝達系を阻害する作用があり、この誘導体ががん治療薬として開発されています。
バイケイソウを食べた羊から生まれた子羊に単眼症などの奇形が多く発生し、その原因物質としてシクロパミンが同定され、これがヘッジホッグ経路を阻害するために胚発生過程の臓器形成に異常が生じて奇形が起こることが明らかになっています。
mTORはラパマイシンの標的分子として同定されたセリン・スレオニンキナーゼで、細胞の分裂や生存などの調節に中心的な役割を果たすと考えられています。がん細胞や肉腫細胞の多くにおいてmTORが活性化されており、mTORの阻害はがん細胞や肉腫細胞の増殖を抑制し、抗がん剤や放射線治療の効き目を高める効果や細胞死(アポトーシス)を誘導する効果が示されています。すでに幾つかのmTOR阻害剤が開発され、抗がん剤として使用されています。
mTORもがん幹細胞の自己複製や増殖や抗がん剤耐性に関与していることが報告されています。
実験系(膵臓がんの細胞株の違いに基づく)によっては、ラパマイシンによるmTORの阻害だけでも膵臓がん細胞の増殖を抑える効果が認められています。
がん幹細胞は、成熟したがん細胞に比べて抗がん剤や放射線に抵抗性が強いため、治療後の再発の原因となっています。がん幹細胞を死にやすくすることががん治療の効果を高めることができるのですが、がん幹細胞は様々なメカニズムで死ににくくなっており、一つの方法だけでは限界があるようです。
この論文でも、抗がん剤治療+ソニック・ヘッジホッグ阻害も抗がん剤治療+mTOR阻害もがん幹細胞を減らすことができなかったという結果です。しかし、抗がん剤治療+ソニック・ヘッジホッグ阻害+mTOR阻害の3つを組み合わせると、膵臓がんのがん幹細胞を消滅できたという結果です。

図: PI3K/Akt/mTOR経路とヘッジホッグ(Hedgehog)経路は、自己複製能や不均等分裂などのがん幹細胞(Cancer Stem Cell)の性質を維持する上で重要は役割を果たしている。PI3K/Akt/mTOR経路は増殖因子や栄養によって活性化され、セリン・スレオニンキナーゼのmTORを活性化して様々なタンパク質をリン酸化して活性化することによって細胞の増殖を促進する。ソニック・ヘッジホッグ・シグナル伝達系は細胞膜にある受容体のPatched-1 (PTCH-1)にソニック・ヘッジホッグ(SHh)が結合することによって開始され、smoothened(SMO)を介してシグナルが伝達され、転写因子の活性化によって細胞の増殖や分化を制御する。この2つの経路を阻害するとがん幹細胞の増殖を抑え、抗がん剤感受性を高めることが報告されている。
膵臓がんに対するジェムザールの効果は極めて低いのですが、mTOR阻害とソニック・ヘッジホッグ阻害の2つを併用すると奏功率を高めることができるかもしれません。
つまり、mTOR阻害剤のラパマイシンあるいはラパマイシン誘導体とソニック・ヘッジホッグ・シグナル伝達系阻害剤の併用は試してみる価値があります。ビタミンD3や半枝連・白花蛇舌草・ベツリン酸にソニック・ヘッジホッグ・シグナル伝達系阻害作用が報告されています。(363話、395話参照)
紫外線で皮膚で作成されたビタミンD3や食品やサプリメントで摂取されたビタミンD3は、それ自体でソニック・ヘッジホッグ・シグナル伝達系を阻害して抗腫瘍作用を示し、さらにビタミンD3が活性化された1,25(OH)2ビタミンD3(カルシトリオール)はビタミンD3受容体を介した転写活性によってがん細胞の増殖抑制や分化誘導を引き起こします。(下図)
がん治療において、数千国際単位から数万国際単位の高濃度のビタミンD3の補充は、試してみる価値はあるように思います(394話参照)。米国では1カプセルが10000 IU以上の製剤も普通のサプリメントとして販売されています。
特に、ラパマイシン誘導体のエベロリムス(アフィニトール)などで治療を受けているときは、ヘッジホッグ阻害作用のある ビタミンD3や半枝蓮や白花蛇舌草の併用は有効かもしれません。

図:ビタミンD3(コレカルシフェロール)は肝臓で25位が水酸化されて25(OH)ビタミンD3となり、さらに腎臓で1位が水酸化されて1,25(OH)2ビタミンD3となって活性型となる。1,25(OH)2ビタミンD3はビタミンD受容体(VDR)と結合し、9-シス-レチノイン酸(9-シス-RA)と結合したレチノイドX受容体(RXR)とヘテロダイマーを形成して遺伝子のプロモーター領域のビタミンD応答配列に結合してビタミンDの標的の遺伝子の転写を促進する。ビタミンDの標的遺伝子の発現を誘導することによって、ビタミンDはカルシウム代謝の制御や細胞増殖抑制、分化誘導、アポトーシス誘導などの生理活性を示す。一方、ビタミンD3と1,25(OH)2ビタミンD3はSmoothened(SMO)の活性を阻害する作用によってソニック・ヘッジホッグ・シグナル伝達系を阻害する。
【メベンダゾールはヘッジホッグ・シグナル伝達系を阻害する】
駆虫薬のメベンダゾールにヘッジホッグ阻害作用が報告されています。メベンダゾールはチュブリン・タンパク質に結合して微小管の重合を阻害する作用によって駆虫作用を示します。
メベンダゾールが微小管重合阻害作用によって、がん細胞の細胞分裂を阻害することが動物実験や臨床例で確認されています。さらに血管内皮細胞増殖因子(VEGF)の受容体(VEGFR-2)の活性化を阻害して血管新生を阻害する作用も報告されています。メベンダゾールは毒性が低く、安価で、駆虫薬として長く使用され安全性が高いためがん治療への応用が検討されています。(401話参照)
メベンダゾールにヘッジホッグ・シグナル伝達系を阻害する作用があることが報告されています。以下のような報告があります。
Repurposing the antihelmintic mebendazole as a hedgehog inhibitor(ヘッジホッグ阻害剤としての抗寄生虫薬メベンダゾールの再利用)Mol Cancer Ther. 2015 Jan; 14(1): 3–13.
【要旨】
ヘッジホッグ(hedgehog)シグナル伝達系は多くの種類のがん細胞で活性化されており、したがって、新規の抗がん剤の開発に有望なターゲットになっている
この研究では、線虫(nematode)や包虫(hydatid)などの寄生虫感染症に古くから使用され、安全性が確かめられているベンズアミダゾール(benzamidazole)の一種のメベンダゾール(mebendazole)が、臨床的に達し得る濃度で、ヘッジホッグ・シグナル系を強力に阻害し、ヘッジホッグが活性化している髄芽腫(medulloblastoma)細胞の増殖を抑制することを示した。
抗寄生虫薬としては、メベンダゾールは線虫のチューブリン(tubulin)に結合し、腸管の微小管合成を阻害する。
ヒトの細胞に対しては、微小管関連の細胞内小器官で、ヘッジホッグ経路の活性化のシグナル伝達の中心をなす一次繊毛(primary cilium)の形成を抑制する。
メベンダゾールによるヘッジホッグ・シグナル伝達系の阻害は、ヘッジホッッグ・シグナル伝達経路を担っている膜タンパク質のSMO(Smoothened)の遺伝子変異(ヘッジホッグ・シグナル伝達系阻害剤であるビスモデギブに耐性の細胞クローンに選択的に認められる)に影響を受けない。
ビスモデギブ(Vismodegib)とメベンダゾールの併用は、ヘッジホッグ・シグナル伝達系を相加的に阻害する。
メベンダゾールは成人や小児に高用量で長期間投与しても副作用は少なく安全に投与できるので、ヘッジホッグ・シグナル伝達系が活性化している多くの腫瘍に対する治療薬として、メベンダゾールの再利用を検討する臨床試験を早急に実施することを提案する。
ヘッジホッグシグナル経路の活性化は発生過程の形態形成において必要で、ヒトのがん細胞においても、しばしば活性化がみられます。
通常のヘッジホッグシグナルはヘッジホッグ(Hh)が受容体のPTCH-1(Patched-1)に結合することによって発動します。
PTCH1にリガンドのHhが結合していない状況では、PTCH1は一次線毛におけるSMO(Smoothened)の活性化を阻止しています。
一次線毛は様々な化学的および機械的シグナルの伝達に必要な細胞内小器官です。
Hhの存在下ではPTCH1は一次線毛から消失し、その結果、活性化したSMOはその下流のシグナル伝達系(転写因子のGLIファミリーなど)を活性化します。
基底細胞がんや髄芽腫など幾つかのタイプのがんでは、PTCH1やそのシグナル経路における遺伝子に変異が起こっており、その結果、SMOとその下流のシグナル伝達経路が恒常的に活性化しています。
その他の多くのがん細胞でも、PTHC1の遺伝子変異とは関係なく、Hhリガンドの過剰発現などによってGLIの恒常的活性化が起こって、細胞のがん化と関連しています。
Hhシグナル伝達系が活性化しているがんの治療において、SMO活性の阻害は有効な治療法となることが報告されています。SMO阻害剤として臨床使用が認められたのがvismodegib (Erivedge)です。
Vismodegib は局所進行あるいは転移のある基底細胞がんの治療効果が証明されています。さらに、通常の治療に抵抗することが多い髄芽腫やグリオーマなど多くの腫瘍に対して臨床試験が行われています。
Vismodegibを単独で使用した場合、倦怠感、嘔吐、体重減少、食欲低下、味覚障害、脱水、筋肉けいれんなどの副作用が出ます。
さらに他の抗がん剤と併用すると、副作用は強く出やすく、その結果、治療の継続が困難になることも多くあります。
転移した髄芽腫の患者にvismodegibを投与すると、驚くほどの奏功を示しますが、多くは一過性の効果で終わります。
再発した腫瘍において、SMO遺伝子の新たな変異が起こっており、vismodegibに対する耐性の原因になっています。
Vismodegibで治療を行うと、vismodegibに耐性のSMO遺伝子の変異をもったがん細胞が選択されて増殖しています。このような再発腫瘍の発生を防ぐ目的や、再発腫瘍の治療の目的で、新規のヘッジホッグシグナル伝達系の阻害剤の開発が求められています。
米国の食品医薬品局(FDA)から線虫感染症の治療薬として認可されているベンズイミダゾール(Benzimidazoles)のメベンダゾールは多形神経膠腫や悪性黒色腫、非小細胞性肺がん、卵巣がん、副腎皮質腫瘍、結腸直腸がんなど多くの腫瘍に対して抗腫瘍作用を示すことが報告されています。
多形神経膠腫(glioblastoma multiforme)に対するメベンダゾールの効果は2011年に偶然に発見されました。グリオブラストーマを移植したマウスを使った研究で、マウスにおけるギョウ虫の繁殖を防ぐ目的でフェンベンダゾール(Fenbendazole)を投与したマウスでは移植腫瘍が増大しないことが発見されました。
フェンベンダゾール(Fenbendazole)は動物に使われるベンゾイミダゾール系の寄生虫治療薬の一種です。さらに研究を進め、ベンゾイミダゾール系薬物の中でメベンダゾールが最も強力にグリオブラストーマの増殖を抑制することが明らかになりました。
グリオブラストーマ細胞をマウスに移植する動物実験でメベンダゾールの経口投与(50mg/kg)は顕著に生存期間を延長(63%程度の延長)を示しました。(Neuro Oncol. 13(9): 974–982.2011年)
メベンダゾールはコルヒチンと同じ部位にチュブリンに結合して、微小管の重合を阻害します。
線虫の腸管細胞のチュブリンの重合を阻害して駆虫作用を発揮します。
ヘッジホッグ阻害剤の探索で、ビンブラスチン(vinblastine)、ビンクリスチン(vincristine)、パクリタキセル(paclitaxel)など微小管に作用する抗がん剤にヘッジホッグ阻害活性があることが報告されています。
メベンダゾールは一次線毛の形成を阻害し、ヘッジホッグ経路のタンパク質の発現を低下させ、Hhが恒常的に活性化しているヒト髄芽腫細胞の増殖と生存を低下させます。メベンダゾールは変異したSMOの活性化を阻害し、腫瘍の再発を抑制します。
すでに薬として認可され使用されている4000以上の物質から抗がん作用を示す物資を探索する研究が行われています。これを「薬品の再開発」と言います。
メベンダゾールは1968年に広範囲の寄生虫感染症の治療薬として開発され、成人だけでなく、妊婦や小児にも使用が可能です。包虫嚢胞には200 mg/kg/dayで48週間投与して副作用は軽微です。
Hh経路の構成成分は一次線毛に集まっています。メベンダゾールは一次繊毛の形成を阻害し、ヘッジホッグ・シグナル伝達系を阻害するという結果です。
【膵臓がんの抗がん剤治療の効果を高める治療】
最初に解説したように、膵臓がんの治療成績は極めて悪いのが現状です。
通常の抗がん剤治療だけでは、限界があります。膵臓がんになって少しでも生き延びる可能性を高めるためには、抗がん剤治療の効き目を高めることを総動員するしかありません。
解糖系やPI3K/Akt/mTORC1系を阻害するケトン食、2-デオキシ-D-グルコース、ラパマイシンやラパマイシン誘導体(エベロリムスなど)、ヘッジホッグ・シグナル伝達系を阻害するビタミンD3、メベンダゾール、半枝蓮と白花蛇舌草を使った漢方薬、アルデヒド脱水素酵素1A1を阻害するジスルフィラム、抗がん剤治療による酸化ストレスを高めるメトホルミン、オーラノフィン、レスベラトロールなどの併用が有用だと思います。魚の油に多く含まれるDHAとEPAも有効です。
これらの治療法は膵臓がんの抗がん剤治療の効果を高める可能性は高いのですが、標準治療では使用できません。保険診療機関では厚生労働大臣が認めた保険適用薬しか使用できないことが法律で定められているからです。
したがって、保険診療機関の医師に治療の全てを任せては、膵臓がんになって生き延びることはできません。自己責任と自分の意志で、治療を工夫するのが大切です。これは他のがんの治療でも同じです。
「保険適用されていない治療は有効性が証明されていないからだ」という意見を言う医師がいますが、これは間違っています。
儲けになる薬(つまり、特許が取れる新規の薬物)しか製薬会社は医薬品として開発し申請しません。製薬会社が開発・申請しなければ保険適用薬にはなりません。
保険で使用できない薬(厚生労働大臣が認可していない薬)の中にも、がんに有効なものは多数見つかっています。このような薬やサプリメントなどを利用すれば、がんの治療成績はもっと良くなります。がん治療の限界の原因の一つに保険診療という制度の存在があることを認識しないと、がんには勝てません。
◎ 膵臓がんの補完・代替医療についてはこちらへ
◎ 膵臓がんの抗がん剤治療の効果を高める方法はこちらへ
(漢方煎じ薬の解説はこちらへ)
| « 521)甘い果物... | 523)医療大麻... » |





