がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
724)ヘッジホッグ・シグナル伝達系をターゲットにしたがん治療:イトラコナゾール+ビタミンD3+メベンダゾール+ニトロキソリン
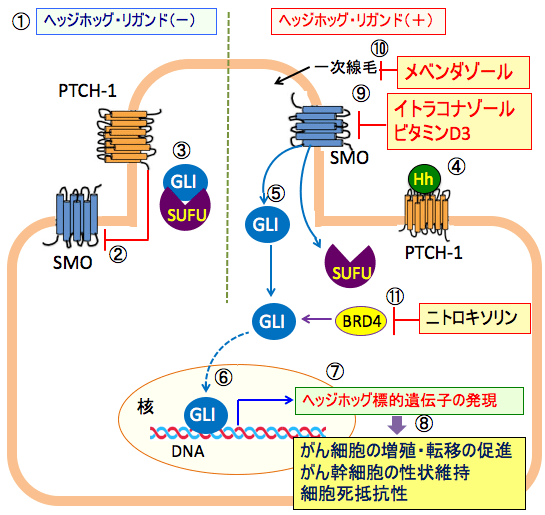
図:ヘッジホッグ・リガンドが無い状況(①)では、12回膜貫通型受容体の Patched-1 (PTCH-1) は7回膜貫通型のGiタンパク質共役受容体のSmoothened (SMO)を阻害している(②)。この状況では、転写因子のGLIはSUFUと結合して活性が阻害され、ヘッジホッグシグナル伝達系は作動しない(③)。PTCH-1にヘッジホッグ・リガンド(Hh)が結合すると(④)、PTCH-1のSMOを阻害する作用が失われ、GLIがSUFUから離れてフリーになり(⑤)、核に移行して(⑥)、ヘッジホッグ標的遺伝子の発現を亢進する(⑦)。その結果、がん細胞の増殖・転移の促進、がん幹細胞の性状維持、細胞死抵抗性の亢進が引き起こされる(⑧)。イトラコナゾールとビタミンD3はSMOに結合して、一次線毛への移動を阻害してSMOの働きを阻害してヘッジホッグシグナル伝達系を阻害する(⑨)。メベンダゾールは微小管重合を阻害して一次線毛の形成を阻害してヘッジホッグシグナル伝達系を阻害する(⑩)。ニトロキソリンはBETブロモドメインタンパク質BRD4の働きを阻害してGLI転写活性を阻害する(⑪)。これらを組み合わせると、ヘッジホッグシグナル伝達系を阻害し、がん細胞の増殖を抑制し、細胞死を誘導できる。
724)ヘッジホッグ・シグナル伝達系をターゲットにしたがん治療:イトラコナゾール+ビタミンD3+メベンダゾール+ニトロキソリン
【ヘッジホッグ(Hedgehog)シグナル伝達系はがん幹細胞の自己複製と増殖を制御している】
胚発生や成長の過程に関与する遺伝子やシグナル伝達系は、細胞の増殖や移動や分化の制御に重要な役割を果たしています。したがって、このような遺伝子やシグナル伝達系の異常は、がん細胞の発生や進行にも関与しています。つまり、がん遺伝子やがん抑制遺伝子の候補になります。
このような胎生期とがん発生過程に共通に関わっているシグナル伝達系の一つにヘッジホッグ・シグナル伝達系があります。
ヘッジホッグ・シグナル伝達系は、ショウジョウバエからヒトに至るまで進化的に保存されており、胎生期における組織や臓器の発生や成長において、細胞の増殖や分化や組織形成など多くの過程に重要な働きを行っています。
成長した組織においては、組織幹細胞の維持や、傷害を受けた組織の修復や再生に重要な役割を担っています。
ヘッジホッグは細胞から分泌されて、その細胞自身(オートクリン)あるいは近くの細胞(パラクリン)の細胞膜にあるPatched-1 (PTCH-1)に結合することによってこのシグナル伝達系が活性化されて、細胞の増殖や移動や分化などの調節を行います。
ヘッジホッグ(Hedgehog)というのはハリネズミのことで、ヘッジホッグ遺伝子の機能を失ったショウジョウバエの胚が小さな歯のような突起物が密集しており、ハリネズミに似ていることからこのような名前になっています。
哺乳類のヘッジホッグにはソニック・ヘッジホッグ(Sonic Hedgehog)、インディアン・ヘッジホッグ(Indian Hegdehog)、デザート・ヘッジホッグ(Desert Hedgehog)の3種類がありますが、最も研究されているのは全身に発現が見られるソニック・ヘッジホッグ・シグナル伝達系です。
インディアン・ヘッジホッグ(インドはりねずみ)とデザート・ヘッジホッゴグ(エチオピアはりねずみ)は実在するハリネズミの種類から命名されていますが、ソニック・ヘッジホッグはセガ・ジェネシスのキャラクターのソニック・ザ・ヘッジホッグから名付けられています。つまり、ソニックヘッジホッグタンパク質は研究者の洒落で命名されたタンパク質です。

ソニック・ヘッジホッグ・シグナル伝達系は細胞膜にある12回膜貫通型の受容体のPatched-1 (PTCH-1)にソニック・ヘッジホッグが結合することによって開始されます。
PTCH-1は7回膜貫通型のGiタンパク質共役受容体のSmoothened (SMO)を阻害する作用がありますが、PTCH-1にソニック・ヘッジホッグが結合するとPTCH-1のSMOを阻害する作用が失われます。その結果、SMOが活性化され、活性化したSMOによって転写因子のGLIが活性化されてヘッジホッグ標的遺伝子の発現が活性化されることになります。(下図)

図:ヘッジホッグが無いときは、PTCH-1(Patched-1)は一次線毛に位置して(①)、SMO(Smoothened)の一次線毛への移動を阻害しているので、SMOは作用できない(②)。その結果、転写因子のGLIはPKA、 CK1、GSK3βでリン酸化され(③)、転写抑制活性のあるGLIRに変換され(④)、ヘッジホッグ標的遺伝子の発現が阻止されている(⑤)。ヘッジホッグ(Hh)が存在すると(産生されると)、HhがPTCH-1に結合し(⑥)、SMOの阻害は解除されて一次線毛に移動し(⑦)、転写因子のGLIはKF7とSUFUから離れ(⑧)、核に移動して転写因子GLI 1/2Aとなって(⑨)、ヘッジホッグ標的遺伝子の発現を誘導し(⑩)、細胞の増殖・移動・分化を制御する(⑪)。
つまり、PTCH-1は発がんを抑制するがん抑制遺伝子であり、SMOはがん化を促進するがん遺伝子の作用を持っています。
一次線毛(primary cilium)は、哺乳類動物の多くの細胞において、細胞増殖を止めるときに、細胞表面に出現する1本の突起様の細胞器官です。一次線毛をもっている細胞の多くは、細胞周期のG0期の細胞分裂を止めた分化した細胞か幹細胞です。
さらに、この一次線毛には、様々な受容体、イオンチャンネル、トランスポーター蛋白、シグナル伝達因子などが集まって、細胞のシグナル伝達に重要な役割を持っています。線毛に圧を加える機械的な刺激や、増殖因子やホルモンなどの化学的な刺激に反応して、これらの細胞外の情報を細胞内に伝えます。
このような作用によって、一次線毛は、細胞の分裂・アポトーシス・分化・移動などの調節に関わり、組織や臓器の発生や恒常性維持に重要な役割を果たしており、細胞のアンテナとしての多様な機能に注目が集まっています。
ヘッジホッグ経路の構成成分は一次線毛に集まっています。ヘッジホッグが無いときは、PTCH-1(Patched-1)は一次線毛に位置して、SMO(Smoothened)の一次線毛への移動を阻害しているので、ヘッジホッグ・シグナル伝達系が作動しないということです。
ヘッジホッグがPTCH-1に結合すると、PHCH-1は一次線毛から離れて、SMOが一次線毛に移動してGLIをフリーにして核に移動し、ヘッジホッグ標的遺伝子の発現を誘導するというのがヘッジホッグシグナル伝達系です。
基底細胞がん、髄芽腫、悪性リンパ腫、白血病、卵巣がん、乳がん、膵臓がん、肺がん、肝臓がん、胃がん、結腸直腸がん、前立腺がん、膀胱がんなど多くのがん細胞種において、ヘッジホッグ・シグナル伝達系の異常な活性化が観察されています。
人間のがんの30%以上にヘッジホッグシグナル系の亢進が認められるという報告もあります。
基底細胞がんや髄芽腫ではほぼ100%の腫瘍にヘッジホッグ系に異常が認められ、膵臓がんでは70%以上に異常が認められると報告されています。
ヘッジホッグシグナル伝達系の活性亢進は、がんの発生過程だけでなく、より浸潤性の高いがん細胞への変化や抗がん剤治療への抵抗性を引き起こしています。
したがって、この経路を阻害すると、がん細胞の増殖や転移を抑制し、抗がん剤治療が効きやすくなることが予想できます。特にmTORC1(哺乳類ラパマイシン標的タンパク質複合体1)の活性とヘッジホッグ・シグナル伝達系の2つの経路を同時に阻害すると、抗腫瘍効果が相乗的に高まることが多くの研究で示されています。
【がん幹細胞はmTORとヘッジホッグ経路が活性化している】
がん幹細胞はがん組織中に少数(数%程度)存在しています。そして、がん幹細胞は正常な組織幹細胞と同様、特別な微小環境中に存在し、周りの細胞から分泌される液性因子などによって、多分化能の維持や分裂増殖が制御されていると考えられています。
がん幹細胞の自己複製や増殖を制御しているシグナル伝達系としてヘッジホッグ(Hedgehog)、mTOR、Notch、Wnt-β-Cateninなどがあります。
膵臓がんのがん幹細胞ではmTORの活性とヘッジホッグシグナル伝達系の活性が非常に亢進しており、これらの経路を阻害すると抗がん剤治療の効果が高まるという報告があります。
以下のような報告があります。
Combined targeted treatment to eliminate tumorigenic cancer stem cells in human pancreatic cancer.(ヒト膵臓がんの腫瘍形成性がん幹細胞を消滅させる標的治療の組合せ)Gastroenterology. 137(3):1102-13. 2009年
【要旨】
研究の背景と目的:膵臓がんは、腫瘍形成性のがん幹細胞の存在により、抗がん剤治療に対して非常に強い抵抗性を示し、ジェムザール治療中もがん幹細胞は生き延び、数を増やしている。ソニック・ヘッジホッグ(sonic hedgehog)シグナル伝達系と哺乳類ラパマイシン標的タンパク質(mammalian target of rapamycin:mTOR)は、いずれもがん幹細胞の自己複製に必須であるため、膵臓がん治療の新たなターゲットとして期待できる。
方法:膵臓がんの培養細胞を使った実験系と動物移植腫瘍を使った実験系を用いて、腫瘍形成性がん幹細胞に対するソニック・ヘッジホッグ阻害剤(cyclopamine/CUR199691)とmTOR阻害剤(ラパマイシン)の効果を検討した。
結果:驚くべきことに、ソニック・ヘッジホッグ阻害剤のシクロパミン(cyclopamine)もラパマイシン(rapamycin)もそれぞれ単独ではがん幹細胞の数を減らすことはできなかった。また、それぞれを単独で抗がん剤治療と併用した場合もがん幹細胞の数を減らすことはできなかった。
ソニック・ヘッジホッグ阻害とmTOR阻害と抗がん剤の3つを同時に併用した場合にのみ、がん幹細胞の数が検出できないレベルまで減少することが、培養細胞を使ったin vitroの実験と移植腫瘍を用いた動物実験(in vivo)の両方で認められた。最も重要なことは、これら3種類を組み合わせた治療によって、ヒト由来の膵臓がん細胞を移植されたマウスは生存期間が顕著に延長したことである。
結論:ソニック・ヘッジホッグとmTORの両方のシグナル伝達系の阻害を通常の抗がん剤治療と併用することによって膵臓がんのがん幹細胞を消滅させることが可能になる。この治療法をさらに検討することは、治療が困難で予後が極めて不良な膵臓がんの新たな治療法の開発につながる。
ヘッジホッグシグナル経路は、様々ながんの発生や進展にも関与していることが明らかになっており、特にがん幹細胞の自己複製能の維持に重要な役割を担っています。
つまり、ヘッジホッグ・シグナル伝達系に関与するタンパク質の遺伝子の変異や発現亢進が組織幹細胞に起こるとがん幹細胞になってがんが発生するということです。
そのため、ヘッジホッグシグナル経路の阻害剤ががん治療薬として開発されており、すでに認可されているものもあり、多くの薬の臨床試験が行われています。
この実験で使用されているシクロパミン(cyclopamine)は米国に自生するバイケイソウという植物からみつかった天然有機化合物で、ヘッジホッグシグナル伝達系を阻害する作用があり、この誘導体ががん治療薬として開発されています。
バイケイソウを食べた羊から生まれた子羊に単眼症などの奇形が多く発生し、その原因物質としてシクロパミンが同定され、これがヘッジホッグ経路を阻害するために胚発生過程の臓器形成に異常が生じて奇形が起こることが明らかになっています。
mTORはラパマイシンの標的分子として同定されたセリン・スレオニンキナーゼで、細胞の分裂や生存などの調節に中心的な役割を果たすと考えられています。がん細胞や肉腫細胞の多くにおいてmTORが活性化されており、mTORの阻害はがん細胞や肉腫細胞の増殖を抑制し、抗がん剤や放射線治療の効き目を高める効果や細胞死(アポトーシス)を誘導する効果が示されています。すでに幾つかのmTOR阻害剤が開発され、抗がん剤として使用されています。
mTORもがん幹細胞の自己複製や増殖や抗がん剤耐性に関与していることが報告されています。
つまりヘッジホッグ経路とmTOR経路を同時に阻害すると、がん幹細胞の増殖や生存を阻害できるということです。
がん幹細胞は、成熟したがん細胞に比べて抗がん剤や放射線に抵抗性が強いため、治療後の再発の原因となっています。がん幹細胞を死にやすくすることががん治療の効果を高めることができるのですが、がん幹細胞は様々なメカニズムで死ににくくなっており、一つの方法だけでは限界があるようです。
この論文でも、抗がん剤治療+ソニック・ヘッジホッグ阻害も抗がん剤治療+mTOR阻害もがん幹細胞を減らすことができなかったという結果です。しかし、抗がん剤治療+ソニック・ヘッジホッグ阻害+mTOR阻害の3つを組み合わせると、膵臓がんのがん幹細胞を消滅できたという結果です。
膵臓がんに対するジェムザールの効果は極めて低いのですが、mTOR阻害とソニック・ヘッジホッグ阻害の2つを併用すると奏功率を高めることができるかもしれません。

図: PI3K/Akt/mTOR経路とヘッジホッグ(Hedgehog)経路は、自己複製能や不均等分裂などのがん幹細胞(Cancer Stem Cell)の性質を維持する上で重要は役割を果たしている。PI3K/Akt/mTOR経路は増殖因子や栄養によって活性化され、セリン・スレオニンキナーゼのmTORを活性化して様々なタンパク質をリン酸化して活性化することによって細胞の増殖を促進する。ソニック・ヘッジホッグ・シグナル伝達系は細胞膜にある受容体のPatched-1 (PTCH-1)にソニック・ヘッジホッグ(SHh)が結合することによって開始され、smoothened(SMO)を介してシグナルが伝達され、転写因子の活性化によって細胞の増殖や分化を制御する。この2つの経路を阻害するとがん幹細胞の増殖を抑え、抗がん剤感受性を高めることが報告されている。
【水虫治療薬のイトラコナゾールは多彩なメカニズムで抗がん作用を発揮する】
イトラコナゾール(商品名イトリゾール等)は、水虫等の白癬(はくせん)菌症、口腔や食道カンジダ症等に広く使用されています真菌(カビなど)治療薬です。真菌コレステロールを形成する主な酵素を阻害して真菌を死滅します。
イトラコナゾールには血管新生阻害作用が報告されています。さらに、ヘッジホッグシグナル伝達系の阻害作用、オートファジー誘導によるがん細胞の細胞死誘導作用などの報告があり、がんの代替治療薬としても注目を集めています。例えば、以下のような報告があります。
Itraconazole exerts its anti-melanoma effect by suppressing Hedgehog, Wnt, and PI3K/mTOR signaling pathways(イトラコナゾールは、ヘッジホッグ、Wnt、およびPI3K / mTORシグナル伝達経路を抑制することにより抗メラノーマ効果を発揮する)Oncotarget. 2017 Apr 25;8(17):28510-28525.
【要旨】
悪性黒色腫は、すべての皮膚がんの中で最も致命的な悪性腫瘍である。広く使用されている全身性抗真菌薬であるイトラコナゾールは、基底細胞がん、前立腺がん、および非小細胞肺がんに対する抗腫瘍効果について検討されている。
イトラコナゾールが悪性黒色腫に対して特定の抗腫瘍効果を有するかどうかは明らかになっていない。この研究の目的は、悪性黒色腫に対するイトラコナゾールの効果を検討し、その作用メカニズムの詳細を明らかにすることである。
In vivoの異種移植腫瘍マウスモデルにおいて、イトラコナゾールが、非イトラコナゾール投与マウスと比較して、黒色腫細胞の増殖を阻害し、黒色腫細胞移植マウスの生存を延長することを認めた。
また、イトラコナゾールで処理された腫瘍組織ではKi-67陽性細胞の減少が認められ、イトラコナゾールが細胞増殖を有意に阻害する可能性を示唆した。
in vitroの実験系で、イトラコナゾールはSK-MEL-28とA375の両方のヒトメラノーマ細胞の増殖とコロニー形成を阻害した。
さらに、イトラコナゾールはGli-1、Gli-2、Wnt3A、β-カテニン、およびサイクリンD1の発現を有意に抑制する一方で、Gli-3およびAxin-1の発現を亢進した。これは、ヘッジホッグ・シグナル伝達系とWntシグナル伝達経路に対するイトラコナゾールの強力な阻害効果を示している。
さらに、イトラコナゾールは、PI3K / mTORシグナル伝達経路(p70S6K、4E-BP1、AKTのリン酸化の抑制によって示される)を大幅に抑制するが、MEKまたはERKのリン酸化には影響しない。
我々のデータは、イトラコナゾールが、ヘッジホッグ、Wnt、およびPI3K / mTORシグナル伝達経路の阻害を介して悪性黒色腫細胞の増殖を阻害することを示唆している。
これらの結果は、イトラコナゾールがいくつかの強力な抗メラノーマ作用を持ち、ヘッジホッグ、Wnt、PI3K / mTORシグナル伝達経路の遮断を介して他の抗がん剤との相乗効果に役立つ可能性があることを示唆している。
以下のような報告もあります。
Expression of Hedgehog Signals and Growth Inhibition by Itraconazole in Endometrial Cancer(子宮体がんにおけるヘッジホッグシグナル系の発現とイトラコナゾールによる 増殖抑制) Anticancer Res. 2016 Jan;36(1):149-53.
この論文では、子宮体がんの手術摘出標本を用いて子宮体がん組織における Hedgehog シグナル系の発現を検討し、さらにイトラコナゾールのin vitro での抗腫瘍効果を検討しています。
子宮体がんでのヘッジホッグシグナル系の発現を確認し、子宮体がんの発生と進展にヘッジホッグシグナル系が関与している可能性を報告し、ヘッジホッグシグナル系の抑制が腫瘍増殖抑制のターゲットになる可能性を示しています。
イトラコナゾールは in vitro で子宮 体がん細胞株の増殖を抑制することを確認し、イトラコナゾールが通常内服用量で子宮体がんに対して 抗腫瘍効果がある可能性を報告しています。
イトラコナゾールがヘッジホッ グシグナル系抑制剤として、単剤あるいは化学療法と併用して、子宮体がんの治療に使用できる可能性を報告しています。
つまり、イトラコナゾールはヘッジホッグシグナル伝達系とmTOR経路の両方を阻害して、抗腫瘍効果を発揮する可能性が報告されています。
【ビタミンDは1000種類以上の遺伝子発現を誘導する】
皮膚で生成されたビタミンD3や食事やサプリメントで摂取したビタミンD3は、肝臓で25位が水酸化されて25-ヒドロキシビタミンD3になり、さらに腎臓で1位が水酸化されて1,25-ジヒドロキシビタミンD3 [1,25(OH)2ビタミンD3]になります。
この1,25(OH)2ビタミンD3が活性型で核内のビタミンD受容体に結合して遺伝子発現などに作用します。25-ヒドロキシビタミンD3[25(OH)ビタミンD3]はビタミンD3の体内貯蔵型として血中濃度を測定して体内のビタミンD3の貯蔵量の指標に使われます(下図)。

図:皮膚への紫外線(HV-B)照射でプロビタミンD3(7-dehydrocholesterol)から生成されるビタミンD3(Cholecalciferol)ならびに食事やサプリメントで摂取されるビタミンD3(①)は、肝臓で25-ヒドロキシラーゼ(25-hydroxylase)によって25(OH)ビタミンD3(Calcidiol)に変換され(②)、さらに腎臓で、1α-ヒドロキシラーゼ(1-alpha hydroxylase)によって(③)、活性型ビタミンD3である1,25(OH)2ビタミンD3(Calcitriol)になる(④)。活性型ビタミンD3と結合したビタミンD受容体は、遺伝子のビタミンD応答配列に結合して遺伝子発現を誘導し(⑤)、骨形成やカルシウム代謝、炎症、免疫、発がん、細胞増殖、分化、アポトーシスなど様々な生理機能の調節に関与する(⑥)。
ビタミンDは複数のメカニズムでがん細胞の増殖を抑制し、細胞の分化や死(アポトーシス)を誘導しますが、抗腫瘍効果の主なメカニズムは、核内のビタミンD受容体に結合して遺伝子発現に作用することです。
ビタミンD受容体(VDR)は核内受容体スーパーファミリーの一員です。
ヒトのVDRは427個のアミノ酸からなる分子量が約50kDaのタンパク質です。
VDRに活性型ビタミンDが結合すると、9-cisレチノイン酸が結合したレチノイドX受容体(RXR)とヘテロダイマー(ヘテロ二量体)を形成し、ビタミンD標的遺伝子のプロモーター上流に存在する特異的エンハンサー配列であるビタミンD応答配列に結合します。
リガンドが結合して核内受容体の構造が変化するとコアクチベーター(転写共役活性化因子)が結合できるようになり、転写を促進できるようになります。
ビタミンD応答配列(VDRE) のコンセンサス配列は、AGGTCAの基本配列が2つ直列に並び、モチーフ間が3bp 離れたものであると考えられており、この配列の 5′上流側にRXRが、3′下流側にVDRが結合します。(下図)

図:活性型ビタミンD3(1α,25(OH)2ビタミンD3:Calcitriol)と結合したビタミンD受容体(VDR)は9-シス-レチノイン酸に結合したレチノイドX受容体(RXR)とヘテロ二量体を形成してビタミンD標的遺伝子の上流にあるビタミンD応答配列に結合する。このヘテロ二量体に転写共役活性化因子(コアクチベーター)などの多くのタンパク質が結合して転写活性が亢進する。
ビタミンD受容体の活性化による増殖抑制には、細胞周期の G0/G1停止とアポトーシスが関与するとの報告が多く、細胞分化も増殖抑制に伴って誘導されると考えられています。
ビタミンDは細胞周期をストップさせるがん抑制遺伝子のp21とp27タンパク質の発現を誘導します。この2つのタンパク質は細胞周期のG0/G1停止を引き起こすサイクリン依存性キナーゼ阻害因子です。
細胞周期は,サイクリン(cyclin)/サイクリン依存性キナー ゼやp21Cip1, p27Kip1, p57Kip2などのサイクリン依存性キナーゼの阻害因子などにより厳密に制御されています。
p21Cip1 遺伝子のプロモーター上流にビタミンD応答配列が存在し、ビタミンD受容体による直接的な遺伝子制御でp21Cip1遺伝子が発現誘導されることが明らかになっています(下図)。

図:細胞が分裂して数を増やしていくとき、細胞周期は4 つの段階に分けられる。すなわち、DNA複製前のG1(Gap1) 期、DNA複製期(S期)、細胞分裂前のG2(Gap2)期、および最後の細胞分裂期(M) 期に分けられる。増殖を休止した状態の細胞はG0期にあると定義される(①)。増殖刺激は、サイクリン(Cyc)というタンパク質で活性化されるサイクリン依存性キナーゼ(CDK)を活性化してRbタンパク質をリン酸化する(②)。Rbタンパク質は転写因子のE2Fと結合してE2Fの活性を阻害しているが、Rbがリン酸化されるとE2Fと結合できなくなってE2Fがフリーになる(③)。フリーになったE2Fは増殖関連遺伝子の転写を促進することによって細胞周期をG1からS期に移行させて細胞周期を回す(④)。サイクリン依存性キナーゼ阻害因子(CDK阻害因子)のp21Cip1は、サイクリン依存性キナーゼ(CDK)を阻害して細胞周期をG1期で停止した状態に維持する(⑤)。食事やサプリメントで摂取したビタミンD3は体内で活性型の1,25(OH)2ビタミンD3(Calcitriol)になり、核内受容体のビタミンD受容体と結合してp21Cip1遺伝子の発現を亢進する(⑥)。p21cip1の発現は細胞増殖を停止する。
【ビタミンD3はmTORC1活性を阻害する】
ビタミンD3は循環器疾患やがんを含めて全死因死亡率を低下させることが報告されています。(394話参照)
ビタミンD3は感染症に対する抵抗力を高めます。最近の話題では、新型コロナウイルス感染症(COVID-19)の重症化を防ぐ効果が指摘されています。(702話参照)
トランプ大統領がCOVID-19に感染したとき、医師団は通常に治療に加えてビタミンD3も投与しています。メラトニンも投与しています。(メラトニンがCOVID-19に効く理由は696話参照)
最近は寿命を延ばす物質のリストにもビタミンD3が入っています。
以上の根拠から、私も1日に4000 IU前後のビタミンD3をサプリメントで摂取しています。
寿命を延ばすメカニズムとしては、解糖系の阻害やmTORC1(哺乳類ラパマイシン標的タンパク質複合体1)の活性抑制などがあります。
ビタミンDは、血清カルシウム濃度の恒常性や骨代謝における作用が主な働きだと考えられていますが、最近の研究によって、細胞の増殖や分化や細胞死(アポトーシス)や免疫機能など多彩な生理活性の制御に重要な役割を担っていることが明らかになっています。
ビタミンD3がmTORC1の活性を抑制する作用も報告されています。これは、活性型ビタミンD3(1,25(OH)2ビタミンD3)がビタミンD受容体を介するメカニズムでDDIT4(DNA-damage-inducible transcript 4)という遺伝子の発現を亢進し、このDDIT4がTuberous Sclerosis Complex 1/2(TSC1/2)を活性化し、これがRheb(Ras homolog enriched in the brain)を阻害してmTORC1の活性を抑制するという作用機序です。(下図)

図:インスリンやインスリン様成長因子-1(IGF-1)などの増殖刺激は受容体を介して(①)PI3K/Akt/mTORC1シグナル伝達系(②)を活性化して、がん細胞の増殖や浸潤や転移を促進し、抗がん剤抵抗性を亢進する(③)。ラパマイシンはmTORC1の活性を直接阻害する(④)。活性型ビタミンDの1,25(OH)2D(⑤)はビタミンD受容体(VDR)を介する遺伝子転写活性(⑥)によってDDIT4(DNA-damage-inducible transcript 4)タンパク質の発現を亢進し(⑦)、このDDIT4はTuberous Sclerosis Complex 1/2(TSC1/2)を活性化し、これがRheb(Ras homolog enriched in the brain)を阻害してmTORC1の活性を抑制するというメカニズムが報告されている(⑧)。
ラパマイシンはmTORC1を直接阻害するのですが、ビタミンD3はDDIT4とTSC1/2とRhebを介して間接的にmTORC1の活性を抑制する作用があるということです。全ての細胞に当てはまるわけではありませんが、一部のがん細胞(前立腺がん細胞など)では活性型ビタミンD3がmTORC1の抑制に関与している可能性が報告されています。
【ビタミンD3はヘッジホッグ・シグナル伝達系を阻害する】
ビタミンD3はヘッジホッグ・シグナル伝達系を阻害する作用が報告されています。以下のような報告があります。
Vitamin D3 triggers antitumor activity through targeting hedgehog signaling in human renal cell carcinoma.(ビタミンD3はヒト腎臓がん細胞においてヘッジホッグ・シグナル伝達系を介する機序で抗腫瘍活性を引き起こす)Carcinogenesis. 33(11): 2084-93, 2012年
【要旨】
人間の淡明細胞型腎細胞がん(clear cell renal cell carcinoma)は、近年における分指標的薬の進歩にもかかわらず、多くは治療抵抗性である。腎臓の臓器発生の過程で活性化するシグナル伝達系の幾つかは、腎細胞がんの発生過程で再び活性化される。そのようなシグナル伝達系の一つがソニック・ヘッジホッグ-Gliシグナル伝達系である。
興味深いことに、活性型ビタミンD3の前駆体であるコレカルシフェロール(cholecalciferol)が、ソニック・ヘッジホッグ-Gliシグナル伝達系を強力に阻害する作用を有することが報告されている。そこでこの研究では、細胞培養による実験系(in vitro)と移植腫瘍を用いた動物実験系(in vivo)において、淡明細胞型腎細胞がんに対するビタミンD3(コレカルシフェロール)の前臨床的な有効性を検討した。
淡明細胞型腎細胞がんの複数の細胞株と、淡明細胞型腎細胞がん患者から採取した腫瘍組織と正常組織において、ビタミンD3受容体とビタミンD3の代謝酵素の発現状況と、コレカルシフェロール投与による効果を検討した。
さらに、淡明細胞型腎細胞がん細胞を移植したマウスの実験系を用いて、コレカルシフェロールのがん細胞の増殖抑制や縮小効果を検討した。その有効性や副作用については週に1回の観察をもとに評価し、さらに血液検査やCT検査によって評価した。
ヒトの淡明細胞型腎細胞がんでは、ビタミンD3受容体とビタミンD3を活性型に変換する代謝酵素の発現量が顕著に低下していた。
コレカルシフェロールの投与は、ソニック・ヘッジホッグ-Gliシグナル伝達系を阻害して、がん細胞の増殖を抑制し、細胞死を増加した。
がん細胞を移植したマウスの実験系では、コレカルシフェロールの投与により、がん組織の発生が阻止され、がん組織が増大してから投与した場合はがん組織を縮小した。
ビタミンD3投与による副作用(石灰化やカルシウムの再吸収)は認めず、安全性には問題なかった。
これらの結果より、淡明細胞型腎細胞がん細胞ではビタミンD3受容体も、ビタミンD3を活性型に変換する代謝酵素も欠損していたが、ビタミンD3の投与は、淡明細胞型腎細胞がん細胞におけるソニック・ヘッジホッグ・シグナル伝達系の再活性化を阻止する強力な治療法であり、その結果、腫瘍を縮小させる効果がある。つまり、コレカルシフェロールはヒトの淡明細胞型腎細胞がんにおいて有効性の高い治療法かもしれない。
淡明細胞型腎細胞がんではビタミンD3の受容体も活性型に変換する代謝酵素も発現が無いという結果ですが、他の多くのがん細胞ではビタミンD受容体は発現しており、1,25(OH)2ビタミンD3ががん細胞の増殖を抑制し分化を誘導する作用を持つことが多くの研究で証明されています。
さらに、ビタミンD3(=コレカルシフェロール)自体にソニック・ヘッジホッグ・シグナル伝達系を阻害する作用が明らかになっています。そのメカニズムはSmoothened(SMO)の働きを阻害するためと言われています。
ビタミンD3の活性型であるカルシトリオール(1,25(OH)2D3)もSMOに作用してソニック・ヘッジホッグ・シグナル伝達系を阻害する作用が報告されています。
つまり、紫外線で皮膚で作成されたビタミンD3や食品やサプリメントで摂取されたビタミンD3は、それ自体がソニック・ヘッジホッグ・シグナル伝達系を阻害して抗腫瘍作用を示し、さらにビタミンD3が活性化された1,25(OH)2ビタミンD3(カルシトリオール)はビタミンD3受容体を介した転写活性によってがん細胞の増殖抑制や分化誘導を引き起こします。(下図)

図:ビタミンD3(コレカルシフェロール)は肝臓で25位が水酸化されて25(OH)ビタミンD3となり(①)、さらに腎臓で1位が水酸化されて1,25(OH)2ビタミンD3となって活性型となる(②)。1,25(OH)2ビタミンDはビタミンD受容体(VDR)と結合し(③)、9-シス-レチノイン酸(9-シス-RA)と結合したレチノイドX受容体(RXR)とヘテロダイマーを形成して遺伝子のプロモーター領域のビタミンD応答配列に結合し(④)、ビタミンDの標的の遺伝子の転写を促進する(⑤)。ビタミンDの標的遺伝子の発現を誘導することによって、ビタミンDはカルシウム代謝の制御や細胞増殖抑制、分化誘導、アポトーシス誘導などの生理活性を示す(⑥)。一方、がん細胞ではソニック・ヘッジホッグ・シグナル伝達系が活性化しており、ヘッジホッグ標的遺伝子の発現が亢進し(⑦)、がん細胞の増殖や生存や移動が亢進している(⑧)。ビタミンD3と1,25(OH)2ビタミンD3はSmoothened(SMO)の活性を阻害する作用によってソニック・ヘッジホッグ・シグナル伝達系を阻害する(⑨)。
がんの補完・代替療法ではサプリメントのビタミンD3を大量に摂取します。ビタミンD3が体内で活性型になって抗腫瘍効果を発揮するという観点から、医薬品の活性型ビタミンD3(コレカルシトール)を使っている場合があります。
サプリメントのビタミンD3は体内で活性型になり、活性型が増えるとフィードバックのメカニズムで活性型の合成を止めます。したがって、ビタミンD3を過剰に摂取してもビタミンDの過剰症は発生しません。
一方、活性型ビタミンD3は過剰に摂取すると過剰症による副作用(高カルシウム血症、尿結石、血管の石灰化など)が発生します。
さらに、ビタミンD3は活性化型でない前駆体のビタミンD3(コレカルシフェロール)自体に、ヘジホッグシグナル伝達系を阻害する作用もあります。
つまり、がん治療に使用する場合、ビタミンD3は医薬品の活性型(コレカルシトール)でなくサプリメントのビタミンD3(コレカルシフェロール)の方が良いということです。がんの治療には、骨粗鬆症の治療に使われている活性型でなく、サプリメントのビタミンD3を多めに摂取するのが重要と言えます。
がん治療において、数千国際単位から数万国際単位の高濃度のビタミンD3の補充は、試してみる価値はあるように思います。米国では1カプセルが10000 IU以上の製剤も普通のサプリメントとして販売されています。
【メベンダゾールは一次線毛の形成を阻害してヘッジホッグ・シグナル伝達系を阻害する】
メベンダゾール(Mebendazole)はベンゾイミダゾール系の広範囲作用型の寄生虫治療薬(駆虫薬)です。線虫、条虫(サナダムシ)、回虫など多くの寄生虫に広く作用します。
メベンダゾールはいくつかのプロテインキナーゼと作用して抗腫瘍活性を示すことが薬剤スクリーニングで明らかになっています。
このような薬剤のスクリーニングとは関係なく、多形神経膠腫に対するメベンダゾールの効果は2011年に偶然に発見されました。
グリオブラストーマを移植したマウスを使った研究で、マウスにおけるギョウ虫の繁殖を防ぐ目的でフェンベンダゾールを投与したマウスでは移植腫瘍が増大しないことが発見されました。フェンベンダゾールは動物に使われるベンゾイミダゾール系の寄生虫治療薬の一種です。さらに研究を進め、ベンゾイミダゾール系薬物の中でメベンダゾールが最も強力にグリオブラストーマの増殖を抑制することが明らかになりました。
コンピュータを使った構造解析や結合活性の解析でメベンダゾールが「TRAF2およびNCK相互作用キナーゼ(TRAF2- and NCK-interacting kinase :TNIK)」の阻害剤として有用である可能性が報告されています。
TNIK(TRAF-2 and NCK-interacting kinase)はセリン・スレオニンキナーゼで、このキナーゼ活性(タンパク質をリン酸化する活性)は結腸直腸がんの増殖活性の維持に必須であることが報告されています。
Wnt/βカテニン経路の最終段階であるβカテニンとTCFの相互作用において、TNIKはTCFのセリン154をリン酸化します。このリン酸化がβカテニン/TCFの遺伝子転写活性に必要だと言うことです。
したがって、TNIKの阻害剤は大腸がんのようにWnt/βカテニンシグナル伝達系が亢進したがんの治療に有効と考えられており、多くの製薬会社が開発しています。
まだ臨床的に使用できるものはありませんが、何十年も前から多くの国で使用されている駆虫薬のメベンダゾールが、TNIKの阻害剤としてかなり有望だという報告です。
ビンクリスチン(Vincristine)はニチニチソウ(Vinca rosea)から発見されたアルカロイドで、造血器腫瘍や脳腫瘍や軟部肉腫を含めて多くのがんの治療に使用されています。
ビンクリスチンはチューブリン二量体に結合し、微小管構造形成を阻害して有糸分裂を中期で停止させます。
メベンダゾールはビンクリスチンより抗がん活性が高いという報告があります。
メベンダゾールの駆虫作用と抗がん作用の主なメカニズムは微小管の重合阻害作用です。
さらに、メベンダゾールは様々なプロテイン・キナーゼの活性を阻害する作用があります。
前述のWnt/βカテニン経路のTRAF2およびNCK相互作用キナーゼ(TRAF2- and NCK-interacting kinase :TNIK)の他に、血管内皮細胞増殖因子受容体のキナーゼ活性を阻害して血管新生を阻害する作用が報告されています。
血管内皮細胞増殖因子受容体(VEGFR)は血管内皮細胞増殖因子(VEGF)をリガンドとする受容体型チロシンキナーゼの一種で、血管内皮細胞の増殖と遊走の促進や血管透過性の亢進などに関与しています。
がん細胞は腫瘍組織に対して酸素や栄養を運搬する血管を増やすため、VEGFの産生を亢進します。VEGFは血管内皮細胞のVEGFRを刺激することにより血管新生を促進します。
したがって、VEGF受容体の活性化を阻害する作用は血管新生を阻害する作用があり、腫瘍組織の増殖を阻止し、転移を抑制します。VEGFRには幾つかのアイソフォームがありますが、血管新生に最も大きく関与しているVEGFR-2のチロシンキナーゼ活性を阻害する作用がメベンダゾールに指摘されています。
メベンダゾールがヘッジホッグ・シグナル伝達系を阻害する作用も報告されています。以下のような報告があります。
Repurposing the antihelmintic mebendazole as a hedgehog inhibitor(ヘッジホッグ阻害剤としての抗寄生虫薬メベンダゾールの再利用)Mol Cancer Ther. 2015 Jan; 14(1): 3–13.
【要旨】
ヘッジホッグ(hedgehog)シグナル伝達系は多くの種類のがん細胞で活性化されており、したがって、新規の抗がん剤の開発に有望なターゲットになっている。
この研究では、線虫や包虫などの寄生虫感染症に古くから使用され、安全性が確かめられているベンズアミダゾールの一種のメベンダゾール(mebendazole)が、臨床的に達し得る濃度で、ヘッジホッグ・シグナル系を強力に阻害し、ヘッジホッグが活性化している髄芽腫細胞の増殖を抑制することを示した。
抗寄生虫薬としては、メベンダゾールは線虫のチューブリン(tubulin)に結合し、腸管の微小管合成を阻害する。
ヒトの細胞に対しては、微小管関連の細胞内小器官で、ヘッジホッグ経路の活性化のシグナル伝達の中心をなす一次線毛(primary cilium)の形成を抑制する。
メベンダゾールによるヘッジホッグ・シグナル伝達系の阻害は、ヘッジホッッグ・シグナル伝達経路を担っている膜タンパク質のSMO(Smoothened)の遺伝子変異(ヘッジホッグ・シグナル伝達系阻害剤であるビスモデギブに耐性の細胞クローンに選択的に認められる)に影響を受けない。
ビスモデギブ(Vismodegib)とメベンダゾールの併用は、ヘッジホッグ・シグナル伝達系を相加的に阻害する。
メベンダゾールは成人や小児に高用量で長期間投与しても副作用は少なく安全に投与できるので、ヘッジホッグ・シグナル伝達系が活性化している多くの腫瘍に対する治療薬として、メベンダゾールの再利用を検討する臨床試験を早急に実施することを提案する。
ヘッジホッグ阻害剤の探索で、ビンブラスチン(vinblastine)、ビンクリスチン(vincristine)、パクリタキセル(paclitaxel)など微小管に作用する抗がん剤にヘッジホッグ阻害活性があることが報告されています。
メベンダゾールは一次線毛の形成を阻害し、ヘッジホッグ経路のタンパク質の発現を低下させ、ヘッジホッグシグナル伝達系が恒常的に活性化しているヒト髄芽腫細胞の増殖と生存を低下させます。メベンダゾールは変異したSMOの活性化を阻害し、腫瘍の再発を抑制します。
すでに薬として認可され使用されている4000以上の物質から抗がん作用を示す物資を探索する研究が行われています。これを「薬品の再開発」と言います。
ヘッジホッグ経路の構成成分は一次線毛に集まっています。メベンダゾールは一次線毛の形成を阻害し、ヘッジホッグ・シグナル伝達系を阻害するという結果です。

図:細胞分裂の際に複製されたDNA(染色体)は微小管によってそれぞれの細胞に分けられる(①)。微小管はαチュブリンとβチュブリンが結合したヘテロ二量体を基本単位として構成され、チュブリンのヘテロ二量体が繊維状につながったものをプロトフィラメントと呼び、これが13本集まって管状の構造(直径25nm)になったものが微小管となる。メベンダゾールはチュブリンに結合して微小管の重合を阻害し、細胞分裂のM期を停止させてアポトーシスを起こす(②)。血管内皮細胞の血管内皮細胞増殖因子受容体-2(VEGFR-2)に血管内皮細胞増殖因子(VEGF)が結合するとVEGFR-2は二量体を形成し、チロシンキナーゼドメインに存在するチロシン残基の自己リン酸化が引き起こされ、細胞内のシグナル伝達系が活性化され、血管内皮細胞の増殖や血管形成が促進されて血管新生が促進する(③)。メベンダゾールはVEGFR-2の活性化を阻止して血管新生を阻害する(④)。Wntが受容体のFrizzledとLRP5/6に結合してWntシグナルが活性化されるとβ-カテニンが細胞質内で増加して核内に移行して転写因子のTCFに結合し、β-カテニン/TCFのターゲット遺伝子(c-mycやサイクリンD1など)の転写を促進して、細胞の増殖を亢進する(⑤)。 メベンダゾールはTCFを活性化するキナーゼのTNIK (Traf2- and Nck-interacting kinase)を阻害してTCFの転写活性を阻害する(⑥)。メベンダゾールは多彩なメカニズムで、がん細胞の増殖を阻止し、細胞死を誘導する。
【BETファミリータンパク質ががん治療のターゲットとして注目されている】
がん細胞の発生原因は、がん遺伝子やがん抑制遺伝子の変異、すなわち塩基配列上の変化が蓄積し、細胞増殖や接着や細胞死などの制御が異常になることによると考えられています。さらに、遺伝子の塩基配列の変化を伴わない遺伝子の発現異常,すなわちエピジェネティクスの機序による遺伝子発現異常も発がんに大きく寄与していることが近年明らかになってきました。
多くのがん細胞において、がん遺伝子や抗アポトーシスタンパク質(Bcl-2など)の発現上昇が確認されています。これらのタンパク質はがん細胞の増殖を促進し、細胞死(アポトーシス)に抵抗性になります。
BETファミリータンパク質は高アセチル化ヒストンへの結合を介して、がん遺伝子や抗アポトーシスタンパク質の発現を促進する作用があります。
ブロモドメインはヒストンのアセチル化リシンを認識し,制御タンパク質を集めてクロマチン構造や遺伝子発現を制御する機能が知られているタンパク質ドメインです。
ブロモドメイン繰り返し配列および特異的末端配列を持つBET(bromodomain and extra-terminal)ファミリータンパク質としてBRD2,BRD3,BRD4,BRDTが知られています。
ヒストンのアセチル化による遺伝子発現の制御には、アセチル化を促進するヒストンアセチル基転移酵素、ヒストンからアセチル基を除去するヒストン脱アセチル化酵素、ヒストンのアセチル化した部分を認識するBETファミリータンパク質の3つが必要です。
ヒストンアセチル基転移酵素の「書き屋(Writer)」とヒストン脱アセチル化酵素の「消し屋(Eraser)」と、BETファミリータンパク質の「読み屋(Reader)」の3つの役割を担うタンパク質が、ヒストンアセチル化の制御を行ってます。

図:「書き屋(Writer)」のヒストンアセチル基転移酵素によってヒストンにアセチル基が結合し(①)、「消し屋(Eraser)」のヒストン脱アセチル化酵素によってアセチル基が除去される(②)。ヒストンアセチル化の少ない部分では遺伝子転写は抑制される(③)。「読み屋(Reader)」のBETファミリータンパク質はヒストンのアセチル化リシンと結合して(④)、転写を制御するタンパク質をリクルートして遺伝子転写を促進する(⑤)。
BETファミリータンパク質は、c-Mycなどのがん遺伝子やBcl-2などの抗アポトーシスタンパク質の転写を亢進します。
したがって、ヒストンのアセチル化リシンとBETファミリータンパク質のブロモドメインの結合を阻害する薬剤をがん細胞に投与すると、遺伝子発現パターンが正常細胞に近づくことが知られています。
ヒストンとBETファミリータンパク質の結合を阻害する低分子化合物(BET阻害剤)が、がんや炎症性疾患の治療薬として注目されています。臨床試験が行われているBET阻害剤が幾つかあります。
このようなBET阻害剤は、ある種のがん細胞に投与すると腫瘍促進遺伝子の発現を選択的に抑制することから、がん治療薬としての可能性が期待されています。
【ニトロキソリンはBRD4を阻害してヘッジホッグシグナル伝達系を阻害する】
BETブロモドメインタンパク質BRD4はSMOおよびSUFUの下流のGLI転写活性を調節することが報告されています。以下のような報告があります。
Epigenetic targeting of Hedgehog pathway transcriptional output through BET bromodomain inhibition(BETブロモドメイン阻害によるヘッジホッグ経路転写出力のエピジェネティックなターゲティング)Nat Med. 2014 Jul; 20(7): 732–740.
【要旨】
ヘッジホッグシグナル伝達経路はいくつかのがん細胞の発がん過程を促進する。この経路を標的とするがん治療薬が開発されており、特にSmoothenedの阻害がターゲットになっている。
しかしながら、Smoothenedまたはその下流のヘッジホッグ経路のタンパク質の遺伝的変化によってSmoothened阻害剤に対する耐性が発生する。
ここでは、BETブロモドメインタンパク質の阻害を介してGLI転写を調節することにより、これらの耐性メカニズムを克服できることを示す。
BETブロモドメインタンパク質BRD4はSMOおよびSUFUの下流のGLI転写活性を調節する。BRD4がGLI1およびGLI2プロモーターを直接結合することがクロマチン免疫沈降研究により明らかになり、BRD4を標的とする小分子阻害剤であるJQ1で処理すると、GLI1およびGLI2プロモーターにおけるBRD4の結合が大幅に減少することが明らかになった。
全体的に、髄芽腫特異的GLI1結合部位に関連する遺伝子は、JQ1治療によって発現が低下し、これはBRD4によるGLI活性の直接調節を支持する。特に、ヘッジホッグ駆動性腫瘍(基底細胞癌、髄芽腫、異型奇形腫/ラブドイド腫瘍)は、Smoothened阻害剤に抵抗性を示す遺伝子変異を有する場合でもBRD4阻害剤のJQ1に応答する。
ニトロキソリンはBRD4阻害作用があります(下図)。657話参照

図:ヒストン脱アセチル化酵素によってヒストンのアセチル化が低下するとクロマチンが凝集して遺伝子転写活性は抑制される(①)。ヒストンアセチル基転移酵素によってヒストンがアセチル化されるとクロマチンが緩み、遺伝子転写活性が亢進する(②)。ヒストンのアセチル化されたリシンを認識するブロモドメインの繰り返し配列と特異的末端配列を持つBET(bromodomain and extra-terminal)ファミリータンパク質(③)は、ヒストンのアセチル化リシンに結合し、転写因子やRNAポリメラーゼなどの転写に必要なタンパク質をリクルートして、がん遺伝子(c-Mycなど)や抗アポトーシスタンパク質(Bcl-2など)の転写を活性化する(④)。その結果、がん細胞の増殖を促進し、細胞死(アポトーシス)に抵抗性になる(⑤)。ニトロキソリンはアセチル化リシンとブロモドメインの結合を阻害する(⑥)。その結果、がん細胞の増殖を抑制し、細胞死を誘導する。
BRD4はGLI1とGLI2の転写活性の制御に重要な役割を担っています。したがって、BRD4阻害はヘッジホッグ経路が亢進しているがん細胞の増殖を阻害できます。
ニトロキソリンはBRD4阻害作用によってヘッジホッグシグナル伝達系を阻害する可能性があります。Smoothened阻害剤に抵抗性を示す腫瘍もBRD4阻害剤のニトロキソリンを併用すると、ヘッジホッグシグナル伝達系を十分に阻害できる可能性があります。

図:ヘッジホッグシグナル伝達系は転写因子のGLIを活性化する(①)。ヒストンのアセチル化されたリシンを認識するブロモドメインの繰り返し配列と特異的末端配列を持つBET(bromodomain and extra-terminal)ファミリータンパク質の一つのBRD4は、ヒストンのアセチル化リシンに結合し、転写因子やRNAポリメラーゼなどをリクルートして(②)、ヘッジホッグ標的遺伝子の転写を促進する(③)。ニトロキソリンはBRD4の第一ブロモドメインとアセチル化ヒストンの結合を阻害する(④)。その結果、転写因子やRNAポリメラーゼのリクルートが阻害され(⑤)、ヘッジホッグ標的遺伝子の転写を抑制する(⑥)。
以上から、SMOを阻害するイトラコナゾール、ビタミンD3、一次線毛の形成を阻害するメベンダゾール、BRD4を阻害するニトロキソリンの併用は、ヘッジホッグシグナル伝達系とmTORC1経路を阻害して、抗腫瘍効果を発揮できます。

図: 2回膜貫通型受容体のPatched-1(PTCH-1)にヘッジホッグ(Hh)結合すると(①)、7回膜貫通型のGiタンパク質共役受容体のSmoothened (SMO)は一次線毛に移行し(②)。GLIがSUFUから離れてフリーになり(③)、核に移行して(④)、ヘッジホッグ標的遺伝子の発現を亢進する(⑤)。その結果、がん細胞の増殖・転移の促進、がん幹細胞の性状維持、細胞死抵抗性の亢進が引き起こされる(⑥)。イトラコナゾールとビタミンD3はSMOに結合して、一次線毛への移動を阻害してSMOの働きを阻害してヘッジホッグシグナル伝達系を阻害する(⑦)。メベンダゾールは微小管重合を阻害して一次線毛の形成を阻害してヘッジホッグシグナル伝達系を阻害する(⑧)。ニトロキソリンはBETブロモドメインタンパク質BRD4の働きを阻害してGLI転写活性を阻害する(⑨)。これらを組み合わせると、ヘッジホッグシグナル伝達系を阻害し、がん細胞の増殖を抑制し、細胞死を誘導できる。
| « 723)小胞体ス... | 725)NAD+前駆... » |



