がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
723)小胞体ストレス+オートファジー阻害+プロテアソーム阻害によるアポトーシス誘導
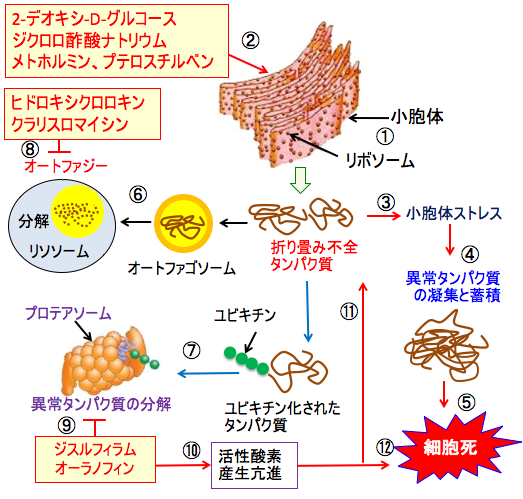
図:リボソームで合成されたタンパク質は小胞体で折り畳みや翻訳語修飾を受けて正常な機能を持ったタンパク質になる(①)。2-デオキシ-D-グルコースはグルコースの利用を妨げる作用と、糖タンパク質の糖鎖の異常を引き起こす作用によって変異タンパク質を増やし、ジクロロ酢酸ナトリウムやメトホルミンやプテロスチルベンはミトコンドリアの活性酸素の産生を増やして酸化ストレスを高め、変異タンパク質を増やす(②)。小胞体内で折り畳み不全のタンパク質が増えると小胞体ストレスを引き起こし(③)、小胞体ストレスが亢進すると異常タンパク質の凝集と蓄積によって(④)、細胞死(アポトーシス)が起こる(⑤)。細胞はオートファジー(⑥)とユビキチン・プロテアソーム系(⑦)で異常タンパク質を分解することによって小胞体ストレスを軽減する。ヒドロキシクロロキンとクラリスロマイシンはオートファジーの過程を阻害する(⑧)。ジスルフィラムとオーラノフィンはプロテアソームでのタンパク分解を阻害する(⑨)。さらに、ジスルフィラムとオーラノフィンは活性酸素の産生を増やし(⑩)、酸化ストレスを亢進して変異タンパク質を増やし(⑪)、さらに細胞死を促進する(⑫)。これらの薬剤の組合せは、がん細胞内で異常なタンパク質を蓄積し、小胞体ストレスを亢進して細胞死を誘導できる。
723)小胞体ストレス+オートファジー阻害+プロテアソーム阻害によるアポトーシス誘導
【細胞内のタンパク質はプロテアソームとオートファジーで分解される】
細胞におけるタンパク質の分解には、ユビキチン・プロテアソーム系とオートファジー・リソソーム系の2つがあります。
ユビキチン・プロテアソーム系はタンパク質に付加されたユビキチン鎖をプロテアソームが認識し,ATP依存的に標的タンパク質を分解するシステムです。
ユビキチン(Ubiquitin)は,アミノ酸76残基からなり,酵母からヒトまであらゆる真核細胞に存在する進化的に保存されたタンパク質です。
ユビキチンは不要なタンパク質、たとえば折り畳み不全などの出来損なったタンパク質や古くなったタンパク質にユビキチンリガーゼによって複数個付加(ポリユビキチン化)されることで、タンパク質分解のシグナルとして働きます。つまり、「このタンパク質を分解してくれ」という目印になります。
ユビキチン自体はあくまで目印なので、分解を行うのは他の物質です。ユビキチンが結合した不要たんぱく質をシュレッダーのように分解する酵素をプロテアソームといいます。
プロテアソームは真核生物のATP依存性プロテアーゼ複合体で、分解目印として働くユビキチンが結合したたんぱく質を選択的に壊す複雑な細胞内装置です(下図)。

図:分解されるタンパク質はユビキチンが複数個結合し、ユビキチンが結合したタンパク質をプロテアソームが認識して、タンパク質を分解する。分解されたタンパク質に結合していたユビキチンは再利用される。
オートファジー(Autophagy)は細胞内タンパクや小器官を二重の脂質膜で包み込み,これをリソソームに輸送し分解する一連のプロセスです。
「auto-」はギリシャ語の「自分自身」を表す接頭語で「phagy」は「食べること」の意で、「自食(じしょく)」と日本語訳されています。
リソソーム(lysosome)は多くの加水分解酵素を含み、消化作用を行う細胞小器官です。
プロテアソームがユビキチン化されたタンパク質を標的として選択的に分解するのに対し、オートファジーでは細胞内で取り込んだ空間をまるごと消化するため、バルク分解系と呼ばれています。また、ミトコンドリアやペルオキシソームなどの細胞小器官をオートファジーによって選択的に分解する機構も存在します。
細胞は栄養飢餓に陥るとオートファジーにより細胞質やオルガネラの一部を分解および再利用し、細胞の生存に必要なエネルギーやアミノ酸を得ています。
さらに、オートファジーを使い老廃物や損傷したミトコンドリア、病原体、異常タンパク質を除去しており、それにより神経変性疾患、がん、糖尿病、心不全、各種の炎症や感染症など、さまざまな疾患の発症を抑制していることが明らかになっています。
細胞が飢餓条件下におかれると、細胞質に隔離膜と呼ばれる扁平な小胞が現れます。その後、膜は細胞質内の異常タンパク質や細胞内小器官を取り込みながら伸長し、先端どうしが融合して、オートファゴソームが形成されます。 オートファゴソームがリソソームと融合して内包物は分解されます。自己消化で得られたアミノ酸は栄養源として再利用されます(下図)。

図:細胞質に隔離膜と呼ばれる扁平な小胞が現れ、異常なタンパク質や細胞内小器官を取り込む(①)。その後、膜は細胞質を取り込みながら伸長し(②)、先端どうしが融合して、オートファゴソームが形成される(③)。 オートファゴソーム内にはミトコンドリアなどの大きなオルガネラも含まれる。オートファゴソームがリソソームと融合すると(④)、内包物は分解される(⑤)。自己消化で得られたアミノ酸は栄養源として再利用される。
【異常なタンパク質が増えると細胞は死滅する】
がん細胞は小胞体ストレスと酸化ストレスを受けやすい状態にあります。
がん細胞の栄養飢餓、虚血、低酸素は折り畳み不全の異常タンパク質を増やして小胞体ストレスを高めます。がん細胞はミトコンドリアの異常によって活性酸素が発生しやすく、がん組織の微小環境における炎症は酸化ストレスを亢進しています。
折り畳み不全の異常タンパク質が増えると細胞死が誘導されます。
折り畳みに失敗した異常なタンパク質は小胞体にとどまります。
このような正常な高次構造に折り畳まれなかった異常タンパク質が小胞体内に蓄積して、細胞への悪影響(=ストレス)が生じることを小胞体ストレス(ERストレス:Endoplasmic reticulum stress)と言います。
小胞体ストレスの原因となる変性タンパク質は、遺伝子変異、ウイルス感染、炎症、有害化学物質、栄養飢餓、低酸素(虚血)などにより生じます。
変性タンパク質が過剰に蓄積し、小胞体ストレスの強さが細胞の回避機能を越えると、細胞死(アポトーシス)が誘導されます。小胞体ストレスはアルツハイマー病などの神経変性疾患などさまざまな疾患の原因となると考えられています。
小胞体ストレスが生じると、細胞は小胞体ストレスを軽減する応答が発動します。これを小胞体ストレス応答と言います。
小胞体ストレスを軽減するために小胞体ストレス応答によってタンパク質合成を止め、シャペロンタンパク質を増やして折り畳みを正常化します。さらにオートファジーとプロテアソームのメカニズムで異常タンパク質を分解します(下図)。
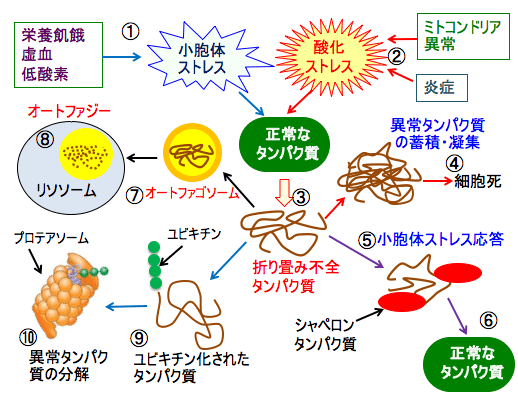
図:がん細胞は栄養飢餓や虚血や低酸素によって小胞体ストレスが亢進している(①)。ミトコンドリア異常と炎症によって酸化ストレスが亢進している(②)、その結果、折り畳み不全の異常タンパク質(③)が蓄積し凝集することによって細胞死が誘導される(④)。小胞体ストレスに対して、小胞体ストレス応答が誘導され(⑤)、タンパク質合成を抑制して小胞体負荷を軽減したり、シャペロンタンパク質によってタンパク質の折り畳みの正常化を促進する(⑥)。異常タンパク質はオートファゴソームに取り込まれ(⑦)、リソソームと癒合してオートファジーのメカニズムで分解される(⑧)。さらに、異常タンパク質にユビキチンが結合し(⑨)、プロテアソームで分解される(⑩)。オートファジーとプロテアソームによる異常タンパク質の分解によって小胞体ストレスを軽減している。
プロテアソームとオートファジーの働きが阻害されると異常タンパク質が細胞内に増え、毒性の強い凝集したタンパク質によってがん細胞に対して致死的に作用します。
腫瘍組織内での低酸素、グルコース飢餓、低pHなど、がん細胞は小胞体ストレスを受けやすい状況にあります。したがって、異常タンパク質の分解を阻害して小胞体ストレスを亢進することは、がん細胞を選択的に死滅させる治療法になります。
例えば、プロテアソーム阻害剤ボルテゾミブは、異常タンパク質の分解を阻害することによって、小胞体に異常タンパク質を大量に蓄積させ、その結果、小胞体機能を破綻させ、細胞を死滅させます。ボルテゾミブ (Bortezomib;商品名はベルケイド)は多発性骨髄腫およびマントル細胞リンパ腫に使用されています。
オートファジーは細胞内の異常タンパク質を分解してリサイクル(再利用)するシステムです。
抗がん剤などでダメージを受けた細胞内小器官や異常タンパク質を分解して細胞のストレス負荷(小胞体ストレス)を軽減します。
同時に栄養枯渇した状態において、細胞内のタンパク質やエネルギーを産生するための物質を得るために分解した栄養素をリサイクルすることによって生存を維持します。
したがって、抗がん治療にオートファジー阻害剤を併用すると、小胞体ストレスの亢進と、栄養飢餓が亢進して細胞が死滅しやすくなって、抗がん剤の効き目を高めることができます。
オートファジーを阻害する作用があるヒドロキシクロロキンやクラリスロマイシンが抗がん剤の効き目を高める効果が明らかになっています(722話参照)。
ジスルフィラムとオーラノフィンはプロテアソームを阻害し、同時に抗酸化システムを阻害して酸化ストレスを高めます。
メトホルミンは小胞体ストレス応答を阻害すると同時にミトコンドリアからの活性酸素の産生を増やして酸化ストレスを高めます。
ジクロロ酢酸ナトリウムはミトコンドリアを活性化して酸化ストレスを高めます。
2-デオキシ-D-グルコースは解糖系を阻害してグルコースの利用を妨げる作用と、糖タンパク質の糖鎖の異常を引き起こす作用によって変異タンパク質を増やし、小胞体ストレスを高めます。
さらに、高濃度ビタミンC点滴やアルテスネイトは酸化ストレスを高めます。
これらを組み合わせると、がん細胞に異常タンパク質を蓄積して死滅できます(下図)。

図:2-デオキシ-D-グルコースは解糖系を阻害しグルコースの利用を妨げる作用と、糖タンパク質の糖鎖の異常を引き起こす作用によって変異タンパク質を増やし小胞体ストレスを誘導する(①)。ジクロロ酢酸ナトリウムやメトホルミンやプテロスチルベンはミトコンドリアの活性酸素の産生を増やして酸化ストレスを高め、変異タンパク質を増やし、小胞体ストレスを促進する(②)。細胞はユビキチン・プロテアソーム系(③)とオートファジー・リソソーム系(④)とで異常タンパク質を分解することによって小胞体ストレスを軽減する。ジスルフィラムとオーラノフィンはユビキチン・プロテアソーム系を阻害する(⑤)。さらに、抗酸化システムを阻害し、活性酸素の産生を増やし、酸化ストレスを高める作用もある(⑥)。ヒドロキシクロロキンとクラリスロマイシンはオートファジーの過程を阻害する(⑦)。これらの薬剤を組み合わせて小胞体ストレスを亢進すると、異常タンパク質の蓄積によって細胞死(アポトーシス)を誘導できる(⑧)。
異常なタンパク質を蓄積して、その毒性によるストレスを「Proteotoxic stress(タンパク毒ストレス)」といいます。がん細胞は遺伝子変異による変異タンパク質や折り畳み不全の異常タンパク質が蓄積しやすい状況になり、これは正常細胞との違いにもなります。
つまり、正常細胞にはあまり影響せず、がん細胞にだけProteotoxic stressを高めることは可能と言えます。がん細胞にProteotoxic stressを十分に高めることができれば、がん細胞を選択的に死滅できます。

図:がん細胞は遺伝子異常や栄養飢餓や低酸素や炎症などによって変異タンパク質や折り畳み不全などの異常なタンパク質が増えている(①)。異常タンパク質はユビキチンが結合して、プロテアソームで分解される(②)。さらに、異常タンパク質をオートファゴソームに取り込んでリソソームで分解するオートファジーの仕組みで異常タンパク質の蓄積を防いでいる(③)。2−デオキシ-D-グルコース、ジクロロ酢酸ナトリウム、メトホルミン、プテロスチルベンは小胞体ストレスと酸化ストレスを高める機序で異常タンパク質(変異タンパク質、折り畳み不全タンパク質)を増やす(④)。ジスルフィラムとオーラノフィンはプロテアソームに作用して、タンパク分解を阻害する(⑤)。ヒドロキシクロロキンとクラリスロマイシンはオートファジーを阻害する(⑥)。したがって、これらの薬の組合せは、不良タンパク質を増やし、細胞内で異常なタンパク質が蓄積すると、その毒性によるストレス(Proteotoxic stress)で細胞は死滅する(⑦)。
【プロテアソームとオートファジーの同時阻害は抗腫瘍効果を増強する】
プロテアソームによるタンパク質分解は、細胞周期を遂行する上で必須であるため、プロテオソームの働きを阻害するとがん細胞は細胞分裂が阻害されて死滅します。
増殖や代謝の盛んな細胞ほどプロテアソームによる蛋白質分解活性が高く、したがって、がん細胞ではプロテアソームの発現が亢進し、高いプロテアソーム活性を有することが知られています。
プロテアソーム阻害剤としてベルケード(一般名ボルテゾミブ)があります。ベルケードは化学療法に抵抗性になった難治性の多発性骨髄腫の治療薬として認可されています。
細胞内で異常なタンパク質が蓄積すると、その毒性によるストレス(Proteotoxic stress)で細胞は死滅します。このような異常タンパク質はプロテアソームでの分解を亢進することによって細胞死を避けることができます。
したがって、プロテアソームの阻害剤は異常タンパク質の蓄積を亢進し、細胞死の誘導を促進します。
一方、オートファジーの阻害もがん細胞の細胞死を誘導します。オートファジーは、異常なタンパク質や細胞内小器官の除去とリサイクルを行うリソソームを使った細胞内のメカニズムです。
従って、オートファジーを阻害すると異常タンパク質が細胞内に蓄積して小胞体ストレスを亢進し、さらに栄養素のリサイクルができないと、栄養飢餓の状態を生存できません。
プロテアソーム阻害剤と、オートファジー阻害剤はそれぞれ単独でがん細胞の増殖を阻止し、細胞死を誘導することが明らかになっています。しかし、それぞれを単独で使用しても、抗腫瘍効果はそれほど強くないようです。
それはオートファジーとプロテアソームが相互に補完しあうからです。つまり、プロテアソームを阻害してもオートファジーが働いて小胞体ストレスを軽減できるからです。
オートファジーを阻害した場合も、プロテアソームが異常タンパク質を分解して小胞体ストレスを軽減できます。
そこで、オートファジー阻害剤とプロテアソーム阻害剤を併用すると、相乗効果が期待できそうに思います。以下のような報告があります。
Simultaneous inhibition of the ubiquitin-proteasome system and autophagy enhances apoptosis induced by ER stress aggravators in human pancreatic cancer cells(ユビキチン-プロテアソームシステムとオートファジーの同時阻害は、ヒト膵臓がん細胞の小胞体ストレス増強剤によって誘導されるアポトーシスを増強する)Autophagy. 2016; 12(9): 1521–1537.
【要旨の抜粋】
正常組織と比較して、がん細胞はタンパク質の合成と分解に大きな変化が生じている。したがって、小胞体の恒常性を調節するタンパク質は、がん治療のターゲットとして注目されている。
ユビキチン-プロテアソームシステムとオートファジーは、細胞のタンパク質恒常性にとって非常に重要である。しかし、がん細胞におけるオートファジーとプロテアソームと小胞体ストレス経路間の相互作用はほとんど解明されていない。
この研究は、アシュワガンダ(Withania somnifera)から抽出された生物学的活性成分のウィタノリド(withanolide)であるウィザフェリンA(withaferin-A)が、ヒト膵臓がん細胞においてオートファゴソームを有意に増加させ、オートファゴソームとリソソームのSNARE媒介融合を阻害してオートファジーによるタンパク質分解を阻害することを明らかにした。
さらにウィザフェリンAはプロテアソームを特異的に阻害し、ユビキチン化タンパク質の蓄積を促進し、その結果、小胞体ストレスを介したアポトーシスを誘導した。
重要なことに、ウィザフェリンAを小胞体ストレス誘導因子と組み合わせると、アポトーシスが相乗的に増強された。
ウィザフェリンAはマウスに投与して十分に許容され、膵臓がん異種移植腫瘍の実験系で、小胞体ストレス誘導因子との併用で、相乗的な増殖阻害効果を示した。
まとめると、これらの発見は、2つの主要な細胞内タンパク質分解システムの同時抑制が膵臓がん細胞を小胞体ストレスに対して脆弱にすることを示している。これは、膵臓がんの新しい治療法の組み合わせとなる可能性がある。
アシュワガンダ(Withania somnifera)から抽出されたウィザフェリンA(withaferin-A)がプロテアソームとオートファジーの両方を阻害する作用があり、このウィザフェリンAに小胞体ストレス誘導剤を併用すると相乗的な増殖抑制効果を発揮するという実験結果です。
以上のような報告から、小胞体ストレスを誘導する方法(2-デオキシ-D-グルコース、ジクロロ酢酸ナトリウム、メトホルミン、プテロスチルベン)にオートファジー阻害剤(ヒドロキシクロロキンとクラリスロマイシン)とプロテアソームの阻害剤(ジスルフィラムとオーラノフィン)の組合せは、がん細胞内で異常タンパク質を蓄積し、小胞体ストレスを亢進して細胞死を誘導できます(トップの図)。
実際にこのような治療法でがんが縮小した例を経験しています。これに経口抗真菌薬のイトラコナゾールを併用するとさらに抗腫瘍効果が増強することを経験しています。
| « 722)オートフ... | 724)ヘッジホ... » |



