がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
890)ザクロ種子油のプニカ酸はフェロトーシス誘導を促進する

図:ドコサヘキサエン酸(DHA)は微細藻類や魚に多く含まれる(①)。共役リノレン酸のプニカ酸はザクロ種子油に多く含まれる(②)。食事からDHAとプニカ酸の摂取量を増やすと、がん細胞の細胞膜に多く取り込まれる(③)。抗がん剤、放射線照射、アルテスネイト、鉄剤、高濃度ビタミンC点滴、スルファサラジン、ジクロロ酢酸ナトリウム(④)は活性酸素の産生を高める(⑤)。飽和脂肪酸の多い細胞膜は脂質の過酸化が起こりにくい(⑥)。多価不飽和脂肪酸は酸化を受けやすいので、DHAとプニカ酸を多く取り込んだがん細胞内では活性酸素の産生が高まると脂質の過酸化によって細胞は酸化傷害を受け(⑦)、脂質二重層が破綻し(⑧)、フェロトーシスの機序で死滅する(⑨)。つまり、食事からのDHAとプニカ酸の摂取量を増やすと、がん細胞のフェロトーシスを増強できる。
890)ザクロ種子油のプニカ酸はフェロトーシス誘導を促進する
【細胞は脂質二重層で包まれている】
体を構成する個々の細胞は細胞膜で囲まれています。細胞膜は脂質二重層によりできており、この細胞膜によって細胞外と細胞内が分けられています。脂質二重層はリン脂質分子が膜状に並んで作られます。リン脂質分子は親水性のリン酸部分と、疎水性の2個の脂肪酸が尻尾のように繋がった構造をしています。
細胞の内外は主に水で満たされているので、リン脂質分子は親水性のリン酸部分(頭部)を外側に、水に反発する疎水性の脂肪酸部分(尾部)を内側にして、3〜6ナノメートル(nm)程度の厚さの2重の層を作って並びます(図)。

図:リン脂質は親水性のリン酸部分(頭部)と、疎水性の脂肪酸部分(尾部)から構成される。疎水性の尾部は水によってはじかれ、互いに引き付けられて内側に並び、親水性の頭部の領域が水に接する外側に露出して膜状の二重層を形成する。この脂質二重層が細胞膜の基本構造になる。
細胞の内外を分ける細胞膜は脂質二重層を土台にして、その中にタンパク質粒子が浮遊するように移動しています。脂質二重層に浮かぶタンパク質粒子は、受容体や物質を通すチャネルなどとして働きます。

図:細胞膜は脂質の二重膜の海に、膜タンパク質が氷山のように頭を少し出して浮かんだような構造をしている。この構造モデルを流動モザイクモデル(fluid mosaic model)と呼んでいる。
【脂肪(油脂)はグリセリンと脂肪酸が結合している】
私たちは食物から様々な種類の「あぶら」を摂取しています。一般に、常温で液体のあぶらを油(oil)、固体のあぶらを脂(fat)と表記し、両方を総称して油脂と言います。
ほとんどの植物性油や魚油は常温で液体であり、油になります。一方、多くの陸上動物(牛脂、豚脂、人間の脂肪など)と熱帯植物(ヤシ油、パーム油、ココアバターなど)のあぶらは常温で個体の脂です。
油脂は3価のアルコールであるグリセロール(グリセリンとも言う)1分子に3分子の脂肪酸 が結合した構造をしています。グリセロールには手(-OH)が3本あり、それに脂肪酸が結合して脂肪(油脂)になります。一般的には脂肪酸が3個ずつ結合してトリグリセリド(中性脂肪)と呼ばれます。グリセロールは全て共通するため、脂肪の種類による性状の違いは脂肪酸の形態に依存します。(図)

図:脂肪(油脂)は3価のアルコールであるグリセロール1分子に3分子の脂肪酸が結合した構造をしている。グリセロールには手(-OH)が3本あり、それに脂肪酸が結合して脂肪(油脂)になる。 R1,R2,R3と示す脂肪酸は1 個ないし複数個の炭化水素(CH2)の連結した鎖 (炭化水素鎖)からなる。脂肪酸の鎖(R1,R2,R3)の構造の違いによって油脂の性状が違ってくる。
脂肪酸は1 個ないし複数個の炭化水素(CH2)の連結した鎖(炭化水素鎖)からなり、その鎖の両末端はメチル基(CH3)とカルボキシル基(COOH)で、基本的な化学構造はCH3CH2CH2・・・CH2COOHと表わされます。
脂肪酸には、飽和脂肪酸と不飽和脂肪酸があり、飽和脂肪酸では、炭化水素鎖の全ての炭素が水素で飽和しています。一方、不飽和脂肪酸では炭化水素鎖中に1個ないし数個の二重結合(C=C)が含まれます。不飽和脂肪酸中で二重結合の数が2個以上のものを多価不飽和脂肪酸と呼びます。多価不飽和脂肪酸にはオメガ(ω)3系とオメガ(ω)6系の2種類があり、これらは細胞機能に対する影響が異なります。(図)

図:脂肪酸は飽和脂肪酸と不飽和脂肪酸に分けられ、多価不飽和脂肪酸にはオメガ3系とオメガ6系がある。
上記の分類は主な脂肪酸に限ったものです。実際は脂肪酸の種類は多数あります。
例えば、牛乳中には400種類以上の脂肪酸が存在すると言われています。それは、不飽和脂肪酸の場合、二重結合の数や位置や立体結合の違いによって、多数の異性体ができるからです。これらの不飽和脂肪酸の多くは存在量が微量で細胞機能や構造に影響を及ぼしませんが、特殊な性質を持って細胞機能や体の健康に影響する脂肪酸も存在します。その代表が「共役脂肪酸」です。
【不飽和脂肪酸は二重結合の部分で折れ曲がる】
飽和脂肪酸では、炭化水素鎖の全ての炭素が水素で飽和していますが、不飽和脂肪酸では炭化水素鎖中に 1 個ないし数個の二重結合が含まれます。
炭素原子は、他の原子と結合できる手を4本持っています。炭素-炭素二重結合とは、2つの炭素原子どうしが互いに2本の手でつながっている状態のことをいい、「C=C」で表記します。
この二重結合の部分で脂肪酸の構造が変化します。飽和脂肪酸はまっすぐな構造をしていますが、炭素間に二重結合がある不飽和脂肪酸は二重結合の部分で折れ曲がっています。
脂肪酸が二重結合の所で曲がる時に、「シス型」と「トランス型」という2種類の構造を取ります(図下)。「シス(cis)は「同じ側」「近い方」、トランス(trans)は「反対側」「遠い方」というような意味の接頭辞です。

図:脂肪酸の炭素間の二重結合(C=C)の部分では「シス型」と「トランス型」という2種類の構造を取る。「シス(cis)は「同じ側」、トランス(trans)は「反対側という意味の接頭辞で、二重結合の所でシス型は水素が同じ側に並び、トランス型は反対側に並ぶ。シス型の2重結合のところで炭化水素の鎖は大きく曲がる。リノール酸はCOOHから9番目と12番目の炭素の部分で二重結合が存在し、この2つは両方ともシス型を示す。共役リノール酸の一種(9c,11t-C18:2)では、9番目の炭素の二重結合はシス型で、11番目の炭素の二重結合はトランス型を示す。
つまり、「シス型」は、二つの水素原子が二重結合の同じ側面側に存在する脂肪酸です。自然界に存在する脂肪酸のほとんどはシス型二重結合の分子構造を持っています。炭化水素鎖がシス型二重結合の部分で大きく曲がり、脂肪酸分子間の結合が弱くなり、より融点が低くなるため、室温では液体となります。
トランス型二重結合では、二つの水素原子が二重結合の反対側に存在し、比較的安定した構造になり、シス型の異性体よりも融点は高くなります。
炭素数と二重結合の数が同じでも、二重結合の位置と立体構造(シス型とトランス型)の違いによって、立体的な構造や大きさに違いが生じるので、脂肪酸の性状が異なります。
【共役脂肪酸は多彩な生理機能を持つ】
不飽和脂肪酸には炭素鎖に少なくとも1つの二重結合が存在します。多価不飽和脂肪酸は、炭素鎖内の二重結合の数と位置に従って分類されます。ほとんどの多価不飽和脂肪酸は、メチレン (-CH2-) 基によって分離された二重結合(-C=C-CH2-C=C-)を示します。
対照的に、一部の多価不飽和脂肪酸はメチレン基によって中断されない二重結合(-C=C-C=C-)を有します。この二重結合を共役型二重結合と言い、分子中にこの二重結合を有する脂肪酸を共役脂肪酸と言います。
1980年代、ウイスコンシン大学パリザ教授らは、焼いたハンバーグ中に発ガンを抑制する物質を発見しました。その抽出物質を精製・分離した結果、炭素数18個で9位にシス、11位にトランス配置の二重結合を有するリノール酸の異性体であることをが判明しました。単結合と交互になっている二重結合は「共役」しているために、この脂肪酸をシス9、トランス11-CLA(共役リノール酸)と呼びます。
この二重結合の位置および幾何型の違いにより、リノール酸の生理作用とは違った効果を発揮していると推測されています。

図:リノール酸はカルボキシル基(COOH)から9番目と12番目の炭素の部分で二重結合が存在し、この2つは両方ともシス型を示す。共役リノール酸の一種(9c,11t-C18:2)では、9番目の炭素の二重結合はシス型で、11番目の炭素の二重結合はトランス型を示す。リノール酸の2つの二重結合はメチレン (-CH2-) 基によって分離されている(-C=C-CH2-C=C-)。共役リノール酸の二重結合はメチレン基によって中断されてない(-C=C-C=C-)。この結合を共役型二重結合という。
共役脂肪酸の中で、共役リノール酸は人間の健康に対する有益な効果について最も広範囲に研究されています。これらの効果には、抗肥満、抗動脈硬化、抗糖尿病、抗発がん、および免疫調節特性が含まれます。
さらに最近は共役リノレン酸に対する関心が大幅に高まっています。
リノール酸とリノレン酸は炭素数が18で同じですが、二重結合はリノール酸は2個、リノレン酸は3個です。
共役リノレン酸は3個の二重結合のうち、少なくとも2個が共役型二重結合を有するリノレン酸の異性体です。

図:αリノレン酸と共役リノレン酸は3個の二重結合を有し、化学構造は同じ(C18H30O2)であるが、二重結合の位置と立体構造が異なる。αリノレン酸はCOOH末端から9番目と12番目と15番目の炭素にシス型二重結合がある。共役リノレン酸の一種のプニカ酸はCOOH末端から9番目と11番目と13番目の炭素に二重結合があるが、9番目と13番目の炭素の二重結合はシス型で、11番目の炭素の二重結合はトランス型で、この3つの二重結合は共役型結合となっている。
【共役リノレン酸のプニカ酸はフェロトーシスを促進する】
共役リノレン酸には、抗炎症作用、抗肥満作用、抗糖尿病作用、抗がん作用が報告されています。
共役リノレン酸には、in vitroおよびin vivoの両方で強力な抗がん作用を発揮することが報告されています。
共役リノレン酸 の 抗がん活性は脂質過酸化に関連していると考えられています。実際、共役リノレン酸は、共役二重結合レベルでの迅速な電子の非局在化によってフリーラジカルが形成されやすいため、非共役の対応物である α-リノレン酸 (C18:3 c9c12c15) よりも自動酸化を受けやすくなっています
フェロトーシスは、アポトーシスやネクロトーシスなどの他の調節細胞死とは形態学的、生化学的、遺伝学的に異なる、鉄介在性の細胞死の一種です。フェロトーシス細胞死は、多価不飽和脂肪酸の酸化によって生成される活性酸素種の一種である脂質ヒドロペルオキシドの圧倒的な蓄積によって特徴付けられます。
共役リノレン酸の一種のプニカ酸(Punicic acid)はザクロ種子油に豊富に含まれます。ザクロ種子油の70〜80%を占めます。食用油でプニカ酸を多く摂取できるザクロ種子油の抗がん作用に注目が集まっています。
ザクロ種子油の摂取は身体機能や組織の恒常性に対して悪影響を及ぼさないことが実証されています。
培養がん細胞を使った実験で、プニカ酸ががん細胞に対して細胞傷害性であり、その傷害作用が抗酸化剤や鉄キレート剤で阻止されることから、フロトーシス誘導によるものと考えられています。
以下のような報告があります。
Punicic acid is an omega-5 fatty acid capable of inhibiting breast cancer proliferation(プニカ酸は乳がんの増殖を阻害することができるオメガ5脂肪酸)Int J Oncol. 2010 Feb;36(2):421-6.
【要旨】
ザクロ抽出物には生理活性物質が多数含まれており、がん治療にも使用されている。プニカ酸(punicic acid)は、ザクロ(Punica granatum) の種子油に含まれるオメガ 5 長鎖多価不飽和脂肪酸である。
多くの長鎖脂肪酸にはがん予防作用があることが報告されている。今回我々は、エストロゲン非感受性乳がん細胞株(MDA-MB-231)とエストロゲン感受性細胞株(MDA-ERalpha7)の両方の増殖に影響を与えるプニカ酸の作用を検討した。
40μMのプニカ酸で処理した乳がん細胞の増殖は、未処理細胞と比較して、MDA-MB-231細胞およびMDA-ERalpha7細胞でそれぞれ92%および96%阻害された。
さらに、プニカ酸は、未処理の対照細胞と比較して、MDA-MB-231 細胞および MDA-ERalpha7 細胞においてアポトーシスをそれぞれ 86 %および 91%誘導し、細胞のミトコンドリア膜電位を破壊した。
この実験系に20 μM の抗酸化物質トコトリエノールを添加することにより、増殖阻害、アポトーシス、およびミトコンドリア膜電位の破壊に対するプニカ酸の効果が阻止された。
PKC 阻害剤ビスインドリルマレイミド I は、プニカ酸の抗がん効果をMDA-MB-231とMDA の両方で部分的に阻止した。
これらの結果は、プニカ酸が脂質過酸化とPKC 経路に依存する乳がん阻害特性を持っていることを示唆している。
プニカ酸のがん細胞に対する細胞死誘導作用が抗酸化剤で阻止されることから、プニカ酸が脂質過酸化による細胞死(フェロトーシス)を誘導することを示しています。以下のような報告もあります。
Punicic Acid Triggers Ferroptotic Cell Death in Carcinoma Cells.(プニカ酸はがん細胞におけるフェロトーシス細胞死を誘発する)Nutrients. 2021 Aug 10;13(8):2751.
【論文の要旨】
植物由来の共役リノレン酸は、がんなどのさまざまな病気に対する予防および治療特性について広く研究されている。特に、ザクロ種子油中に最大 83% 存在する共役リノレン酸異性体 (C18:3 c9t11c13) であるプニカ酸は、抗がん効果を発揮することが示されているが、その細胞毒性の背後にあるメカニズムは不明のままである。
過酸化脂質の圧倒的な蓄積によって引き起こされる細胞死であるフェロトーシスは、共役リノレン酸の細胞毒性の根底にある潜在的なメカニズムとして最近浮上している。
本研究では、プニカ酸が、単層または三次元回転楕円体として増殖した HCT-116 結腸直腸がん細胞および FaDu 下咽頭がん細胞に対して非常に細胞毒性があることを示す。
我々のデータは、プニカ酸ががん細胞のフェロトーシスを引き起こすことを示している。これは重大な脂質過酸化を誘発するが、その影響はフェロトーシス阻害剤の添加によって防止される。
抗がん特性を持つ既知の多価不飽和脂肪酸であるドコサヘキサエン酸 (DHA) と組み合わせると、プニカ酸の細胞毒性が相乗的に増加する。
私たちの発見は、がんの予防と治療のためのフェロトーシス感作植物化学物質としてプニカ酸を使用する可能性を強調している。
プニカ酸は脂質過酸化を促進してがん細胞を死滅する効果を示唆しています。つまり、フェロトーシスを亢進する可能性を示唆しています。
ドコサヘキサエン酸 (DHA)がフェロトーシスの誘導を促進することは多くの報告があります。(804話参照)
したがって、ドコサヘキサエン酸とザクロ種子油を併用すると、フェロトーシス誘導において相乗的な効果が期待できます。
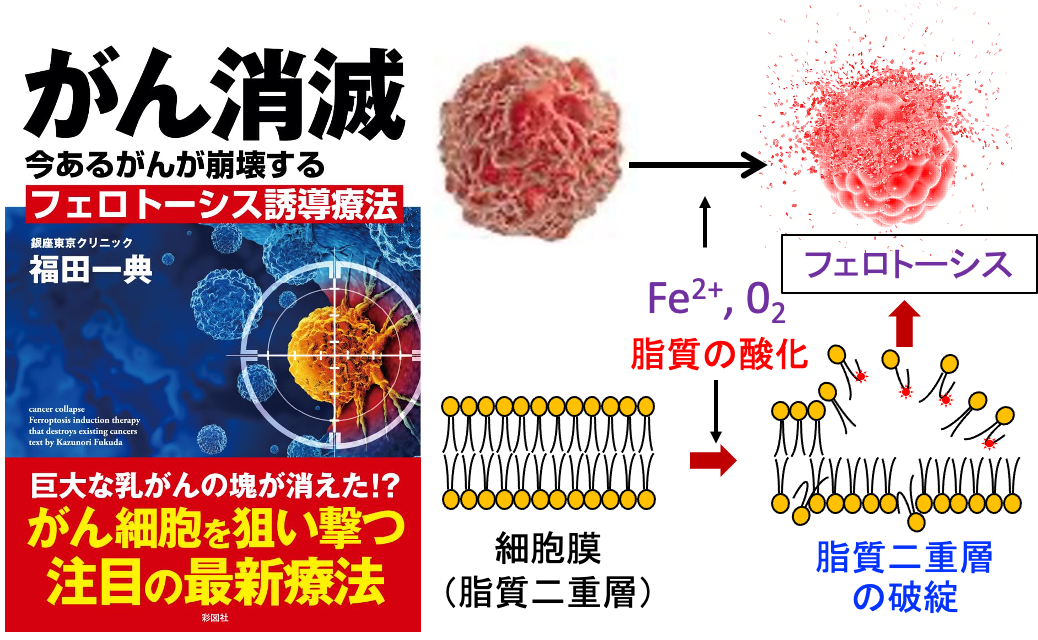
抗がん剤、放射線照射、アルテスネイト、鉄剤、高濃度ビタミンC点滴、スルファサラジン、ジクロロ酢酸ナトリウムなど活性酸素の産生を高める治療法と併用すると、がん細胞をフェロトーシスで死滅できます。(トップの図)
◉ がんのフェロトーシス誘導療法については以下のサイトで解説しています。
http://www.f-gtc.or.jp/ferroptosis-induction/ferroptosis.html
| « 889)人類は太... | 891)抗がん剤... » |