がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
582)健康寿命を延ばすミトコンドリア活性化法
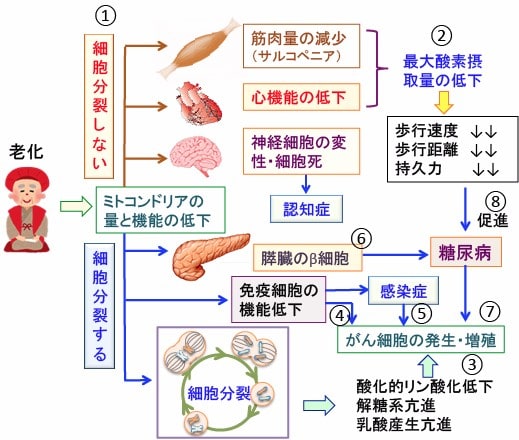
図:老化すると全身の細胞のミトコンドリアの量と機能が低下する。細胞分裂しない筋肉や心筋細胞や神経細胞では、ミトコンドリア機能の低下によって、筋肉量の減少や心機能の低下や認知症を引き起こす(①)。筋肉量の減少や心臓機能の低下は最大酸素摂取量を低下させ、歩行速度や歩行距離や持久力を低下させる(②)。細胞分裂している多くの細胞では、ミトコンドリア機能の低下はミトコンドリアでの酸化的リン酸化の低下、解糖系亢進、乳酸産生亢進というワールブルグ効果を引き起こし、細胞のがん化を促進する(③)。また、リンパ球などの免疫細胞の機能低下は免疫監視機構の働きを低下させて、がん細胞の増殖を許してしまう(④)。免疫機能の低下は感染症を引き起こし、感染症はがん細胞の発生や増殖を促進する(⑤)。膵臓のβ細胞のミトコンドリア機能が低下するとインスリンの分泌が低下して糖尿病になる(⑥)。糖尿病はがんの発生と増殖を促進する(⑦)。運動機能の低下は糖尿病の発症を促進させる(⑧)。つまり、全身の細胞のミトコンドリアの機能の低下が老化とがんの重要な原因となっている。したがって、全身のミトコンドリアの働きを高めることは老化とがんの予防につながり、健康寿命を延ばす。
582)健康寿命を延ばすミトコンドリア活性化法
【抗酸化剤はがんや老化を抑制できない】
がんと老化の原因として活性酸素の関与を重視する考え方は根強くあります。しかし、抗酸化剤のサプリメントを摂取しても寿命延長もがん予防効果も得られないことは多くの研究で明らかになっています。
「活性酸素が老化やがんの原因」という考えを、老化とがんの「フリーラジカル仮説」や「酸化ストレス仮説」と呼んでいます。
活性酸素は遺伝子のDNAを傷つけることによってがんの発生の原因となり、細胞膜や細胞内タンパク質などを酸化して機能傷害を引き起こすことによって老化を促進するという考えです。
老化のフリーラジカル仮説は1956年にDenham Harmanによって提唱され、その後、この「老化やがんが体内で発生した活性酸素によって促進される」と言う考えは、多くの研究者に支持されています。
そして、抗酸化剤の摂取によって体の酸化ストレスを軽減することは、がんや動脈硬化などの生活習慣病を始め、様々な老化性疾患の予防や症状の改善に役立つと考えられています。
しかし、ヒトでの臨床試験では、抗酸化物質のサプリメント(ビタミンAやCやEなど)を多く摂取しても寿命を延ばすことも発がん率を低下させる結果も得られていません。
抗酸化性サプリメントが動脈硬化や神経変性疾患やがんなどの老化性疾患の発症予防に効果があるはずだという仮説を基に、1970年代以降に多くの臨床試験や疫学研究が実施されていますが、多くの研究はこの仮説を否定する結果になっています。
逆に、ビタミンEなどの抗酸化性サプリメントの過剰摂取は死亡率を高め、したがって寿命を短縮するという大規模疫学研究の結果が複数報告されています。
体の抗酸化作用は老化やがんの予防に有効なのに、抗酸化剤のサプリメントの補充は逆効果という現象をどのように説明するかということになります。
最近は、「ホルミシス」の考えでこの現象が説明されています。「適度な酸化ストレスは細胞のストレス抵抗性を高めるので、過剰な抗酸化剤は細胞のストレス抵抗性を弱めるので逆効果になる」という考えです。
無菌状態で暮らすと、免疫力が退化して感染症に対する抵抗力が低下するのと同じで、絶えず適度な刺激があった方が体は抵抗力や治癒力を高めることができるので、寿命延長や病気予防に有利になるという現象です。
【適度なストレスはストレス抵抗性を増強する】
体には、軽度なストレスを受けると、そのストレスを排除するために細胞内システムが活性化して、そのストレスに対する抵抗力を高めるようになるという仕組みがあります。
生物に対して通常有害な作用を示すものが、微量であれば逆に刺激作用を示す有益な作用になるという現象で、こうした生理的刺激作用を「ホルミシス(Hormesis)」と言います。
除草剤(農薬)のパラコートは活性酸素を発生させます。線虫を様々な濃度のパラコートの入った培地で育てて、その寿命を検討した実験があります。
パラコートの濃度が極めて低い(0.005mM以下)と寿命に影響は及ぼしませんが、濃度が0.01mMから0.5mMの場合は、寿命が最大で60%くらい延長します。1mM以上だと逆に寿命は短縮します。軽度の酸化ストレスは寿命を延ばし、高度の酸化ストレスはダメージを与えるので寿命は短縮するという結果です。

図:細胞へのストレスの刺激強度が強いと細胞にダメージを与える。しかし、軽度なストレス刺激は細胞のストレ抵抗性やダメージに対する修復能を高め、その結果寿命を延ばす。
ミトホルミシス(Mitohormesis)というのは「ミトコンドリアをターゲットにしたホルミシス効果」という意味です。
例えば、ミトコンドリアでの活性酸素の産生が高まると、細胞内の抗酸化力が高まるので、ストレスに対する抵抗力が高まって寿命が延びるという考えです。
適度な有酸素運動はミトコンドリアでの呼吸活性を上昇させ、活性酸素種の発生が増えます。体内で活性酸素が増えると活性酸素を消去するために、細胞は抗酸化酵素や解毒酵素の発現を高めます。その結果、細胞のストレス抵抗性は高められ、加齢関連疾患の発症を抑制し、寿命を延ばす作用を発揮するのです。
有酸素運動でミトコンドリアでの酸素呼吸が増えて活性酸素種が増えたとき、抗酸化作用のあるサプリメントを摂取して活性酸素種を消去すると、運動の健康作用は消えてしまいます。運動後に抗酸化性サプリメントを過剰に摂取すると、ホルミシス効果が働かなくなるためです。
ただし、過度の運動の後に、過剰に発生した活性酸素の害を軽減する目的で抗酸化剤を摂取するのは意味があるかもしれません。過剰な活性酸素は細胞に酸化傷害を引き起こすからです。
しかし、日頃から過剰の抗酸化剤を摂取していると、むしろ細胞の抗酸化力や解毒力などのストレス抵抗性を弱めて、酸化傷害を受けやすい状態になる可能性があります。過剰な抗酸化性サプリメントの摂取ががんの発生を促進し、寿命を短くする理由となっていることが指摘されています。
つまり、抗酸化性サプリメントの摂取には良い面と悪い面の2面性があることを認識しておくことが重要です。

図:適度な運動はミトコンドリアでの呼吸活性を上昇させ、活性酸素種の発生を増やす。その結果、ホルミシス効果で細胞は抗酸化酵素や解毒酵素の発現を高め、ストレス抵抗性を高めて、加齢関連疾患の発症を抑制し、がんの発生を抑制し、寿命を延ばす。一方、過度の運動は活性酸素の産生が増え、細胞膜やDNAの酸化傷害を高め、加齢関連疾患の発症やがんの発生を促進し寿命を短縮する。抗酸化剤はこのどちらの過程も阻害する。したがって、過度の運動による酸化傷害を阻止するが、適度な運動による健康作用を妨げるという2面性がある。
【抗酸化剤はミトホルミシスを働かなくする】
活性酸素を消去する抗酸化剤には良い面と悪い面の2面性があることを説明しました。体内で発生する活性酸素を消去することは全て良さそうに思うのですが、活性酸素による適度な酸化ストレスがある方が老化を防ぎ、長生きできるのです。そのメカニズムをもう少し説明します。
抗酸化剤が健康に良くないというのは糖尿病でも指摘されています。
「抗酸化剤はヒトにおける身体運動の健康増進作用を阻止する(Antioxidants prevent health-promoting effects of physical exercise in humans.)」というタイトルの論文があります。(Proc Natl Acad Sci U S A. 2009 May 26;106(21):8665-70.)
運動は様々な健康作用があり、インスリン抵抗性を改善して、糖尿病の予防に有効であることは証明されています。
この論文では、運動後に抗酸化性のサプリメントを摂取すると、運動の健康作用がキャンセルされるという結果を報告しています。
運動で軽度の酸化ストレスが発生すると、ミトホルミシスのメカニズムで体の抗酸化力を高めるのですが、抗酸化剤を摂取するとそのミトホルミシスが作用しないので、運動の健康作用(インスリン抵抗性の改善など)がキャンセルされるということです。
ミトホルミシスというのは、ミトコンドリアでの活性酸素の発生が増えると、酸化ストレスを軽減するために、細胞は抗酸化酵素の発現や活性を高めて抗酸化力を高め、その結果、老化を抑制し、寿命を延ばすというメカニズムです。
この論文では、運動はミトホルミシスの機序でインスリン抵抗性が改善し、糖尿病が予防できるが、抗酸化剤を摂取すると、その効果が無くなると報告しています。
この研究では、抗酸化剤としてビタミンC (1000 mg/日) と ビタミン E (400 IU/日)を投与しています。
運動するとPPARγ(ペルオキシソーム増殖因子活性化受容体)やPGC1α(PPARγコアクチベーター1α)の発現が亢進し、内因性の抗酸化酵素(SODやグルタチオンペルオキシダーゼなど)の発現などにより酸化ストレス抵抗性が亢進します。しかし、ビタミンCとビタミンEを摂取すると、この抗酸化酵素の発現誘導が阻止されるというメカニズムです。(下図)
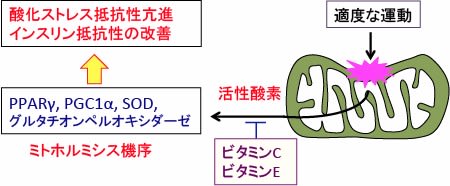
図:適度な運動によってミトコンドリアでの活性酸素の産生が増えると、細胞はPPARγ(ペルオキシソーム増殖因子活性化受容体)やPGC1α(PPARγコアクチベーター1α)の発現が亢進し、スーパーオキシド・ディスムターゼ(SOD)やグルタチオンペルオキシダーゼなどの内因性の抗酸化酵素の発現亢進などにより酸化ストレス抵抗性が亢進する。運動後にビタミンCやEを摂取すると、このミトホルミシスの機序が起こらなくなり、運動の健康作用が消失する。
【抗酸化剤はがん細胞の発生・増殖・転移を促進する】
1970年代からのがん予防の研究分野では、「抗酸化剤はがんを予防する」というのががん予防研究の基本でした。そして、抗酸化剤を使ったがん予防の臨床試験が多数行われました。
しかし、がん化学予防剤の本命と言われたβカロテンが、大規模臨床試験で「喫煙者がβカロテンを摂取すると肺がんの発症率が高まる」という研究結果が1994年に発表されました。(N Engl J Med. 1994 Apr 14;330(15):1029-35.)
その後の多くの研究で、ビタミンCやEなどの抗酸化性サプリメントのがん予防効果は否定されています。最近の研究では、「抗酸化剤はがんの発生や進展を促進する」という考えが優勢になっています。
がん治療においても、抗酸化性サプリメントの使用はマイナスという考え方が、最近は主流になっています。この点に関しては504話と505話で解説しています。
細胞内で活性酸素の98%はミトコンドリアで発生すると言われています。がんと老化に対する活性酸素の2面性は、ミトコンドリアの観点から理解すると、判りやすくなります。
【がんと老化はミトコンドリアの機能低下で発生する】
がんと老化は切り離せません。
一般的には、加齢とともに、がんの発生数は増えます。超高齢者はがんが少ないという例外はありますが、これは超高齢ではがんを抑える要因が増えるためです(538話参照)
加齢(aging)は、時間に比例して徐々に進行する組織や臓器の機能低下を引き起こし、慢性疾患に罹患しやすくなり、最終的には死に至ります。
がん細胞は組織幹細胞におけるゲノムDNAの突然変異の蓄積によって発生します。この遺伝子変異は時間に比例して蓄積するので、加齢は遺伝子変異の蓄積の最大の原因になっています。これが加齢とともにがん細胞の発生が増える理由です。

図:がん細胞は遺伝子変異の蓄積によって発生し、悪性度が進行する。したがって、加齢とともにがん細胞の発生は増える。
さらに、がん細胞を排除する免疫細胞の働きも加齢によって低下してくるため、発生したがん細胞の増殖を許してしまいます。つまり、体の老化による組織機能の低下はがんの発生を促進することになります。
近年、体の老化のメカニズムにおいてミトコンドリアの機能低下の関与が重要視されています。筋肉やその他の組織のミトコンドリアの量や機能の低下が、組織や臓器の機能低下の原因になっているからです。
がんもミトコンドリアの機能の低下(異常)が指摘されています。がん細胞では、解糖系が亢進し、ミトコンドリアでの酸素呼吸(酸化的リン酸化)が抑制されています。
つまり、体の細胞の老化もがん化も「ミトコンドリア機能の低下」という点で共通のメカニズムで説明できるのです。
糖尿病やメタボリック症候群、神経変性疾患、循環器疾患、がんなど多くの疾患の発症がミトコンドリアの機能障害との関連が強いことが明らかになっています。
健康的な加齢、老化関連疾患の予防、長寿達成のためには、ミトコンドリアの品質と機能を高めることが最も重要と言えます。(トップの図)
【糖尿病は膵臓のβ細胞のミトコンドリアの機能低下で発症する】
糖尿病は1960年代くらいまでは極めて稀な病気でしたが、現在では5人に一人が糖尿病あるいは糖尿病予備軍と言われるくらいに増えています。
糖尿病ががんの発生を増やすことは多くの研究で確認されています。 多くの疫学研究で、糖尿病が発がんリスクを高めることが確認されています。
日本で行なわれた大規模調査では、糖尿病と診断されたことのある人はない人に比べ、20~30パーセントほどがんの発生率が高くなることが報告されています。
最近のメタアナリシスによると,糖尿病は非ホジキンリンパ腫,膀胱がん,乳がん,大腸がん,子宮内膜がん,肝がん,膵がんなどの発症リスクを高めることが示されています。
さらに、糖尿病があるとがんの進行が早く転移しやすいことも指摘されています。高血糖や高インスリン血症ががん細胞の増殖を促進するからです。(216話参照)
様々なメカニズムで、糖尿病はがんの発生や進展を促進するので、日本で糖尿病患者が増えていることは、がんの発生が増えている原因の一つと言えます。
糖尿病の原因のひとつは、膵臓のβ細胞の働きが低下し、血糖値を下げるインスリンが出なくなることです。
食物から摂取したグルコース(ブドウ糖)が消化管から吸収されて血液中のグルコース濃度(血糖値)が上昇すると、膵臓のランゲルハンス島のβ細胞からインスリンが分泌されます。

図:膵臓の内部に島の形状で散在する内分泌を営む細胞群があり、これをランゲルハンス島という。ランゲルハンス島はグルカゴンを分泌するα細胞、インスリンを分泌するβ細胞、ソマトスタチンを分泌するδ細胞などから構成される。
β細胞のミトコンドリア機能の低下が糖尿病の発症に重要な要因になっていることが明らかになっています。
すなわち、β細胞がインスリンを合成に分泌するためにはミトコンドリアで産生されるATPが必要ですが、β細胞のミトコンドリアの機能が低下するとインスリンの合成も分泌も低下して、糖尿病が発症すると考えられています。
糖質の多い食事をしてインスリンの産生を増やすと、β細胞のミトコンドリアはATP産生の負担が増え、活性酸素の産生量も増え、ミトコンドリアのダメージが蓄積してきます。傷ついたミトコンドリアはオートファジー(細胞の自食作用)の一種のミトファジーで分解され、ミトコンドリア新生によってミトコンドリアの品質と機能を維持するメカニズムが存在しますが、ミトファジーやミトコンドリア新生の機能も加齢とともに低下して、最終的に糖尿病になります。

図:糖質の多い食事で食後の血糖値が上昇するとインスリン分泌が増加する(①)。インスリンは脂肪合成を促進するので肥満を引き起こす(②)。肥満になって内蔵脂肪が増えると、脂肪組織から分泌される炎症性サイトカイン(TNF-αやIL-6)が増え、アディポネクチンの量が減る(③)。その結果、インスリンの働きが低下し(インスリン抵抗性)、それを補うためにインスリンがさらに多量に分泌される(④)。高インスリン血症はさらに肥満を促進するので悪循環を形成し、ますます症状が悪化する(⑤)。炎症性サイトカインの産生増加は炎症を増悪させ酸化ストレスを高める(⑥)。アディポネクチンの産生低下はAMP依存性プロテインキナーゼ(AMPK)の活性を低下させる(⑦)。肥満とAMPKの活性低下はインスリン抵抗性をさらに亢進する(⑧)。酸化ストレスとインスリン分泌増加は膵臓のβ細胞のミトコンドリアの負荷を高め、AMPK活性低下はミトファジー低下とミトコンドリア新生を抑制してミトコンドリアの品質と機能を低下する(⑨)。その結果、β細胞のエネルギー産生が低下し、インスリン分泌が減少して糖尿病が発症する(⑩)。
したがって、糖質摂取を減らしてβ細胞への負担を減らせば、糖尿病になりにくくなります。
AMP依存性プロテインキナーゼ(AMPK)はミトファジーとミトコンドリア新生を促進し、ミトコンドリアの品質コントロールに関与しています。AMPKは運動やカロリー制限やメトホルミンで活性化されます。
運動不足とカロリー過剰な食事はβ細胞を含めて全身のミトコンドリアの品質を低下させることになります。
【ミトコンドリアは増やすことも鍛えることもできる】
約20億年前に好気性細菌のα-プロテオバクテリアが原始真核細胞に寄生してミトコンドリアになったと考えられています。ミトコンドリアは元々は細菌であったので、分裂して増殖することができます(576話参照)。
ダメージを受けて機能異常を起こしたミトコンドリアはミトコンドリアに特異的なオートファジーによる除去システムのミトファジー(mitophagy)によって分解され、新しいミトコンドリアがミトコンドリア新生(mitochondrial biogenesis)によって作られます。
このようなミトファジーとミトコンドリア新生のバランスによってミトコンドリアの品質が決まります。
AMP活性化プロテインキナーゼ(AMPK)はミトファジー(ミトコンドリア)を誘導し、ミトコンドリア新生を促進します。AMPKを活性化する薬として糖尿病治療薬のメトホルミンがあります。メトホルミンはミトコンドリアの品質を良くする効果が期待できます。
運動やカロリー制限やケトン食や魚油(500話参照)もAMPKを活性化します。
運動の持久力を短時間で高める方法があります。運動をする1時間くらい前にジクロロ酢酸ナトリウム(約1g)とビタミンB1とR体αリポ酸を摂取して、コーヒーを1杯飲み、さらに20分くらい前にケトン・サプリメントのβヒドロキシ酪酸(18g)を摂取します。
ジクロロ酢酸はピルビン酸脱水素酵素キナーゼを阻害してピルビン酸脱水素酵素の活性を高め、その結果、ピルビン酸からアセチルCoAの変換が促進されて、ミトコンドリアでのTCA回路が亢進します。ビタミンB1とαリポ酸はピルビン酸脱水素酵素の活性に必要な補因子です。
ケトン体のβヒドロキシ酪酸は体内でアセト酢酸に変換され筋肉や心臓のエネルギー源となり、ハードな運動をするスポーツ選手向けに海外ではサプリメントとして販売されています。ミトコンドリアで代謝されるので、筋肉や心臓のミトコンドリア機能を高めます。
サプリメントのコエンザイムQ10(CoQ10)とコーヒーに含まれるカフェインは酸化的リン酸化を活性化し、ATP産生を高める作用があります。(下図)

図:グルコースが解糖系で代謝されてピルビン酸に変換された後、ピルビン酸脱水素酵素によってミトコンドリア内でアセチルCoAに変換される(①)。アセチルCoAはミトコンドリア内でTCA回路と呼吸酵素複合体における酸化的リン酸化によってATPが産生される(②)。R体αリポ酸とビタミンB1はピルビン酸脱水素酵素の活性に必要な補因子であり(③)、コエンザイムQ10(CoQ10)とカフェインは酸化的リン酸化を活性化する作用がある(④)。ピルビン酸脱水素酵素はピルビン酸脱水素酵素キナーゼによってリン酸化されることによって活性が阻害されている(⑤)。ジクロロ酢酸ナトリウムはピルビン酸脱水素酵素キナーゼを阻害する作用があり、その結果ピルビン酸脱水素酵素を活性化する(⑥)。ケトンサプリメントで補ったケトン体(βヒドロキシ酪酸)はミトコンドリアで代謝されてエネルギー源となる。これらを運動前に摂取すると、筋肉と心臓のエネルギー産生を短時間で高めることができ、運動のパフォーマンスを高める。
つまり、運動の前にこれら(ジクロロ酢酸、ビタミンB1、R体αリポ酸、CoQ10、コーヒー、ケトンサプリメント)を摂取すると、心臓と筋肉のミトコンドリアでの代謝を短時間で亢進して、最大酸素摂取量を増やして、持久力が高くなるのです。この方法はコーヒー代を含めて1回に数百円で、確実に持久力を高めます
しかも、有酸素運動は筋肉細胞のミトコンドリアを増やす作用もありますので、運動を継続すると筋肉細胞のミトコンドリアを長期的に増やすことができます。ジョギングのような有酸素運動は、老化に伴う筋肉量の減少や心臓機能の低下を予防します。有酸素運動が認知症の予防に有効という疫学研究の結果も報告されています。
健康ドリンクのリゲインにはジクロロ酢酸ジイソプロピルアミンとビタミンB1が含まれていますが、ジクロロ酢酸ジイソプロピルアミンはピルビン酸脱水素酵素キナーゼ4(PDK4)を阻害することが報告されています。
つまり、リゲインはジクロロ酢酸ジイソプロピルアミンとビタミンB1の組合せがミトコンドリアの酸素呼吸を活性化するので、体力を高める効果があることが医学的に納得できます。
ジクロロ酢酸ジイソプロピルアミンは第一三共からリバオール(Liverall)という商品名で販売されています。50年以上前から慢性肝疾患の治療薬として使用されています。(549話参照)
長期的にミトコンドリアを増やし、機能を高める方法としてはアセチル-L-カルニチン、メトホルミン、ベザフィブラート、レスベラトロールが有効です(後述)。
この方法を実施すると筋肉と心臓の働きを良くし、抗老化とがん予防効果が期待できます。
私は5 km程度のジョギングを週に1〜2回行っていますが、2年くらい前まではジョギング中に休む(歩く)ことは無かったのですが、2年くらい前から途中で数回休まないと5kmを走れなくなりました。そこで、上記のようなサプリメントを摂取するようになり、その結果、10 kmを休みなくジョギングしても、途中でへたばることもなく、走ったあとも疲れなくなりました。その結果、苦痛になっていたジョギングが最近は楽しくなりました。いくら走っても疲れないからです。老化に伴う運動機能の低下を予防するためには、積極的にミトコンドリアの品質を良くし、ミトコンドリアの量を増やすことが、老化予防と筋力低下の治療として有効だと言えます。
【アセチル-L-カルニチンはミトコンドリアのタンパク質のアセチル化を亢進する】
アセチル-L-カルニチンがミトコンドリアや核のタンパク質のアセチル化を促進して、遺伝子発現やタンパク質活性に影響することは良く知られています。
アセチル-L-カルニチンはアセチルCoAを増やして、ミトコンドリアタンパク質のアセチル化を増やし、酸化的リン酸化を亢進してミトコンドリア機能を高めることが報告されています。以下のような論文があります。アセチル-L-カルニチンは若返り作用があるという内容です。
Mitochondria in the elderly: is acetylcarnitine a rejuvenator? (高齢者のミトコンドリア:アセチルカルニチンは若返り薬?)Adv Drug Deliv Rev. 2009 Nov 30; 61(14): 1332–1342.
【要旨】
内因性のアセチルカルニチンは炭水化物やアミノ酸や脂肪酸やステロールやケトン体などを含む複数の代謝経路において合成されるアセチルCoAの指標であり、主にトリカルボン酸サイクル(TCA回路)によって利用される。
高齢の動物や人においてアセチルカルニチンの補充は、ミトコンドリアの量や機能の維持を含めて、有益な効果を発揮する。
これらの効果は用量依存的であり、短期間の治療でも認められる。
アセチルカルニチンの作用機序を理解するために、我々はこの化合物の代謝と役割を検討する。
我々は、ミトコンドリアタンパク質のアセチル化が、ミトコンドリア遺伝子の発現およびミトコンドリアタンパク質合成の特異的増加をもたらすことを示唆する。
老化したラットの心臓において、この効果は、シトクロムb含有量の増加、呼吸酵素複合体III活性の回復、および酸化的リン酸化を引き起こし、加齢性のミトコンドリア機能の欠損の改善をもたらす。
アセチルカルニチン(アセチル-L-カルニチンと同じ)は加齢に伴うミトコンドリア機能の低下を改善し、そのメカニズムとしてミトコンドリア蛋白質のアセチル化が重要という内容です。この論文の内容を以下の図でまとめています。(この論文のFig3の日本語訳)

図:アセチルカルニチンはカルニチン・アセチルトランスフェラーゼ(CAT)によってコエンザイムA(CoA)にアセチル基を移してアセチルCoAを生成する。アセチルCoAはミトコンドリアのタンパク質をアセチル化し、ミトコンドリアの転写や蛋白合成を増やす。その結果、チトクロームbが増え、呼吸鎖酵素の活性が亢進し、酸化的リン酸化を増やす。その結果、ミトコンドリア機能を亢進する。
以下のような報告があります。
Acetyl-L-carnitine increases mitochondrial protein acetylation in the aged rat heart.(アセチル-L-カルニチンは老齢ラットの心臓におけるミトコンドリアのタンパク質のアセチル化を増やす)Mech Ageing Dev. 2015 Jan;145:39-50.
【要旨】
これまでの研究で、高齢のラットにアセチルカルニチンを投与すると、心臓の筋原線維間ミトコンドリアにおける呼吸鎖複合体IIIの加齢による機能低下を正常化し、虚血/再灌流心臓の機能の回復を促進することを示した。
この報告では、アセチルカルニチンの作用メカニズムとして、ミトコンドリアタンパク質のアセチル化の関与を検討した。
高齢ラットにアセチルカルニチンを投与すると、心臓のアセチルカルニチン含有量を回復させ、ミトコンドリアタンパク質のリジンのアセチル化を増加させ、心臓の筋線維鞘下(subsarcolemmal)および筋原線維間(interfibrillar)のミトコンドリアにおけるリジンアセチル化タンパク質の数を増加させた。
TCA回路、ミトコンドリアのβ酸化、呼吸鎖におけるATP合成に関与する酵素タンパク質に、多くのアセチル化を認めた。
イソクエン酸デヒドロゲナーゼ、長鎖アシル-CoAデヒドロゲナーゼ、呼吸酵素複合体Vおよびアスパラギン酸アミノトランスフェラーゼのアセチル化は、酵素活性を低下させた。
いくつかのタンパク質は、アセチルカルニチンの投与後にのみアセチル化されたので、外因性アセチルカルニチンがアセチル供与体として作用することが示唆された。
アセチルカルニチン投与はミトコンドリアタンパク質の量を変化させた。 31種のタンパク質において2倍以上の量の増加あるいは減少が観察された。
以上の結果から、老化したラットの心臓において、アセチルカルニチンの投与は、タンパク質アセチル化のためのアセチル基を提供し、ミトコンドリアタンパク質の量に影響を及ぼすことが明らかになった。
老化した動物にアセチルカルニチンを投与すると、心臓のミトコンドリアのタンパク質のアセチル化を増やして、ミトコンドリアのタンパク質の量に影響を及ぼすということです。
つまり、アセチルカルニチンによるミトコンドリア機能の活性化の機序には、アセチルカルニチンによるタンパク質のアセチル化が重要だということです。
アセチル-L-カルニチン(アセチルカルニチン)がミトコンドリアの機能を高め、運動機能を亢進することは多くの報告があります。以下のような論文があります。
Acetyl-l-carnitine fed to old rats partially restores mitochondrial function and ambulatory activity.( 老齢ラットに給餌されたアセチル-1-カルニチンは、ミトコンドリア機能および歩行活動を部分的に回復させる)Proc Natl Acad Sci U S A. 1998 Aug 4; 95(16): 9562–9566.
【要旨】
老齢のラットにアセチル-l-カルニチンに与えた後に、ミトコンドリア機能および歩行活性を測定した。若齢(3〜5ヶ月齢)および老齢(22〜28ヶ月齢)のラットに、飲料水中にアセチル-1-カルニチンを1.5%(wt / vol)含む飲水を与え、1ヶ月後にし、肝細胞を単離した。
アセチル-l-カルニチンの補充は、ミトコンドリア膜電位の加齢関連低下を有意に逆転させた。年齢とともに有意に低下するカルジオリピンも回復させた。
アセチル-l-カルニチンは、年齢と共に減少する細胞の酸素消費を、若いラットのレベルまで増加させる。しかし、酸素1分子あたりの活性酸素の生成は、未投与の老齢ラットより約30%高い。
アセチル-l-カルニチンを補充した老齢ラットの細胞では、未投与の老齢のラットに比べて、細胞内のグルタチオンおよびアスコルビン酸の量は、それぞれ約30%および50%低かった。これは、アセチルーl−カルニチンの補充は酸化ストレスを高めることを意味している。
老齢のラットの歩行能力(移動距離の平均値として評価)は、幼若動物よりもほぼ3分の1に低下した。
アセチルーl−カルニチンの補充は、若年ラットおよび老齢ラットの両方において、歩行活動を有意に増加させ、その増加は高齢ラットでより大きかった。
したがって、老齢ラットへのアセチル-l-カルニチンの補給は、ミトコンドリア機能および全身代謝活性の多くの指標の年齢関連低下を著しく逆転させるが、酸化ストレスを増加させる可能性がある。
ミトコンドリアを活性化すると、細胞の酸素消費が増え、活性酸素の産生量が増えて細胞の酸化ストレスを高めることになりますが、ミトコンドリアの活性を高めることによって歩行能力を若いレベルに戻すことができます。
つまり、アセチル-l-カルニチンと抗酸化作用のあるサプリメントを摂取すれば、ミトコンドリア機能を高め、活性酸素の害を減らして、抗老化作用が期待できると言えます。
この論文の考察(Discussion)の最後に、R体αリポ酸を投与すると、老齢ラットの細胞の活性酸素の産生を減らし、アセチルカルニチンを投与中でも活性酸素の産生を減らすと記述されています。
R体αリポ酸はピルビン酸脱水素酵素の補酵素として働くので、ミトコンドリアを活性化する作用もあります。ビタミンB1もピルビン酸脱水素酵素の働きに必要です。
したがって、アセチル-l-カルニチンとR体αリポ酸とビタミンB1の併用はミトコンドリアの働きを良くする効果が期待できます。
【高脂血症治療薬ベザフィブラートはミトコンドリアを増やす】
ミトコンドリアが増えることを「Mitochondrial Biogenesis」と言います。「ミトコンドリア新生」や「ミトコンドリア発生」と訳されています。細胞内でミトコンドリアが新しく発生することです。通常、既存のミトコンドリアが増大して分かれて増えていきます。
ミトコンドリア新生で最も重要な働きを担っているのが、PGC-1α(Peroxisome Proliferative activated receptor gamma coactivator-1α)です。日本訳は「ペルオキシソーム増殖因子活性化受容体γコアクチベーター1α」です。
PPARのリガンド(ベザフィブラート、ピオグリタゾンなど)やメトホルミンやカロリー制限やケトン体や運動はこのPGC-1αを活性化する作用があります。
ベザフィブラートはペルオキシソーム増殖因子活性化受容体(Peroxisome proliferator-activated receptor:PPAR)の汎アゴニスト(pan-agonist)です。高脂血症治療薬として使われています。安価です。
PPARにはアルファ型(PPARα)、ガンマ型(PPARγ)、デルタ型(PPARδ)の3種類のサブタイプがありますが、ベザフィブラートはこの3種類のPPARを活性化する作用があります。ベザフィブラートがミトコンドリアを増やして機能を高め、その結果、細胞のがん化や悪性進展を阻止することが報告されています。以下のような報告があります。
Increases in Mitochondrial Biogenesis Impair Carcinogenesis at Multiple Levels(ミトコンドリア新生の増加は、発がん過程の多くのレベルで阻止する)Mol Oncol. 2011 Oct; 5(5): 399–409.
【要旨】
多くのがん細胞でミトコンドリアでの酸素呼吸が低下しているが、この現象ががん細胞の発生や悪性進展においてどのような役割を担っているかはまだ明らかになっていない。
この現象をより理解するために、ミトコンドリアの機能をさらに阻害する方法ではなく、逆にペルオキシソーム増殖因子活性化受容体(PPAR)/ PPARγコアクチベーター1α (PGC-1α)経路を活性化することによってがん細胞のミトコンドリアを増やすことによって、その変化を検討した。
PPAR/PGC-1α経路の活性化は、PPARの汎アゴニストで、さらにPGC-1αの発現を促進する作用があるベザフィブラートをがん細胞に投与することで行った。
ベザフィブラートで処理すると、がん細胞のミトコンドリアのたんぱく質と酵素活性が亢進した。
ミトコンドリアの数と機能が亢進したがん細胞では、グルコース含有培地においてがん細胞の増殖活性は低下した。
さらに、このようながん細胞は浸潤性が低下し、この現象は乳酸の産生量の減少と直接的に関係していた。
驚くべきことに、ベザフィブラートを投与したがん細胞はミトコンドリアのマーカーの量が増加していたにも拘らず、酸素呼吸の量には変化は起こらなかった。しかしながら、呼吸共役とATP量においては増加が見られた。
これらの結果は、ミトコンドリアでの酸化的リン酸化を亢進させると、がん細胞の増殖能や浸潤能は低下し、がんの進展が阻止されることを示している。
がんというのは一般には遺伝子異常と考えられていますが、代謝異常という観点からミトコンドリアの異常ががん細胞の発生や進展に関与していることが指摘されています。
1920年代にオットー・ワールブルグが、酸素が十分に利用できる状況でも、がん細胞ではミトコンドリアでの酸化的リン酸化が低下し、解糖系でのエネルギー産生が亢進し、その結果、乳酸の産生が増えていることを指摘しています。
現在では、多くのがん細胞で、ミトコンドリアでの酸化的リン酸化が低下していることが知られています。
解糖系が亢進し、乳酸が増え、がん細胞の周囲が酸性化すると、がん細胞が周囲組織に浸潤しやすくなり、転移が促進されます。血管新生も亢進します。
ミトコンドリアDNAを欠損させて、ミトコンドリアでの酸化的リン酸化を阻害すると、がん細胞は悪性度を増し、浸潤や転移が促進されることが報告されています。
この論文では、がん細胞のミトコンドリアの機能を活性化するとどうなるかを検討しています。
Mitochondrial Biogenesisは「ミトコンドリア新生」や「ミトコンドリア発生」と訳されています。細胞内でミトコンドリアが新しく発生することです。通常、既存のミトコンドリアが増大して分かれて増えていきます。
ミトコンドリア新生で最も重要な働きを担っているのが、PGC-1α(Peroxisome Proliferative activated receptor gamma coactivator-1α)です。日本語訳は「ペルオキシソーム増殖因子活性化受容体γコアクチベーター1α」です。
PGC-1αは転写因子のPPAR-γと結合して、PPAR-γの転写活性を高める因子として見つかりました。
PGC-1αは核内受容体を中心とするさまざまな転写因子と結合し標的遺伝子の発現を制御する転写コアクチベーターです。骨格筋、心筋、脂肪、脳などの臓器においてミトコンドリアの生合成および酸化的リン酸化を促進するなど細胞のエネルギー産生を制御する役割が知られています。
運動すると骨格筋のPGC-1α量が増えます。
ケトン体はPGC-1αタンパク質の発現を亢進します。カロリー制限はサーチュイン(Sirtuins)を活性化し、PGC-1αの発現を亢進します。
糖尿病治療薬のメトホルミンはAMP依存性プロテインキナーゼ(AMPK)を活性化してPGC-1αの発現と活性を亢進します。
高脂血症治療薬のベザフィブラートはPPARを活性化し、PGC-1αの発現量を増やし、ミトコンドリア新生を増加させる作用があります。
この論文では、がん細胞のミトコンドリア機能をPPARの汎アゴニストのベザフィブラートで活性化すると、解糖系が抑制され、乳酸の産生が低下し、がん細胞の増殖や浸潤が抑制されることを報告しています。
ベザフィブラートを使ってがん細胞のミトコンドリア(酸化的リン酸化)を活性化すると、がん細胞の悪性度は低下するという結論です。

図:PPAR(ペルオキシソーム増殖因子活性化受容体)の汎アゴニスト(受容体に結合して活性化する物質)であるベザフィブラートは、直接あるいはPPARを介してPGC-1α(PPARγコアクチベーター1α)を活性化する(1)。PGC-1αはミトコンドリア新生を亢進して、細胞内のミトコンドリアの数と量を増やす(2)。ミトコンドリア新生が亢進すると、細胞の酸化的リン酸化が亢進し、解糖系が抑制され乳酸産生が低下する(3)。このような代謝の変化はがん細胞における代謝異常(ワールブルグ効果)を正常化する(4)。ワールブルグ効果の抑制は、がん細胞の増殖・浸潤・転移を抑制する(5)。ベザフィブラートなどのPPARアゴニストは、PI3K/Aktシグナル伝達系抑制や血管新生阻害作用や抗炎症作用など多彩な機序による抗がん作用も示す(6)。メトホルミン、カロリー制限、ケトン体もPGC-1αを活性化するので、ミトコンドリア新生を亢進する作用がある(7)。ミトコンドリア新生を亢進する治療法はがん細胞の増殖抑制に効果がある。
ベザフィブラートでミトコンドリアを活性化すると、ミトコンドリアの機能異常を是正できるという報告もあります。以下のような論文もあります。
A metabolic shift induced by a PPAR panagonist markedly reduces the effects of pathogenic mitochondrial tRNA mutations.(PPARの汎アゴニストによって誘導される代謝シフトは病的なミトコンドリアtRNA変異の作用を顕著に軽減する)J Cell Mol Med. 2011 Nov;15(11):2317-25.
【要旨】
ミトコンドリアDNAでコードされたトランスファーRNA(tRNA)遺伝子の変異は多くの疾患の原因となっている。
培養細胞(in vitro)と動物実験(in vivo)の系で、合成アゴニストによるペルオキシソーム増殖因子活性化受容体の活性化は、ミトコンドリアでの酸化的リン酸化反応を刺激し、ミトコンドリアの量を増やし、さらに酸化的リン酸化に関与するたんぱく質の遺伝子変異による欠損を部分的に代償する。
この研究では、異なるミトコンドリアtRNAの変異をもつ細胞を使って、PPARの汎アゴニストであるベザフィブラートが、酸化的リン酸化の欠損の効果を減弱できるかどうかを検討した。
実験の結果、ベザフィブラートはミトコンドリアの量とミトコンドリアtRNAの定常レベルの量を増やし、ミトコンドリアのたんぱく質の合成を亢進した。このミトコンドリア機能の改善の結果、酸化的リン酸化活性は上昇し、ミトコンドリアにおけるATP産生能を亢進した。
PPARの汎アゴニストは、ミトコンドリア新生を制御するPPARγコアクチベーター-1α(PGC-1α)の発現を亢進することが知られている。
さらに、変異したミトコンドリアtRNAを持って酸化的リン酸化が機能している細胞株を選択すると、これらの細胞では、ベザフィブラート投与と同様に、PGC-1αの発現が3倍に増えていた。
これらの実験結果から、ミトコンドリア新生を亢進し、酸化的リン酸化活性を高めることは、ミトコンドリアの異常に起因する疾患の治療として有効であることが示唆された。
つまり、ミトコンドリアDNAの変異などでミトコンドリア機能が低下していても、ベザフィブラートでミトコンドリア新生を亢進して酸化的リン酸化を促進すると、ミトコンドリア機能異常を改善できるということです。
がん細胞におけるミトコンドリア異常をベザフィブラートが改善できる可能性が示唆されます。
ミトコンドリアの機能を活性化する方法は、がんと老化を予防します。具体的な方法は以下の図でまとめています。私も実践していますが、効果を実感しています。運動機能(持久力)が明らかに良くなっています。

図:ジクロロ酢酸ナトリウム、R体αリポ酸、ビタミンB1はピルビン酸脱水素酵素を活性化する。コエンザイムQ10(CoQ10)とカフェイン(コーヒから摂取)は酸化的リン酸化を活性化する。運動、ベザフィブラート、メトホルミン、ケトン体、アセチル-L-カルニチンはミトコンドリアの量を増やし、機能を活性化する。これらを組み合せると、全身のミトコンドリアを活性化し、老化とがんの予防と治療に役立つ。
| « 581)抗がん剤... | 583)がん細胞... » |



