がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
361) 膠芽腫に対するラパマイシンとレチノイド(イソトレチノイン)の相乗効果

図:栄養摂取やインスリン、成長ホルモン、IGF-1などの増殖刺激が細胞に作用すると、それらの受容体などを介してPI3キナーゼ(Phosphoinositide 3-kinase:PI3K)というリン酸化酵素が活性化され、これがAktというセリン・スレオニンリン酸化酵素をリン酸化して活性化する。活性化したAktは細胞内のシグナル伝達に関与する様々な蛋白質(mTORC1やFoxOなど)の活性を制御することによって細胞の増殖や生存(死)の調節を行う。正常細胞では、栄養摂取の制限やメトホルミンでmTORC1の阻害やFoxOの活性化ができる。しかし、がん細胞では、PI3K/Akt/mTORC1シグナル伝達系に関与する様々なタンパク質の遺伝子変異などによってAktやmTORC1は恒常的に活性化している。このような異常が存在する場合、がん細胞の増殖を抑制するにはAktやmTORC1を直接阻害したり、FoxOなどの転写因子を直接活性化する方法が必要になる。
361) 膠芽腫に対するラパマイシンとレチノイド(イソトレチノイン)の相乗効果
【多形膠芽腫とレチノイドの抗がん作用】
多形膠芽腫(glioblastoma multiforme)は増殖活性が高く、進行が極めて早く、ヒトの悪性腫瘍の中で最も予後不良の腫瘍と言われています。
膠芽腫が再発しやすいのは、がん幹細胞が抗がん剤や放射線治療に抵抗性を示すためと考えられており、がん幹細胞の抗がん剤や放射線に対する感受性を高める方法が検討されています。
その一つにメトホルミンがあります。メトホルミンは糖尿病治療薬ですが、転写因子のFOXO3aの活性化を介して、膠芽腫のがん幹細胞の抗がん剤や放射線に対する感受性を高めることが報告されています。膠芽腫やがん幹細胞やFOXO3aについては339話で解説しています。
難治性にきびの治療薬であるイソトレチノイン(Isotretinoin)は、レチノイドの一種ですが、IGF-1の産生を減少させる作用や転写因子FoxOを活性化する作用が報告されており、がんの治療に利用する研究が行われています。
レチノイド(retinoid)はビタミンA(レチノール)およびその誘導体や類縁化合物の総称です。レチノイドは生体内では活性型であるAll-trans retinoic acid (ATRA)として細胞核内の受容体に結合して、その生理作用を発揮します。
イソトレチノイン(13-cisレチノイン酸)は体内でATRA(All-trans レチノイン酸)に変換されて効果を発揮します。レチノイドの作用機序やイソトレチノインについては323話で解説しています。
レチノイドのイソトレチノンが膠芽腫に対して抗腫瘍効果を示すことが以前から報告があります。
臨床試験も行われています。以下のような報告があります。
Isotretinoin maintenance therapy for glioblastoma: A retrospective review.(膠芽腫のイソトレチノイン維持療法:回顧的レヴュー)J Oncol Pharm Pract. 2013 May 15. [Epub ahead of print]
テキサス大学MDアンダーソンがんセンターからの報告です。
【要旨】
目的;膠芽腫に対する標準的な治療法として外科的切除や放射線治療やテモゾロマイド(temozolomide)が行われている。イソトレチノインが膠芽腫の再発を遅らせる目的の維持療法として使用されているが、この治療法の有効性についてはまだ証明されていない。この研究の目的は、イソトレチノン維持療法を受けた患者とこれを受けなかった患者の生存率や無再発生存期間や副作用などを比較することである。
方法:この研究はMDアンダーソンがんセンターで2004年から2009年に治療を受けた膠芽腫の成人患者を対象にした過去に遡った総括(retrospective review)である。患者は外科切除とテモゾロマイドを併用した放射線治療とその後に術後補助化学療法としてテモゾロマイドの投与を受けた。この標準治療を受けた患者群を対象群(コントロール群)として、同様の治療を受けイソトレチノン維持療法を追加した群の治療成績を比較した。
結果:コントロール群は70名で、イソトレチノイン維持療法を併用した患者は18名であった。無再発生存期間はコントロール群では8.3ヶ月に対して、イソトレチノイン維持療法を併用した群では25.3ヶ月であった(p=0.04)。2年後と3年後の全生存率には統計的な有意差は認めなかった(p=0.11)。イソトレチノインの毒性として皮膚や代謝や精神的な副作用が認められた。
結論:イソトレチノイン維持療法を併用すると無再発生存期間は延長したが、この過去に遡った研究では全生存率を改善する効果は認めなかった。イソトレチノイン維持療法の有用性については、膠芽腫患者の生活の質(QOL)に対する影響や、その副作用との兼ね合いで判断されなければならない。
この臨床試験では、イソトレチノインの投与によって無再発生存期間が約3倍(コントロール群の8.3ヶ月に対して、イソトレチノイン維持療法を併用した群では25.3ヶ月)なるという成績でしたが、2年目や3年目の生存率に統計的な差が無かったのと、イソトレチノインには副作用もあるので、イソトレチノン維持療法の有用性は低いかもしれないという結果です。
しかし、イソトレチノイン投与群の症例が少ないのとretrospective(過去に遡る)研究であるため、まだ結論は出せません。
膠芽腫は非常に進行が早く、平均生存期間は12~14カ月程度と言われているがんなので、レチノイドだけを追加しても2年とか3年の生存率では差がでにくいのかもしれません。
【mTOR阻害剤とレイチノイドの併用は多形膠芽腫のがん幹細胞の治療抵抗性を阻害する】
レチノイドだけでは膠芽腫に対する抗腫瘍効果は弱いのですが、レチノイドにmTOR阻害剤のラパマイシンを併用すると抗腫瘍効果が高まる可能性を示唆する報告があります。培養細胞を使った実験レベルの研究ですが、以下のような論文があります。
Targeting cancer stem cells in glioblastoma multiforme using mTOR inhibitors and the differentiating agent all-trans retinoic acid. (mTOR阻害剤と分化誘導剤の全トランス・レチノイン酸を用いた多形膠芽腫のがん幹細胞を標的とした治療)Oncol Rep. 2013 Oct;30(4):1645-50.
ニューヨーク医科大学(New York Medical College)の神経外科学部門(Department of Neurosurgery)からの報告です。
【要旨】
多形膠芽腫は原発性脳腫瘍の中では最も悪性度の高い腫瘍で、治療に抵抗性で多くは予後が極めて悪い。
この腫瘍が再発しやすい理由の一つは、多形膠芽腫のがん幹細胞が抗がん剤や放射線治療に抵抗性を示すからである。したがって、がん幹細胞を標的にした治療法の開発が多形膠芽腫の治療成績を高めるために必要である。
ラパマイシンの標的タンパク質はmTORC1とmTORC2という2種類の複数のタンパク質から構成されるタンパク質複合体であり、それぞれ細胞の増殖(proliferation)と移動(migration)の制御を行っている。
多形膠芽腫のがん幹細胞ではmTORタンパク質の機能異常が存在することが示されている。レチノールの誘導体である全トランス・レチノイン酸(All-trans retinoic acid, ATRA)は、がん幹細胞と正常な神経前駆細胞の細胞分化を誘導する。
この研究の目的はがん幹細胞の維持におけるmTORの役割を明らかにし、mTOR経路の阻害剤と分化誘導剤の併用によって多形膠芽腫のがん幹細胞を標的とした治療の可能性を検討することである。
実験の結果、ATRAによって幹細胞のマーカーのNestinが消失したことから、ATRAはがん幹細胞の分化を誘導することが明らかになった。
これらの結果はウェスタンブロット法でATRA処理後にNestinの発現量が時間依存性に減少することから確認された。
この効果は、mTOR阻害剤(ラパマイシン)やPI3K阻害剤(LY294002)やMEK1/2阻害剤(U0126)との併用でも同様に認められた。
活性化したpERK1/2(extracellular signal-regulated kinase 1/2)の発現は、mTOR経路の阻害剤の有無にかかわらず、ATRAの投与によって促進された。(つまり、ATRAはpERK1/2の発現を直接誘導するということ)
がん幹細胞の増殖は、ATRA単独処理あるいはATRAとラパマイシンの併用処理によって抑制された。
多形膠芽腫細胞の運動性(motility)はATRA、ラパマイシン、LY29002のそれぞれ単独の投与によって抑制された。しかしながら、これらを併用するとがん細胞の運動性を阻害効果は増強したので、相乗効果が示唆された。
これらの結果は、ATRAによる分化誘導作用はERK1/2シグナル伝達系を介して起こり、多形膠芽腫の治療におけるmTOR経路の阻害剤と分化誘導剤の併用の重要性を示唆している。
培養細胞を使った実験なので、人体で本当に相乗効果があるのかはまだ不明です。しかし、ラパマイシンやラパマイシン誘導体ががんや肉腫の増殖を抑制することは臨床試験でも証明されています。
mTOR阻害剤とレチノイドの併用が白血病細胞の増殖を抑える効果が動物実験で報告されています。
Inhibition of mammalian target of rapamycin signaling potentiates the effects of all-trans retinoic acid to induce growth arrest and differentiation of human acute myelogenous leukemia cells.(ヒト急性骨髄性白血病細胞の増殖停止と細胞分化を誘導する全トランスレチノイン酸の効果を哺乳類ラパマイシン標的タンパク質シグナル伝達系の阻害は増強する)Int J Cancer. 125(7):1710-20. 2009年
この論文は高知医科大学の血液・呼吸器内科学教室からの報告です。
全トランスレチノイン酸(ATRA)は急性骨髄性白血病の増殖抑制作用と分化誘導作用を示しますが、その効果がmTORC1阻害剤のエベロリムス(everolimus)の併用によって増強されるという実験結果です。マウスに移植した実験系でもATRAとエベロリムスの併用で増殖抑制効果が相乗的に増強することが確認されています。
以上のような研究結果から、多形膠芽腫細胞や急性骨髄性白血病を含めて多くのがんの治療としてラパマイシン(あるいはラパマイシン誘導体)とレチノイド(イソトレチノイン)の併用は検討してみる価値がありそうです。
【抗がん作用と免疫抑制作用と寿命延長効果を持つラパマイシン】
ラパマイシン(Rapamycin)は免疫抑制剤として臓器移植の際の拒絶反応を防ぐために使用される薬ですが、このラパマイシンに寿命延長効果と抗がん作用が明らかになったことから、ラパマイシンの生体内のターゲット分子である哺乳類ラパマイシン標的タンパク質(mammalian target of rapamycin:略してmTOR)というタンパク質が見つかりました。
ラパマイシンは1975年にイースター島(モアイ像で有名な南太平洋の島)の土壌から発見されたStreptomyces hygroscopicsという放線菌の一種が産生する有機化合物です。
イースター島はポリネシア語で「ラパ・ヌイ(Rapa Nui)」と言い、この「ラパ」と「菌類が合成する抗生物質」を意味する接尾語の「マイシン」とを組み合わせて「ラパマイシン」と名付けられています。
ラパマイシンは最初は抗生物質として開発されましたが、リンパ球の増殖を抑制する作用が見つかり、免疫抑制剤として使用されるようになりました。1991年に酵母におけるラパマイシンの標的タンパク質が見出されてTOR(target of rapamycin)と命名され、後に哺乳類のホモログ(相同体)が見出されてmTOR(mammalian target of rapamycin:哺乳類ラパマイシン標的タンパク質)と命名されました。
ラパマイシンの薬効としては、免疫抑制作用の他に、平滑筋細胞増殖抑制作用や抗がん作用や寿命延長効果が知られています。平滑筋細胞増殖抑制作用に関しては、狭心症や心筋梗塞の治療に使われる血管内ステントに冠動脈再狭窄予防効果を目的としてラパマイシンを配合したステントが製品化され、心臓カテーテル治療において使用されています。また、リンパ脈管筋腫症の治療薬としても使用されています。
寿命延長作用については、生後600日のマウス(人間では60歳ほどに相当)にラパマイシンを投与すると、通常に比べてメスは平均で13%、オスは9%長生きしたという動物実験の結果が報告されています。
ラパマイシン自体に抗がん作用が報告されていますが、ラパマイシンの構造を改変した物質(ラパマイシン誘導体)が抗がん剤として開発されて、すでに幾つかの薬が臨床で使用されています。このようなラパマイシンの多彩な薬効は、このラパマイシンがターゲットにするmTORが細胞の増殖やエネルギー産生に重要な役割を担っているからです。
【哺乳類ラパマイシン標的蛋白質(mTOR)の働きを阻害するとがん細胞は死滅する】
mTORはラパマイシンの標的分子として同定されたセリン・スレオニンキナーゼで、細胞の分裂や生存などの調節に中心的な役割を果たしています。
mTORにはmTOR複合体1(mammalian target of rapamycin complex 1:mTORC1)とmTOR複合体2(mammalian target of rapamycin complex 2:mTOR2)の2種類があります。mTORに幾つかのタンパク質がくっついて異なる複合体を形成し、それがmTORC1とmTORC2の2種類あるということです。
mTORC1は成長因子や、糖やアミノ酸などを含む栄養素のセンサーとして機能し、mTORC2は細胞骨格やシグナル伝達の制御をしています。インスリンやインスリン様成長因子によって活性化されるのはmTORC1の方です。
mTORC1は、糖やアミノ酸などの栄養素の状況、エネルギー状態、成長因子(増殖因子)などによる情報を統合し、エネルギー産生や細胞分裂や生存などを調節しています。
細胞の増殖というのは、栄養とエネルギーが利用できる状態にあるときに、新たな細胞構成成分(タンパク質、核酸、脂質など)を合成して、細胞の数を増やす生化学的プロセスのことです。したがって、増殖するためには、細胞を新たに作る材料(栄養素)とエネルギー(糖質や脂質を酸化して得られるATP)が必要です。増殖因子や成長因子やホルモンなどによって細胞増殖の指令(シグナル)が来たときに、栄養素とエネルギーの供給が十分にある条件で、タンパク質や脂質の合成を促進して細胞増殖を実行するのがmTORC1です。
栄養摂取やインスリン、成長ホルモン、IGF-1、サイトカインなどの増殖刺激が細胞に作用すると、それらの受容体などを介してPI3キナーゼ(Phosphoinositide 3-kinase:PI3K)というリン酸化酵素が活性化され、これがAktというセリン・スレオニンリン酸化酵素をリン酸化して活性化します。活性化したAktは、細胞内のシグナル伝達に関与する様々な蛋白質の活性を調節することによって細胞の増殖や生存(死)の調節を行います。
このAktのターゲットの一つがmTORC1です。Aktによってリン酸化(活性化)されたmTORC1は細胞分裂や細胞死や血管新生やエネルギー産生などに作用してがん細胞の増殖を促進します(下図)。この経路をPI3K/Akt/mTORC1経路と言い、がん細胞や肉腫細胞の増殖を促進するメカニズムとして極めて重要であることが知られています。すなわち、PI3K/Akt/mTORC1経路の阻害はがん細胞や肉腫細胞の増殖を抑制し、細胞死(アポトーシス)を誘導することができるため、がん治療のターゲットとして注目されています。
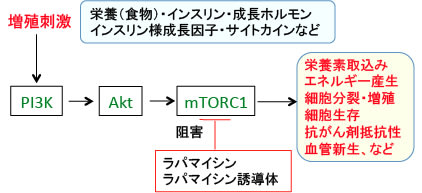
したがって、mTORC1を阻害するとがん細胞で亢進している解糖系を抑制できます。
355話で解説した「解糖系を阻害しながらクエン酸回路(TCA回路)を活性化する」方法(2-デオキシ-D-グルコースやジクロロ酢酸ナトリウムなど)にmTORC1阻害剤を併用すると抗腫瘍効果を増強できます。
前述のように細胞内のシグナル伝達系が正常であれば、メトホルミンでAMPK を活性化するばmTORは抑制できます。
| « 360) 転写因子... | 362)女性が男... » |





