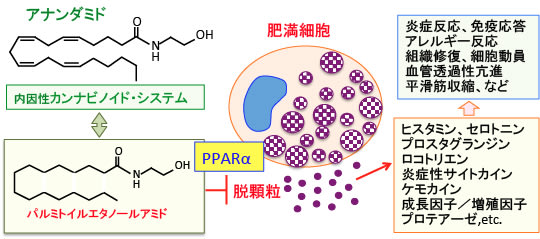
図:肥満細胞(マスト細胞)はヒスタミンなどの炎症性メディエーターが詰まった顆粒を持っている。肥満細胞が活性化され、「脱顆粒」によって顆粒内部の炎症性メディエーターが遊離すると炎症反応やアレルギー反応が引き起こされる。脂肪酸エタノールアミドのパルミトイルエタノールアミドは肥満細胞のPPARα(ペルオキシソーム増殖因子活性化受容体α)に作用して脱顆粒を抑制して、抗炎症作用を示す。さらに、アナンダミドの代謝などにも影響して内因性カンナビノイドシステムに作用することも報告されている。これらの作用によってパルミトイルエタノールアミドは炎症や疼痛を軽減する効果を発揮する機序が報告されている。
440)パルミトイルエタノールアミド(その1):肥満細胞とPPARαとカンナビノイド
【オータコイドと肥満細胞】
傷害や細菌感染など体の組織に異常が発生したとき、それに対応するために異常部位に様々な細胞が動員されたり、様々な生理活性物質が産生されます。このような生体内で局所的に生成されて作用する生理活性物質を総称してオータコイド(Autacoid)といいます。
オータコイドにはヒスタミン、セロトニン、ブロスタグランジン、サイトカインなどが含まれます。
ヒスタミンやセロトニンは細胞内に貯蔵されていて刺激に応じて細胞外に放出されますが、その他のものは刺激に応じて合成されます。
肥満細胞(マスト細胞, mast cell)は全身の粘膜下組織や結合組織に存在する骨髄由来の細胞で、血管が分布する組織であればほぼ全ての組織で見いだすことができます。
肥満細胞の中にはヒスタミンや炎症性サイトカインなどの各種化学伝達物質(ケミカルメディエーター)を含む顆粒が多く存在し、膨れた形態が肥満に似ているため肥満細胞という名称になっています。
肥満細胞は細胞表面にIgE受容体が存在し、これに抗原が結合したIgEを介して受容体の架橋が成立すると、それがトリガーとなって細胞膜酵素の活性化がうながされ、内容物である顆粒からヒスタミンなどが放出されます。これを脱顆粒と言います。花粉症や蕁麻疹は抗原刺激による肥満細胞の脱顆粒によるヒスタミン放出によって発症します。
肥満細胞はこのような即時型アレルギー反応の中心となって働く細胞ですが、近年では、アレルギー以外の様々な免疫応答や炎症反応に関与することや、疼痛にも関与することが明らかになっています(下図)。

図:肥満細胞(マスト細胞)は中身の詰まった顆粒を多数有しており、この顆粒の中にはヒスタミンなどの炎症性メディエーターが含まれている。肥満細胞はIgEに対する高親和性受容体を発現しており、抗原が結合したIgEを介して受容体が架橋することにより、肥満細胞が活性化され、「脱顆粒」と呼ばれるプロセスを経て、顆粒内部のヒスタミンをはじめとする炎症性メディエーターが遊離する。その結果、炎症や免疫応答などに関与する。
【パルミトイルエタノールアミドは肥満細胞の活性化を抑制する】
大豆レシチンや卵黄や落花生油に抗炎症作用と鎮痛作用を示す成分があることが1950年代から知られていました。その活性成分として発見されたのがパルミトイルエタノールアミド(Palmitoylethanolaide; PEA)です。
PEAは炭素数16の脂肪酸のパルミチン酸にエタノールアミンが結合した構造です。
PEAは体内でも合成され、脳や肝臓や筋肉組織など様々な組織に存在します。
PEAは古くから鎮痛作用や抗炎症作用が知られています。ヨーロッパでは1970年代から鎮痛作用のあるサプリメントとして販売されています。製品名はPeaPureなどです。
チェコスロバキアにおいて1960年代から1970年代にかけてPEAの臨床試験が多く実施され、その抗炎症作用と鎮痛作用が確認されました。PEAはアスピリンより鎮痛作用が強いことが報告されています。1975年にランセットにPEAの鎮痛作用が報告されています。
初期の研究結果はPEAが感染症に対する抵抗力を高めること、抗炎症作用を示すことを明らかにしています。
例えば、マウスにPEAを経口で投与すると赤痢菌毒素やストレプトリシンO(溶血性連鎖球菌の外毒素)や生きたグループAストレプトコッカスの投与による死亡率を低下しました。
事前にPEAを投与して準備しておくと、外傷性ショックによる死亡を減らすことも報告されています。
PEAが抗がん剤治療の副作用を軽減することや、白血病の動物実験で、抗がん剤治療(シスプラチン、シクロフォスファミド、ビンクリスチン、メソトレキセート)とPEAの併用で生存率が高まることが報告されています。
PEAが神経障害性疼痛や抗がん剤による神経障害を軽減する効果も報告されています。
このような確実な効果が臨床的に確認されていましたが、その作用メカニズムは長く不明でした。
PEAの作用メカニズムの研究が進んだのは、1993年にリータ・レーヴィ=モンタルチーニ(Rita Levi-Montalcini)の研究グループが、N-アセチルエタノールアミン型(N- acylethanolamine type)の脂質アミドが肥満細胞の活性を調整する作用があることを偶然に発見したからです。
レーヴィ=モンタルチーニ博士は神経成長因子と上皮成長因子の発見の功績で1986年にノーベル賞(生理学・医学賞)を受賞したイタリアの神経学者です。
肥満細胞に対する神経成長因子の作用がPEAによって影響を受けることを報告しています。
これが、PEAの抗炎症作用の最初のメカニズムの報告です。
その後もPEAがPPARα(ペルオキシソーム増殖因子活性化受容体α)のリガンドであることや、内因性カンナビノイドシステムに影響する作用などが報告されています。
1992年から2000年にかけて内因性カンナビノイドのアナンダミドやカンナビノイド受容体CB1とCB2や核内受容体のPPARなどが発見され、それによってPEAがこれらの体内システムに作用することが明らかになってきました。
【PEAはPPARαのリガンド】
ペルオキシソーム増殖因子活性化受容体(Peroxisome proliferator-activated receptor:PPAR)については
437話で解説しています。
ペルオキシソーム増殖因子活性化受容体(PPAR)はレチノイン酸受容体(RAR)やレチノイドX受容体(RXR)などと同じ核内受容体スーパーファミリーに属する核内受容体の一種です。PPARにはα、γ、δの3種類があります。
このうちPPARαを活性化すると様々な抗腫瘍効果が得られることが多くの研究で報告されています。
たとえば、PPARαの活性化はペルオキシソームを増やして脂肪酸のβ酸化を亢進し、グルコースの解糖系を抑制する働きがあるので、がん細胞のワールブルグ効果(酸素がある条件でも、がん細胞はグルコースの嫌気性解糖系でエネルギーを産生していること)を阻害して、がん細胞の増殖を抑える可能性が指摘されています。
さらに、インスリン様成長因子-1のシグナル伝達系(PI3K/Akt)を抑制する作用や、抗炎症作用や血管新生阻害作用などの抗腫瘍効果が報告されています。
転写因子のFoxO3Aを活性化してがん細胞の増殖抑制とアポローシス誘導作用があることが報告されています。
PEA(パルミトイルエタノールアミド)がPPARαのリガンドであることはPPARが発見された数年後の1990年に報告されています。さらに、PEAの抗炎症作用がPPARαを介することが報告されています。以下のような論文があります。
The Nuclear Receptor Peroxisome Proliferator-Activated Receptor-α Mediates the Anti-Inflammatory Actions of Palmitoylethanolamide. (パルミトイルエタノールアミドの抗炎症作用は核内受容体のペルオキシソーム増殖因子活性化受容体αを介する) Mol Pharmacol 67:15–19, 2005
PEAがPPAR-αのmRNAの発現を誘導し、PPAR-αのアゴニストとして作用して抗炎症作用や鎮痛作用を示すことを報告しています。これらの作用は、PPAR-α遺伝子を欠損したマウスでは認められなかったため、PEAの抗炎症作用と鎮痛作用がPPAR-αを介するメカニズムで起こっていると結論づけています。
PEAは脂肪酸エタノールアミドで、体内で何らかの刺激によって酵素によって合成され、必要なくなれば分解酵素で分解されます。
つまり、PEAは脂肪酸由来のケミカルメディエーターとして炎症や免疫応答の制御に関わっていると考えられています。
PEAは中枢神経系でも炎症反応を抑制や神経保護作用を示すことが報告されています。
最近の研究で、核内受容体のペルオキシソーム増殖因子活性化受容体(PPAR)と細胞膜受容体(Gタンパク質共役型受容体)であるカンナビノイド受容体の相互作用が明らかになっています。(
437話参照)
内因性カンナビノイドのアナンダミド(アラキドノイルエタノールアミド;arachidonoylethanolamide)は脂肪酸の一種のアラキドン酸とエタノールアミンが結合したもので、パルミトノイルエタノールアミドも脂肪酸エタノールアミドであるため、PEAの作用が内因性カンナビノイドシステムと関連がある可能性が指摘されていますが、まだ十分に解明されていません。

図:内因性カンナビノイドの一種のアナンダミド(arachidonoylethanolamide)はω6系多価不飽和脂肪酸のアラキドン酸にエタノールアミンが結合した構造を呈し、パルミトイルエタノールアミドは飽和脂肪酸のパルミチン酸にエタノールアミンが結合した構造をしている。
【内因性カンナビノイドは脂質から産生される】
大麻(マリファナ)は細胞内の受容体に作用して、鎮痛作用や吐き気止め作用や食欲増進作用など様々な薬効を示します。大麻の薬効の多くは大麻に特異的に含まれるカンナビノイドと呼ばれる成分が関与しています。現在80種類以上のカンナビノイドが大麻から分離・同定されています。
大麻のカンナビノイドが作用する受容体が幾つか見つかっていますが、その代表がCB1とCB2です。
1964年にイスラエルのワイズマン研究所の ラファエル・メコーラム(Raphael Mechoulam) 博士らによって、大麻の精神変容作用の原因成分としてΔ9-テトラヒドロカンナビノール(THC)が分離され、1988年にTHCが直接作用する受容体が発見されてカンナビノイド受容体タイプ1(CB1)と命名されました。CB1は中枢神経系のシナプスに存在し、感覚神経の末端部分にも存在します。さらに筋肉組織や肝臓や脂肪組織など非神経系の組織にも分布しています。
数年後にタイプ2の受容体(CB2)の遺伝子が発見されました。CB2は主に免疫系の細胞に発現しています。
CB1とCB2の存在はこれらの受容体に作用する体内成分が存在することを意味しています。大麻成分に反応するために動物体内にCB1とCB2が存在するとは考えにくいからです。
カンナビノイド受容体と反応する体内物質を内因性カンナビノイドと言います。
1992年に内因性カンナビノイドのアナンダミド(anandamide)がメコーラム博士らによって発見されました。アナンダミドはサンスクリット語の「至福」を意味します。メコーラム博士は内因性カンナビノイドが人間の快感や幸福感を引き起こす物質だと考えたと思われます。
アナンダミドはアラキドノイルエタノールアミド (arachidonoylethanolamide) と言うのが正式名称で、脂肪酸の一種のアラキドン酸とエタノールアミンが結合したものです。
さらに、2番目の内因性カンナビノイドとして2-アラキドノイルグリセロール(2-arachidonoylglycerol; 2-AG)が発見されました。この2-AGはアラキドン酸にグリセロールが結合したものです。さらにいくつかの内因性カンナビノイドが見つかっていますが、多くは脂肪酸の代謝産物です。
内因性のカンナビノイドが同定されると、それらの生合成や分解に関与する酵素や、受容体とリガンドが結合したあとのシグナル伝達経路が解明されました。
アナンダミドは脂肪酸アミドハイドロラーゼ(fatty acid amide hydrolase; FAAH)によって分解され、2-アラキドノイルグリセロールはモノアシルグリセロール・リパーゼ(monoacylglycerol lipase; MGL)などによって分解されます。
つまり、体内には内因性カンナビノイド(アナンダミドや2-アラキドノイルグリセロールなど)と、それらを合成する酵素や分解する酵素、内因性カンナビノイドが結合するカンナビノイド受容体によって内因性カンナビノイド・システムが構成されています。
内因性カンナビノイドのアナンダミドと2-アラキドノイルグリセロールは細胞膜のリン脂質からホスホリパーゼによって生成されるアラキドン酸の代謝産物です。
内因性カンナビノイドは生理的あるいは病的刺激によってオンデマンド(要求に応じて)に細胞膜のリン脂質を分解して合成・分泌されて、カンナビノイド受容体を刺激して生理作用を示します。
内因性カンナビノイドシステムの活性化は、リガンド(内因性カンナビノイド)がCB1やCB2と直接的に作用する他に、内因性カンナビノイドの細胞内取り込みや細胞内での分解の阻害によっても起こります。
CB1とCB2を阻害剤でブロックしても、植物カンナビノイドや合成カンナビノイドや内因性カンナビノイドが作用を及ぼすことが知られており、これは、これらのカンナビノイドがCB1とCB2以外のターゲットが存在することを示唆しています。実際、内因性カンナビノイドはCB1とCB2以外に、CPR55やイオンチャネルのTRPV1など多くの受容体やイオンチャネルに作用することが報告されています。しかし、その全容はまだ解明されていません。
カンナビノイド系は極めて複雑なネットワークやメカニズムで生体機能を制御しており、生体機能の調節において極めて重要な働きを担っていることが明らかになりつつあります。

図:内因性カンナビノイドのアナンダミドと2−アラキドノイルグリセロールはシグナルによってオンデマンド(要求に応じて)に合成酵素が活性化されて細胞膜などの脂肪酸から合成される。アナンダミドと2−アラキドノイルグリセロールはカンナビノイド受容体のCB1とCB2や、Gタンパク共役型受容体のGPR55やCa透過性の陽イオンチャネルの一種であるTRPV1などに作用して細胞機能を制御している。アナンダミドは脂肪酸アミドハイドロラーゼ(fatty acid amide hydrolase; FAAH)によって分解され、2-アラキドノイルグリセロールはモノアシルグリセロール・リパーゼ(monoacylglycerol lipase; MGL)などによって分解され、活性が制御されている。アンンダミドはFAAHによってアラキドン酸とエタノールアミンに分解され、2-アラキドノイルグリセロールはMGLによってアラキドン酸とグリセロールに分解される。
【パルミトイルエタノールアミド(PEA)は内因性カンナビノイド?】
アナンダミドはアラキドン酸とエタノールアミンが結合した脂肪酸エタノールアミドの一種です。
脂肪酸エタノールアミドは,脂肪酸とエタノールアミンが縮合して生成する化合物で、神経伝達物質として生理学的に重要な機能を有するものがあり、その代表がアラキドン酸にエタノールアミンが結合したアナンダミドと言えます。アナンダミドはカンナビノイド受容体CB1とCB2のほかGPR55やTRPV1などにも作用します。
アラキドン酸は4つの2重結合を含む炭素数20の脂肪酸で、ω6系多価不飽和脂肪酸です。細胞膜中のリン脂質として存在し、ホスホリパーゼA2によってリン脂質から遊離し、プロスタグランジンやトロンボキサンやロイコトリエンなどの化学伝達物質が作られます。
アナンダミドも細胞間のシグナル伝達のセカンドメッセンジャーとして、刺激に応じて産生され、内因性カンナビノイドシステムで働いています。アナンダミドは最初に発見された内因性カンナビノイドで、化学合成したものがCB1とCB2に親和性を示すことで内因性カンアビノイドであることが証明されました。
アナンダミドと同じような脂肪酸エタノールアミドは哺乳動物で多く見つかっています。
炭素数16の脂肪酸のパルミチン酸にエタノールアミンが結合した構造のパルミトイルエタノールアミドは、古くから鎮痛作用や抗炎症作用が知られています。
パルミトイルエタノールアミドはCB1とCB2には親和性を有しませんが、CPR55に作用することや、アナンダミドの働きに影響することから、内因性カンナビノイドの一種という意見もあります。
【PEAは内因性カンナビノイドシステムに作用して抗炎症作用を示す?】
以下のような論文があります。
Palmitoylethanolamide, a naturally occurring lipid, is an orally effective intestinal anti-inflammatory agent.(天然に存在する脂質のパルミトイルエタノールアミドは経口で有効な腸管内の抗炎症物質である)Br J Pharmacol. 172(1):142-58. 2014
【要旨】
研究の背景と目的:パルミトイルエタノールアミド(Palmitoylethanolamide;PEA)は、カンナビノイド受容体のCB1とCB2、イオンチャネルの一種のtransient receptor potential vanilloid type-1 (TRPV1) 、ペルオキシソーム増殖因子活性化受容体α(Peroxisome proliferator-activated receptor α:PPARα)、Gタンパク質共役型受容体のGPR55など、様々な生体内分子に作用することが知られている。これらのPEAのターゲット分子は腸管粘膜の炎症の制御に関与していることが明らかになっている。そこで、この研究ではマウスの炎症性腸炎の実験モデルを用いて、PEAの効果を検討した。
実験方法:マウスの腸管内にジニトロベンゼンスルフォン酸(dinitrobenzenesulfonic acid;DNBS)を投与して炎症性腸炎を発症させた。炎症の程度は、炎症マーカーや病理組織の検査、蛍光色素を用いた腸管透過性、免疫染色による腸管粘膜細胞の増殖活性で評価した。PEAと内因性カンナビノイドの量は液体クロマトグラフィーで測定し、受容体と酵素のmRNA発現レベルはRT-PCR法で測定した。
主な結果:DNBSの投与によって腸管内に炎症性傷害が起こり、腸粘膜のPEAと内因性カンナビノイドの量は増加し、TRPV1とGPR55のmRNAは減少した。CB1とCB2とPPARαのmRNAのレベルは変化を認めなかった。PEA(体重1kg当たり1mg)を経口あるいは腹腔内の投与は、炎症の程度と腸管粘膜の透過性を低下させ、腸粘膜上皮細胞の増殖を刺激し、腸粘膜のTRPV1とCB1受容体の発現を亢進した。このPEAの抗炎症作用は、CB2受容体やGPR55やPPARαのアンタゴニスト(阻害剤)によって減弱し、TRPV1アンタゴニストのカプサゼピン(capsazepine)によって増強された。
結論:PEAはマウスの腸炎の実験モデルで抗炎症作用を示し、この作用にはカンナビノイド受容体CB2とGPR55とPPARαが関与しており、イオンチャネルのTRPV1によって制御されていることが示された。
複数の臨床試験でPEAが様々な疼痛の軽減に有効であることが示されています。
PEAは体内で産生されPPARαのアゴニスト活性が示されています。つまり、PEAはPPARαの内因性アゴニストです。
しかし、PEAの鎮痛作用はPPARαのアゴニスト作用だけでは説明できません。つまり、PPARαリガンドの全てが鎮痛作用を持っていないからです。
その他の受容体(カンナビノイド受容体やTRPV1など)の関与も示唆されています。
つまり、PEAの抗炎症作用や鎮痛作用はPPARαだけでなくカンナビノイド受容体やGPR55などの受容体にも作用して極めて利用価値の高い物質のようです。
PEAはヨーロッパ(オランダなど)ではサプリメントとして販売されています。商品名はPeaPureやNormastです。これらは、抗炎症と鎮痛の目的で使用されています。ネットから購入できます。
糖尿病性神経障害や抗がん剤による神経障害、手術後疼痛、座骨神経痛、多発性硬化症など様々な原因で起こる神経障害性疼痛の軽減に有効性が臨床試験で確認されています。
また、PPARαのリガンドであることなどから、がん治療への応用も期待できます。
PEAと大麻のカンナビノイド(カンナビジオールなど)とCB2リガンドのβカリオフィレンやPPARαリガンド(フェノフィブラート)などを併用することによって、新規の鎮痛作用や抗がん作用が期待できるかもしれません。
● パルミトイルエタノールアミドについては
こちらのサイトで紹介しています。