がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
719)ニコチンアミド・リボシドとジクロロ酢酸は筋萎縮性側索硬化症(ALS)の進行を抑制する:ミトコンドリアの活性化をターゲットにしたALS治療と抗老化治療
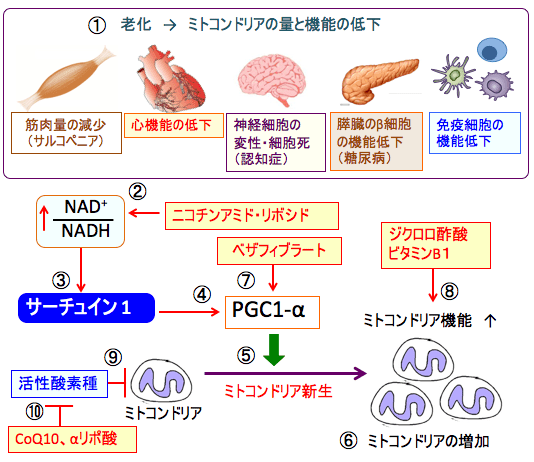
図:老化すると全身の細胞のミトコンドリアの量と機能が低下し、筋肉量の減少や心臓機能の低下や神経細胞の変性・細胞死(=認知症)を引き起こす。さらに、膵臓のβ細胞のミトコンドリア機能が低下するとインスリンの分泌が低下して糖尿病を引き起こし、リンパ球などの免疫細胞の機能低下も起こる(①)。ニコチンアミド・アデニン・ジヌクレオチド(NAD+)の前駆体のニコチンアミド・リボシドの補充はNAD+/NADH比を高め(②)、サーチュイン1を活性化する(③)。サーチュイン1はPGC-1α(PPARγコアクチベーター1α)を活性化し(④)、PGC-1αはミトコンドリア新生を亢進して(⑤)、細胞内のミトコンドリアの数と量を増やす(⑥)。PPAR(ペルオキシソーム増殖因子活性化受容体)の汎アゴニスト(受容体に結合して活性化する物質)であるベザフィブラートは、直接あるいはPPARを介してPGC-1αを活性化する(⑦)。ジクロロ酢酸とビタミンB1はピルビン酸脱水素酵素を活性化する機序でミトコンドリア機能(物質代謝とエネルギー産生)を亢進する(⑧)。ミトコンドリアは活性酸素種によってダメージを受けている(⑨)。抗酸化作用のあるCoQ10、αリポ酸は酸化ストレスを軽減して、ミトコンドリアのダメージを阻止する(⑩)。したがって、ニコチンアミド・リボシド+ジクロロ酢酸+ビタミンB1+ベザフィブラート+CoQ10+αリポ酸の組合せは、老化に伴う諸臓器機能の低下の改善や、ミトコンドリアの機能低下による様々な疾患(筋萎縮性側索硬化症など)の治療に試してみる価値がある。
719)ニコチンアミド・リボシドとジクロロ酢酸は筋萎縮性側索硬化症(ALS)の進行を抑制する:ミトコンドリアの活性化をターゲットにしたALS治療と抗老化治療
【ミトコンドリアは元は細菌だった】
ミトコンドリアは赤血球以外の全ての細胞に存在する細胞小器官です。
1個の細胞当たり平均で300~400個のミトコンドリアが存在します。肝臓や腎臓や筋肉や脳など代謝が活発な細胞には数千個のミトコンドリアが存在し、細胞質の40%程度を占めています。全部で体重の約10%を占めると言われています。
つまり、私たちの体の約10%はミトコンドリアが構成しているのです。
真核細胞のミトコンドリアは好気性細菌のαプロテオバクテリアが原始真核細胞に寄生したものという「細胞内共生説」が定説になっています。
まだ酸素が無い太古の地球に生きていた生物は解糖系のみでエネルギーを得ていました。ところが、海中に発生した藻類が光合成によって吐き出す酸素が大気中に増えていくと、酸素の無い環境で生きていた生物は酸化力の強い酸素に触れることでダメージを受けるようになります。
そのためこの時期には原始真核生物の多くが絶滅し、あるいは酸素の影響を受けることのない深海などに移動していきました。このような状況で誕生したのが、酸素を使ってATPを生成する好気性細菌です。
そして、約20億年前に好気性細菌のα-プロテオバクテリアが原始真核細胞に寄生してミトコンドリアになったと考えられています。
大気中に増える酸素による悪影響に苦しんでいた嫌気性の原始真核生物にとって、酸素を使ってATPを作り出す好気性細菌との共生は好都合でした。
好気性細菌は生体にダメージを与える酸素をグルコースに結合させ、二酸化炭素と水に分解し、さらにその過程でATPを大量に生成することができるからです。この細胞内共生によって酸素が豊富な環境で生物が急速に進化することになります。
このように、ミトコンドリアはかつて細菌であったため、見かけは細菌に似ています。直径は1ミクロン(1ミクロンは1000分の1ミリ)以下で、長さは1~4ミクロン程度で、俵型やいも虫様の立体構造をしています。
ミトコンドリアは2枚の膜(内膜と外膜)によって細胞質から隔てられ、内膜は複雑に入り組んで「クリステ」という無数の襞や管を形成しています。内膜が襞上にくびれているのは、表面積を増やすためで、この内膜でATPの産生が行われています。
内膜上に電子伝達系やATP合成にかかわる酵素群などが一定の配置で並んでいます。
マトリックスには、TCA回路に関わる酵素やミトコンドリア独自のDNAなどが含まれています。たんぱく質合成のためにリボソームも持っていてミトコンドリア内でたんぱく合成もできます。そして、ミトコンドリア自身が増殖もします。(下図)

図:細胞内には機能を分担するために、様々な小器官が存在する。ミトコンドリアは酸素を使ってグルコースや脂肪酸やアミノ酸を燃焼してATPを産生する働きや、物質代謝やアポトーシスの制御など多彩は機能を持っている。
【ミトコンドリアは細胞の生存と死の両方を制御している】
ミトコンドリアは酸素を使ってグルコース(ブドウ糖)や脂肪酸やアミノ酸を燃焼してエネルギーのATP(アデノシン3リン酸)を産生する働きがあります。つまり、細胞の発電所のような器官です。
ミトコンドリアはATPの産生以外に、カルシウム代謝の制御、様々な物質の合成、アポトーシス(細胞死)の制御など重要な細胞機能を担っています。
アポトーシスは、形態学上は核の凝集と細胞収縮、それにDNAの断片化などによって特徴づけられる細胞死の一種です。個体の発生段階で、過剰にできた細胞を選択的に除去し、器官形成を完成するのに必要なプロセスです。
また、老化した細胞や修復不能なダメージを受けた細胞を除去する際にも、アポトーシスのメカニズムで細胞死が起こります。
このアポトーシスの過程は極めて複雑ですが、ミトコンドリアに存在するたんぱく質が重要な役割を果たしています。
たとえば、電子伝達系で働く「チトクロームC」というたんぱく質は、ミトコンドリアから放出されると、たんぱく分解酵素群が次々に活性化されて、細胞死へと導きます。
アポトーシスは多数のタンパク質によって制御されていますが、中心になるのがBcl-2やBaxと呼ばれるタンパク質群(Bcl-2ファミリー蛋白質)です。
Bcl-2 ファミリー蛋白質には、アポトーシスを抑制するBcl-2-サブファミリー(Bcl-2, Bcl-XLなど)と、アポトーシスを促進する Baxサブファミリー(Bax、Bakなど) および BH3-onlyサブファミリー (Bid、Bim、Badなど)があります
Bcl-2およびそのファミリー蛋白質の主な作用部位はミトコンドリア膜で、このミトコンドリア膜の透過性を制御することにより、細胞の生死を決定しています。
ミトコンドリアの膜透過性が亢進すると、膜間スペースに存在するアポトーシス誘導蛋白質(シトクロムCなど)が細胞質に漏出します。漏出したシトクロムCはカスパーゼと呼ばれる蛋白分解酵素群を段階的に活性化してアポトーシスが実行されます。
Baxはアポトーシス実行時のミトコンドリアの膜透過性亢進に必須の分子として働き、
Bcl-2はBaxと直接結合してBaxの働きを阻止します。
Bcl-2のようなアポトーシス促進蛋白質の活性が、Baxのような抑制蛋白質の活性を凌駕した場合に、ミトコンドリア膜透過性亢進が誘導され、アポトーシスが実行されます。
このように、ミトコンドリアは細胞の生存と死の両方の制御に重要な働きを担っています。
【ミトコンドリアは融合と分裂を繰り返す】
ミトコンドリアは常に融合(fusion)過程により結合し、分裂(fission)過程により分割しています。融合が活性化すると長くつながった構造が形成され、逆に分裂が活性化すると小さな断片化した形状が増えます。このようにミトコンドリアの形態はダイナミックに変化しています。
ミトコンドリア(mitochondria)はギリシャ語の「糸」を意味する「mitos」と「小さい粒」を意味する「chondrion」をつなげた用語です。線状になったり球状になったりする状態を観察して「mitochondria」と命名されたようです。
顆粒状・桿状・糸状のいずれの形のミトコンドリアも、他のミトコンドリアと融合して1本になったり、分裂して数個のミトコンドリアになるというミトコンドリア・ダイナミクスの存在は100年以上前から知られています
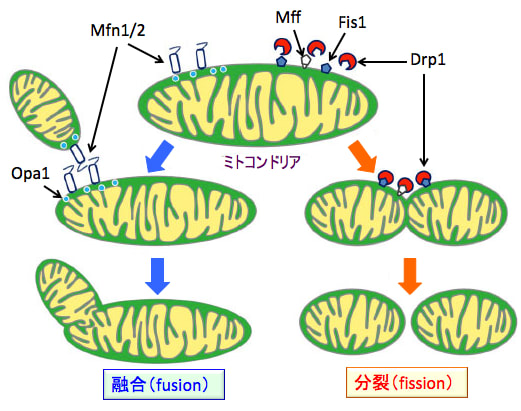
図:ミトコンドリアは融合(fusion)と分裂(fission)によって形態をダイナミックに変化させる。融合が活性化すると長くつながった構造が形成され、逆に分裂が活性化すると小さな断片化した形状が増える。ミトコンドリアの融合は、3 種類の GTPase(Mfn1、Mfn2、Opa1)の働きにより引き起こされる。Mitofusion タンパク質である Mfn1 および Mfn2 はミトコンドリア外膜の膜融合に、Opa1 はミトコンドリア内膜の膜融合に関わっている。一方ミトコンドリアの分裂は、ミトコンドリア外膜タンパク質 Fis1 (fission protein 1 )とMff (mitochondrial fission factor)、GTPase である Drp1(dynamin-related protein 1) の働きにより引き起こされる。Drp1は通常は細胞質に存在し、ミトコンドリア分裂のときに、ミトコンドリア外膜にリクルートされる。Fis1とMffはDrp1のアダプターたんぱく質として機能する。(参考:Research Reports in Clinical Cardiology. 5: 111-122, 2014)
【ミトコンドリアは増やすことも鍛えることもできる】
細胞内でミトコンドリアが新しく生じることをミトコンドリア新生 (Mitochondrial biogenesis)と言います。
ミトコンドリアを構成するタンパク質には、核内DNA にコードされているものと、ミトコンドリア内 DNAにコードされているものがあります。
核内DNA にコードされているタンパク質は、細胞質で合成された後、ミトコンドリア外膜と内膜を通過してミトコンドリア内部に輸送されます。ミトコンドリアDNAにコードされているたんぱく質はごく少数です。
ダメージを受けて機能異常を起こしたミトコンドリアはミトコンドリアに特異的なオートファジーによる除去システムのミトファジー(mitophagy)によって分解され、新しいミトコンドリアがミトコンドリア新生(mitochondrial biogenesis)によって作られます。
このようなミトファジーとミトコンドリア新生のバランスによってミトコンドリアの品質が決まります。これは、ミトコンドリアの品質を良くすることも可能であることを意味します。

図:細胞内のミトコンドリアの数や体積や形態や機能は、ミトコンドリアの新生(発生)、融合、分裂、分解(ミトファジー)のバランスで制御されている。融合が進行すると大きな管状のネットワークを形成し、分裂が進むと小さなミトコンドリアが増える。ミトコンドリアの融合と分裂のバランスの異常が、様々な疾患の原因となっている。(参考:Journal of Cell Science 123: 2533-2542, 2010)
AMP活性化プロテインキナーゼ(AMPK)はミトファジー(ミトコンドリアの分解)を誘導し、ミトコンドリア新生を促進します。
AMPKを活性化する薬として糖尿病治療薬のメトホルミンやブルーベリーに含まれるプトロスチルベン(715話参照)があります。つまり、メトホルミンやプテロスチルベンはミトコンドリアの品質を良くする効果が期待できます。
運動やカロリー制限やケトン食や魚油(500話参照)もAMPKを活性化します。
運動の持久力を短時間で高める方法があります。運動をする1時間くらい前にジクロロ酢酸ナトリウム(約1g)とビタミンB1とR体αリポ酸を摂取して、コーヒーを1杯飲みます。
ジクロロ酢酸はピルビン酸脱水素酵素キナーゼを阻害してピルビン酸脱水素酵素の活性を高め、その結果、ピルビン酸からアセチルCoAの変換が促進されて、ミトコンドリアでのTCA回路が亢進します。ビタミンB1とαリポ酸はピルビン酸脱水素酵素の活性に必要な補因子です。
サプリメントのコエンザイムQ10(CoQ10)とコーヒーに含まれるカフェインは酸化的リン酸化を活性化し、ATP産生を高める作用があります。(下図)

図:グルコースが解糖系で代謝されてピルビン酸に変換された後、ピルビン酸脱水素酵素によってミトコンドリア内でアセチルCoAに変換される(①)。アセチルCoAはミトコンドリア内でTCA回路と呼吸酵素複合体における酸化的リン酸化によってATPが産生される(②)。R体αリポ酸とビタミンB1はピルビン酸脱水素酵素の活性に必要な補因子であり(③)、コエンザイムQ10(CoQ10)とカフェインは酸化的リン酸化を活性化する作用がある(④)。ピルビン酸脱水素酵素はピルビン酸脱水素酵素キナーゼによってリン酸化されることによって活性が阻害されている(⑤)。ジクロロ酢酸ナトリウムはピルビン酸脱水素酵素キナーゼを阻害する作用があり、その結果ピルビン酸脱水素酵素を活性化する(⑥)。これらを運動前に摂取すると、筋肉と心臓のエネルギー産生を短時間で高めることができ、最大酸素摂取量が増加し(⑦)、持久力など運動のパフォーマンスを高めることができる(⑧)。
つまり、運動の前にこれら(ジクロロ酢酸、ビタミンB1、R体αリポ酸、CoQ10、カフェインを含むコーヒー)を摂取すると、心臓と筋肉のミトコンドリアでの代謝を短時間で亢進して、最大酸素摂取量を増やして、持久力が高くなるのです。この方法はコーヒー代を含めて1回に数百円で、確実に持久力を高めます。
しかも、有酸素運動は筋肉細胞のミトコンドリアを増やす作用もありますので、運動を継続すると筋肉細胞のミトコンドリアを長期的に増やすことができます。ジョギングのような有酸素運動は、老化に伴う筋肉量の減少や心臓機能の低下を予防します。有酸素運動が認知症の予防に有効という疫学研究の結果も報告されています。
健康ドリンクのリゲインにはジクロロ酢酸ジイソプロピルアミンとビタミンB1が含まれていますが、ジクロロ酢酸ジイソプロピルアミンはピルビン酸脱水素酵素キナーゼ4(PDK4)を阻害することが報告されています。
ジクロロ酢酸ジイソプロピルアミン(diisopropylamine dichloroacetate)はビタミン様物質として知られ、食品ではゴマやビール酵母などによく含まれるパンガミン酸の構成成分です。
一般用医薬品では、肝臓の働きをサポートし、疲れを改善する効果を期待して、肉体疲労時の滋養強壮・栄養補給ドリンク剤などに配合されています。
リゲイン、新グロモント、ヘパリーゼ、リポビタンDなど多くのドリンク剤に配合されています。
医薬品としてはリバオール(Liverall)があります。50年以上前から慢性肝疾患の治療薬として使用されています。
リバオールは第一三共が製造販売していました(現在は製造販売権をアルフレッサファーマに譲渡されています)。20mg1錠の薬価が5.9円と極めて安価な薬です。健康ドリンクのリゲインなどにはリバオールとビタミンB1が入っています。この組合せはミトコンドリアの酸素呼吸を活性化するので体力を高める効果があることが医学的に納得できます。

図:ジクロロ酢酸ジイソプロピルアミンは多くのドリンク剤に配合されている。医薬品としてはリバオールがある。
長期的にミトコンドリアを増やし、機能を高める方法としてはメトホルミン、ベザフィブラート、NAD+前駆体のニコチンアミド・リボシドやニコチンアミド・モノヌクレオチドなどがが有効です(後述)。
つまり、ミトコンドリアの数と量を長期的に増やす方法と、ミトコンドリアの機能を活性化する方法を併用すると、筋肉や心臓などの諸臓器の働きを良くし、運動能力の向上と、抗老化とがん予防効果が期待できます。
【神経変性疾患の治療法としてのミトコンドリア品質管理】
ミトコンドリアの数を増やし機能を高める方法は、神経変性疾患など様々な疾患の治療法として注目されています。例えば、ミトコンドリアの品質の向上が筋萎縮性側索硬化症の進行抑制に有効である可能性が指摘されています。以下のような報告があります。
Mitochondrial quality control in amyotrophic lateral sclerosis: towards a common pathway?(筋萎縮性側索硬化症におけるミトコンドリア品質管理:共通の経路に向かって?)Neural Regen Res. 2017 Jul; 12(7): 1052–1061.
【要旨】
筋萎縮性側索硬化症(ALS)は、上位および下位の運動ニューロンの喪失を特徴とする壊滅的な神経変性疾患である。 ALSの病因の中心的な決定要因であると提案されているミトコンドリア機能障害を含む様々なメカニズムが疾患の開始と進行に寄与している。
ミトコンドリア機能の欠陥は主にALS発症に関連したSOD1変異体で説明されているが、他のALS症例においてもミトコンドリアの機能不全が関与していることは今では十分に確立されている。
そのような状況において、ミトコンドリア品質管理システムは、ミトコンドリアの正常な機能を回復させ、損傷したミトコンドリアの構成要素を排除および交換することにより、またはミトファジーを通じてオルガネラ全体を分解することにより、細胞死を防ぐことができる。
最近の証拠は、ALS関連遺伝子がミトコンドリアの品質管理システムを妨害することを示している。このレビューは、ミトコンドリアの品質管理の欠陥が、ALSでの運動ニューロンにおけるミトコンドリア損傷の蓄積に関与していることに焦点を当てる。
つまり、筋萎縮性側索硬化症では、運動ニューロンのミトコンドリアにダメージが蓄積して運動ニューロンの細胞死が起こることを指摘しています。
ミトコンドリアの品質管理にサーチュイン3(SIRT3)の役割の重要性も指摘されています。以下のような報告があります。
SIRT3 Regulation of Mitochondrial Quality Control in Neurodegenerative Diseases.(神経変性疾患におけるミトコンドリア品質管理のSIRT3による制御)Front Aging Neurosci. 2019; 11: 313.
【要旨】
神経変性疾患は、中枢神経系内のニューロンの選択的変性および喪失によって引き起こされる運動および/または認知機能の進行性の低下を特徴とする障害である。最も一般的な神経変性疾患は、アルツハイマー病、パーキンソン病、ハンチントン病である。
ニューロンには高いエネルギー需要があり、ミトコンドリアの品質と機能の調節不全は、ニューロンの変性の重要な原因となる。
ミトコンドリアの品質管理は、ミトコンドリアの完全性を維持し、正常なミトコンドリア機能を確保する上で重要な役割を果たしている。したがって、ミトコンドリアの品質管理の欠陥は神経変性疾患の重要な原因となる。
ミトコンドリアの脱アセチル化酵素SIRT3は、ミトコンドリア機能に大きな影響を与えることが明らかになっている。最近の研究はまた、SIRT3がミトコンドリアの品質管理に役割を果たしていることを示している。
これには、折り畳み不全のタンパク質の再折り畳みまたは分解、ミトコンドリア・ダイナミクス、ミトファジー、ミトコンドリア新生が含まれ、これらは神経変性疾患で異常が見られる。
ミトコンドリアの品質管理という方法論でミトコンドリアの機能を良くすれば、ALSなどの神経変性疾患の治療に役立つ可能性があります。
ミトコンドリアのサーチュイン3の活性化はパーキンソン病などの神経変性疾患の治療にも有効です。
Oxidized nicotinamide adenine dinucleotide-dependent mitochondrial deacetylase sirtuin-3 as a potential therapeutic target of Parkinson's disease.( パーキンソン病の潜在的な治療標的としての酸化型ニコチンアミドアデニンジヌクレオチド依存ミトコンドリア脱アセチル化酵素サーチュイン-3) Ageing Res Rev. 2020 Jun 12;62:101107.
【要旨】
ミトコンドリア障害は、パーキンソン病における進行性のドーパミン・ニューロンの変性と関連している。
最近の研究結果は、ミトコンドリアタンパク質であるサーチュイン3(SIRT3)が酸化型ニコチンアミドアデニンジヌクレオチド(NAD +)依存性脱アセチル化酵素であり、ミトコンドリアの完全性と機能を維持する上で重要な役割を担っていることを明らかにしている。
SIRT3は、ミトコンドリアにおけるATP生成とエネルギー代謝、抗酸化防御、細胞死と増殖を含むミトコンドリア機能の調節に重要な役割を果たしている。
SIRT3は、転写因子を脱アセチル化し、さまざまなシグナル伝達経路とクロストークして、ミトコンドリア機能を協調的に調節し、防御的ミトコンドリア品質管理システムを調節する。
NAD +レベルとSIRT3活性の低下は、老化プロセスに関連しており、パーキンソン病の病因とも関連している。
さらに、SIRT3は、PTEN誘導キナーゼ1(PINK1)およびPDタンパク質2 E3ユビキチンタンパク質リガーゼ(パーキン)に結合して脱アセチル化して、ミトファジーを促進する。
パーキンソン病におけるロイシンリッチリピートキナーゼ2(LRRK2)のG2019S変異は、SIRT3の機能障害と関連している。
さらに、SIRT3はパーキンソン病におけるα-シヌクレイン凝集とドーパミンニューロンの変性を防ぐ作用がある。
SIRT3の化学的活性化因子とNAD +前駆体は、SIRT3の活性を亢進して、パーキンソン病の実験モデルにおいてドーパミン・ニューロンの変性を防ぐことができる。
以上をまとめると、SIRT3はパーキンソン病の治療標的として有望であり、神経保護作用を備えたSIRT3機能的制御剤の研究は臨床的に興味深い。
【ミトコンドリア新生を亢進するとミトコンドリア機能異常を是正できる】
ベザフィブラートでミトコンドリアを活性化すると、ミトコンドリアの機能異常を是正できるという報告があります。以下のような論文があります。
A metabolic shift induced by a PPAR panagonist markedly reduces the effects of pathogenic mitochondrial tRNA mutations.(PPARの汎アゴニストによって誘導される代謝シフトは病的なミトコンドリアtRNA変異の作用を顕著に軽減する)J Cell Mol Med. 2011 Nov;15(11):2317-25.
【要旨】
ミトコンドリアDNAでコードされたトランスファーRNA(tRNA)遺伝子の変異は多くの疾患の原因となっている。培養細胞(in vitro)と動物実験(in vivo)の系で、合成アゴニストによるペルオキシソーム増殖因子活性化受容体の活性化は、ミトコンドリアでの酸化的リン酸化反応を刺激し、ミトコンドリアの量を増やし、さらに酸化的リン酸化に関与するたんぱく質の遺伝子変異による欠損を部分的に代償する。
この研究では、異なるミトコンドリアtRNAの変異をもつ細胞を使って、PPARの汎アゴニストであるベザフィブラートが、酸化的リン酸化の欠損の効果を減弱できるかどうかを検討した。
実験の結果、ベザフィブラートはミトコンドリアの量とミトコンドリアtRNAの定常レベルの量を増やし、ミトコンドリアのたんぱく質の合成を亢進した。このミトコンドリア機能の改善の結果、酸化的リン酸化活性は上昇し、ミトコンドリアにおけるATP産生能を亢進した。
PPARの汎アゴニストは、ミトコンドリア新生を制御するPPARγコアクチベーター-1α(PGC-1α)の発現を亢進することが知られている。
さらに、変異したミトコンドリアtRNAを持って酸化的リン酸化が機能している細胞株を選択すると、これらの細胞では、ベザフィブラート投与と同様に、PGC-1αの発現が3倍に増えていた。
これらの実験結果から、ミトコンドリア新生を亢進し、酸化的リン酸化活性を高めることは、ミトコンドリアの異常に起因する疾患の治療として有効であることが示唆された。
ミトコンドリアDNAには22種類のtRNAの遺伝子がコードされています。ミトコンドリアDNAの変異などでミトコンドリア機能が低下していても、ベザフィブラートでミトコンドリア新生を亢進して酸化的リン酸化を促進すると、ミトコンドリア機能異常を改善できるということです。
PGC-1αの活性化はミトコンドリア新生の亢進と同時に、異常なミトコンドリアを分解するミトファジーを亢進して、ミトコンドリアの品質を良くする効果があるということです。(下図)

図:PPARの汎アゴニストのベザフィブラートやAMP活性化プロテインキナーゼやサーチュイン1を活性化するメトホルミン、カロリー制限、ケトン体、水素ガスはPGC-1α(ペルオキシソーム増殖因子活性化受容体γコアクチベーター1α)を活性化する。PGC-1αはミトコンドリア新生を亢進して新しいミトコンドリアを増やし、ミトファジーを亢進して異常なミトコンドリアの分解を亢進する。その結果、ミトコンドリアの品質を良好に維持する。
ベザフィブラートはミトコンドリア新生を亢進して、さらに異常なミトコンドリアの分解(ミトファジー)を亢進して、がん細胞におけるミトコンドリア異常を是正し、がん細胞の増殖や浸潤を抑制できる可能性が報告されています。
これは、ミトコンドリアDNAの変異によってミトコンドリア機能が低下しているALS患者の場合でも、ミトコンドリア新生を亢進するとミトコンドリアの機能を改善できる可能性を示唆しています。
【サーチュイン1はPGC-1αを活性化してミトコンドリアを増やす】
Mitochondrial Biogenesisは「ミトコンドリア新生」や「ミトコンドリア発生」と訳されています。細胞内でミトコンドリアが新しく発生することです。通常、既存のミトコンドリアが増大して分かれて増えていきます。
ミトコンドリア新生で最も重要な働きを担っているのが、PGC-1α(Peroxisome Proliferative activated receptor gamma coactivator-1α)です。日本語訳は「ペルオキシソーム増殖因子活性化受容体γコアクチベーター1α」です。
PGC-1αは転写因子のPPAR-γと結合して、PPAR-γの転写活性を高める因子として見つかりました。
PGC-1αは核内受容体を中心とするさまざまな転写因子と結合し標的遺伝子の発現を制御する転写コアクチベーターです。骨格筋、心筋、脂肪、脳などの臓器においてミトコンドリアの生合成および酸化的リン酸化を促進するなど細胞のエネルギー産生を制御する役割が知られています。
運動すると骨格筋のPGC-1α量が増えます。
運動や絶食やメトホルミンがAMP活性化プロテインキナーゼ(AMPK)を活性化し、AMPKはサーチュインを活性化して転写因子のPGC-1αとFOXOファミリータンパク質を活性化し、ミトコンドリア機能や代謝を制御することが知られています(下図)。

図:運動や絶食やメトホルミンは筋肉細胞内のAMP/ATP比を上昇し(①)、AMP依存性プロテインキナーゼ(AMPK)を活性化する(②)。AMPK活性化はNAD+/NADH比を高め(③)、サーチュイン1(SIRT1)を活性化する(④)。AMPKはPGC-1α(Peroxisome Proliferator- activated receptor gamma coactivator-1α:ペルオキシソーム増殖因子活性化受容体γコアクチベーター1α)をリン酸化し(⑤)、さらにSIRT1で脱アセチル化されて活性化する(⑥)。サーチュイン1はFOXOファミリーなどの転写因子を脱アセチル化して活性化する(⑦)。活性化したPGC-1αやFOXOはミトコンドリア機能や代謝を制御する。(図中のPはリン酸化、Acはアセチル基を示す)
【ニコチンアミド・リボシドはNAD+を増やしてALSの進行を抑制する】
NAD+(ニコチンアミドアデニンジヌクレオチド)はナイアシンというビタミンから体内で合成されます。NAD+は解糖系およびミトコンドリアでのエネルギー産生反応に必要な因子です。
脱水素酵素ではNAD+を補酵素とし、NAD+が水素の受け取り手となっています。
NAD+の構造の中で酸化還元反応に関与しているのはニコチンアミドの部分です。酸化型のNAD+が水素と電子を受け取って還元型のNADHになります。

図;NAD+が水素(H+)と電子(e-)を受け取ってNADHになる(①)。NAD+は還元型基質から水素を受け取り(②)、その基質を酸化し、還元型のNADHとH+を生成する(③)。NADH+H+は、他の物質の還元に使われる(④)。
NAD+は、全ての真核生物と多くの古細菌、真正細菌で用いられる電子伝達体です。さまざまな脱水素酵素の補酵素として機能し、酸化型 (NAD+) および還元型 (NADH) の2つの状態を取ります。
NAD+は生物のおもな酸化還元反応の多くにおいて必須成分(補酵素)であり、好気呼吸(酸化的リン酸化)の中心的な役割を担っています。
NAD+レベルは加齢とともに低下し、加齢に関連する疾患の発症に重要な役割を担っていることが明らかになっています。
NAD+の細胞内レベルを上昇させる方法は、動物モデルで老化を遅らせ、筋肉機能を回復させ、脳での神経再生を促進し、代謝性疾患を改善することが示されています。
筋萎縮性側索硬化症(ALS)の治療にもNAD+の細胞内レベルを上昇させる方法の有効性が指摘されています。
以下のような報告があります。
Evaluation of the NAD + biosynthetic pathway in ALS patients and effect of modulating NAD + levels in hSOD1-linked ALS mouse models.(ALS患者におけるNAD +生合成経路の評価およびhSOD1関連ALSマウスモデルにおけるNAD +レベルの調節の影響)Exp Neurol. 2020 May;327:113219.
【要旨】
筋萎縮性側索硬化症(ALS)は、運動ニューロンの進行性変性を特徴とする。多様なALSの動物モデルの星状膠細胞(Astrocyte)は、神経細胞との共培養で運動ニューロンの細胞死を誘導する。 NAD +の利用性を高める、またはNAD +依存型脱アセチル化酵素のSIRT3とSIRT6の発現を増やすと、細胞培養モデルでの神経毒性が阻止される。
マウスのALSモデルでNAD +の利用性を高める効果を評価するために、NAD +を消費する酵素(CD38)の阻害と生体利用可能なNAD +前駆体(ニコチンアミドリボシド)の補給という2つの戦略を使用した。
CD38の活性阻害は、hSOD1にリンクした2種類のALSマウスモデルの生存に影響を与えなかった。
一方、ニコチンアミド・リボシドの補充は運動ニューロンの変性を遅らせ、脊髄の神経炎症のマーカーを減少させ、筋肉の代謝を変化させ、hSOD1マウスの生存を適度に増加させた。
さらに、ALS患者における脊髄におけるNAD +合成に関与する酵素(NAMPTおよびNMNAT2)の発現の変化と、SIRT6発現の低下を確認した。
これは、人間のALSの病理において、NAD+に関連した神経保護経路の欠損を示唆している。
私たちのデータは、ALSにおけるNAD +レベルの増加による治療の可能性を示唆している。さらに、NAD +レベルを高める治療がALSの動物モデルの病状改善に有効であり、生体利用可能なNAD+の前駆体を使用してNAD +レベルを高めることがALSの治療法として有望であることを示唆している。
この論文は米国のサウスカロライナ医科大学の研究グループからの報告です。
ニコチンアミド・リボシドをサプリメントとして補充すると体内のNAD +レベルを高めることができます。つまり、ALSの治療にニコチンアミド・リボシドの補充療法が有効である可能性を示唆しています。
老化に伴いNAD+量およびサーチュイン活性が低下しますが、ニコチンアミドリボシド(nicotinamide riboside:NR)やニコチンアミドモノヌクレオチド(nicotinamide mononucleotide:NMN)などのNAD+中間代謝産物の補充がサーチュインを効果的に再活性化することが明らかになっています。

図:ニコチンアミド・アデニン・ジヌクレオチド(nicotinamide adenine dinucleotide:NAD+)はトリプトファンやニコチン酸やニコチンアミドなどから生成するルートもあるが、特にNAD+の前駆物質であるニコチンアミド・モノヌクレオチド(nicotinamide mononucleotide:NMN)とニコチンアミド・リボシド(nicotinamideriboside:NR)をサプリメントとして摂取すると体内のNAD+を増やすことができる。
【ジクロロ酢酸ナトリウムはミトコンドリア機能を活性化する】
ジクロロ酢酸ナトリウム(Sodium Dichloroacetate)はピルビン酸脱水素酵素キナーゼを阻害してピルビン酸脱水素酵素を活性化します。
ピルビン酸脱水素酵素はピルビン酸をアセチルCoAに変換する酵素で、ミトコンドリアでのTCA回路での代謝を亢進します。
がん細胞のミトコンドリアを活性化するときも使います。がん細胞のミトコンドリアをジクロロ酢酸で活性化するとがん細胞を死滅させることができます。(506話参照)
ジクロロ酢酸ナトリウムはミトコンドリアでのグルコース代謝とATP産生を亢進します。
ALSの動物実験モデルでジクロロ酢酸ナトリウムは脊髄の運動ニューロンの減少を抑制し、ALSの運動機能障害の発症を遅らせ、生存期間を延ばす効果が報告されています。
以下のような報告があります。
Modulation of astrocytic mitochondrial function by dichloroacetate improves survival and motor performance in inherited amyotrophic lateral sclerosis(ジクロロ酢酸による星状膠細胞のミトコンドリア機能の亢進は遺伝性筋萎縮性側索硬化症の生存と運動能力を改善する)PLoS One. 2012;7(4):e34776.
【要旨】
ミトコンドリア機能障害は、筋萎縮性側索硬化症(ALS)の神経変性につながる病原性メカニズムの1つである。 ALS発症に関連するSOD1(G93A)変異を発現する星状膠細胞はミトコンドリアの呼吸能力の低下を示し、運動ニューロンの死を引き起こす原因と関連する。
星状膠細胞を介した毒性は、ミトコンドリアを標的とした抗酸化剤によって防ぐことができ、神経毒性の発現におけるミトコンドリアの重要な役割を示している。
しかし、ミトコンドリアの代謝を活性化するために現在使用されている薬物がALSの進行を抑制できるかどうかは不明である。
ここでは、ピルビン酸脱水素酵素複合体活性(PDH)の活性化によりミトコンドリアの機能状態を改善するジクロロ酢酸(DCA)の疾患修飾効果をテストした。
SOD1(G93A)変異を発現するラットから分離された星状膠細胞培養にジクロロ酢酸を投与すると、ジクロロ酢酸はピルビン酸脱水素酵素複合体のリン酸化を低減し、ミトコンドリアにおける酸素呼吸を亢進した。
特に、ジクロロ酢酸はSOD1(G93A)アストロサイトの共培養条件での運動ニューロンへの毒性を完全に防止した。
SOD1(G93A)変異を発現しているマウスの飲料水中にジクロロ酢酸(500 mg / L)を慢性投与すると、未投与のマウスと比較して生存が2週間増加した。
全身性のジクロロ酢酸の投与は、SOD1(G93A)変異マウスの腰髄組織で測定された減少したミトコンドリア呼吸を正常化した。
ジクロロ酢酸の顕著な効果は、疾患の末期における握力のパフォーマンスの改善であり、これは、長指伸筋の神経筋接合部領域の回復と相関していた。全身性のジクロロ酢酸の投与は、SOD1(G93A)マウスにおいてアストロサイトの反応性を減少させ、運動ニューロンの損失を防いだ。
以上の結果から、ジクロロ酢酸によるミトコンドリアの酸化還元状態の改善が、ALSの治療に役立つ可能性を示している。
【ニコチンアミドリボシドの服用は血液中のNAD+を増やす】
NAD+の前駆体のサプリメントとしての補充は体内のNAD+の濃度を高めることができます。以下のような報告があります。
Nicotinamide riboside is uniquely and orally bioavailable in mice and humans(ニコチンアミド・リボシドはマウスおよび人間において、独特かつ経口的に生物学的に利用可能である)Nat Commun. 2016 Oct 10;7:12948.
【要旨】
ニコチンアミド・リボシドは、NAD +前駆体ビタミンとして広く使用されている。 ここでは、人間の血中NAD +代謝におけるニコチンアミド・リボシドの経時的および用量依存的な影響を検討する。
1人の個人の予備試験で、ニコチンアミド・リボシドの単回経口投与で血中のNAD+濃度は2.7倍も上昇し、マウスの肝NAD +を上昇させた。さらに、ニコチン酸とニコチンアミドより優れた薬物動態を示した。
さらに、100mg、300mg、および1,000 mgのニコチンアミド・リボシドの単回投与により、血中NAD +は用量依存的に増加することが示された。 また、NRからNAD +への変換の途中の中間代謝産物であるとは考えられていなかったニコチン酸アデニンジヌクレオチド(NAAD)がニコチンアミド・リボシドから形成されることを報告し、NAADの上昇がNAD +の充足の高感度なバイオマーカーであることを発見した。
以下のような報告があります。
An open-label, non-randomized study of the pharmacokinetics of the nutritional supplement nicotinamide riboside (NR) and its effects on blood NAD+ levels in healthy volunteers.(健康なボランティアにおける栄養補助食品ニコチンアミドリボシド(NR)の薬物動態と血中NAD +濃度に対する影響に関する非盲検非ランダム化研究)PLoS One. 2017; 12(12): e0186459.
【要旨の抜粋】
目的:この研究は、人間におけるニコチンアミドリボシドの経口投与における薬物動態と血液中のニコチンアミドアデニンジヌクレオチド(NAD +)レベルに対するニコチンアミドリボシドの影響を検討した。
背景:ミトコンドリア機能障害は心不全の発症と進行に重要な役割を果たすが、ミトコンドリアを標的とした治療法は行われていない。
最近のマウスを使った研究では、NADH /NAD +比の不均衡と、心筋を含む複数の組織のミトコンドリア機能障害との関連が報告されている。さらに、NAD +前駆体であるニコチンアミドモノヌクレオチド(NMN)は心機能を改善し、別のNAD +前駆体であるニコチンアミドリボシド(NR)は筋肉、肝臓、褐色脂肪のミトコンドリア機能を改善した。したがって、人間におけるニコチンリボシドの薬物動態研究は、将来の臨床試験にとって重要である。
方法:8人の健康なボランティアを対象としたこの非盲検非ランダム化研究では、1日目と2日目に250 mgのニコチンアミドリボシドを経口投与し、7日目と8日目に最大用量1000 mgを1日2回に増量した。9日目の朝に1000 mg のニコチンアミドリボシドを投与した後、被験者は24時間の薬物動態研究を完了した。全血中のニコチンアミドリボシドのレベル、臨床血液化学、およびNAD +レベルを分析した。
結果:経口ニコチンアミドリボシドは忍容性が良好で、有害事象は認められなかった。 ニコチンアミドリボシド(p = 0.03)とNAD +(p = 0.001)の両方で、投与前に比較して有意な増加が観察された。NAD +は100%の増加を認めた。 ニコチンアミドリボシドおよびNAD +レベルの投与前から投与後9日目までの絶対変化は、高い相関を認めた(R2 = 0.72、p = 0.008)。
結論:人間において、ニコチンアミドリボシドは血液中のNAD +を増加させるため、ニコチンアミドリボシドは遺伝性および/または後天性疾患によるミトコンドリア機能障害の患者の治療法としての可能性がある。
この研究では、1日目と2日目は1日250mgを1回、3日目と4日目は250mgを1日2回(1日500mg)、5日目と6日目は500mgを1日2回(1日1000mg)、7日目と8日目は1000mgを1日2回(1日2000mg)と増やして投与しています。
9日目の朝に1000mgを投与した時点を0時としてそれ以降24時間の血中濃度を測定しています。
投与前に比べて、9日目にはNAD +の血中濃度は平均100%(35〜168%)の上昇を認めたという結果です。
この研究ではニコチンアミドリボシド服用による副作用は認められていません。
ニコチンアミド・リボシドを毎日1から2グラム程度を摂取すると、心臓や神経系などの老化性疾患の進行予防に役立つ可能性は高いと言えます。
NAD +の前駆物質であるニコチンアミド・モノヌクレオチド(nicotinamide mononucleotide:NMN)とニコチンアミド・リボシド(nicotinamideriboside:NR)は以前はかなり高額でしたが、最近は安価に入手できるようになっています。
アルツハイマー病や筋萎縮性側索硬化症などの神経変性疾患、多くの関連疾患の治療に有用です。
1日1から2グラム程度を摂取すると、老化抑制や若返りに効果が期待できる可能性もあります。
心臓疾患にも有効です。
私自身は数年前から心房細動が頻回に起こっていましたが、NMNとNRを合わせて1日2グラム程度を毎日服用するようになって、心房細動は全く起こらなくなりました。
加齢とともに筋力がします。この筋力低下を防ぐ目的で運動は有効です。
運動による筋力低下予防において、筋肉のNAD +の量が多いほど筋力を高める効果が高い可能性が報告されています。
以下のような報告があります。
Nicotinamide riboside-A missing piece in the puzzle of exercise therapy for older adults?(ニコチンアミドリボシド:高齢者のための運動療法のパズルの欠けている部分?)Exp Gerontol. 2020 Aug;137:110972.
【要旨】
身体の活動性を維持することは、高齢者の加齢に伴う疾患を予防するために重要である。持久性トレーニングと筋力トレーニングは、加齢による運動障害を防ぐが、運動だけでは必ずしも身体機能と心肺機能の期待される改善が得られるわけではない。
最近の前臨床研究による証拠は、運動トレーニングに対する応答の違いの理由は、ニコチンアミドアデニンジヌクレオチド(NAD +)代謝における加齢に伴う調節異常が関与している可能性を示唆している。
NAD +は、エネルギー産生およびシグナル伝達経路における必須の酵素補因子である。
体内のNAD +のレベルは、いくつかの慢性および退行性疾患(心血管疾患、アルツハイマー病、パーキンソン病、筋ジストロフィーなど)において低下しており、老化にともなって体内のNAD +レベルは低下する。
運動は安静時よりも高いエネルギー消費を必要とするため、NAD +不足の状態ではエネルギー代謝が低下し、運動反応が不十分になる可能性がある。
最近、ビタミンB3誘導体であるNAD +前駆体のニコチンアミドリボシドは、NAD +代謝の恒常性を改善し、動物のさまざまな臓器におけるエネルギー代謝と細胞機能を回復する効果が示された。
ニコチンアミド・リボシドは高齢者でもテストされており、安全性に問題ないと考えられている。しかし、ニコチンアミド・リボシド補充のみの身体的パフォーマンスへの影響は不明である。
このレビューの目的は、ニコチンアミド・リボシトの補充のみの場合と、身体運動とニコチンアミド・リボシドの補充を併用した場合の、運動能力と骨格筋および心血管機能に対する効果を検討することである。
人間の臨床試験での有効性はまだ証明されていませんが、動物実験では、NAD +前駆体のNRやNMNを補充して体内のNAD +量を増やすと運動機能を高めることが報告されています。
運動するとき筋肉や体内のNAD +量を増やすことは、人間でも運動機能を高めることは十分に予測できます。
老化予防のために運動を行うのであれば、NRやNMNでNAD +の体内量を増やしておくと、運動による筋肉増強や健康作用をさらに高めることができると思います。
○ NRやNMNについてはこちらへ:
○ ALSの治療についてはこちらへ:
| « 718)プテロス... | 720)時を戻そ... » |



