がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
825) c-Mycをターゲットにしたがん治療(その2):ニトロキソリンとプテロスチルベン

図:染色体DNAの末端部分にはTTAGGGという配列が多数繰り返されたテロメアという構造が存在する(①)。正常細胞では細胞分裂のたびにテロメアが短縮し(②)、その短縮が限界に達するとDNAの複製ができなくなり、細胞はもはや分裂することが出来ず、細胞死を引き起こす(③)。多くのがん細胞ではテロメラーゼの発現と活性が亢進しており(④)、テロメアを再生することによって無限の分裂能(不死化)を獲得している(⑤)。テロメラーゼはテロメラーゼRNA要素とテロメラーゼ逆転写酵素の2つのサブユニットから構成され(⑥)、テロメラーゼ逆転写酵素はc-Mycによって転写が亢進される(⑦)。テロメラーゼ逆転写酵素はテロメア非依存性機序によってc-Mycの安定性を高め、c-Mycの転写活性を亢進する(⑧)。c-Mycはがん細胞の増殖を促進し、細胞死を抑制する(⑨)。ニトロキソリン、プテロスチルベン、メベンダゾール、イベルメクチン、メトホルミンはc-Mycを阻害する機序によって、c-Myc依存性およびテロメラーゼ依存性の機序によってがん細胞の増殖を阻害し、細胞死を誘導する(⑩)。
825) c-Mycをターゲットにしたがん治療(その2):ニトロキソリンとプテロスチルベン
【BETファミリータンパク質のBRD4がc-Myc遺伝子の転写に関与】
c-Mycは転写レベルでの調節や、RNAおよびタンパク質の安定性での調節といったように、様々なレベルでの調節を受けています。
c-Myc mRNAはかなり不安定であり、c-Myc遺伝子が強く転写されても、細胞内でc-Myc mRNAは蓄積しがたく、さらにc-Myc mRNAは,let-7などいくつかのmiRNAによる翻訳の抑制も受けています。
c-Mycタンパク質の58番目のスレオニン残基がGSK-βによってリン酸化を受けると、プロテオソーム分解系によりすみやかに分解されます。
ドコサヘキサエン酸(DHA)がc-Myc の58番目のスレオニン残基 のリン酸化レベルを増加し、c-Myc タンパク質の分解を促進することは前回(824話)解説しました。
このようにc-Mycタンパク質は、正常細胞では細胞内にあまり多く蓄積しないようにさまざまな調節を受けています。しかし、がん細胞はそういったc-Mycタンパク質の量を制限する機構から回避することで細胞内に比較的多くの量のc-Mycタンパク質の蓄積を達成しています。
その最も典型的な例としては、がん細胞がリン酸化されないように58番目のスレオニン残基を変異させることで、c-MycCタンパク質の安定性を増していることがあげられます。
転写レベルでの調節では、c-Myc遺伝子プロモーター上にBRD4(ブロモドメイン含有タンパク質4)という転写調節因子が結合し、転写を促進していることがわかっており、小分子化合物を用いてBRD4の活性を抑制することでc-Mycの発現を低下させ、がんを治療しようとする試みがなされています。
BETファミリータンパク質は高アセチル化ヒストンへの結合を介して、がん遺伝子や抗アポトーシスタンパク質の発現を促進する作用があります。
ブロモドメインはヒストンのアセチル化リシンを認識し,制御タンパク質を集めてクロマチン構造や遺伝子発現を制御する機能が知られているタンパク質ドメインです。
ブロモドメイン繰り返し配列および特異的末端配列を持つBET(bromodomain and extra-terminal)ファミリータンパク質としてBRD2,BRD3,BRD4,BRDTが知られています。
ヒストンのアセチル化による遺伝子発現の制御には、アセチル化を促進するヒストンアセチル基転移酵素、ヒストンからアセチル基を除去するヒストン脱アセチル化酵素、ヒストンのアセチル化した部分を認識するBETファミリータンパク質の3つが必要です。
ヒストンアセチル基転移酵素の「書き屋(Writer)」とヒストン脱アセチル化酵素の「消し屋(Eraser)」と、BETファミリータンパク質の「読み屋(Reader)」の3つの役割を担うタンパク質が、ヒストンアセチル化の制御を行ってます。(下図)

図:「書き屋(Writer)」のヒストンアセチル基転移酵素によってヒストンにアセチル基が結合し(①)、「消し屋(Eraser)」のヒストン脱アセチル化酵素によってアセチル基が除去される(②)。ヒストンアセチル化の少ない部分では遺伝子転写は抑制される(③)。「読み屋(Reader)」のBETファミリータンパク質はヒストンのアセチル化リシンと結合して(④)、遺伝子転写を促進する(⑤)。
ヒストンのアセチル化リシンとBETファミリータンパク質のブロモドメインの結合を阻害する薬剤をがん細胞に投与すると、遺伝子発現パターンが正常細胞に近づくことが知られています。
ヒストンとBETファミリータンパク質の結合を阻害する低分子化合物(BET阻害剤)が、がんや炎症性疾患の治療薬として注目されています。臨床試験が行われているBET阻害剤が幾つかあります。
このようなBET阻害剤は、ある種のがん細胞に投与すると腫瘍促進遺伝子の発現を選択的に抑制することから、がん治療薬としての可能性が期待されています。
【ニトロキソリンはBETタンパク質を阻害する】
抗生物質のニトロキソリンがBETタンパク質を阻害することが報告されています。以下のような論文があります。
Discovery of novel BET inhibitors by drug repurposing of nitroxoline and its analogues.(ニトロキソリンとその類似体の薬物再利用による新規BET阻害剤の発見)Org Biomol Chem. 2017 Nov 15;15(44):9352-9361.
【要旨】
ブロモドメイン含有タンパク質(bromodomain-containing proteins)のBETファミリーは、がん、炎症および心血管疾患を含む多くの疾患の治療に有望な薬物標的であると考えられている。それ故、BET阻害作用のある新規な化合物の開発が注目されている。
安全性および薬物動態が既知の化合物から阻害剤を見出すという薬物再利用戦略は大きな利点を有しており、それ故近年の医薬品開発者の関心を高めている。この薬物再利用戦略を使って、薬物ライブラリーからBRD4特異的阻害作用を有する化合物を探索し、続いてALPHAスクリーニングアッセイ試験を実施した。
FDA承認抗生物質であるニトロキソリンは、BRD4(ブロモドメイン含有タンパク質4)の第一ブロモドメインとアセチル化ヒストン4ペプチドとの間の相互作用を50%阻害濃度(IC50)が0.98μMで阻害することを明らかにした。
ニトロキソリンは、非BETブロモドメイン含有タンパク質に対して阻害作用を示さず、良好な選択性で全てのBETファミリーメンバーを阻害した。従ってニトロキソリンは選択的BET阻害剤と呼べる。
ニトロキソリン-BRD4_BD1複合体の結晶構造に基づいて、ニトロキソリンの作用機構およびBET特異性を決定した。
BET関連疾患の1つであるMLL白血病に対するニトロキソリンの抗がん活性はこれまで研究されていなかったので、我々はニトロキソリンがMLL白血病の治療薬として有効かどうかを試験した。
ニトロキソリンは細胞周期停止とアポトーシスを誘導することによりMLL白血病細胞の増殖を効果的に抑制した。ニトロキソリンの有効性は、少なくとも部分的には、BETの阻害および標的遺伝子転写の抑制によるものである。 BET阻害剤としてのニトロキソリンの発見は、BETファミリー関連疾患の治療のためのニトロキソリンおよびその誘導体の潜在的用途を示唆している。
BET (bromodomain and extra-terminal)ファミリータンパク質は、ブロモドメインにおいてヒストンのアセチル化されたリシンを認識することにより、転写活性化因子として機能します。BRD4はこのようなBETファミリータンパク質の1つです。
BETファミリータンパク質のBRD4の阻害剤(=ニトロキソリン)はc-Mycの発現を抑制する作用があると言えます。

図:ヒストンのアセチル化されたリシンを認識するブロモドメインの繰り返し配列と特異的末端配列を持つBET(bromodomain and extra-terminal)ファミリータンパク質の一つのBRD4は、ヒストンのアセチル化リシンに結合し、転写因子やRNAポリメラーゼなどをリクルートして(①)、c-Myc遺伝子の転写を促進する(②)。ニトロキソリンはBRD4の第一ブロモドメインとアセチル化ヒストンの結合を阻害する(③)。その結果、転写因子やRNAポリメラーゼのリクルートが阻害され(④)、c-Myc遺伝子の転写を抑制する(⑤)。
ニトロキソリンの尿路感染症の治療に使う量は1日に500から750mgです。この尿路感染症に使用する服用量で十分な抗腫瘍効果が期待できることが動物実験の研究で報告されています。
【細胞分裂するたびにDNAのテロメアが短くなる】
人間の胎児から取り出した線維芽細胞を培養すると次第に分裂の速度が落ちて、約50回の分裂回数が限界で、いくら栄養物質や増殖を促進する物質を加えても分裂することはできずに最後は死んでしまいます。
一方、成人の人間から取り出した線維芽細胞の分裂できる回数はその年齢に応じて減少していることも明らかになっています。すなわち、細胞の中には細胞の分裂した回数をきちんと数える装置があって、ある回数を過ぎると細胞は死を向かえるプログラムが働き出すのです。
細胞の分裂回数に限界を設けているのが遺伝子の末端のテロメアの存在です。染色体DNAの末端部分にはTTAGGGという配列が多数繰り返された構造がみつかりテロメアと名付けられました。この6塩基のリピート部分には遺伝情報が入っていないので、無くなっても遺伝子の発現には問題ない部分です。しかし、テロメアが無くなると細胞はDNAの複製ができなくなります。
DNAは2本の鎖状で、それぞれの鎖を鋳型にして新しいDNA鎖を合成します。新しい鎖を作るとき、DNAポリメラーゼという酵素が鋳型のDNA上を移動しながら、新生DNAを作ります。この酵素が鋳型のDNAに結合するためには、まずプライマーとよばれるRNAが鋳型のDNAの末端に結合する必要があります。
DNAポリメラーゼはRNAプライマーに結合し、そこから新生DNAの合成を開始します。その際、プライマーが結合した鋳型DNAの末端部は複製されません。そのため、細胞分裂でDNAを複製するたびに、染色体のDNA末端は少しづつ切れて短くなっていきます。これを末端複製問題(end replication problem)といいます。
通常、1回の細胞分裂で、テロメアから50から100塩基分が失われてテロメアが短縮していきます。テロメアの短縮が限界に達すると、細胞はもはや分裂することが出来なくなります。
短くなっても問題ないように、最初から遺伝情報とは関係なく必要のないDNA配列(TTAGGGの繰り返し配列)がテロメアとして存在しているのです。しかし、テロメアの長さに限界があるので、いずれはテロメアが無くなると、もはや細胞分裂ができなくなります。(下図)

図:染色体の末端にはテロメアという構造があり(①)、この部分のDNAはTTAGGGという配列が多数繰り返されている(②)。細胞分裂するたびに、このテロメア部分のDNAは短くなり(③)、テロメアが無くなった時点で、細胞はそれ以上に分裂することができなくなる(④)。
生殖細胞や幹細胞(骨髄の造血細胞や消化管粘膜上皮細胞のように細胞回転が早い細胞を供給している細胞)やがん細胞のように無限に分裂できる細胞もありますが、これはテロメアを延ばすことができるテロメラーゼという酵素が働いて、テロメアの長さを維持しているからです。普通の細胞にはテロメラーゼ活性はほとんどありません。
【がん細胞ではテロメラーゼ活性が亢進している】
通常、1回の細胞分裂で、テロメアから50から100塩基分が失われてテロメアが短縮していきます。テロメアの短縮が限界に達すると、細胞はもはや分裂することが出来なくなります。
多くのがん細胞ではテロメラーゼ(telomerase)と呼ばれるテロメア合成酵素が活性化しており、この酵素の働きによってテロメアが安定に維持されます。
通常であれば、細胞分裂するたびにテロメアが短縮するのですが、がん細胞ではテロメラーゼ活性を亢進して、テロメアを再生して短縮を阻止しています。がん細胞が無限に分裂出来るのはこのためです。

図:染色体DNAの末端部分にはTTAGGGという配列が多数繰り返されたテロメアという構造が存在する(①)。正常細胞では細胞分裂のたびにテロメアが短縮し(②)、その短縮が限界に達するとDNAの複製ができなくなり、細胞はもはや分裂することが出来ず、細胞死を引き起こす(③)。多くのがん細胞ではテロメラーゼの発現と活性が亢進しておりテロメアを再生できる(④)。その結果、がん細胞は無限の細胞分裂能(不死化)を獲得している(⑤)。
テロメラーゼ(telomerase)はテロメアの末端にTTAGGGのリピート配列を付加することで染色体DNAの末端を維持する酵素です。
テロメラーゼは逆転写酵素活性を持つヒト・テロメラーゼ逆転写酵素(human telomerase reverse transcriptase :TERT)と、テロメアリピートの鋳型として機能するRNA要素(テロメラーゼRNA要素:TERC)から構成されます。
テロメラーゼRNA要素(telomerase RNA component: TERC)はテロメラーゼによるテロメアの複製(逆転写)の際の鋳型として機能します。脊椎動物型TERC配列の50位付近に存在するCCCUAA配列が鋳型として機能します。
テロメラーゼ活性が低い細胞は、一般に細胞分裂ごとにテロメアの短縮が進み、やがてヘイフリック限界と呼ばれる細胞分裂の停止が起きます。
テロメラーゼは、ヒトでは生殖細胞・幹細胞・がん細胞などでの活性が認められ、それらの細胞が分裂を継続できる性質に関与しています。
このことから、テロメラーゼ活性を抑制することによるがん治療法となり、活性を高めることは細胞の分裂寿命の延長による抗老化療法となります。
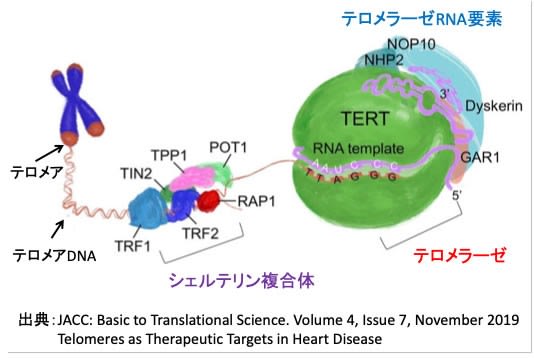
図:ヒト・テロメラーゼ複合体はヒト・テロメラーゼ逆転写酵素(human telomerase reverse transcriptase :TERT)とテロメラーゼRNA要素(telomerase RNA component :TERC)、dyskerin、リボヌクレオプロテイン(GAR1, NHP2, NOP10)から構成される。テロメラーゼRNA要素(TERC)がRNAテンプレートとなってテロメラーゼ逆転写酵素(TERT)がテロメアの末端にDNAヌクレオチドを追加してテロメアを伸長する。シェルテリン複合体(Shelterin complex)はテロメアを保護し、テロメラーゼ活性を制御する。シェルテリン複合体は、TRF1(telomere repeat binding factor 1)、 TRF2(telomere repeat binding factor 2)、RAP1(repressor/activator protein 1)、POT1(protection of telomere 1)、 TIN2(TRF1- and TRF2-interacting nuclear protein 2)、TPP1(ACD shelterin complex subunit and telomerase recruitment factorの6つのサブユニットから構成される。
【テロメラーゼ逆転写酵素はテロメア伸長以外の作用も有する】
テロメラーゼ逆転写酵素はテロメアを伸長するテロメラーゼ活性のほかに、発がん遺伝子のMycの発現を制御する作用があることが報告されています。以下のような報告があります。
Telomerase regulates MYC-driven oncogenesis independent of its reverse transcriptase activity(テロメラーゼはその逆転写酵素活性とは無関係にMYC駆動の発がんを制御する)J Clin Invest. 2015;125(5):2109-2122.
【要旨】
がん細胞では、MYCの活性化とテロメラーゼの再活性化がともに起こっていることが多い。テロメラーゼの再活性化は細胞複製の不死化に不可欠であると考えられており、MYCはその補因子とともに、がん細胞における増殖に必須の役割を担っている。
テロメラーゼの触媒サブユニットであるテロメラーゼ逆転写酵素(telomerase reverse transcriptase :TERT)の再活性化は、腫瘍におけるテロメラーゼ活性の再活性化を意味する。
テロメラーゼ逆転写酵素の再活性化は腫瘍におけるいくつかの「がんの特徴」の獲得と機能的に関連しているが、これらのメカニズムがテロメアに対するテロメラーゼの役割だけで説明できるかは不明である。
ここでは、テロメラーゼ逆転写酵素遺伝子欠損マウスが、MYC誘発リンパ腫の発症を抑制するが、テロメラーゼRNA要素(telomerase RNA component: TERC)遺伝子欠損マウスではMYC誘発リンパ腫の発症を抑制しないことを示した。
テロメラーゼ逆転写酵素はがん細胞におけるMYC安定化の制御を行っていることを明らかにした。
テロメラーゼ逆転写酵素はクロマチン上のMYCレベルを安定化させ、その標的遺伝子の活性化または抑制に関与した。
テロメラーゼ逆転写酵素は、MYCユビキチン化とプロテアソーム分解を調節したが、この作用は逆転写酵素活性とテロメア伸長における役割とは無関係であった。
これらのデータに基づいて、がん細胞におけるMYCの直接の転写ターゲットであるテロメラーゼ逆転写酵素の再活性化は、MYC依存性発がんを増強するフィードフォワードメカニズム(feed-forward mechanism)を提供すると結論付ける。
テロメラーゼはテロメラーゼ逆転写酵素とテロメラーゼRNA要素の2つのサブユニットから構成されます。テロメアを伸長するテロメラーゼ活性にはこの2つのサブユニットが必要です。
「テロメラーゼ逆転写酵素遺伝子欠損マウスが、MYC誘発リンパ腫の発症を抑制するが、テロメラーゼRNA要素遺伝子欠損マウスではMYC誘発リンパ腫の発症を抑制しない」ということは、MYC誘発リンパ腫が、テロメラーゼの活性化とは関係ないが、テロメラーゼ逆転写酵素の存在は必要ということを示唆します。これは、テロメラーゼ逆転写酵素はテロメラーゼ活性とは異なるメカニズムでMYC誘発性リンパ腫の発生に関与することを意味します。
フィードフォワード(feed-forward)とは、自動制御の一種で、『出力に変動を起こさせるような外乱を予測し、前もって打ち消してしまう制御方式。ふつう、フィードバック制御に付加して用いられる。』と解説されています。
テロメラーゼ逆転写酵素(TERT)はMYCの安定化と転写活性を亢進し、一方MYCは、TERTの転写を亢進します。このフィードフォワードメカニズム(feed-forward mechanism)の結果として、テロメラーゼ逆転写酵素活性とMYC活性の両方が増強し、MYC依存性発がんを増強するという機序です。
これをまとめると以下のような図になります。

図:テロメラーゼ逆転写酵素(telomerase reverse transcriptase:TERT)はテロメラーゼRNA要素(telomerase RNA component: TERC)と複合体を構成してテロメアを伸張する作用を発揮し(①)、細胞複製(DNA複製)を永続させて細胞を不死化する(②)。これがテロメラーゼ逆転写酵素のテロメア依存性作用となる(③)。一方、テロメラーゼ逆転写酵素(TERT)はテロメアとは関係なく、MYCタンパク質のユビキチン化を低下させてプロテアソームでの分解を低下し、MYCタンパク質の安定化を亢進し、クロマチン結合のMYC/MAXを増やし、MYC/MAX転写活性を亢進する(④)。MYCのターゲット遺伝子は細胞周期や細胞増殖や代謝の制御に関与し、これらのMYCの下流のターゲットの遺伝子発現の亢進によって発がんが強化される(⑤)。このMYC/MAXによる転写活性はテロメラーゼ逆転写酵素(TERT)の発現を亢進する(⑥)。このテロメラーゼ逆転写酵素のこの機能はテロメラーゼRNA要素(TERC)を必要とせず、テロメアに対する機能とは無関係(非依存性)である(⑦)。 このフィードフォワードメカニズム(feed-forward mechanism)の結果として、テロメラーゼ逆転写酵素活性が増強し、MYC依存性発がんを増強する。
【プテロスチルベンのテロメラーゼ活性阻害作用】
前述の論文では、MYCの阻害はテロメラーゼ逆転写酵素の発現を阻害することが報告されています。
プテロスチルベンがMYCを阻害してテロメラーゼ逆転写酵素の発現を阻害することが報告されています。以下のような論文があります。
Pterostilbene down-regulates hTERT at physiological concentrations in breast cancer cells: potentially through the inhibition of cMyc.(プテロスチルベンは乳がん細胞において生理的濃度でヒト・テロメラーゼ逆転写酵素の発現を抑制する: cMycの阻害を介する可能性) J Cell Biochem. 2018 Apr; 119(4): 3326–3337.
【要旨】
ヒト・テロメラーゼ逆転写酵素(Human telomerase reverse transcriptase :hTERT)は、テロメラーゼの触媒サブユニットであり、多くのがん細胞で発現が亢進している。
プテロスチルベンは、主にブルーベリーに含まれる天然のスチルベノイドで、抗菌物質(ファイトアレキシン)として機能し、抗酸化活性を示し、さまざまな種類のがん細胞の増殖を阻害する。
この研究は、生理学的に達成可能な濃度のプテロスチルベンが乳がん細胞の増殖を阻害し、hTERTの発現を抑制できるかどうかを明らかにする目的で行った。
我々は、プテロスチルベンが乳がん細胞のMCF-7とMDA-MB-231に対して細胞増殖を時間依存性と用量依存性の両方で抑制し、正常細胞のMCF10A細胞に対しては有意な毒性を示さないことを見出した。
プテロスチルベンはまた、両方の乳がん細胞株においてアポトーシスを増加させることが示された。
2種類の乳がん細胞(MCF-7およびMDA-231)において、プテロスチルベンは、用量依存的にG1およびG2 / M相での細胞周期を停止した。
hTERTの発現は、時間および用量依存的に、プテロスチルベン投与によって抑制された。
さらに、プテロスチルベンは両方の乳がん細胞株において、用量依存的にテロメラーゼレベルを低下させた。
さらに、プテロスチルベンによるhTERT阻害のターゲットと考えられるcMycは、 プテロスチルベン投与によってmRNAとタンパク質の両方で発現が抑制された。
以上の結果は、乳がんの発生と進行に対する天然の予防および治療剤としてのプテロスチルベンの有用性を示唆している。
プテロスチルベンを豊富に含む食品を摂取することで達成できるレベルの血中濃度で、ヒト・テロメラーゼ逆転写酵素の発現を抑制できると言う報告です。
さらに、プテロスチルベンはテロメラーゼ活性自体も阻害する作用があります。
c-Mycはテロメラーゼ逆転写酵素の遺伝子発現を亢進します。そして、プテロスチルベンはc-Mycの発現を阻害します。
c-Mycがテロメラーゼの発現と活性を亢進するので、c-Mycの発現や活性を阻害する治療法をプテロスチルベン治療に併用すると、テロメラーゼ阻害作用をさらに強化できる可能性があります。

図:染色体DNAの末端部分にはTTAGGGという配列が多数繰り返されたテロメアという構造が存在する(①)。正常細胞では細胞分裂のたびにテロメアが短縮し(②)、その短縮が限界に達するとDNAの複製ができなくなり、細胞はもはや分裂することが出来ず、細胞死を引き起こす(③)。多くのがん細胞ではテロメラーゼの発現と活性が亢進しており(④)、テロメアを再生することによって無限の分裂能(不死化)を獲得している(⑤)。プテロスチルベンはがん細胞のヒト・テロメラーゼ逆転写酵素の発現と活性を阻害してテロメラーゼ活性を阻害する(⑥)。さらに、プテロスチルベンはがん遺伝子のc-Mycの発現を阻害し、がん抑制遺伝子のp53やp21の活性を高め、細胞周期を停止し、STAT3やAkt経路を阻害する(⑦)。その結果、がん細胞の増殖を抑制しアポトーシスを誘導する(⑧)。
【プテロスチルベンはWnt/βカテニン経路の阻害作用もある】
c-Mycの発現はWnt/βカテニン経路の下流にあることは前回(824話)解説しています。
プテロスチルベンがWnt/βカテニン経路を阻害してc-Mycの発現を抑制する作用が報告されています。
以下のような報告があります。
Dietary intake of pterostilbene, a constituent of blueberries, inhibits the β-catenin/p65 downstream signaling pathway and colon carcinogenesis in rats(ブルーベリーに含まれるプテロスチルベンの食事摂取は、ラットのβ-カテニン/p65下流シグナル伝達経路と結腸発癌を阻害する)Carcinogenesis. 2010 Jul; 31(7): 1272–1278.
ラットに発がん物質のアゾキシメタンを注射して大腸がんを発生する実験モデルで、コントロールまたは 40 ppm のプテロスチルベン含有食餌を 45 週間継続的に与えられました。その結果、プテロスチルベンの投与が大腸発がんを抑制することが示されました。
プテロスチルベンの投与は増殖細胞核抗原を低下させ、βカテニンとサイクリン D1とc-Myc の発現を抑制しました。さらに、プテロスチルベンは、炎症誘発性サイトカイン、腫瘍壊死因子-α、インターロイキン (IL)-1β、および IL-4 の粘膜レベルを低下させました。
この実験では、ラットに40ppmの濃度のプテロスチルベンを含有する食餌を与えています。
40ppmは1,000,000分の40=25000分の1です。
人間で換算すると乾燥重量500g(500,000mg)の食事で20mgです。
つまり、人間で1日数十mgのレベルで、プテロスチルベンの抗腫瘍効果が期待できると言えます。
前回(824話)の内容と合わせると、メベンダゾール、ニトロキソリン、メトホルミン、ビタミンD3、イベルメクチン、ラパマイシン、ドコサヘキサエン酸の組み合わせはc-Myc活性を抑制してがん細胞の増殖を抑えることができます。

図:β-カテニン(β-cat)は細胞間接着結合部分に局在し, 膜貫通型の接着タンパクであるE-カドヘリンに結合し、カドヘリンとアクチン細胞骨格との連結を助けている(①)。E-カドヘリンと会合していないβ-カテニンはリン酸化され、ユビキチン化を受けて最終的にプロテアソームで分解される(②)。Wntは細胞膜上のFrizzled(7回膜貫通型受容体)と共役受容体である1回膜貫通型LRP5/6(Low-density lipoprotein receptor-related protein5/6)に結合する(③)。Wntが受容体に結合するとβ-カテニンのリン酸化が抑制され、β-カテニンの分解が阻止される(④)。βカテニンは細胞質に蓄積し核内に移行し(⑤)、転写因子のTCF(T cell factor)と複合体を形成し(⑥)、c-Myc遺伝子の転写のスイッチがオンになり(⑦)、c-Mycタンパク質が合成される(⑧)。c-MycはATPと核酸とタンパク質の合成を促進し、細胞増殖を亢進する(⑨)。β-カテニンとTCFの相互作用において、TNIK(TRAF-2 and NCK-interacting kinase)によるTCFのセリン154のリン酸化が必要(⑩)。メベンダゾールはTNIKの活性を阻害して、βカテニン/TCFターゲット遺伝子のc-Mycの発現を阻害する(⑪)。増殖刺激はAktを活性化し(⑫)、AktはmTORC1を活性化する(⑬)。活性化したmTORC1はc-Myc遺伝子の発現を促進する(⑭)。AMP活性化プロテインキナーゼ(AMPK)はmTORC1を阻害する(⑮)。メトホルミンとビタミンD3とドコサヘキサエン酸はAMPKを活性化する(⑯)。イベルメクチンはAkt活性化を阻害する(⑰)。ドコサヘキサエン酸が代謝されて生成するレゾルビンD1(⑱)はc-Mycタンパク質の分解を促進する(⑲)。ラパマイシンはmTORC1を直接阻害する(⑳)。ヒストンのアセチル化されたリシンを認識するブロモドメインの繰り返し配列と特異的末端配列を持つBET(bromodomain and extra-terminal)ファミリータンパク質(㉑)は、ヒストンのアセチル化リシンに結合し、RNAポリメラーゼなどの転写に必要なタンパク質をリクルートして、c-Mycの転写を活性化する(㉒)。ニトロキソリンはアセチル化リシンとブロモドメインの結合を阻害してc-Mycの発現を阻害する(㉓)。プテロスチルベンはc-Mycの発現を阻害する(㉔)。以上から、メベンダゾール、メトホルミン、ビタミンD3、ドコサヘキサエン酸、イベルメクチン、ニトロキソリン、プテロスチルベンはc-Myc遺伝子の転写を異なるメカニズムで阻害し、相乗効果が期待できる。
| « 824) c-Mycを... | 826)がん幹細... » |



