独立行政法人の科学技術振興機構(JST)が開催した「21世紀の医療イノベーション ナノバイオテクノロジーが切り拓く最先端医療への挑戦」という国際シンポジウムを拝聴した話の続きです。
この国際シンポジウムの中心テーマは、細胞シートを用いた再生医療とDDS(ドラッグ・デリバリー・システム)を用いた治療や医療の二つの基盤技術です。細胞シートを用いる再生医療は、東京女子医科大学先端生命医科学研究所の所長・教授の岡野光夫さんの研究グループが、薬を患部に直接送るDDSを用いた治療や医療は、東京大学大学院工学系研究科・医学系研究科の教授の片岡一則さんの研究グループが担当しています。
この二つの基盤技術の研究開発はともに、内閣府の「最先端研究開発支援プログラム」に選ばれた30件の大型研究開発プログラムの一つです。岡野さんの研究グループには1年当たり約34億円の予算が、片岡さんの研究グループには同約34億円の予算が割り振られています(執行額ではありません)。二つともに、中心研究者が研究支援担当機関として科学技術振興機構を指名しています。
1月18日午後の後半の講演は、片岡さんの研究グループが講演されました。


一番手は国立がん研究センター東病院部長の村松保広さんです。DDSがガン治療をパラダイムシフトさせるという趣旨の講演でした。
胃ガンやすい臓ガンは難治がんと呼ばれる治療が難しいガンです。その理由は、抗ガン剤を投入すると副作用が大きいなどの課題があり、有効な化学療法がないからだそうです。このため、DDSと呼ばれるミクロのカプセル(高分子ミセルで作成します。直径は20~100ナノメートル)に抗ガン剤を入れ、ガン患部の近くでDDSから抗ガン剤を徐々に放出する治療法の研究開発を進めています。
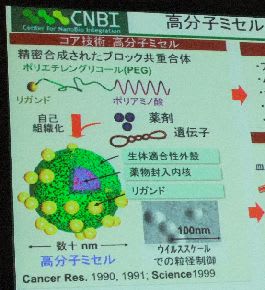
例えば、「NK105」という抗ガン剤をDDSの中に入れて治療する研究開発が進んでいます。DDSはその事業化は、大学発ベンチャー企業のナノキャリア(千葉県柏市)が担当し、日本化薬と実施権のライセンス契約を締結し、日本化薬が製造しています。現在、「第Ⅱ相臨床試験」まで研究開発は進んでいるそうです。
「難治ガンは間質(血管、神経、膠原繊維、繊維芽細胞などの結合組織を指す)が豊富という病態生理学を利用して、ガン関連間質抗体を開発し、ミセル製剤とのハイブリッド製品をつくって、難治ガン治療を目指した非臨床と臨床開発を進める」とのことです。「間質」という医学の専門用語が説明無く、いきなり出てくるので、とても難解な講演でした。
二番手は東京大学大学院医学系研究科の准教授の西山伸宏さんでした。DDSの中に光応答性の物質を含ませ、ガンの患部付近で放出し、ガン患部と光応答性の物質を結合させ、ガン患部を光らせるなどの画像をつくるイメージングを研究開発しているそうです。光応答性物質と結合したガン患部に対して、レーザーなどの強力な光を照射する治療法を研究開発しているそうです。例えば、光が当たると、細胞内のミトコンデリアが活性酸素を放出し、アポトーシス (apoptosis) によって細胞が死ぬ現象を利用するガン治療法を追究しているそうです。講演内容の光応答性ナノデバイスの研究開発はかなり先端的なものと感じました。
三番手は東京医科歯科大学の生体材料工学研究所教授の宮原裕二さんです。「生体分子認識検出用マイクロバイオチップの創製」というタイトルでお話しされました。半導体ではお馴染みのFET(電界効果トランジスタ)の部分の表面に1本鎖のDNAを“核酸プローブ”として植え付けます。1本鎖のDNAは、2本の遺伝子が二重らせんをつくることで安定化します。この際のマイナスイオンの増加量を、FETによって精密測定するバイオ・トランジスタ・チップを試作されています。最近研究開発が活発化している“マイクロRNA”(mRNA)の塩基配列の解析を進めるそうです。こうしたバイオチップを追究し、簡便な臨床検査システムを実用化したいと語ります。
三つの講演ともに、同じ研究分野の研究者向けに語る講演で、異分野・他分野の聴講者向けの言葉の配慮が感じられませんでした。異分野融合が重要との発言はあるのですが。とにかく内容が難解なために、集中力を必要とする講演会でした。
この国際シンポジウムの中心テーマは、細胞シートを用いた再生医療とDDS(ドラッグ・デリバリー・システム)を用いた治療や医療の二つの基盤技術です。細胞シートを用いる再生医療は、東京女子医科大学先端生命医科学研究所の所長・教授の岡野光夫さんの研究グループが、薬を患部に直接送るDDSを用いた治療や医療は、東京大学大学院工学系研究科・医学系研究科の教授の片岡一則さんの研究グループが担当しています。
この二つの基盤技術の研究開発はともに、内閣府の「最先端研究開発支援プログラム」に選ばれた30件の大型研究開発プログラムの一つです。岡野さんの研究グループには1年当たり約34億円の予算が、片岡さんの研究グループには同約34億円の予算が割り振られています(執行額ではありません)。二つともに、中心研究者が研究支援担当機関として科学技術振興機構を指名しています。
1月18日午後の後半の講演は、片岡さんの研究グループが講演されました。


一番手は国立がん研究センター東病院部長の村松保広さんです。DDSがガン治療をパラダイムシフトさせるという趣旨の講演でした。
胃ガンやすい臓ガンは難治がんと呼ばれる治療が難しいガンです。その理由は、抗ガン剤を投入すると副作用が大きいなどの課題があり、有効な化学療法がないからだそうです。このため、DDSと呼ばれるミクロのカプセル(高分子ミセルで作成します。直径は20~100ナノメートル)に抗ガン剤を入れ、ガン患部の近くでDDSから抗ガン剤を徐々に放出する治療法の研究開発を進めています。

例えば、「NK105」という抗ガン剤をDDSの中に入れて治療する研究開発が進んでいます。DDSはその事業化は、大学発ベンチャー企業のナノキャリア(千葉県柏市)が担当し、日本化薬と実施権のライセンス契約を締結し、日本化薬が製造しています。現在、「第Ⅱ相臨床試験」まで研究開発は進んでいるそうです。
「難治ガンは間質(血管、神経、膠原繊維、繊維芽細胞などの結合組織を指す)が豊富という病態生理学を利用して、ガン関連間質抗体を開発し、ミセル製剤とのハイブリッド製品をつくって、難治ガン治療を目指した非臨床と臨床開発を進める」とのことです。「間質」という医学の専門用語が説明無く、いきなり出てくるので、とても難解な講演でした。
二番手は東京大学大学院医学系研究科の准教授の西山伸宏さんでした。DDSの中に光応答性の物質を含ませ、ガンの患部付近で放出し、ガン患部と光応答性の物質を結合させ、ガン患部を光らせるなどの画像をつくるイメージングを研究開発しているそうです。光応答性物質と結合したガン患部に対して、レーザーなどの強力な光を照射する治療法を研究開発しているそうです。例えば、光が当たると、細胞内のミトコンデリアが活性酸素を放出し、アポトーシス (apoptosis) によって細胞が死ぬ現象を利用するガン治療法を追究しているそうです。講演内容の光応答性ナノデバイスの研究開発はかなり先端的なものと感じました。
三番手は東京医科歯科大学の生体材料工学研究所教授の宮原裕二さんです。「生体分子認識検出用マイクロバイオチップの創製」というタイトルでお話しされました。半導体ではお馴染みのFET(電界効果トランジスタ)の部分の表面に1本鎖のDNAを“核酸プローブ”として植え付けます。1本鎖のDNAは、2本の遺伝子が二重らせんをつくることで安定化します。この際のマイナスイオンの増加量を、FETによって精密測定するバイオ・トランジスタ・チップを試作されています。最近研究開発が活発化している“マイクロRNA”(mRNA)の塩基配列の解析を進めるそうです。こうしたバイオチップを追究し、簡便な臨床検査システムを実用化したいと語ります。
三つの講演ともに、同じ研究分野の研究者向けに語る講演で、異分野・他分野の聴講者向けの言葉の配慮が感じられませんでした。異分野融合が重要との発言はあるのですが。とにかく内容が難解なために、集中力を必要とする講演会でした。

















癌組織や炎症部位の血管内皮細胞間には200nm程度の広い隙間が開いており、100nm以下の直径につくられたDDSの製剤を癌組織に集めることが可能なことを意味しています。これを巧みに生かしたいものです。