がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
836)油を変えるとがんが消える(その2):ドコサヘキサエン酸(DHA)は天然の抗がん剤
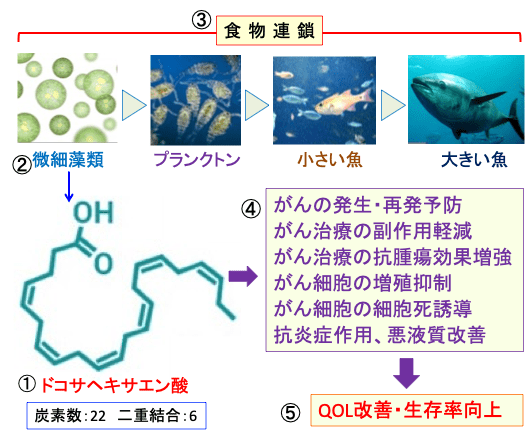
図:魚油に多く含まれるドコサヘキサエン酸(①)は炭素数が22個で二重結合が6個のオメガ3系多価不飽和脂肪酸。ドコサヘキサエン酸(DHA)は魚が作っているのではなく、微細藻類が産生している(②)。DHAは食物連鎖で魚に蓄積し、それを人間が食べてDHAを摂取している(③)。DHAには、がんの発生・再発予防、がん治療の副作用・抗腫瘍効果増強、がん細胞の増殖抑制・細胞死誘導、抗炎症作用、悪液質改善作用など多彩なメカニズムで抗腫瘍効果を発揮し、がん患者のQOL(生活の質)を改善し、生存率を高めることができる。ドコサヘキサエン酸(DHA)は天然の抗がん剤と言える。
836)油を変えるとがんが消える(その2):ドコサヘキサエン酸(DHA)は天然の抗がん剤
【ドコサヘキサエン酸はPPARγのアゴニスト】
ペルオキシソーム増殖因子活性化受容体γ(PPARγ)は細胞の生存に重要な役割を果たしています。PPARγの活性化によってがん細胞の増殖や転移が抑制される効果が、培養がん細胞や動物に移植した腫瘍を使った実験で報告されています。
ドコサヘキサエン酸(DHA)がPPARγのリガンドになり、しかもPPARγの発現を亢進することが明らかになっています。例えば、マウスに肺がんを移植した実験系で、DHAがPPARγの発現と活性を亢進し、炎症反応を促進するNF-κB経路を抑制し、NF-κBを介した抗アポトーシス因子(Bcl-2やBcl-XL)細胞外マトリックス分解酵素の発現を抑制することが示されています。その結果、肺がん細胞のアポトーシスを促進し、転移を抑制しました。(以下の論文)
DHA/EPA-Enriched Phosphatidylcholine Suppresses Tumor Growth and Metastasis via Activating Peroxisome Proliferator-Activated Receptor γ in Lewis Lung Cancer Mice.(DHA / EPAに富むホスファチジルコリンは、ペルオキシソーム増殖因子活性化受容体γの活性化を介してルイス肺がんマウスの腫瘍の成長と転移を抑制する)J Agric Food Chem. 2021 Jan 20;69(2):676-685.
ドコサヘキサエン酸(DHA)とエイコサペンタエン酸(EPA)によるがん細胞のアポトーシス誘導はPPARγの活性を阻害するPPARγアンタゴニストによって阻害されることから、DHAとEPAの抗腫瘍効果がPPARγの活性化を介することが明らかになっています。また、この効果はEPAよりDHAの方が強いことが示されています。(以下の論文)
Docosahexaenoic Acid Induces Growth Suppression on Epithelial Ovarian Cancer Cells More Effectively than Eicosapentaenoic Acid.(ドコサヘキサエン酸はエイコサペンタエン酸より、より効果的に上皮性卵巣がん細胞の増殖を抑制する)Nutr Cancer. 2016;68(2):320-7.
【PPARγはアディポネクチンの産生を増やす】
PPARγは脂肪組織でインスリン感受性を高めるアディポネクチン遺伝子の発現を促進します。アディポネクチンはインスリン抵抗性を改善する作用によって糖尿病を治療する効果を発揮します。さらに、アディポネクチンには抗老化作用やがん予防効果があります。インスリンが老化と発がん過程を促進するためです。
アディポネクチンは脂肪細胞から分泌される善玉ホルモンのようなタンパク質で、肝臓や筋肉細胞のアディポネクチン受容体に作用してAMP活性化プロテインキナーゼ(AMPK)を活性化し、インスリン抵抗性を改善し、動脈硬化や糖尿病を防ぐ作用があります。
アディポネクチンは血中に1分子ずつバラバラにではなく、複数個がくっついた形で存在しています。低分子量(3量体)、中分子量(6量体)、高分子量(12~18量体)です。中でも高分子量アディポネクチンの生理活性が最も強いことが知られています(図)。
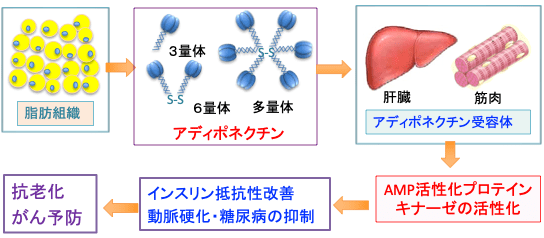
図:アディポネクチンは主に脂肪細胞から分泌されるアディポカインの一種で、低分子量(3量体)、中分子量(6量体)、高分子量(12~18量体)の形で存在する。肝臓や筋肉細胞の受容体に作用してAMP活性化プロテインキナーゼ(AMPK)を活性化し、インスリン抵抗性を改善し、動脈硬化や糖尿病を防ぐ作用がある。これらの作用は抗老化とがん予防の効果がある。
肥満が老化やがんの発生・増殖を促進することは多くの研究で明らかになっています。その最も大きな理由は、「インスリン抵抗性」を高めるためです。インスリン抵抗性とはインスリンの作用が低下した状態のことです。インスリン抵抗性になるとそれを代償するために血中のインスリン濃度が高まります。インスリンは老化速度とがん細胞の増殖を促進する作用があります。
肥満になって脂肪が増えると、脂肪組織にマクロファージなどの炎症細胞が浸潤し、TNF-αやIL-6などの炎症性サイトカインの産生が増えます。これらの炎症性サイトカインは脂肪細胞からのアディポネクチンの産生を減少させます。
肥満は脂肪組織における炎症を引き起こし、体を一種の慢性炎症状態にしています。この慢性炎症状態は、炎症性サイトカインの産生や酸化ストレスを高め、老化と発がんを促進する原因にもなります。インスリン抵抗性が亢進して血中のインスリン濃度が高くなると、老化を早めて寿命を短くすることになります。(図)。

図:肥満による脂肪組織・脂肪細胞の増加は炎症性サイトカインを増やし、アディポネクチンを低下させてインスリン抵抗性を高め、高インスリン血症を引き起こす。インスリンは老化と発がんを促進し、寿命を短縮し、がん細胞の発生や増殖・転移を促進する。
多くの疫学研究で、血清アディポネクチンの濃度とがんの発生率が逆相関することが示されています。例えば、血清アディポネクチンの濃度と様々ながんの発生率を検討した2002年から2011年までに発表された45編の研究論文をレヴューした総説論文があります
Serum adiponectin level and different kinds of cancer: a review of recent evidence.(血清アディポネクチン濃度と様々な種類のがん:最近のエビデンスのまとめ)ISRN Oncol. 2012;2012:982769.
この論文によると、血清アディポネクチンの濃度が高いほど、乳がん、前立腺がん、子宮内膜がん、大腸がん、食道がん、膵臓がんなど多くのがんの発生率が減少することが示されています。
また、アディポネクチンはがん抑制遺伝子のLKB1を活性化し、その下流のシグナル伝達系にあるAMPK(AMP活性化プロテインキナーゼ)の活性化とmTOR(mammalian target of rapamycin:哺乳類ラパマイシン標的タンパク質)の活性阻害によって、がん細胞の増殖や転移を防ぐ作用があることが報告されています。そして、アディポネクチンは糖尿病や動脈硬化やメタボリック症候群を予防し、寿命を延ばす作用があります。
したがって、アディポネクチンの産生を増やすことは、長寿とがん予防の両方を達成するために極めて重要と言えます。
【ドコサヘキサエン酸はアディポネクチンを増やす】
ドコサヘキサエン酸(DHA)はペルオキシソーム増殖因子活性化受容体γ(PPARγ)のリガンドであり、PPARγは脂肪組織のアディポネクチン遺伝子の発現を促進します。
複数の脂肪組成の食事を摂取して比較するランダム化クロスオーバー介入試験で、ドコサヘキサエン酸が豊富なキャノーラ油がアディポネクチン濃度を上昇させることが報告されています。以下のような報告があります。
Docosahexaenoic acid-enriched canola oil increases adiponectin concentrations: a randomized crossover controlled intervention trial.(ドコサヘキサエン酸が豊富なキャノーラ油はアディポネクチン濃度を上昇させる:ランダム化クロスオーバー介入試験)Nutr Metab Cardiovasc Dis. 2015 Jan;25(1):52-9.
この臨床試験は、肥満でメタボリック症候群の症状がある114人の成人男女が参加しています。4週間のウォッシュアウト期間で区切られた5つの食事をそれぞれ4週間摂取しました。3000 キロカロリー当たり60gの油を含む食事で、油は次の5種類です。
1)トウモロコシ/ベニバナ油混合 (リノール酸が多い)
2)亜麻仁/紅花油混合(α-リノレン酸が多い)
3)従来のキャノーラ油(オレイン酸が多い)
4)高オレイン キャノーラ油 (オレイン酸含有量が最も多い)
5)ドコサヘキサエン酸(DHA)強化高オレイン キャノーラ油(オレイン酸とDHAが多い)
その結果、DHA強化キャノーラ油が最も血漿アディポネクチン濃度を増加させ、炎症性サイトカインのインターロイキン-1βや炎症反応(CRP)を低下させました。つまり、DHA が豊富なキャノーラ油は、植物由来の多価不飽和脂肪酸(リノール酸、αリノレン酸)と比較して、アディポネクチンを増やし抗炎症効果を発揮するという結果です。
肥満の女性が減量の目的でライフスタイルを変更している時に、魚油由来のオメガ3系多価不飽和脂肪酸のエイコサペンタエン酸 (EPA) とドコサヘキサエン酸(DHA)の摂取を増やした場合の効果を検討した臨床試験が行われています。
Effect of n-3 fatty acids supplementation during life style modification in women with overweight.(太りすぎの女性のライフスタイル変更中のn-3脂肪酸補給の効果)Cent Eur J Public Health. 2018 Dec;26(4):265-271.
ライフスタイル変更だけのグループに比べて、DHA+EPA摂取を増やしたグループでは体重と腹囲と体脂肪が減少し、最大酸素摂取量が増えました。また、DHA+EPA摂取群では血漿中のアディポネクチンの濃度が増えていました。
アディポネクチンはインスリン抵抗性を改善して、インスリン濃度を低下させます。インスリンは脂肪合成を促進して体脂肪を増やす作用があります。DHAとEPAは脂肪組織におけるアディポネクチンの産生を増やし、インスリン抵抗性を改善することによって減量効果を促進すると考えられます。
【がん幹細胞では脂肪酸結合タンパク質の発現が増えている】
細胞内において、炭素数12個以上の長鎖脂肪酸は不溶性であり、長鎖脂肪酸が細胞内を移動するためにはこれに結合して可溶化し、生理活性を発揮させる分子が必要となります。その役割を担っているのが脂肪酸結合タンパク質(Fatty Acid Binding Protein :FABP)です。FABP分子ファミリーには12種類に及ぶ分子種が同定されており、脂肪酸の細胞内取り込み・輸送・代謝を調節し、シグナル伝達の制御や遺伝子転写の制御など様々な細胞機能に関わっています。(図)

図:脂肪酸結合タンパク質(FABP)は細胞内で脂肪酸の輸送に関わる(①)。脂肪酸はミトコンドリアとペルオキシソームではβ酸化によって分解されてエネルギー(ATP)を産生し(②)、細胞質内でシグナル伝達に関与し(③)、余分なものは脂肪滴に貯蔵される(④)。脂肪酸はFABPによって核内に輸送され、ペルオキシソーム増殖因子活性化受容体γ(PPARγ)のリガンドとして遺伝子転写を制御する(⑤)。
がん細胞では脂肪酸結合タンパク質(FABP)の発現が亢進しており、FABPの発現が多いほど、がん細胞の増殖や転移が促進され、患者の予後が不良であることが明らかになっています。
脂肪酸結合タンパク質7(Fatty Acid Binding Protein 7:FABP7)は脳組織に発現する脂肪酸結合タンパク質(FABP)です。特に神経幹細胞に多く発現しています。
脳腫瘍の膠芽腫では脂肪酸結合タンパク質7(FABP7)の発現が亢進しています。特にがん幹細胞にFABP7の発現量が高いことが示されています。FABP7は膠芽腫にがん幹細胞のマーカーとして使用されています。
FABP7の発現の多い膠芽腫は予後不良であることが報告されています。123例の膠芽腫においてFABP7の発現を検討した研究が報告されています。FABP7の発現が認めない症例の生存期間の平均が21.5ヶ月に対して、FABP7の発現が認められた症例の生存期間の平均は15.7ヶ月で、FABP7の発現は生存期間の短縮と関連していました。FABP7の細胞核での発現は、上皮成長因子受容体(EGFR)の増幅と浸潤性の亢進と関連していました。
つまり、FABP7の発現、特にFABP7の細胞核での発現は、膠芽腫細胞のEGFR増幅と浸潤亢進と間者の予後不良と関連している可能性が示されました。(以下の論文)
FABP7 expression in glioblastomas: relation to prognosis, invasion and EGFR status.(神経膠芽腫における FABP7 発現: 予後、浸潤および EGFR 状態との関係)J Neurooncol. 2007 Sep;84(3):245-8
FABP7 の高発現は、神経膠腫の血管新生を促進し、神経膠腫患者の予後不良と関連していることが示されました。神経膠腫の予後および血管新生阻害薬の有効性を予測するための潜在的なバイオマーカーとしてFABP7が同定されています。(以下の論文)
Identification of FABP7 as a Potential Biomarker for Predicting Prognosis and Antiangiogenic Drug Efficacy of Glioma(神経膠腫の予後および血管新生阻害薬の有効性を予測するための潜在的なバイオマーカーとしての FABP7 の同定)Dis Markers. 2022; 2022: 2091791.
【ドコサヘキサエン酸は脂肪酸結合タンパク質7と結合して核内に移動する】
膠芽腫幹様細胞は脂質代謝が亢進しており、脂肪酸結合タンパク質7 (FABP7)、脂肪酸輸送体 CD36、アシルCoA結合タンパク質 (ACBP)などの脂質代謝の重要な要素は全て、膠芽腫神経幹様細胞で高度に発現していることが報告されており、脂質代謝の重要性が強調されています。
成人の脳は、脂質、特に長鎖多価不飽和脂肪酸が非常に豊富です。脳内の主な2種類の長鎖多価不飽和脂肪酸は、ω-6系 のアラキドン酸と ω-3 系のドコサヘキサエン酸 (DHA) です。
DHA とアラキドン酸 は、がんにおいて相反する役割を果たしていると考えられています。
アラキドン酸は、プロスタグランジン E2 (PGE2) などの ω-6 シリーズのエイコサノイドの前駆体であり、炎症、がん細胞の増殖および浸潤を刺激します。対照的に、DHA はプロテクチンとレゾルビンの前駆体であり、炎症を解消し、がん細胞の増殖を抑制します。
健康な成人の脳では、多価不飽和脂肪酸におけるオメガ6系とオメガ3系のバランスが厳密に制御されており、DHAレベルは総脂質と総リン脂質の両方でアラキドン酸 レベルを超えています。
しかし、ヒト膠芽腫組織では、アラキドン酸のレベルは健康な脳組織と同様のままですが、DHAレベルは50%程度減少し、DHA:アラキドン酸の比率は大幅に低下しています。(下記の文献)
The fatty acid composition of human gliomas differs from that found in nonmalignant brain tissue.(ヒト神経膠腫の脂肪酸組成は、正常な脳組織に見られるものとは異なる)Lipids. 1996 Dec;31(12):1283-8.
膠芽腫細胞へのDHAの補給は細胞増殖と移動を阻害し、アポトーシスを誘導します。さらにDHAは膠芽腫細胞の放射線感受性を高めることが報告されています。
脳の脂肪酸結合タンパク質のFABP7は、通常は胎児の脳の発生中に神経幹細胞で発現され、膠芽腫の幹細胞でも発現が亢進しています。FABP7は膠芽腫が周囲組織に浸潤している部分で発現が亢進しており、FABP7の発現は膠芽腫細胞の遊走・浸潤の増加と相関することが報告されています。
ラットの脳に膠芽腫細胞を移植する実験モデルで、ドコサヘキサンエン酸(DHA)が豊富な食餌を与えたラットは、対照食のラットと比較して、膠芽腫細胞中のDHAが増加し、DHA対アラキドン酸の比率が増加しました。がん細胞内でのDHAの増加はFABP7に依存して膠芽腫の増殖を抑制しました。
FABP7 は神経膠芽腫の神経幹様細胞におけるドコサヘキサエン酸(DHA)の取り込みを促進することが報告されています。DHA投与は、膠芽腫神経幹様細胞の DHAの量とDHA:アラキドン酸比を増加させ、FABP7 がDHAの取り込みを促進しました。また、DHAの取り込みが増加すると、膠芽腫神経幹様細胞の移動がFABP依存性に阻害されました。(以下の論文)
FABP7 Facilitates Uptake of Docosahexaenoic Acid in Glioblastoma Neural Stem-like Cells.(FABP7 は神経膠芽腫の神経幹様細胞におけるドコサヘキサエン酸の取り込みを促進する)Nutrients. 2021 Aug; 13(8): 2664.
「FABP7依存性」というのは、FABP7遺伝子が欠損したラットではDHAによる増殖抑制が認められなかったからです。つまり、「DHAによる膠芽腫幹様細胞の増殖・遊走の阻害は、FABP7発現に依存する」ということです。
膠芽腫においてFABP7の発現は増殖や浸潤や遊走を促進するので、予後不良のマーカーとなっています。しかし、ドコサヘキサエン酸(DHA)を多く摂取すると、このFABP7の発現が多いほど、増殖や遊走や浸潤が抑えられるということです。DHA の取り込みが膠芽腫神経幹様細胞の移動の阻害につながるのは FABP7 が存在する場合のみであることを示しています。
以上の実験結果から、ドコサヘキサエン酸(DHA)を多く摂取することは、膠芽腫の増殖と遊走・浸潤を抑制できることになります。ただし、この抑制作用は、脂肪酸結合タンパク質に対するDHAとアラキドン酸の比率に依存します。DHAの摂取量が多くてもアラキドン酸の摂取量が多ければ、DHAによるFABP7依存性の増殖抑制効果は得られないといえます。
オメガ6系多価不飽和脂肪酸(リノール酸、アラキドン酸)の摂取を減らし、DHAを多く摂取する食事は膠芽腫の増殖や再発の抑制に有効と思います。(図)
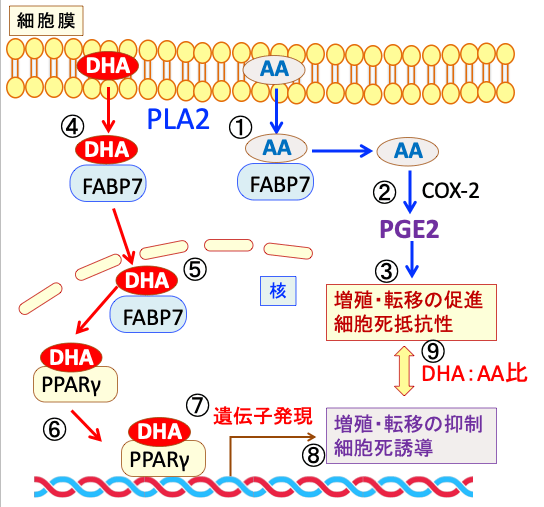
図:ホスホリパーゼA2(PLA2)によって細胞膜から切り離されたアラキドン酸(AA)は細胞質内で脂肪酸結合タンパク質7(FABP7)と結合して細胞質内を移動し(①)、シクロオキシゲナーゼ-2(COX-2)によってプロスタグランジンA2(PGE2)に変換され(②)、PGE2はがん細胞の増植・転移を促進し、細胞死に抵抗性にする(③)。一方、ドコサヘキサエン酸(DHA)はPLA2によって細胞膜から遊離したあとFABP7と結合し(④)、細胞核内に移動し(⑤)、ペルオキシソーム増殖因子活性化受容体γ(PPARγ)と結合し(⑥)、遺伝子の転写調節領域に結合して遺伝子発現を誘導する(⑦)。その結果、がん細胞の増殖・転移を抑制し、細胞死を誘導する(⑧)。がん細胞の増殖や細胞死に対する作用は、細胞膜中のDHAとAAの比率に依存することになる(⑨)。
【ドコサヘキサエン酸(DHA)はがん細胞のフェロトーシスを促進する】
鉄はイオンの価数が変化する遷移金属で、簡単に二価イオン(Fe2+)と三価イオン(Fe3+)の両方の型を行き来するので、電子の移動を伴う生体反応に利用できます。鉄イオンは細胞の呼吸、核酸合成、増殖などに必須な補助因子として重要な役割を果たしています。したがって、がん細胞は鉄の需要が増え、鉄の取込みが増えています。
鉄は様々な生体反応に必須の物質ですが、過剰になると活性酸素発生の触媒作用を発揮することによって細胞の酸化傷害を引き起こします。 2価のフリーの鉄は過酸化水素(H2O2)と反応してより有毒なヒドロキシルラジカルを生じ、DNA障害、脂質酸化、細胞死などを引き起こします。
がん細胞内に過剰な2価鉄イオンが存在することを利用して、がん細胞を死滅させる治療が注目されています。がん細胞にはフリーの2価鉄が蓄積しているので、過酸化水素(H2O2)と反応して酸化作用の強いヒドロキシルラジカル(・OH)を発生させ、さらに脂質と反応して脂質ラジカルを発生させて強い細胞傷害を引き起こします。
鉄が関与する細胞死をフェロトーシス(ferroprosis)と言います。フェロトーシスは、鉄依存的な活性酸素種の発生と過酸化した脂質の蓄積によって細胞死が起こります。細胞内の鉄に依存する細胞死であり、他の金属類には依存しません。「フェロ(Ferro)」は「鉄」という意味です。

図:がん細胞はトランスフェリン受容体の発現が増加し、鉄の取り込みが増えている。細胞内の鉄は活性酸素種の産生を増やし、細胞膜の脂質を過酸化して細胞膜を傷害し、細胞膜を破綻して細胞死を誘導する。この細胞死をフェロトーシスという。
がん細胞は細胞分裂をして数を増やし、増殖します。細胞数を増やすために、細胞膜に使う脂肪酸の合成が亢進しています。さらに、がん細胞は自分で作った脂肪酸以外に、食事から摂取して血液中に存在する脂肪酸を積極的に取り込んで、細胞膜の合成に使います。食事からのDHAやEPAの摂取を増やすと、がん細胞の細胞膜にDHAやEPAが多く取り込まれます。
DHAは二重結合が6個存在する多価不飽和脂肪酸です。不飽和脂肪酸は酸化されて過酸化脂質になります。DHAは酸化されやすいので、鉄を多く含み、活性酸素の産生が増加しているがん細胞では、DHAは過酸化脂質を増やし、細胞膜の酸化傷害を増強します。つまり、DHAを多く取り込んだがん細胞はフェロトーシスが起こりやすくなるのです。
放射線治療や多くの抗がん剤は、がん細胞に活性酸素を産生してフェロトーシスで最終的に死滅することが明らかになっています。したがって、食事からのDHAの摂取を増やすと、放射線や抗がん剤による細胞死を起こしやすくなります。(図)

図:食事(①)からのドコサヘキサエン酸(DHA)は細胞膜に取り込まれる(②)。多価不飽和脂肪酸は酸化を受けやすいので、がん細胞内で鉄介在性に活性酸素の産生が高まると(③)、脂質の過酸化によって細胞は酸化傷害を受け(④)、フェロトーシスの機序で死滅する(⑤)。抗がん剤、放射線照射はがん細胞に比較的選択的にフェロトーシスを誘導する(⑥)。食事からのDHAの摂取量を増やすと、がん細胞のフェロトーシスを増強できる。(赤丸印は活性酸素による脂質酸化を示す。多価不飽和脂肪酸は酸化を受けやすいことを示している。)
【脂肪酸の不飽和結合が多いほど融点が低くなる】
脂肪酸は、構造の違いにより「飽和脂肪酸」と「不飽和脂肪酸」の2種類に分類できます。パルミチン酸(炭素数16)やステアリン酸(炭素数18)のように炭素と炭素の間に二重結合が全くない脂肪酸を飽和脂肪酸といい、二重結合がある脂肪酸を不飽和脂肪酸といいます。一般に、脂肪酸は炭素の数が多くなるほど融点(固体から液体に変化する温度)が高くなります。また、同じ炭素数の脂肪酸を比較した場合、二重結合の数が多くなるほど融点が低くなります。
炭素原子は、他の原子と結合できる手を4本持っています。炭素-炭素二重結合とは、2つの炭素原子どうしが互いに2本の手でつながっている状態のことをいい、「C=C」で表記します。
分子が接近すると分子間に引力のような力が働きます。この分子間引力をファンデルワールス力(van der Waals force)といいます。ファンデルワールス力は、分子間の距離が近づくほど強くなります。
飽和脂肪酸は炭素原子が直鎖状に並びます。まっすぐな棒状の構造なので、たくさんの分子が集まると、鉛筆を束ねた構造になります。したがって、ぎゅぎゅう詰めになるので、分子が動きにくくなり固体となります。ファンデルワールス力が強く働いて分子間の結合が強固になるためです。液体にするには熱を加え加えなければなりません。したがって、融点が高くなります。
一方、不飽和脂肪酸は二重結合の部分でくの字に曲がった構造になります。分子が曲がっているため、分子を束ねると隙間の多い構造になり、分子間のファンデルワールス力は弱くなります。その結果、分子は動き回ることができ、融点が低下して液体になります。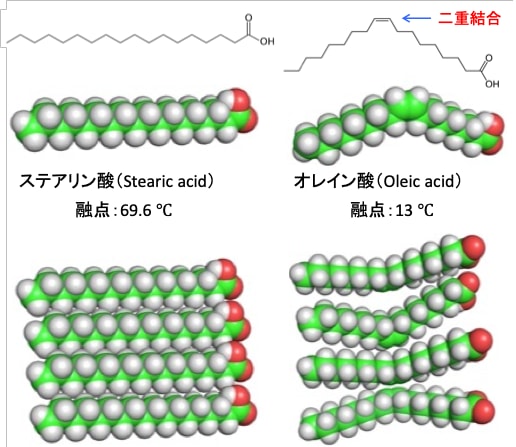
図:脂肪酸のステアリン酸とオレイン酸は、どちらも18個の炭素原子で構成される。ステアリン酸は炭素結合が全て飽和しているが、オレイン酸は不飽和脂肪酸であり、1つのシス二重結合を含んでいる。ファンデルワールス力による分子間の引力による結合はステアリン酸の方がオレイン酸よりはるかに強くなる。その結果、ステアリン酸の融点は69.9 ℃であり、オレイン酸の13℃の融点よりも高くなっている。不飽和脂肪酸が豊富な細胞膜は、飽和脂肪酸が豊富な膜よりも流動性が高くなる。
脂肪は、それを構成している脂肪酸の構造の違いによって融点などの化学的性状が異なってきます。二重結合をもつ不飽和脂肪酸の多い脂肪は常温で液状になりますが、飽和脂肪酸になると固まりやすくなります。飽和脂肪酸の多いラードやバターや肉の脂は常温で固体になります。植物油や魚油が液体なのは不飽和脂肪酸が多いからです。
細胞膜は流動性を持ち、脂質や膜タンパク質は動いています。この流動性は膜の構成物質で決まります。特にリン脂質を構成する脂肪酸の不飽和度(二重結合の数)に影響されます。不飽和度が高まるほど脂肪酸の融点は低くなるためです。つまり、不飽和脂肪酸を多く含む細胞膜は流動性が高まります。
魚油はオメガ3系不飽和脂肪酸のドコサヘキサエン酸(DHA)とエイコサペンタエン酸(EPA)が多いのですが、これは魚がDHAやEPAを合成しているわけではありません。DHAとEPAは微細藻類から由来します。つまり、ある種の微細藻類がDHAやEPAを合成し、それをプランクトンが食べ、プランクトンを小型魚が食べ、小型の魚が大型の魚(マグロ、カツオなど)に食べられるという食物連鎖によって大型魚にDHAとEPAが多く含まれることになります。それを人間が食べています。

図:ドコサヘキサエン酸(①)は魚が作っているのではなく、微細藻類が産生している(②)。ドコサヘキサエン酸(DHA)は食物連鎖で魚に蓄積し(③)、人間は魚を食べてDHAを摂取している(④)。
温度が低下する海の中では、飽和脂肪酸が多い細胞膜は流動性が低下します。藻類が高度多価不飽和脂肪酸を合成しているのは、低温の環境でも細胞膜の流動性を維持するためと考えられています。実際、近年の気候温暖化に伴って海水の温度が上昇しているのに比例して海洋中のDHAとEPAの産生量が減少しているという研究結果が報告されています。
【脂質ラフトはシグナル分子間の相互作用のプラットフォームとして働いている】
細胞膜はリン脂質を基本成分とする油の膜(脂質二重層)から成り、そこに膜タンパク質が挿入されて出来ています。細胞膜は流動的で、膜タンパク質は生体膜上をダイナミックに移動しています。

図:細胞膜は脂質の二重膜の海に、膜タンパク質が氷山のように頭を少し出して浮かんだような構造をしている。この構造モデルを流動モザイクモデル(fluid mosaic model)と呼んでいる。
細胞外から細胞内へのシグナル伝達は細胞表面でランダムに発生しているのではありません。シグナルを受け取り、細胞内に効率良くシグナルを伝達するためのネットワークのプラットフォームや中継基地のような構造が存在します。
細胞膜は均一な構造体ではなく、ところどころに分子の集合体を作っています。このように分子が集まった微小領域を膜マイクロドメイン、あるいは脂質ラフト(lipid raft)と言います。
ラフト(Raft)とは筏(いかだ)のことで、細胞膜中に特定の脂質(スフィンゴミエリンやコレステロールなど)とタンパク質(受容体など)が集合した領域(構造)が脂質ラフトです。脂質ラフトはステロールとスフィンゴ脂質に富んだ10-200 nmサイズの小さく不均一で非常に動的なドメインであり、細胞機能のコンパートメント化(区画化)を担っています。
脂質ラフトの部分はコレステロールや飽和脂肪酸が多く、膜の流動性が低下し、海に浮かぶ筏のような構造物を提供し、プラットホームや中継基地のような機能を担っています。
脂質ラフト(膜マイクロドメイン)は膜の内外のシグナル伝達や物質輸送などで重要な役割を果たしています。(下図)

図:細胞膜の脂質分布は均質ではなく、一部の脂質は限局したドメイン(区画)を形成している。これを流動膜に浮かぶ筏(いかだ)になぞらえて脂質ラフトと呼ぶ。脂質ラフトの脂質およびタンパク質組成は周囲の細胞膜とは異なり、コレステロールやスフィンゴ脂質が多く、流動性が低下し、シグナル伝達タンパク質のプラットフォームおよびハブとして機能する。脂質ラフトにはシグナル伝達系のタンパク質が集合し、シグナル分子間の相互作用の場として働いている。
細胞膜の脂質ラフト上に受容体などの機能性物質が集合することにより、シグナル伝達や物質輸送の窓口として機能しています。シグナル伝達において複数の分子が連続して作用する場合、それらの分子を一箇所に集めることにより、それらの分子が相互作用する確率を高め、一連の反応を速やかに行うことができます。
たとえば、がん細胞ではインスリン様成長因子 I (IGF-I)/ホスファチジルイノシトール 3-キナーゼ (PI3K)/Akt シグナル伝達系の活性が亢進しています。IGF-1がPI3K(PI3キナーゼ)を活性化してAkt (プロテインキナーゼBまたはPKBとしても知られている)をリン酸化して活性化します。
Akt はセリン/スレオニンキナーゼです。多くのシグナル伝達経路のネットワークの中心的存在で、下流の幅広いターゲット分子や相互作用分子を介してさまざまな細胞内反応を引き起こします。がん細胞においてはAktの活性化はがん細胞の増殖・転移を亢進し、アポトーシスに抵抗性にします。
このIGF-1/PI3K/Aktに関与する受容体やタンパク質は脂質ラフトに集まって、効率良くシグナル伝達を行なっています。(図)

図:インスリン様成長因子-1(IGF-1)はIGF-1受容体(IGF-1R)に結合すると、PI3キナーゼ(PI3K)というリン酸化酵素が活性化される。PI3Kは細胞膜の構成成分であるイノシトールリン脂質をリン酸化する酵素でp80とp110の2つのサブユニットから構成されている。PI3Kはホスファチジルイノシトール4,5-二リン酸(PIP2)の3位のOHをリン酸化してホスファチジルイノシトール3,4,5-三リン酸(PIP3)を生成する。生成したPIP3がAktをリン酸化して活性化する。活性化したAktは、細胞内のシグナル伝達に関与する様々なタンパク質の活性を調節することによって細胞の増殖や生存(あるいは死)の調節を行う。がん細胞においてはAktの活性化はがん細胞の増殖・転移を亢進し、アポトーシスに抵抗性にする。IGF-1、IGF-1R、PI3K、PIP2、PIP3、Aktのタンパク質は脂質ラフトに集合して、シグナル伝達を効率化している。
【ドコサヘキサエン酸は脂質ラフトの性状を変えて、抗腫瘍効果を発揮する】
がん細胞は細胞分裂をして数を増やし、増殖します。細胞数を増やすために、細胞膜に使う脂肪酸の合成が亢進しています。さらに、がん細胞は自分で作った脂肪酸以外に、食事から摂取して血液中に存在する脂肪酸を積極的に取り込んで、細胞膜の合成に使います。食事からのDHAやEPAの摂取を増やすと、がん細胞の細胞膜にDHAやEPAが多く取り込まれます。
がん細胞の細胞膜に取り込まれたDHAやEPAががん細胞の脂質ラフトの性状を変えることによって、がん細胞の増殖を抑制し、細胞死を誘導する作用が報告されています。
がん細胞を使った実験で、ドコサヘキサエン酸(DHA)やエイコサペンタエン酸(EPA)を投与すると、脂質ラフトのコレステロールとスフィンゴミエリンの含有量が減少し、脂質ラフト自体が減少することが報告されています。
つまり、DHAやEPAは脂質ラフトの生物物理学的特性を変化させ、増殖シグナルの伝達系を抑制し、がん細胞の増殖を抑制し、細胞死を誘導することが報告されています(以下の文献)。
Chemical-physical changes in cell membrane microdomains of breast cancer cells after omega-3 PUFA incorporation. Cell Biochem Biophys. 2012 Sep;64(1):45-59.
【コレステロールはがん細胞の増殖を促進する】
がん細胞は、正常細胞よりも高レベルの細胞内コレステロールと脂質ラフトを含んでいます。がん細胞内のコレステロールが高いほど悪性度が高いという報告があります。
多くの実験系で、高脂肪や高コレステロールの食餌ががんの発生や増殖を促進することがマウスの実験で示されています。このような実験で、脂肪の量を増やさずにコレステロールだけを増やした食餌を与えるとがんの発生と増殖が促進されることから、コレステロール自体にがんを促進する作用があると考えられています。これは、高脂肪・高コレステロール食による発がん促進作用が、コレステロールの合成を阻害する薬剤(スタチン)によって阻止されることからも支持されています。
このように、コレステロールががんの発生や増殖を促進することが多くの研究で示されています。前述のように、細胞膜でコレステロールが増えると、細胞膜の流動性に影響し、さらに脂質ラフトの構造にも影響して、その結果、シグナル伝達系にも影響する可能性が指摘されています。
DHAやEPAを多く摂取すると、脂質ラフトのコレステロールの量を減らし、がん細胞の脂質ラフトとそこに分布する増殖関連タンパク質を減らすことができるので、がん細胞の増殖を抑制する効果を発揮することができるのです。

図:細胞膜の脂質分布は均質ではなく、一部の脂質は限局したドメイン(領域)を形成しており、脂質ラフトと呼ぶ(①)。脂質ラフトはコレステロールやスフィンゴ脂質が多く、流動性が低下し、シグナル伝達タンパク質のプラットフォームおよびハブとして機能する(②)。脂質ラフトにはシグナル伝達系のタンパク質が集合し、シグナル分子間の相互作用の場として働いている(③)。ドコサヘキサエン酸は脂質ラフトのコレステロールを減らし、脂質ラフトを減少してがん細胞の増殖シグナル伝達系の活性を低下させる(④)。
【ドコサヘキサエン酸は上皮成長因子受容体シグナル伝達を抑制する】
上皮成長因子受容体(Epidermal Growth Factor Receptor; EGFR)は、細胞膜を貫通して存在する分子量170キロダルトンの糖タンパク質で、チロシンキナーゼ型受容体の一種です。細胞外(血液や体液中)にある成長因子(EGFやTGF-αなど)のシグナルを細胞内に伝える働きをします。
EGFRは621個のアミノ酸から構成される細胞外領域(リガンド結合ドメイン)、23個のアミノ酸の膜貫通領域、542個のアミノ酸の細胞内領域(チロシンキナーゼ・ドメイン)を持ちます。
細胞外領域に上皮成長因子(EGF)やTGF-αなどのリガンドが結合すると、受容体は細胞膜上を移動して、EGFR同士、あるいは他のErbBファミリー受容体と二量体を形成します。
二量体を形成すると、細胞内領域にあるチロシンキナーゼ部位はATP(アデノシン三リン酸)を利用して受容体の細胞内領域にあるチロシン残基を自己リン酸化します。チロシンのリン酸化が起こると、さらに細胞内のシグナル伝達系のタンパク質が次々に活性化され、増殖シグナルが核まで伝わり、増殖に関連する遺伝子の発現が起こります。その結果、細胞増殖、アポトーシス抑制、血管新生、浸潤・転移などが起こります。
細胞内で機能している多数のシグナル伝達経路の中で、がん細胞の増殖と生存で最も重要なのが、PI3K-Akt経路(生存シグナル経路)とERK-MAPK経路(増殖シグナル経路)です。(図)
細胞膜の増殖因子受容体にリガンド(増殖因子)が結合し2量体化すると、PI3Kのリン酸化活性からAktのリン酸化を通して、アポトーシス(細胞死)の誘導を阻害します。(PI3K-Akt経路)
増殖因子による刺激は、低分子量G蛋白質Rasを経由して、Raf→MEK→ERKとリン酸化反応するMAPK経路(MAPKカスケード)によりシグナルが伝達されます。活性化したERKは最終的に核へ移行し、転写因子が活性化され、細胞増殖関連の遺伝子が発現します。(ERK-MAPK 経路)

図:チロシンリン酸化型受容体の上皮成長因子受容体(EGFR)にリガンド(EGFやTGF-α)が結合し2量体化すると(①)、受容体が自己リン酸化されて活性化する(②)。受容体が活性化されるとPI3Kのリン酸化活性からAktがリン酸化されて活性化する(PI3K/Akt経路 ③)。一方、受容体の活性化は、低分子量G蛋白質Rasを経由して、Raf→MEK→ERKとリン酸化反応するMAPK経路によりシグナルが伝達される(④)。PI3K/Akt経路とMAPK経路の活性化は、最終的に核の転写因子の活性化を介して、がん細胞の増殖や転移を亢進し、アポトーシスに抵抗性(死ににくくなる)の性質を持つようになる(⑤)。
EGFRは正常組織において細胞の分化や増殖の調節に重要な役割を演じていますが、このEGFRに遺伝子異常(増幅や変異や構造変化)や過剰発現が起きると、PI3K/Akt経路とMAPK経路が恒常的に活性化し、細胞のがん化や、増殖、浸潤、転移などに関与するようになります。
つまり、細胞内のEGFRの遺伝子に変異をきたすと成長因子と結合しなくても、細胞を増殖させるシグナルが常にスイッチがオンの状態となり、細胞分裂が止まらなくなり、がん細胞が無制限に増殖するようになります。
実際に多くのがんで上皮成長因子受容体(EGFR)遺伝子の変異や過剰発現が認められています。EGFR遺伝子の変異を持つがんは、EGFRのチロシンキナーゼ活性を阻害する薬が有効な治療薬となります。
ドコサヘキサエン酸(DHA)はEGFR シグナル伝達を抑制することが報告されています。その作用メカニズムとして、DHAが脂質ラフトに多く取り込まれると、EGFRシグナル伝達系に影響を与えるためと考えられています。DHAは22 個の炭素と 6 個の二重結合を持ち、人間の膜に一般的に見られる最も長く、最も不飽和な脂肪酸です。このユニークな生物物理学的特徴が、細胞膜や脂質ラフトの機能に影響する可能性が指摘されています。(下記の論文)
Membrane therapy using DHA suppresses epidermal growth factor receptor signaling by disrupting nanocluster formation.(DHA を使用した膜療法は、ナノクラスター形成を妨害することにより、上皮成長因子受容体シグナル伝達を抑制する) J Lipid Res. 2021; 62: 100026.
【ドコサヘキサエン酸はWnt/β-カテニンシグナル伝達経路を阻害する】
ドコサヘキサエン酸がWnt/β-カテニンシグナル伝達経路を阻害することが複数の研究グループから報告されています。
例えば、青島大学(Qingdao University)の研究グループは、マウスとヒトの乳がん細胞を用いた培養細胞の実験系で、DHAが細胞増殖を阻害し、G1期での細胞周期の停止を誘導することを明らかにしています。その作用メカニズムとして、DHAはβ-カテニンの発現およびT細胞因子/リンパ球増強因子(T cell factor/lymphoid-enhancing factor)の転写因子活性を低下させ、さらに、c-myc やサイクリン D1 などのWnt/βカテニン経路の下流に位置する標的遺伝子の発現を抑制しました。
乳がんを有するマウスを用いた動物実験では、マウスに 5% 魚油添加食餌を 30 日間与えると、腫瘍組織の β-カテニンの有意な発現抑制が誘導され、アポトーシスが顕著に増加し、マウス乳がんの成長が大幅に減少し、乳がんの肺転移を減少させました。(下記の論文)
Docosahexaenoic acid inhibited the Wnt/β-catenin pathway and suppressed breast cancer cells in vitro and in vivo(ドコサヘキサエン酸は、in vitro および in vivo で Wnt/β-カテニン経路を阻害し、乳がん細胞を抑制する)J Nutr Biochem. 2014 Feb;25(2):104-10.
韓国の忠南大学校(Chungnam National University)の研究グループは、ヒト膵臓がん細胞を用いた実験で、同様の結果を報告しています。 ドコサヘキサエン酸 (DHA) は培養細胞(in vitro)とマウスの動物実験(in vivo)の実験系で、DHAが Wnt/β-カテニン シグナル伝達経路を阻害することを報告しています。(下記の論文)
Omega-3-polyunsaturated fatty acids suppress pancreatic cancer cell growth in vitro and in vivo via downregulation of Wnt/Beta-catenin signaling(オメガ-3-多価不飽和脂肪酸は、Wnt/ベータ-カテニンシグナル伝達の抑制を介して、in vitro および in vivo で膵臓がん細胞の増殖を抑制する)Pancreatology. 2011;11(6):574-84.
これらの実験結果は、DHAがWnt/β-カテニン シグナル伝達を抑制し、c-Myc やサイクリン D1の発現の抑制を介して、抗がん作用を発揮する可能性を示唆しています。(824話参照)
【ドコサヘキサエン酸はAMPKを活性化してmTORC1を阻害してc-Myc発現を抑制する】
AMP活性化プロテインキナーゼ (AMPK)はグルコース欠乏や低酸素などにより細胞内ATP量が減少すると、AMP/ATP 比の増加に伴いAMPKが活性化されます。AMPKはmTORC1活性を抑制して、異化作用の亢進や細胞成長の停止をもたらし、エネルギー消費の抑制(同化抑制)とエネルギー産生の亢進(異化促進)へと細胞の代謝をシフトさせます。(図)

図:AMPKは触媒作用を持つαサブユニットと、調節作用を持つβサブユットとγサブユニットから構成されるヘテロ三量体として存在する(①)。運動やカロリー制限や虚血や低酸素などによってATPが減少してAMP/ATP比が上昇すると(②)、γサブユニットに結合していたATPがAMPに置換する(③)。これによってAMPKの構造変化が起こると、LKB1というリン酸化酵素の親和性が高まり、αサブユニットのスレオニン172がリン酸化されると、さらにAMPKの活性が高まる(④)。活性化したAMPKは異化を亢進してエネルギー産生を亢進し、物質合成(同化)を抑制するように代謝をシフトする(⑤)。活性化したAMPKはmTORC1(哺乳類ラパマイシン標的タンパク質複合体1)を阻害し(⑥)、がん細胞の増殖抑制や、抗老化や寿命延長の効果を引き起こす。
ポイツ・ジェガース症候群(Peutz-Jeghers syndrome)という遺伝性疾患があります。食道を除く消化管に多数のポリープを生じ、口唇、口腔粘膜、手掌、足底に特有な色素斑をみとめます。
10万人に一人くらいの発症率で、常染色体性優性の遺伝形式をとり、原因遺伝子は19番染色体短腕にあるLKB1遺伝子です。LKB1はセリン・スレオニンキナーゼで、AMP活性化プロテインキナーゼ(AMPK)をリン酸化して活性化します。つまり、LKB1はがん抑制遺伝子と言えます。
DHA(ドコサヘキサエン酸)やEPA(エイコサペンタエン酸)のようなオメガ3系多価不飽和脂肪酸がLKB1を活性化してAMP活性化プロテインキナーゼ(AMPK)のリン酸化を引き起こし、mTORシグナル伝達系を阻害することが報告されています。(以下の論文)
Omega-3 polyunsaturated fatty acid promotes the inhibition of glycolytic enzymes and mTOR signaling by regulating the tumor suppressor LKB1.(オメガ3系多価不飽和脂肪酸はがん抑制遺伝子のLKB1の制御を介して、解糖系酵素とmTORシグナル伝達系の阻害を促進する)Cancer Biol Ther. 2013 Nov 1; 14(11): 1050–1058.

図:オメガ3系多価不飽和脂肪酸のDHA(ドコサヘキサエン酸)とEPA(エコサペンタエン酸)はLKB1の活性を亢進してAMPKを活性化し、mTORC1を抑制する。
【ドコサヘキサエン酸はc-Mycタンパク質の分解を促進する】
ドコサヘキサンエン酸がc-Mycタンパク質の分解を促進することが複数の研究機関から報告されています。例えば、中国医科大学(China Medical University)から、ドコサヘキサエン酸が膵管腺がん細胞におけるc-Mycタンパク質の抑制により細胞増殖を阻害することが報告されています。
Docosahexaenoic Acid Inhibits Cell Proliferation through a Suppression of c-Myc Protein in Pancreatic Ductal Adenocarcinoma Cells(ドコサヘキサエン酸は、膵管腺がん細胞におけるc-Mycタンパク質の抑制により細胞増殖を阻害する)Antioxidants (Basel). 2021 Oct 28;10(11):1721.
培養したヒト膵管腺がん細胞にドコサヘキサエン酸(DHA)を添加すると、DHAは細胞周期の停止の誘導を介して用量依存的に細胞増殖を阻害しました。 DHAはc-Myc タンパク質の分解を促進し、多くの増殖関連タンパク質の発現を抑制しました。
同様の論文は韓国のソウル大学校( Seoul National University)からも報告されています。ドコサヘキサエン酸から生成される内因性脂質メディエーターであるレゾルビン D1は炎症の収束を促進します。レゾルビンD1が腫瘍壊死因子-α(TNFα)で刺激された正常な結腸細胞、および結腸がん細胞においてc-Mycの発現を阻害することを発見しました。レゾルビンD1はc-Mycタンパク質のユビキチン化とその後のプロテアソーム分解を刺激することにより、HCT 116 ヒト結腸がん細胞で恒常的に過剰発現した c-Myc タンパク質の分解を促進してc-Mycタンパク量を減少させました。
RvD1 inhibits TNFα-induced c-Myc expression in normal intestinal epithelial cells and destabilizes hyper-expressed c-Myc in colon cancer cells(RvD1は、正常な腸上皮細胞でTNFα誘導性のc-Myc発現を阻害し、結腸がん細胞で過剰発現したc-Mycを不安定化する)Biochem Biophys Res Commun. 2018 Feb 5;496(2):316-323.
これらの研究から、DHAはc-Mycタンパク質の分解を促進する機序などでc-Mycの活性を低下させると考えられます。
以上のように、ドコサヘキサエン酸は様々なメカニズムで抗腫瘍活性を発揮し、天然の抗がん剤と言っても過言ではないと思います。
【培養した微細藻類由来DHAが注目されている】
がん治療におけるドコサヘキサエン酸(DHA)の有効性が明らかになっています。植物油に含まれるαリノレン酸は人間の体内ではDHAにはほとんど変換されません。抗がん作用はエイコサペンタエン酸(EPA)よりドコサヘキサエン酸(DHA)の方が強いことが報告されています。
がん治療には1日3から5グラムのDHAの摂取が有効であることが多くの研究で示されています。通常の魚油の場合、DHA含有量は10%から20%程度です。1日5グラムのDHAを摂取するには25gから50gの魚油の摂取が必要になります。
そこで、微細藻類の中でもDHA含有量が極めて多いシゾキトリウム(Schizochytrium sp.)をタンク培養して製造したDHA(フランス製)を原料にした「微細藻類由来オイル(DHA含有量51%)」を製造してがん治療に使用しています。閉鎖環境での培養のため、汚染の心配がありません。しかも、植物由来なので、菜食主義者(ベジタリアン、ヴィーガン)も摂取できます。
詳細は以下のサイトで紹介しています。
http://www.f-gtc.or.jp/DHA/DHA-51.html
新刊紹介:

画像をクリックするとYouTubeの動画に移行します。
| « 835)油を変え... | 837)断酒薬の... » |





