がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
837)断酒薬のジスルフィラムは小胞体ストレスと酸化ストレスを高めてがん細胞は死滅する
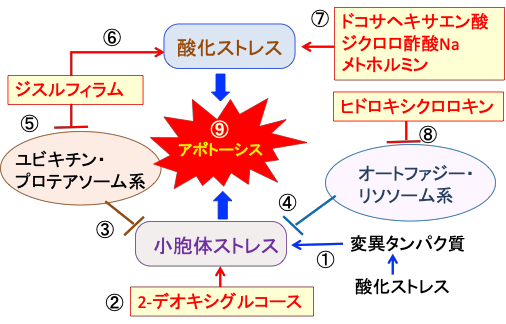
図: 酸化ストレスは変異タンパク質を増やして小胞体ストレスを亢進する(①)。2-デオキシグルコースは糖鎖異常の糖タンパク質を増やして小胞体ストレスを誘導する(②)。これに対して、ユビキチン・プロテアソーム系(③)とオートファジー・リソソーム系(④)で異常タンパク質を分解することによって小胞体ストレスを軽減する。ジスルフィラムはユビキチン・プロテアソオーム系を阻害し(⑤)、活性酸素の産生を増やして酸化ストレスを亢進する(⑥)。ドコサヘキサエン酸、ジクロロ酢酸ナトリウム、メトホルミンは酸化ストレスを高める(⑦)。ヒドロキシクロロキンはオートファジー・リソソーム系を阻害する(⑧)。これらを組み合わせると、がん細胞の小胞体ストレスと酸化ストレスが亢進して細胞死(アポトーシス)を誘導できる(⑨)。
837)断酒薬のジスルフィラムは小胞体ストレスと酸化ストレスを高めてがん細胞は死滅する
【アルコールの代謝産物のアセトアルデヒドには毒性がある】
多くのコホート研究をまとめた研究では、50gのアルコール(5%のビールで1000ml)を毎日飲むと、大腸がんの発生リスクを約40%高めることが報告されています。膵臓がんもアルコールで発がんリスクが上がることが明らかになっています。
アルコールが発がんを促進する理由は幾つかあります。例えば、アルコールが腸粘膜の透過性を亢進して発がん物質の細胞内への取込みを増やす可能性が指摘されています。
エタノールが薬剤代謝酵素のチトクローム P4502E1 (CYP2E1)の発現を誘導し、活性酸素の産生を増やすメカニズムも提唱されています。
しかし、最も有力な考えは、アルコールがアルコール脱水素酵素やCYP2E1やカタラーゼでアセトアルデヒドに変換されるからです。アセトアルデヒドはDNAと結合してDNA付加体を作ってDNA変異を引き起こしたり、様々な毒作用があります。
このアセトルデヒドを酢酸に変換する酵素がアルデヒド脱水素酵素(ALDH)です。ALDHはアルデヒド(CHO)を酸化してカルボン酸(COOH)にする反応を触媒する酵素です。
飲酒するとエチルアルコール(エタノール)はアルコール脱水素酵素でアセトアルデヒドに代謝されます。アセトアルデヒドは毒性が強く、細胞や組織にダメージを与え、二日酔いや発がんの原因になります。そこで体は、アルデヒド脱水素酵素によってアセトアルデヒドを無害な酢酸に変換しています(図)。

図:エチルアルコール(エタノール)はアルコール脱水素酵素でアセトアルデヒドに代謝され、アセトルデヒドはアルデヒド脱水素酵素によって酢酸に代謝される。
【がん幹細胞はアルデヒド脱水素酵素の発現が亢進している】
私たちの体は、一つの受精卵が分裂して分かれた胚細胞が、神経細胞や心筋細胞や肝細胞や皮膚細胞など異なった機能を持つ細胞に分化していきます。
「分化」というのは、単一あるいは同一であったものが、複雑化したり、異質化したりしていく現象で、未熟な胚細胞が異なった機能をもった細胞に成熟する過程が細胞分化です。
組織の細胞には幹細胞(stem cell)と成熟した体細胞が存在します。組織の幹細胞とは、組織固有の多分化能を有して各臓器・組織を構成する細胞の供給源となる細胞です。組織幹細胞は自己複製によって幹細胞を維持すると同時に、不均等分裂(非対称分裂)により一部が自己複製のサイクルから逸脱して成熟細胞へと分化して、組織を構成する細胞(体細胞)を作り出しています。
図:組織幹細胞は自己複製によって幹細胞を増やす(①)。幹細胞は不均等分裂(非対称分裂)を繰り返し、幹細胞自身と成熟した体細胞を作る(②)。幹細胞は多分化能を持ち、様々な細胞へ分化できる(③)。
組織幹細胞は、分裂して自分と同じ細胞を作り出すことができ(自己複製能)、いろいろな細胞に分化できる(多分化能)という二つの重要な性質を持ち、この性質により、限られた寿命のある体細胞を絶えず供給し、傷ついた組織を修復することができるのです。
がん組織においても正常組織における幹細胞システムに類似した階層性が存在し、その中にがん幹細胞と呼べるような細胞が存在して通常のがん細胞を供給しながらがん組織を構成していることが明らかになっています。
がん幹細胞(cancer stem cell)は、がん細胞を生み出すもとになる細胞であり、がん組織中に少数(数%程度)存在しています。通常の抗がん剤治療や放射線治療に対して、成熟したがん細胞は死滅しやすいのですが、がん幹細胞は様々な機序で抵抗性を示します。
がん幹細胞の生存を維持している幹細胞特性(Stemness)を阻害すると、がん幹細胞は死滅しやすくなります。がん幹細胞がいなくなれば、がんは自然消滅します。成熟がん細胞はがん幹細胞のように増殖できないため、がん組織を増大できず、時間が経てば死滅してがん組織は縮小するからです。

図:抗がん剤治療や放射線治療に対して、成熟したがん細胞が死滅しやすいが、がん幹細胞が抵抗性を示す(①)。がん幹細胞が生き残れば、がんはいずれ再燃・再発する(②)。がん幹細胞特性(幹細胞において自己複製能や多分化能といった未分化性の維持にかかわる生物学的特性)を維持しているメカニズムを阻害すると抗がん剤感受性を高めることができる(③)。がん幹細胞が死滅すれば、がん組織を消滅できる(④)。
がん幹細胞のマーカーの一つがアルデヒド脱水素酵素です。つまり、アルデヒド脱水素酵素はがん幹細胞に多く発現しています。
細胞にとってアルデヒドは毒性があるので、アルデヒドを早く代謝するためにアルデヒド脱水素酵素(ALDH)が必要なのです。この酵素の発現が多いがんほど増殖が早く予後が悪いことが報告されています。そして、ALDH活性を阻害するとがん細胞の増殖や転移を抑制でき、抗がん剤の効き目を高めることができます。
【アルデヒド脱水素酵素は抗がん剤耐性を引き起こす】
アルデヒド脱水素酵素(ALDH)が抗がん剤のシスプラチン耐性に重要な働きをしていることが複数の研究で示されています。
シスプラチンは白金錯体に分類される抗悪性腫瘍剤(抗がん剤)です。2つの塩素原子部位でDNAと結合するため、DNA鎖内に架橋が形成され、DNA複製を阻害し、細胞分裂しているがん細胞および正常細胞を死滅させます。多くの固形がんの治療に使用され、効き目は高いのですが、その作用機序から副作用が強いのも特徴です。
シスプラチンで治療していると、ほぼ確実にシスプラチン耐性のがん細胞が出現し、シスプラチンはいずれ効かなくなります。
シスプラチン感受性および耐性の非小細胞性肺がん細胞株において、シスプラチンの投与はアルデヒド脱水素酵素(ALDH)の発現の高いがん細胞集団の出現または増大を誘導し、シスプラチン耐性をさらに高める結果が報告されています。つまり、ALDHを発現しているがん細胞はシスプラチンに耐性の性質を持つので、ALDH陽性細胞が選択的に増え、シスプラチンがさらに効きにくくなるという現象が起こることを示唆しています。
図:がん組織は様々な性状のがん細胞から構成されている。シスプラチンを投与すると、多くのがん細胞は死滅するが、アルデヒド脱水素酵素(ALDH)を発現しているがん細胞(図中でALDHと記載)はシスプラチンに耐性を示して生き残る。さらにシスプラチンを投与しても、アルデヒド脱水素酵素(ALDH)の発現の高いがん細胞はシスプラチンに耐性を示すので、シスプラチン治療に生き残って増殖する。増殖したがん細胞はアルデヒド脱水素酵素陽性がん細胞(ALDH)の割合が増え、さらにシスプラチン耐性が増強される。
膵臓がん細胞のゲムシタビン耐性にもアルデヒド脱水素酵素の関与の可能性が報告されています。
ゲムシタビン(Gemcitabine)はピリミジン代謝を阻害することによって抗がん作用を発揮します。ゲムシタビンは細胞内でゲムシタビン3リン酸に代謝されてDNAに取り込まれてDNA合成を阻害し、細胞死(アポトーシス)を誘導します。進行した膵臓がんの抗がん剤治療でファーストラインの抗がん剤として単独あるいは他の抗がん剤と併用して使用されています。
しかし、膵臓がん細胞は内因性あるいは獲得性にゲムシタビンに耐性を持つことが治療効果を妨げています。したがって、このような抗がん剤耐性を阻止できれば、膵臓がんに対する抗がん剤治療の有効性を高めることができます。
耐性獲得のメカニズムとしては、薬物の取込みや代謝、細胞死や増殖に関する遺伝子の変化(死滅しにくくなる)などがあります。さらに、がん幹細胞はアルデヒド脱水素酵素活性が亢進しており、アルデヒド脱水素酵素活性を阻害すると、ゲムシタビン耐性が阻止できることが報告されています。
ゲムシタビンは細胞内で活性酸素種を増やしアポトーシスを促進します。したがって、活性酸素を消去するとゲムシタビンによる増殖抑制効果は低下します。このようにゲムシタビンの抗腫瘍効果に活性酸素種の産生亢進が関与しており、アルデヒド脱水素酵素は活性酸素の産生を減らすので、ゲムシタビンの抗腫瘍効果を低下させることになります。

図:がん組織にはがん幹細胞が少数存在する。がん幹細胞は自己複製してがん幹細胞を維持すると同時に、成熟がん細胞を供給してがん組織を構成している。抗がん剤治療に対して、成熟がん細胞は死滅しやすいが、がん幹細胞は様々な機序で抵抗性を示す。がん幹細胞が生き残れば、がんは再燃・再発する。抗がん剤治療(ゲムシタビン)を繰り返すと、ゲムシタビンに抵抗性のがん幹細胞が生き残り、がん幹細胞が増えることによって、さらにゲムシタビン抵抗性が増強し、腫瘍は増大する。がん幹細胞が過剰に発現しているアルデヒド脱水素酵素を阻害するとがん幹細胞はゲムシタビンで死滅しやすくなり、がん組織を消滅できる。
ゲムシタビン耐性だけでなく、白金製剤やタキサン系の抗がん剤に耐性の卵巣がん、多剤耐性の胃がん細胞、シクロフォスファミド耐性のヒトがん細胞などでアルデヒド脱水素酵素の発現亢進が報告されており、アルデヒド脱水素酵素は多くの種類のがん細胞における薬剤耐性の原因となっている可能性が示唆されています。
アルデヒド脱水素酵素は、乳がん、大腸がん、膵臓がん、肺がん、肝臓がん、卵巣がんなど多くの種類のがんにおいて、がん幹細胞のマーカーとして認められており、がん幹細胞において発現が亢進しています。そして、アポトーシス抵抗性や抗がん剤耐性の原因となっています。
膵臓がんだけでなく、抗がん剤治療一般において、アルデヒド脱水素酵素の阻害は、抗腫瘍効果を高める効果が期待できます。
【ジスルフィラムはアルデヒド脱水素酵素を阻害する】
ジスルフィラム(Disulfiram)は、加硫促進剤や寄生虫疾患の治療薬(軟膏)など様々な領域で利用されている汎用性の高い物質です。ゴム処理労働者や疥癬患者が、アルコール飲料を飲んだあとに極めて強い有害反応を経験することが知られ、その原因がゴム処理過程で使用する加硫促進剤や疥癬の治療薬に含まれるチウラム・ジスルフィド(thiuram disulfides)に曝露されたことによることが70年以上前に明らかになりました。この発見により、ジスルフィラムは断酒薬として有用であることが示され、アルコール中毒の治療薬として認可され、60年間以上前から処方薬として使用されています。アルコールを飲むと強い副作用が出ますが、アルコールさえ飲まなければ、ジスルフィラムは極めて副作用の少ない薬です。
アルデヒド脱水素酵素の阻害剤であるジスルフィラムはアルコールの代謝でできるアセトアルデヒドの分解を阻害することによって、アセトアルデヒドの有害な症状がでるので、アルコールを飲めなくするのです。 ジスルフィラムはALDHの多くのアイソフォームを不可逆的に阻害します。
図:エチルアルコール(エタノール)はアルコール脱水素酵素でアセトアルデヒドに代謝され、アセトルデヒドはアルデヒド脱水素酵素によって酢酸に代謝される。ジスルフィラムはアルデヒド脱水素酵素を阻害する。アセトアルデヒドは毒性が強いので、細胞や組織にダメージを与える。
ジスルフィラムを経口摂取すると、消化管内および血液内で1分子のジスルフィラムは2分子のジエチルジチオカルバミン酸(diethyldithiocarbamate)に速やかに変換され、さらにジエチルチオカルバミン酸メチルエステル・スルホキシド(diethylthiocarbamic acid methyl ester sulfoxide)に代謝されます。
ジスルフィラムのこの代謝物(ジエチルチオカルバミン酸メチルエステル・スルホキシド)は、アルデヒド脱水素酵素(aldehyde dehydrogenase:ALDH)の酵素活性部位のスルフヒドリル基(-SH)と反応してALDHの酵素活性を強力に阻害する作用があります(図)。
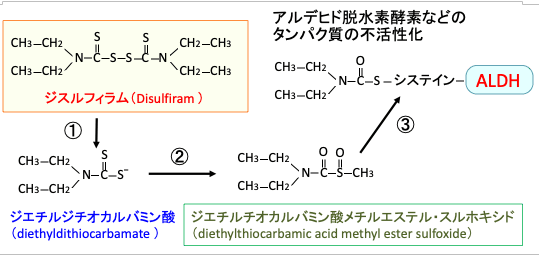
図:ジスルフィラムを経口摂取すると、消化管内および血液内で1分子のジスルフィラムは2分子のジエチルジチオカルバミン酸(diethyldithiocarbamate)に変換される(①)。ジエチルジチオカルバミン酸は、さらにジエチルチオカルバミン酸メチルエステル・スルホキシド(diethylthiocarbamic acid methyl ester sulfoxide)に代謝される(②)。ジエチルチオカルバミン酸メチルエステル・スルホキシドは、アルデヒド脱水素酵素(aldehyde dehydrogenase:ALDH)の酵素活性部位のシステインのスルフヒドリル基(-SH)と反応してALDHに結合し、ALDHの酵素活性を阻害する。
【ジスルフィラムはがん細胞の酸化ストレスを高める】
ジスルフィラムはタンパク質のシステインに反応して活性を阻害する機序によって、アルデヒド脱水素酵素だけでなく、プロテインキナーゼCやP糖蛋白質やDNAメチルトランスフェラーゼなど様々ながん促進性のタンパク質を阻害します。
ジスルフィラムの代謝物は銅イオンや亜鉛イオンと複合体を形成するため、細胞内の重金属イオンの貯蔵量を減らし、その結果、スーパーオキシド・ディスムターゼ(酸化ストレスから細胞を保護する)やマトリックス・メタロプロテイナーゼ(がん細胞の浸潤や転移を促進する)のような酵素活性に亜鉛や銅が必須の酵素の活性を阻害する作用があります。
ジスルフィラムの抗腫瘍効果は二価重金属の存在下で強く現れます。がん細胞内には正常細胞よりもこのような二価の重金属(銅や亜鉛)が多く存在するので、ジスルフィラムの毒性はがん細胞に強くでます。
ジスルフィラムと銅イオンの複合体内における一価の銅イオンCu(I)と二価の銅イオンCu(II)の酸化還元サイクルは、グルタチオンの酸化と過酸化水素の産生を引き起こし、細胞内の酸化ストレスを高めることになります。
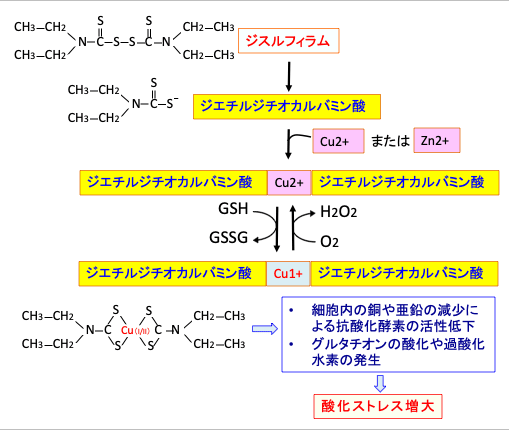
図:ジスルフィラムの代謝産物のジエチルジチオカルバミン酸は二価の重金属(銅や亜鉛)と複合体を形成する。その結果、細胞内の重金属イオンの貯蔵量を減らし、酵素活性に亜鉛や銅が必須の酵素の活性を阻害する作用がある。また、ジスルフィラムと銅イオンの複合体内における一価の銅イオンCu(I)と二価の銅イオンCu(II)の酸化還元サイクルは、グルタチオン(GSH)の酸化と過酸化水素(H2O2)の産生を引き起こし、細胞内の酸化ストレスを高める。がん細胞内には正常細胞よりもこのような二価の重金属が多く存在するので、ジスルフィラムの毒性はがん細胞に強く出る。
【ジスルフィラムは小胞体ストレスを亢進してアポトーシスを誘導する】
小胞体ストレス(Endoplasmic reticulum stress)とは、正常な高次構造にフォールディング(折り畳み)されなかったタンパク質(変性タンパク質; unfolded protein)が小胞体に蓄積し、それにより細胞への悪影響(ストレス)が生じることす。
小胞体ストレスは細胞の正常な生理機能を妨げるため、細胞にはその障害を回避し、恒常性を維持する仕組みが備わっています。この小胞体ストレスに対する細胞の反応を小胞体ストレス応答(unfolded protein response:UPR)といいますが、変性タンパク質が過剰に蓄積し、小胞体ストレスの強さが細胞の回避機能を越えると、細胞死(アポトーシス)が誘導されます。
ジスルフィラムは小胞体ストレスを亢進してがん細胞のアポトーシスを誘導する作用が指摘されています。以下のような論文があります。
Induction of autophagy-dependent apoptosis in cancer cells through activation of ER stress: an uncovered anti-cancer mechanism by anti-alcoholism drug disulfiram.(小胞体ストレスの活性化によるがん細胞のオートファジー依存性アポトーシスの誘導:アルコール中毒治療薬ジスルフィラムによる新規の抗がんメカニズム)Am J Cancer Res. 2019 Jun 1;9(6):1266-1281.
この論文では、ジスルフィラムの抗がん作用の新規のメカニズムとして、小胞体ストレスの誘導を報告しています。強い小胞体ストレスが長期間持続すると細胞は死滅するということです。

図:リボソームで合成されたタンパク質は小胞体で折り畳みや翻訳語修飾を受けて正常な機能を持ったタンパク質になる(①)。小胞体内で折り畳み不全のタンパク質が増えると小胞体ストレスを引き起こし(②)、小胞体ストレスが亢進すると異常タンパク質の凝集と蓄積によって(③)、細胞死(アポトーシス)が起こる(④)。細胞はオートファジー(⑤)とユビキチン・プロテアソーム系(⑥)で異常タンパク質を分解することによって小胞体ストレスを軽減する。ジスルフィラムはプロテアソームでのタンパク分解を阻害する(⑦)。さらに、ジスルフィラムは活性酸素の産生を増やし(⑧)、酸化ストレスを亢進して変異タンパク質を増やし(⑨)、さらに細胞死を促進する(⑩)。
がん細胞は、正常な細胞に比べてストレスの多い状況で生きています。それは、低酸素や低グルコースや異常タンパク質の蓄積や活性酸素の産生増加などによって細胞内でストレスの高い状況が起こっているのです。
ストレスの代表が小胞体ストレスと酸化ストレスです。
この小胞体ストレスと酸化ストレスをがん細胞に特異的に高めることによってがん細胞を選択的に死滅させようという治療法が注目されています。
抗がん剤治療や放射線治療は、がん細胞に小胞体ストレスや酸化ストレスを高めて死滅させます。これに対して、がん細胞や小胞体ストレス応答や抗酸化システムを亢進して対抗します。
がん細胞の抵抗(小胞体ストレス応答や抗酸化システム)を阻害すると、抗がん剤治療や放射線治療の効果を高めることができます。(下図)

図:がん組織内ではがん細胞は低酸素や低グルコースによるストレスを受け、さらに抗がん剤や放射線もがん細胞にダメージを与える(①)。その結果、がん細胞は異常タンパク質や活性酸素種の産生増加と蓄積によって、小胞体ストレスと酸化ストレスを受ける(②)。これに対して、がん細胞は小胞体ストレス応答、抗酸化システム、オートファジーやプロテアソームにおけるタンパク質分解などのメカニズムで細胞内ストレスに対して応答して、生存を維持しようとする(③)。このバランスが崩れて、小胞体ストレスおよび酸化ストレスが増強すると、細胞傷害の増大によって細胞死(アポトーシス)が起こる(④)。2-デオキシグルコース、メトホルミン、ジスルフィラム、ジクロロ酢酸ナトリウム、ヒドロキシクロロキンは小胞体ストレス応答や抗酸化システムやオートファジーやプロテアソームを阻害することによってストレス応答を阻害する(⑤)。さらに、異常タンパク質や活性酸素の蓄積を亢進して小胞体ストレスと酸化ストレスを亢進する(⑥)。がん細胞内のストレスを増強し、ストレス応答による恒常性維持機構を破綻させると、がん細胞を死滅できる。
ジスルフィラムは日本ではノックビンという製品名で処方箋医薬品として使用されています。私は海外から錠剤(250mg)の製剤を医師の個人輸入でがん治療に使用しています。
飲酒することが全く無く、溶解液にアルコールを使用した抗がん剤(パクリタキセルなど)を使用する可能性が無い場合はジスルフィラムを試してみる価値はあります。
その場合、ジスルフィラムの抗腫瘍効果を高める治療を併用すると、がんを縮小できます。
【ジスルフィラムとドコサヘキサエン酸は相乗的な抗がん作用を示す】
魚油に含まれるω3系不飽和脂肪酸のドコサヘキサエン酸(DHA)はジスルフィラムの抗がん作用を増強することが報告されています。以下のような報告があります。
Docosahexaenoic acid and disulfiram act in concert to kill cancer cells: a mutual enhancement of their anticancer actions. (ドコサヘキサエン酸とジスルフィラムは協調して作用してがん細胞を殺す:それぞれの抗がん作用を相互に増強する)Oncotarget. 2017 Mar 14;8(11):17908-17920.
【要旨】
我々はこれまで、ヒト癌細胞におけるクリオキノール(clioquinol)とドコサヘキサエン酸(docosahexaenoic acid:DHA)の相乗的な抗がん作用を報告してきた。しかし、クリオキノールはその神経毒性のために臨床使用が禁止されている。
この研究では、DHAと協働して、がん細胞をより効果的に殺し、腫瘍増殖を抑制する物質として、ジスルフィラムをクリオキノールの代替化合物として同定した。
ジスルフィラムとDHAによる同時投与は、単独で使用されたジスルフィラムおよびDHAの抗腫瘍効果と比較して、より大きなアポトーシス細胞死およびインビトロおよびインビボでの腫瘍増殖の抑制を誘導した。
作用機序の研究では、Nrf2媒介性ヘムオキシゲナーゼ1(HO-1)遺伝子転写の亢進によって証明されるように、ジスルフィラムがDHA誘導性酸化ストレスを増強することを示した。
他方、腫瘍塊形成能およびがん幹細胞数のジスルフィラム誘発性の抑制をDHAが増強することが判明し、がん幹細胞の変化がジスルフィラムおよびDHAの組み合わせの抗がん作用に関与することが示された。
従って、臨床的に承認された薬物であるDHAおよびジスルフィラムは、がん細胞をより効果的に死滅させるために相乗効果を発揮する。この組み合わせ作用は、細胞の酸化ストレスの増強およびがん幹細胞の幹細胞の性状の抑制が関連している。
魚油に多く含まれるドコサヘキサンエン酸(DHA)とジスルフィラム(DSF)を併用すると、がん細胞の酸化ストレスが亢進し、がん幹細胞の性質(Stemness)が低下して抗がん剤感受性が亢進するという結果です。
抗がん剤治療中にω3系(n-3系)多価不飽和脂肪酸のDHAとEPAを摂取すると、抗がん剤の副作用を軽減し、奏功率や生存率などの抗腫瘍効果を高めることができることは多くの臨床試験で示されています。
【2-デオキシ-D-グルコースは酸化ストレスと小胞体ストレスを引き起こす】
細胞内の酸化ストレスは、がん細胞の増殖や転移を抑制する方向で作用します。したがって、がん細胞の酸化ストレスを高めることはがんの治療に有効です。
がん細胞の酸化ストレスを高める方法としてケトン食、2-デオキシ-D-グルコース、メトホルミン、レスベラトロール、ジクロロ酢酸ナトリウム、アルテスネイト、高濃度ビタミンC点滴、半枝蓮、ジスルフィラムなどがあります。
2-デオキシ-D-グルコース(2-DG)はがん細胞の解糖系とペントース・リン酸経路(Pentose Phosphate Pathway: PPP)を阻害し、がん細胞の酸化ストレスを高めます。2-DGは小胞体ストレスを高めてがん細胞を死滅させる作用も報告されています。
小胞体(Endoplasmic reticulum)は、細胞内における分泌・膜タンパク質の品質管理において大切な小器官です。
2-DGは解糖系を阻害する以外に、タンパク質に糖鎖が着くN-グリコシル化の過程を阻害するので、糖タンパク質の生成を阻害します。
グリコシル化というのはタンパク質に糖類が付加する反応で、小胞体で行われて、正常に糖が付加したタンパク質はゴルジ体に運ばれます。
糖鎖異常の糖タンパク質は、折り畳みが不完全な異常タンパク質になり、小胞体に蓄積して小胞体ストレスを引き起こし、細胞死の原因にもなります。
ユビキチン・プロテアソーム系を阻害するジスルフィラムに、オートファジーを阻害するヒドロキシクロロキン、小胞体ストレスと酸化ストレスを高める2-デオキシグルコース、メトホルミンを併用する治療法は試してみる価値はあります。副作用はほとんどなく、がん細胞を比較的選択的に攻撃します。(トップの図)
注:ジスルフィラム服用中は飲酒はできません。奈良漬けのようなアルコールの入った食品も食べれません。本剤はアルデヒドデヒドロゲナーゼを阻害するので肝臓におけるエタノール(エチルアルコール)代謝を抑制し、悪酔いの原因となるアセトアルデヒドを体内に蓄積させます。このため少量の酒でも苦しい目に遭い、断酒、節酒の効果がもたらされます。アルコールに対する感受性はジスルフィラム服用後少 なくとも14日間は持続します。つまり、ジスルフィラムの服用を中止して2週間以上経過しないとアルコールは摂取できません。
抗がん剤のパクリタキセルは溶解剤としてエタノールを用いていますので、パクリタキセル治療中はジスルフィラムは使用できません。他にもアルコールで溶解する抗がん剤があるので、点滴による抗がん剤治療を受けているときには、溶解剤などでエタノールを使用していないことを確認する必要があります。アルコールを使用した抗がん剤を使用する場合は、ジスルフィラムを2週間以上中止してからになります。
従って、将来的に使用する可能性がある抗がん剤についても考慮する必要があります。
| « 836)油を変え... | 838)がん細胞... » |



