がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
458)肥満と内因性カンナビノイドとDHA/EPA
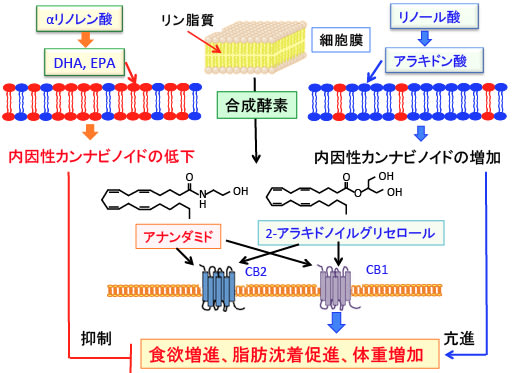
図:内因性カンナビノイド(アナンダミドと2-アラキドノイルグリセロール)は細胞膜のリン脂質に含まれるアラキドン酸から合成される。食事からのリノール酸やアラキドン酸の摂取が多いと細胞膜のアラキドン酸(細胞膜の図の青で示す)の量が増え、内因性カンナビノイドの産生量も増える。一方、ω3系不飽和脂肪酸のドコサヘキサエン酸(DHA)やエイコサペンタエン酸(EPA)の摂取量が多いと、DHAやEPA(細胞膜の図の赤で示す)がアラキドン酸と置き換わるので、内因性カンナビノイドの産生量は低下する。CB1の活性化は食欲を高め、脂肪沈着を促進し、体重を増やす作用がある。肥満が増加する原因の一つにリノール酸摂取量の増加が指摘されている。
458)肥満と内因性カンナビノイドとDHA/EPA
【人類は太りやすい体質を持っている】
現在の先進国では飢饉が起こることはありません。機械化された農耕や食糧の保存技術の進歩によって食物は有り余っている状況です。
人類の歴史の中で、農耕が始まったのは1万年くらい前です。それ以前の旧石器時代は狩猟採集によって食物を得ていたので、毎日食事を食べられるという保証はありませんでした。
人類の祖先がまだ森に居たころは食糧は豊富でしたが、氷河期が始まって森林が縮小し、人類が狩猟採取を始めた250万年くらい前から、農耕が始まる1万年前までの間、人類は飢餓との戦いの中で進化してきました。
(「376:人類は狩猟採集時代にインスリン抵抗性を獲得した」参照)
その結果、食べられるときに食べて、それを体脂肪などに蓄積し、食事が食べられなくても当分は困らないような体内システムを作り上げてきました。
人間は肥満や2型糖尿病になりやすい体質を持っています。
この体質は食物の少なかった狩猟採集時代には生存に有利に働きますが、食物が豊富になった現代社会ではこの体質が肥満や糖尿病などの疾病の原因となっています。
季節的に食糧が入手できない太古の環境では、食事摂取できるときに体内にエネルギーを溜め込むために必要ないわゆる倹約遺伝子と呼ばれる遺伝子が進化の過程で人類の遺伝子プールの中に広がったという考えがあります。
「倹約遺伝子仮説(Thrifty Gene Hypothesis)」という考えで、1962年に米国のニール(James V Neel)博士によって提唱されています。
基礎代謝量を少なくしたり、脂肪の蓄積を促進するような遺伝子が倹約遺伝子の候補になっています。 食物が足りないときには、少ないエネルギー消費量で生き残れる倹約遺伝子型を持っている人が有利です。
しかし食物が豊富になると倹約遺伝子型を持っている人は肥満や糖尿病になりやすいと考えられます。(「377:なぜ肥満が流行しているのか」参照)
【カンナビノイド受容体CB1の活性化は食欲を増進し肥満を誘導する】
大麻に含まれる薬効成分のΔ9-テトラヒドロカンナビノール(THC)が作用する受容体として発見されたカンナビノイド受容体のCB1とCB2は様々な組織に発現しています。
さらにCB1とCB2の内因性のリガンド(アナンダミド、2-アラキドノイルグリセロールなど)や内因性リガンドの合成酵素や分解酵素などによって「内因性カンナビノイド・システム」を構築して、多様な生理作用に関わっています。(内因性カンナビノイド・システムについては441話、445話参照)
CB1受容体の活性化は、食欲を高めて食物摂取を亢進し、エネルギー消費を減らし、体脂肪の合成を促進して、体内にエネルギーを蓄積する方向で作用します。
つまり、内因性カンナビノイド・システムは人類が狩猟採集で生命を維持していく上で重要なシステムであったと考えられます。
摂食行動や体内でのエネルギーの産生と消費の恒常性維持は、中枢神経系(特に視床下部や大脳辺縁系)と末梢の臓器(脂肪組織、骨格筋、肝臓、膵臓、小腸など)によって調節されていますが、その制御に内因性カンナビノイドシステムが重要な役割を担っています。
インスリン(血糖降下作用)やレプチン(食欲抑制作用)やグレリン(摂食亢進作用)や副腎皮質ホルモンなど様々なホルモンや生理活性ポリペプチドによって内因性カンナビノイドシステムの活性は調整されています。
逆に内因性カンナビノイドはオピオイド(モルヒネ)やセロトニンやγアミノ酪酸(GABA)など、中枢神経系において食欲の調節を行っている神経伝達物質や神経ペプチド(神経ホルモン)の放出を制御しています。
カンナビノイド受容体CB1の活性化は食欲を高める作用を発揮します。
肥満していない人に比べて肥満した人では、脂肪組織や肝臓や膵臓、視床下部における内因性カンナビノイドシステムの活性が高くなっているという報告があります。
一般的に、内因性カンナビノイドシステムの活性亢進は、栄養摂取の亢進、エネルギー貯蔵の亢進、エネルギー消費の抑制を引き起こすと考えられています。その結果、体重を増やし、肥満を引き起こすことが明らかになっています。
CB1受容体の遺伝子を欠損するマウスは食事摂取が少なく、エネルギー消費が増え、体重が減少します。
CB1受容体のアンタゴニスト(阻害剤)は食欲を低下させ、体重を減らすことが知られています。
逆に、CB1受容体を活性化するΔ9-テトラヒドロカンナビノール(THC)は脂肪細胞における脂肪分解を抑制し、脂肪の蓄積を促進する作用があります。
このような効果は、進行したがんやエイズの患者の食欲不振や消耗状態の改善に有効です。実際、大麻や合成THC(ドロナビノール、ナビロン)が食欲を高め、体重を増やす効果によって、進行がんやエイズの患者の消耗状態を改善することが証明されています。
しかし、CB1の活性化は食事摂取量が過多と組合わさると、肥満やメタボリック症候群の発生を促進することになります。
CB1の活性化による食欲増進と脂肪蓄積の亢進は、それが良い場合と悪い場合があることになります。
【CB1の阻害は食欲を低下させ体重を減らすが、うつ症状を引き起こす】
カンナビノイド受容体タイプ1(CB1)は中枢神経系において様々な神経伝達調節を行っており、記憶・認知、運動制御、食欲調節、報酬系の制御、鎮痛など多岐にわたる生理作用を担っています。
さらに、消化管にもCB1受容体は発現しており、腸管運動に関わっています。
大麻に最も多く含まれるカンナビノイドであるΔ9-テトラヒドロカンナビノール(THC)はCB1とCB2に結合して作用を発揮します。
過剰に摂取すると、中枢神経系のCB1の活性化によって気分の高揚などの精神作用による症状(副作用)がでます。
THCは脳に作用して食欲を高める作用があります。この食欲亢進作用はCB1の刺激によるものです。
さらに鎮痛作用や吐き気を軽減する作用があるため、エイズや進行がんの患者さんの食欲不振や体重減少、抗がん剤治療による吐き気や嘔吐に対する治療に使われています。
ドロナビノール(商品名:マリノール)は合成したΔ9-テトラヒドロカンナビノール(THC)製剤で、米国やドイツなどで処方薬として認可されています。
ナビロン(商品名:セサメット)もTHCを模倣した合成カンナビノイドで、米国やカナダや英国などで承認されています。エイズ患者の食欲不振や体重減少、抗がん剤治療に伴う吐き気や嘔吐、多発性硬化症などの神経障害性疼痛の治療に使用されています。
THCによる食欲増進作用はCB1受容体の作用によります。
CB1受容体の阻害剤は食欲を低下させます。体重を減らす効果も確かめられています。
CB1受容体阻害による体重減少は食欲低下による食物摂取量の減少だけでなく、脂肪分解を促進するなどエネルギー消費を高めることも関与しています。
したがって、CB1受容体の阻害剤が肥満やメタボリック症候群の治療薬として期待されました。 実際に、CB1受容体のアンタゴニスト(阻害薬)のリモナバン(Rimonabant)が開発され、発売になりました。
予想通りに食欲減退と体重減少の効果はあったのですが、抑うつや自殺企図の副作用が問題になって発売中止になっています。
つまり、CB1受容体の働きを阻害することは食欲を低下させる目的では有効ですが、脳内報酬系の抑制などで幸福感や快感を得ることができなくなるようです。
脳内報酬系というのは動物が自分で積極的に行動したくなるモチベーションを与える仕組みです。食欲も脳内報酬系によって亢進します。この快感を得る仕組み(脳内報酬系)を抑制することは食欲を低下できますが、何もやる気が無くなって生きる意味を失わせるのです。(脳内報酬系については444話参照)
大麻は抑うつや不安感の軽減に有効です。 CB1受容体を阻害するとうつ症状や不安感が強くなることが多くの動物実験モデルが示されています。
一方、CB1受容体を活性化すると不安や恐怖が軽減します。合成THC製剤が外傷後ストレス障害(Post Traumatic Stress Disorder:PTSD)の症状を改善することが報告されています。
薬は効能があれば、副作用もあります。CB1を活性化する薬は、食欲を高め、不安や抑うつを軽減する効果がありますが、飽食と組合わさると、肥満やメタボリック症候群の発症を促進するという副作用が出てきます。
CB1の阻害剤は食欲を低下させ肥満を改善しますが、うつ症状や自殺企図などの副作用がでます。 目的に応じて、それらの薬効を使い分けることになります。
【内因性カンナビノイドはω6系不飽和脂肪酸のアラキドン酸から合成される】
カンナビノイド受容体のCB1とCB2の内因性リガンド(受容体に結合して活性化する物質)であるアナンダミドと2-アラキドノイルグリセロールは細胞膜のリン脂質に含まれるアラキドン酸から酵素によって合成されます。
アラキドン酸はリノール酸から合成されます。 脂肪酸は1 個ないし複数個の炭化水素(CH2)の連結した鎖(炭化水素鎖)からなり、その鎖の両末端はメチル基(CH3)とカルボキシル基(COOH)で、基本的な化学構造はCH3CH2CH2・・・CH2COOHと表わされます。
脂肪酸には、飽和脂肪酸と不飽和脂肪酸があり、飽和脂肪酸では、炭化水素鎖の全ての炭素が水素で飽和しています。
一方、不飽和脂肪酸では炭化水素鎖中に1個ないし数個の二重結合(CH=CH)が含まれます。不飽和脂肪酸中で二重結合の数が2個以上のものを多価不飽和脂肪酸と云い、5 個以上の二重結合を持つ脂肪酸を高度不飽和脂肪酸と呼びます。
脂肪は、それを構成している脂肪酸の構造の違いによって融点などの化学的性状が異なってきます。二重結合をもつ不飽和脂肪酸の多い脂肪は常温で液状になりますが、飽和脂肪酸になると固まりやすくなります。固まりやすい脂肪を多く摂取すると血液がドロドロになって動脈硬化が起こりやすくなります。

図:脂肪酸は飽和脂肪酸と不飽和脂肪酸に分けられ、多価不飽和脂肪酸にはオメガ3系とオメガ6系がある。
リノール酸 CH3(CH2)3 CH2CH=CHCH2CH=CH(CH2)7COOH では、CH3 に最も近い二重結合は、CH3から6番目のCにあります。この位置に二重結合を持つ全ての脂肪酸をω6系不飽和脂肪酸に分類します。
α-リノレン酸CH3CH2CH=CHCH2CH=CHCH2CH=CH(CH2)7COOH では、CH3に最も近い二重結合はCH3から3番目のC にあります。この位置に二重結合を持つ全ての脂肪酸をω3系不飽和脂肪酸に分類します。
最近ではω6の代わりにn-6 を用いてn-6系不飽和脂肪酸、そしてω3の代わりにn-3を用いてn-3系不飽和脂肪酸と呼ぶことが多くなっています(下図)。
図:CH3 に最も近い二重結合がCH3から3番目のCにある脂肪酸をω3系不飽和脂肪酸、CH3から6番目のCに最初の二重結合がある脂肪酸をω6系不飽和脂肪酸という。
動物(人を含む)はリノール酸とα-リノレン酸を合成できません。これら2種類の不飽和脂肪酸は動物にとって不可欠であり、動物はこれらを食物として摂取する必要がありますのでこれらを必須脂肪酸と言います。
ω6 系不飽和脂肪酸はリノール酸 → γ-リノレン酸 → アラキドン酸のように代謝されていき、アラキドン酸からプロスタグランジン、ロイコトリエン、トロンボキサンなどの重要な生理活性物質が合成されます。内因性カンナビノイドのアナンダミドも2−アラキドノイルグリセロールもアラキドン酸から合成されます。
アラキドン酸はリノール酸から体内で合成されますが、体内で十分な量が生成されないためアラキドン酸も必須脂肪酸になっています。
ω3系不飽和脂肪酸はα-リノレン酸 → エイコサペンタエン酸(EPA) → ドコサヘキサエン酸(DHA)と代謝されていきます。α-リノレン酸から体内でEPAとDHAが産生されますが、その量は少ないので、食事やサプリメントでEPAとDHAを積極的に摂取する意味はあります。
細胞は下図のような脂質二重層から成る細胞膜によって細胞外と細胞内が分けられています。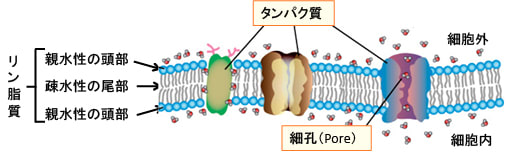
図:リン脂質は親水性のリン酸部分の頭部に、疎水性の脂肪酸が2本の尾部がついた構造をしており、これが2重の層を形成して細胞膜が構成されている。水溶性の物質は脂肪の膜を通過できないので、細胞膜を貫通するようにタンパク質が存在し、物質を通す通路や外界の刺激を細胞内に伝える受容体として働いている。
食事から摂取された脂肪は代謝されてエネルギー源となり、また分解されて生成した脂肪酸は細胞膜などに取り込まれます。
細胞膜の構成成分として使われる場合、その脂肪酸自体は変化せず、それぞれの構造や性質を保ったまま使われます。
つまり、細胞膜をつくるとき脂肪酸の違いを区別せず、手当たり次第にあるものを使用するのです。その結果、食事中の脂肪酸の種類によって細胞の性質も変わってきます。
さらに、その細胞膜の脂肪酸から作られるプロスタグランジンやロイコトリエンなどの化学伝達物質の種類も違ってきて、炎症やアレルギー反応や発がんに影響することが明らかになっています。
内因性カンナビノイドのアナンダミドや2-アラキドノイルグリセロールは細胞膜に含まれるアラキドン酸から合成されるので、細胞膜にアラキドン酸が多いほど産生量が増えることになります。
逆に、ドコサヘキサエン酸(DHA)やエイコサペンタエン酸(EPA)のようなω3系不飽和脂肪酸を多く摂取すると、細胞膜のアラキドン酸がDHAやEPAに置き換わって量が減るので、内因性カンナビノイドの産生が減ることになります。(下図)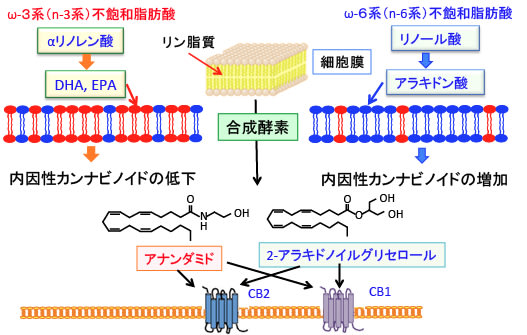
図:内因性カンナビノイド(アナンダミドと2-アラキドノイルグリセロール)はon demand(刺激に応じて)に細胞膜の脂質のアラキドン酸から合成される。食事からのリノール酸やアラキドン酸の摂取が多いと細胞膜のアラキドン酸量が増え、内因性カンナビノイドの産生量も増える。一方、ω3系不飽和脂肪酸のドコサヘキサエン酸(DHA)やエイコサペンタエン酸(EPA)の摂取量が多いと内因性カンナビノイドの産生量は低下する。
【リノール酸は内因性カンナビノイドを増やして食欲を亢進する】
リノール酸はω6系不飽和脂肪酸で必須脂肪酸(体内で合成できない)です。リノール酸は内因性カンナビノイドの原料になるアラキドン酸に変換されます。
したがって、リノール酸の多い食事は内因性カンナビノイドのアナンダミドや2-アラキドノイルグリセロールの産生を高めることが考えられます。以下のような報告があります。
Dietary Linoleic Acid Elevates Endogenous 2-AG and Anandamide and Induces Obesity.(食事からのリノール酸摂取は内因性カンナビノイドの2-AGとアナンダミドを増やし肥満を誘導する)Obesity (2012) 20, 1984–1994.
内因性カンナビノイドの活性を抑制することは肥満を減少させる重要なターゲットになっている。
内因性カンナビノイドの2-アラキドノイルグリセロール(2-AG)とアナンダミド(AEA)はω-6系不飽和脂肪酸のアラキドン酸から作られる。
我々は、アラキドン酸の前駆物質であるリノレン酸の食事からの摂取量が増えると内因性カンナビノイドシステムの活性が亢進し、肥満を誘導することを明らかにした。
20世紀における米国の食生活におけるリノール酸の摂取量(摂取エネルギーに占めるリノール酸の%)の増加が肥満の増加と相関することが示された。
マウスを、生まれてから次のような食餌で14週間飼育した。
中等度脂肪食(摂取エネルギーの35%が脂肪)と高脂肪食(摂取エネルギーの60%が脂肪)において、リノール酸の摂取量が摂取エネルギーの1%の場合と8%の場合と、8%のリノール酸に1%のエイコサペンタエン酸(EPA)とドコサヘキサエン酸(DHA)を加えた食餌を与えた。
食餌中のリノール酸の量が増えると、肝細胞と赤血球のアラキドン酸-リン脂質の量が増え、2-AGと1-AGとアナンダミドのレベルが3倍に増え、その結果、マウスは食餌摂取量が増え、脂肪蓄積が増加した。
8%リノール酸の食餌に1%のω3系不飽和脂肪酸(EPA+DHA)を加えると、代謝のパターンは1%リノール酸の食餌を似た結果になった。
高脂肪食(摂取エネルギーの60%が脂肪)において、リノール酸の摂取量を1%に減らすと、高脂肪食による肥満促進効果を抑制した。
このような動物実験モデルは、20世紀における人間のリノール酸摂取量の増加と肥満の増加の関連を示唆している。
以上をまとめると、食事中のリノール酸は組織のアラキドン酸の量を増やし、その結果内因性カンナビノイドの2-AGやアナンダミドを増やし、肥満を誘導する。
このようなリノール酸による脂肪蓄積の増加は、EPAやDHAの摂取量を増やして、アラキドン酸リン脂質の量を減らし、内因性カンナビノイド・システムの活性を減らすことによって防ぐことができる。
つまり、食事中のω6系不飽和脂肪酸:ω3系不飽和脂肪酸の比率が高いと、細胞膜の脂質二重層のリン脂質にアラキドン酸が多く占め、その結果、内因性カンナビノイドのアナンダミドや2-アラキドノイルグルコースの産生量が増えるので、食欲が亢進し、体重も増える結果になります。
ω3系不飽和脂肪酸のαリノレン酸を多く含む亜麻仁油や紫蘇油(エゴマ油や、DHAやEPAを多く含む魚の油を多く摂取してω6:ω3の比率を低下させると、これらの脂肪酸がアラキドン酸に置き換わるので、アナンダミドや2-アラキドノイルグルコースの産生量が減るので、体重を減らす効果があるというメカニズムです。
DHAやEPAを多く摂取すると体重を減らす効果が得られることになり、その作用機序として内因性カンナビノイドシステムが関与しているということです。
食事から摂取する脂肪酸の種類や量が内因性カンナビノイド・システムの活性に影響し、食欲や代謝に影響することが報告されています。 以下のような論文もあります。
Fatty Acid Modulation of the Endocannabinoid System and the Effect on Food Intake and Metabolism(脂肪酸による内因性カンナビノイド・システムの制御と食事摂取と代謝に対する影響)Int J Endocrinol. 2013; 2013: 361895. doi: 10.1155/2013/361895 PMCID: PMC3677644
【要旨】 内因性カンナビノイドとそのGタンパク質共役型受容体から成る内因性カンナビノイド・システムは、食事摂取や糖代謝や脂質代謝に重要な役割を果たしており、肥満の研究領域で注目されている。
肥満や過体重の人は、アラキドン酸由来の内因性カンナビノイドのアナンダミドと2-アラキドノイル・グリセロールの血中濃度が高く、カンナビノイド受容体の発現パターンにも変化が認められている。
その結果、食欲を亢進し、脂肪組織にエネルギーを蓄積する方向で脂肪合成やインスリン感受性やグルコース代謝を変化させる。
内因性カンナビノイドは食事からの脂肪酸に由来される産物であるため、食事から摂取される脂肪酸の組成や量が、内因性カンナビノイドの産生量に影響する。
例えば、エイコサペンタエン酸とドコサヘキサエン酸は細胞膜のアラキドン酸と置き換わることによって、アナンダミドや2-AGの産生を減らす。
同様に、オレイン酸由来のオレオイル・エタノールアミド(oleoyl ethanolamide)は満腹感を高め、血中の脂肪酸濃度を減らし、脂肪酸のβ酸化を亢進し、脂肪組織におけるアナンダミドや2-AGの働きを阻害する。
アナンダミドや2-AGの前駆物質となる脂肪酸の豊富な植物由来の脂肪の摂取を増やすことは、エネルギー摂取量と体重を増やすことになるので、食事中の脂肪が内因性カンナビノイド・システムの活性に影響することを理解することは健康を考える上で重要である。
過体重と肥満は世界中で増加しており、糖尿病や心血管疾患など多くの病気の原因となり、その結果、国の財政的な負担を増やすので、健康問題において最も重要な問題と考えられています。
体重が増えるということは、エネルギー摂取量がエネルギー消費量より多いことが原因です。
先進国では、食事からのエネルギー摂取の30%以上がエネルギー含量が濃い脂肪からであり、さらに砂糖の多い食品の摂取量も多く、体脂肪と体重を増やしています。
食事摂取量は食欲によって影響を受けます。 体内のエネルギー量が低下すると食欲が亢進します。
食欲や栄養素の代謝に内因性カンナビノイド・システムが重要な働きを行っていることが明らかになっています。 アラキドン酸の代謝産物であるアナンダミド(アラキドノイルエタノールアミド)と2−アラキドノイル・グリセロール(2-AG)はカンナビノイド受容体のCB1とCB2に結合し、大脳辺縁系や視床下部や後脳に作用して食欲を刺激します。
肥満者では内因性カンナビノイド・システムの活性が高くなっていることが報告されています。
2-AGのレベルは、BMIと腹囲と内臓脂肪のレベルと正の相関があります。 2-AGとアナンダミドは脂肪組織におけるグルコースの取込みを亢進し、脂肪合成を促進します。
このように、肥満やメタボリック症候群の治療の目的では内因性カンナビノイドのレベルを低下させる方が良いと言えます。 一方、がんなどの消耗性疾患では、内因性カンナビノイドのレベルを高めることが食欲の亢進と体重増加に有効です。
医療大麻の使用もその適応を間違わなければ、極めて有効です。
【培養した微細藻類由来DHAが注目されている】
がんや認知症や循環器疾患の予防や治療にDHAやEPAが有効であることは確立しています。従って、DHAやEPAの多い脂の乗った魚を多く食べることが推奨されています。しかし、魚のメチル水銀やマイクロプラスチックなど海洋汚染に由来する有害物質の魚への蓄積の問題が、魚食を安易に推奨できない事態になっています。
メチル水銀は毒性が強く、血液により脳に運ばれ、やがて人体に著しい障害を与えます。母親が妊娠中にメチル水銀を体内に取り込んだことにより、胎児の脳に障害を与えることもあります。
魚は自然界に存在する水銀を食物連鎖の過程で体内に蓄積するため、日本人の水銀摂取の80%以上が魚介類由来となっています。魚摂取が増えるとメチル水銀の体内摂取が増え、胎児の脳の発育に悪影響を及ぼすことが明らかになり、厚生労働省は平成15年(2003年)に妊婦の魚摂取に関する注意事項を公表しています。つまり、妊婦や小児は魚を多く食べてはいけないと言っています。
海洋でDHAとEPAを作っている微細藻類を培養して、培養した微細藻類からDHAとEPAを取り出せば、汚染物質がフリーのDHA/EPAを製造できます。閉鎖環境での培養のため、汚染の心配がありません。植物由来なので菜食主義者も抵抗なく摂取できます。(下図)

図:オメガ3系多価不飽和脂肪酸のエイコサペンタエン酸(EPA)やドコサヘキサエン酸(DHA)は微細藻類が合成している(①)。プランクトン(②)が微細藻類を食べ、小型魚(③)がプランクトンを食べ、大型魚(④)が小型魚を食べるという食物連鎖によって、魚油にEPAやDHAが蓄積している。人間は魚油からDHAとEPAを摂取している(⑤)。環境中の水銀(⑥)が魚に取り込まれてメチル水銀になって魚に蓄積する(⑦)。DHAとEPAを産生している微細藻類をタンク培養して油を抽出すると(⑧)、汚染物質がフリーで、植物由来のDHA/EPAが製造できる(⑨)。
がん治療には1日3から5グラムのDHAの摂取が有効であることが多くの研究で示されています。通常の魚油の場合、DHA含有量は10%から20%程度です。1日5グラムのDHAを摂取するには25gから50gの魚油の摂取が必要になります。
そこで、微細藻類の中でもDHA含有量が極めて多いシゾキトリウム(Schizochytrium sp.)をタンク培養して製造したDHA(フランス製)を原料にした「微細藻類由来オイル(DHA含有量51%)」を製造してがん治療に使用しています。
詳細は以下のサイトで紹介しています。
| « 457)医療大麻... | 459) マラリア... » |




