がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
694)免疫原性細胞死の誘導(その2):Ivermectin(イベルメクチン)
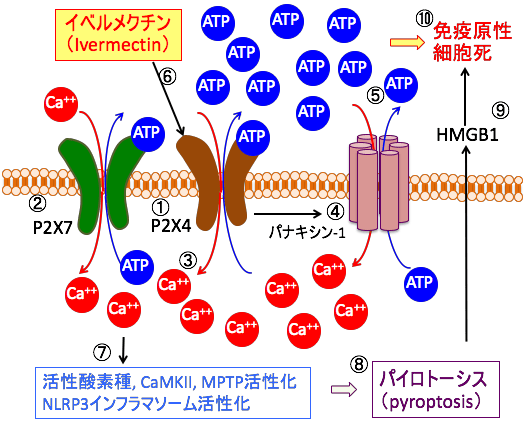
図:P2X4(①)とP2X7(②)は細胞外のATPにより活性化されるリガンド作動性イオンチャネルで、ATPにより活性化されたP2X4とP2X7によるイオンの流入は、膜電位の変化やCa2+の濃度上昇を引き起こす(③)。P2X4/P2X7はパネキシン-1(Pannexin-1)チャネルの開口部の拡大を誘導し(④)、ATPの放出を亢進する(⑤)。駆虫薬のイベルメクチンはP2X4受容体をアロステリックに調節し、P2X4/P2X7/パネキシン-1によるATP放出を増強する(⑥)。細胞内へのカルシウム(Ca2+)の流入は、NADPHオキシダーゼによる活性酸素種の産生を亢進し、Ca2 + /カルモジュリン依存性プロテインキナーゼII(CaMKII)やミトコンドリア透過性移行孔(MPTP)を活性化し、さらにNLRP3インフラマソームの活性化を引き起こし(⑦)、炎症応答を引き起こすパイロトーシス(pyroptosis)による細胞死を引き起こす(⑧)。パイローシスによる細胞死はHMGB1(High-mobility group box 1 protein)を細胞外に放出し(⑨)、細胞外に放出されたATPとHMGB1は免疫原性細胞死を引き起こす(⑩)。
694)免疫原性細胞死の誘導(その2):Ivermectin(イベルメクチン)
【私たちの体にはがん細胞を排除する免疫システムが存在する】
私たちの体内には、遺伝子が変異した異常細胞(がん細胞)を見つけて排除する免疫監視機構が存在します。
がん細胞は、免疫細胞が変異細胞を認識して攻撃を仕掛ける原因となるがん抗原を多数持っています。
がん細胞は、遺伝子の突然変異によって正常な増殖制御を失うことで発生します。さらに、がんが進行する過程で、ゲノムの不安定性に基づく遺伝子変異を蓄積します。
これらの遺伝子変異は正常とは異なる変異タンパク質を作ります。この変異タンパク質は免疫系に「非自己」として認識され、免疫応答の標的として免疫反応を強く誘導する抗原となります。このような抗原をネオアンチゲン(neoantigen)と言います。
ネオアンチゲンはがん細胞の遺伝子変異の結果,アミノ酸が置き換わって新規に生じた抗原で、もともとの宿主体内には存在しなかった抗原であるため、がん細胞を排除するキラーT細胞のターゲットになります。つまり、ネオアンチゲンはがんワクチンの候補となります。
免疫系は正常な「自己」の抗原には反応しませんが、ネオアンチゲンは正常な細胞には存在しないため「非自己」として認識されて強い免疫反応の標的になるのです。
私たちの体内では、毎日多数のがん細胞ができていますが、免疫監視の機能が正常であれば、通常はがん細胞が増殖して成長することはありません。免疫細胞ががん細胞を排除しています。
しかし現実は、発生したがん細胞は増殖し、転移しています。
がん免疫監視機構が存在するにもかかわらず、がん細胞が発生し進行するのは幾つかの理由があります。
一つは免疫監視機構の機能が低下して、がん細胞を排除できないという理由です。これにはエフェクター細胞(キラーT細胞やNK細胞など)の機能低下や、免疫抑制性の要因(制御性T細胞や骨髄由来抑制細胞やM2型腫瘍関連マクロファージなど)の存在などが含まれます。
老化や栄養失調やストレスなど、様々な要因でエフェクター細胞の機能は低下します。がん細胞はエフェクター細胞の働きを抑制する微小環境を構築しています。
もう一つは、がん細胞が抗原性を低下させているという理由です。がん細胞は不均一な集団で、がん抗原の発現の低いがん細胞が免疫監視機構による排除を回避して選択的に生き残る可能性があります。がん抗原の発現が低下すれば、免疫細胞は正常細胞と区別できないので、そのがん細胞を排除できません。
米国ワシントン大学医学部のR.D. Schreiberらが提唱している「がん免疫編集説(cancer immunoediting)」によれば、発がんにおける免疫系とがんの関わりは「排除相(Elimination)」「平衡相(equilibrium)」「逃避相(escape)」とよばれる3 相に分けられます。
最初に出現した変異細胞(がん細胞)は免疫原性が高いため、免疫監視機構によって異物と判断され、免疫担当細胞が攻撃することによって排除されます(排除相)。
しかし免疫原性の低い(免疫応答が容易に誘導されるがん抗原を有しない)がん細胞は免疫担当細胞からの攻撃にさらされないため、排除されることなく長期にわたって選択的に生存します(平衡相)。
さらに、がん組織内に免疫抑制性の細胞(骨髄由来抑制細胞や制御性T細胞など)や免疫抑制因子(プロスタグラジンE2や組織の酸性化など)が増え、積極的に抗腫瘍免疫応答を抑制する環境を作り上げ、免疫系からの攻撃を逃避することで無限に増殖し臨床的がんになります(逃避相)。
つまり、がん細胞は免疫系からの攻撃を受けにくい免疫原性の低いがん細胞を選択する(免疫選択)とともに、生体に備わっている様々な免疫抑制機構を用いて免疫系から逃避(免疫逃避)することで、 生体内で増殖し臨床的な「がん」となるということです。
したがって、がん細胞を攻撃するエフェクター細胞(キラーT細胞やNK細胞など)の働きを高め、がん細胞によって構築された免疫抑制ネットワークを解除すると共に,免疫原性の低いがん細胞に対して強力な免疫応答を誘導することができれば、進行したがんでも、免疫細胞の力で排除できる可能性が高まります。

図:がん細胞が発生すると、がん細胞に存在するがん抗原をターゲットにして樹状細胞やマクロファージやキラーT細胞などの免疫担当細胞(エフェキター細胞)ががん細胞を攻撃し(①)。がん細胞は免疫的に排除される(②)。がん抗原を多く発現している「免疫原性の高い変異細胞(がん細胞)」はこの排除相で排除されるが、がん抗原の発現の弱い「免疫原性の低い変異細胞(がん細胞)」は免疫担当細胞からの攻撃が弱いので、排除されることなく長期にわたって選択的に生存する(③)。この状態を平衡相と言う。がん細胞を攻撃するエフェクター細胞の働きを阻害する骨髄由来抑制細胞(MDSC)や制御性T細胞(Treg)やM2型腫瘍関連マクロファージ(TAM)や免疫阻害因子(プロスタグランジンE2やキヌレニンや乳酸など)によってエフェクター細胞の機能が低下すると、がん細胞は免疫監視から逃避して増殖し、臨床的がんになる(⑤)。これを逃避相と言う。がん細胞は抗腫瘍免疫応答を抑制する環境を積極的に構築している。
【ダメージ関連分子パターンが免疫応答を刺激する】
何らかのダメージやストレスで細胞が傷害されたときは、それを認識して対応する必要があります。細胞がダメージを受けたとき、そのような細胞からは通常であれば細胞内に隠れている成分が放出され、炎症細胞や免疫細胞を活性化するメカニズムが存在します。
このような炎症を引き起こす細胞内にある成分をDAMPs(damage-associated molecular patterns; ダメージ関連分子パターン)と総称しています。
細胞傷害に伴って細胞から放出され、周囲の組織や細胞に危険を知らせるアラームのような役割を担う因子のことです。
DAMPsが細胞外や細胞膜上に露出するような細胞死が起こると、炎症細胞(マクロファージや好中球など)やリンパ球や線維芽細胞などが動員され、炎症反応が引き起こされ、ダメージを受けた組織の修復が起こります。つまり、DAMPsは異常部位を示す「find me」シグナルなのです。
このメカニズムは自己免疫疾患などの慢性炎症性疾患の原因ともなります。
しかし、抗がんや放射線を使ったがん治療の場合は、このダメージ関連分子パターン(DAMPs)を誘導する細胞死のメカニズムを利用すると、がん特異免疫を増強できることが知られています。
DAMPsは骨髄や末梢組織から未成熟な樹状細胞をがん組織に動員し、樹状細胞は死滅したがん細胞から放出されたがん抗原によって活性化され成熟します。樹状細胞から抗原提示を受けて活性化したキラーT細胞(細胞傷害性T細胞)は増殖してがん細胞を抗原特異的に攻撃します(下図)。

図:抗がん剤(①)によってがん細胞が死滅すると、死滅したがん細胞からカルレチキュリン(CRT)やATPやHMGB1(High-mobility group box 1 protein)などのダメージ関連分子パターン(damage-associated molecular patterns ; DAMPs)が放出される(②)。DAMPsは骨髄や末梢組織から未成熟な樹状細胞をがん組織に動員する(③)。がん組織において死滅したがん細胞から放出されたがん抗原は未熟樹状細胞に取り込まれ、未成熟樹状細胞は活性化されて成熟樹状細胞に分化誘導される(④)。成熟樹状細胞は最寄りのリンパ節に移動し、MHC(Major Histocompatibility Complex)のクラスI及びクラスIIに結合したがん抗原をTCR(T細胞受容体)を介して、CD4+T細胞(ヘルパーT細胞)とCD8+T細胞(キラーT細胞)に提示する(⑤)。がん抗原に反応するキラーT細胞(細胞傷害性T細胞)は抗原提示によって活性化されてクローナルに増殖し(⑥)、がん細胞をがん抗原特異的に攻撃する(⑦)。
放射線照射や一部の抗がん剤が免疫原性の高い細胞死を誘導することが知られており、このような細胞死をもっと効率的に行う手段があれば、がん治療の効果を高めることができます。
DAMPsは、細胞質や核やミトコンドリアや小胞体などに存在する成分が放出されたもので、炎症細胞や免疫細胞を刺激します。
DAMPsとしては、ミトコンドリアのATPや DNAやフォルミルペプチド、核のヒストンやHigh-mobility group box 1 protein(HMGB1)、High-mobility group nucleosome binding protein 1(HMGN1)、細胞質のATPやF-アクチン、小胞体のカルレチキュリン(Calreticulin)などが知られています。(下図)

図:細胞がダメージを受けたとき、通常であれば細胞内に隠れていた成分が放出され、炎症細胞や免疫細胞を活性化するメカニズムが存在する。このような炎症を引き起こす細胞内にある成分をDAMPs(damage-associated molecular patterns; ダメージ関連分子パターン)と総称している。DAMPsは、細胞質や核やミトコンドリアや小胞体などに存在する成分が放出されたもので、炎症細胞や免疫細胞を刺激する。DAMPsとして、ミトコンドリアのATP, DNA, フォルミルペプチド、核のヒストンやHigh-mobility group box 1 protein(HMGB1)、High-mobility group nucleosome binding protein 1(HMGN1)、細胞質のATPやF-アクチン、小胞体のカルレチキュリン(Calreticulin)などが知られている。
免疫原性細胞死を誘導できる抗がん剤として多くのアントラサイクリン系薬(doxorubicin, epirubicin, idarubicinなど)、mitoxantrone、 オキサリプラチン(oxaliplatin)、シクロフォスファミド(cyclophosphamide) 、bortezomibなどが報告されています。
例えば、大腸がんや乳がんでは、アントラサイクリンやオキサリプラチンががん組織内のキラーT細胞の数を増やし、免疫抑制性に作用する制御性T細胞の数を減らすことが報告されています。
従来、抗がん剤の抗腫瘍効果は、がん細胞を直接死滅させる機序によると考えられてきました。しかし、免疫応答を誘導して、免疫監視機構を活性化する機序も関与していることが指摘されるようになったのです。
したがって、抗がん剤治療と免疫療法を積極的に併用する有用性も根拠があります。
【駆虫薬のイベルメクチンは免疫原性細胞死の誘導剤】
イベルメクチン(ivermectin)は、土壌から分離された放線菌Streptomyces avermitilisの発酵産物から単離されたアベルメクチン類から誘導されました。日本国内では、腸管糞線虫症と疥癬の治療薬として保険適用されています。
イベルメクチンは、中南米やアフリカのナイジェリアやエチオピアで感染者が多く発生している糸状虫症の特効薬です。糸状虫症はオンコセルカ症や河川盲目症とも呼ばれ、激しい掻痒、外観を損なう皮膚の変化、永久失明を含む視覚障害を起こします。
その他、リンパ系フィラリア症など多くの種類の寄生虫疾患に有効で、人間だけでなく、動物の寄生虫疾患治療薬として広く使用されています。
イベルメクチンの安全性は非常に高く、寄生虫に感染した人間に対して、寄生虫が死滅する過程で引き起こされる免疫応答や炎症反応に起因する症状以外には、副作用をほとんど起こらないと言われています。
さらに、多数の前臨床試験で抗がん作用が確認されています。したがって、がん治療薬として再利用を検討する候補薬としての条件が揃っていると言えます。

図:Ivermectin(イベルメクチン)は、22,23-ジヒドロアベルメクチンB1a(H2B1a)が80%以上、22,23-ジヒドロアベルメクチンB (H2B1b)が20%以下の混合物。イベルメクチンは糞線虫症、糸状虫症、疥癬症など多くの寄生虫疾患の治療に使用されている。イベルメクチンが様々なメカニズムで抗がん作用を発揮することが報告されている。
イベルメクチンは、がん細胞に対する直接的な増殖抑制作用やアポトーシス誘導作用のほかに、抗腫瘍免疫を増強する作用も報告されています。がん細胞の免疫原性細胞死を誘導する作用も報告されています。以下のような報告があります。
Modulation of P2X4/P2X7/Pannexin-1 sensitivity to extracellular ATP via Ivermectin induces a non-apoptotic and inflammatory form of cancer cell death.(イベルメクチンを介した細胞外ATPに対するP2X4 / P2X7 / Pannexin-1感受性の調節は、非アポトーシス性および炎症性の形態のがん細胞死を誘発する)Sci Rep. 2015; 5: 16222.
【要旨】
P2X7受容体の過剰発現は、腫瘍の増殖と転移と相関する。しかし、ATPの放出は、免疫原性がん細胞死、ならびに外傷または虚血再灌流傷害の部位での壊死性細胞死によって引き起こされる炎症反応に関連している。
FDA承認の抗寄生虫剤イベルメクチンは、P2X4受容体をアロステリックに調節し、乳がん細胞におけるプリン作動性シグナル伝達の生存促進作用と細胞毒性作用のバランスを切り替えることができる。
これは、P2X4 / P2X7を介するパネキシン-1(Pannexin-1)チャネルの開口部の拡大を誘導し、アポトーシスと壊死の混在したカスパーゼ-1の活性化と関連する細胞死を引き起こし、この細胞死形態はパイロトーシス(pyroptosis)と一致する。
このがん細胞死はATP放出とP2X7受容体による細胞死シグナル伝達系に依存し、この細胞死は、NADPHオキシダーゼによって生成された活性酸素種、Ca2+ /カルモジュリン依存性プロテインキナーゼII(CaMKII)またはミトコンドリア透過性移行孔(mitochondrial permeability transition pore)の阻害によって阻止された。
イベルメクチンは、オートファジーを誘導し、炎症の主要なメディエーターのATPとHMGB1の放出を誘発した。
P2X4 / P2X7シグナル伝達系の亢進は、がん組織におけるATPが多い微小環境と関連している。プリン作動性受容体の制御は、がん免疫療法の効果を高める可能性がある。
この論文の内容を理解するには、炎症を引き起こすダメージ関連分子パターン(damage-associated molecular patterns; DAMPs)としてのATPの作用メカニズム、ATPの受容体のP2X4やP2X7とそのシグナル伝達系、イオンチャネルのパネキシン-1(Pannexin-1)、細胞死の形態のパイロトーシス(pyroptosis)などに関する知識が必要です。これらについては、後述します。
この論文を簡単にまとめると、駆虫薬のイベルメクチンが、P2X4受容体に作用してアロステリックな調節を行い、P2X4/P2X7を介してイオンチャネルのパネキシン-1を開口させてATPの放出を亢進し、パイロトーシス(pyroptosis)という非アポトーシス性の細胞死を誘導し、がん細胞の免疫原性細胞死を亢進する効果があるということです。
【エネルギー通貨のATPは免疫細胞を動員する危険シグナルとしても作用する】
細胞が生存し活動するエネルギーとしてアデノシン三リン酸(Adenosine Triphosphate:ATP)という体内物質を利用しています。ATPはアデノシンに化学エネルギー物質のリン酸が3個結合したもので、生物が必要とする活動エネルギーを保存した「エネルギー通貨」のような分子で、エネルギーを要する生物体の反応過程には必ず使用されています。
ATPがエネルギーとして使用されるとADP(Adenosine Diphosphate:アデノシン-2-リン酸)とAMP(Adenosine Monophosphate:アデノシン-1-リン酸)が増えます。すなわち、ATP → ADP + リン酸 → AMP+2リン酸というふうに分解され、リン酸を放出する過程でエネルギーが産生されます。
細胞はグルコースや脂肪酸に保存されているエネルギーをATP分子に捕獲し、筋肉の収縮や能動輸送や物質合成などの細胞の仕事に使っているのです。(下図)

図:ATP(アデノシン3リン酸)は核酸を構成する塩基の一種であるアデニンがリボースに結合し、そのリボースに3つのリン酸基が並んで結合している分子。ATPから加水分解によってリン酸基が外れるときにエネルギーが放出される。細胞は化学的な仕事を行うために必要なエネルギーの獲得と移動に関してATPを使用しており、ATPは生体内のエネルギー通貨として機能している。
細胞内におけるエネルギー物質である ATP は、生体の環境変化に伴う様々な刺激に応じて細胞外に放出され、細胞間の情報伝達物質としても働きます。
感染や炎症や壊死などの損傷を受けた細胞から放出された細胞外のアデノシン5'-三リン酸(ATP)は、好中球、マクロファージ、樹状細胞などの貪食細胞を損傷部位に動員する危険シグナルとして機能します。
細胞外ATP は細胞膜上の プリン作動性(P2)受容体を介して炎症反応を引き起こすことが知られています。
P2 受容体には多くのサブタイプが存在しますが、炎症反応の中心的役割を果たす受容体として P2X7 受容体がよく知られています。
P2X7 受容体はリンパ球、マクロファー ジ、樹状細胞など多くの免疫細胞に発現しており、活性化により様々な炎症性サイトカインの産生・放出や 炎症反応 の活性化に関与します。
パネキシン-1(Pannexin1)はイオンチャネルで、ATPの放出にも関わります。
前述の論文では、「イベルメクチンが、P2X4受容体をアロステリックに調節し、P2X4 / P2X7を介するパネキシン-1(Pannexin-1)チャネルの開口部の拡大を誘導し、ATP放出を亢進し、炎症反応を引き起こして、ピロトーシス(pyroptosis)という細胞死を誘導する」と報告しています。
「アロステリック」とは 「別の形」 を意味する用語です。酵素や受容体の形が変わることで酵素活性や受容体活性が変化することを「アロステリック調節」といいます。
イベルメクチンがP2X4受容体に結合すると、この受容体の構造の変化を引き起こして、その働きを変化させるということです。この場合、イベルメクチンはP2X4の働きを増強します。
また、NADPHオキシダーゼによって生成された活性酸素種、Ca2+ /カルモジュリン依存性プロテインキナーゼII(CaMKII)またはミトコンドリア透過性移行孔(mitochondrial permeability transition pore)の阻害によって細胞死が阻止されたということは、細胞死にこれらのメカニズムが関与していることを意味します。
いずれにしても、イベルメクチンはがん細胞からのパネキシン-1からのATP放出を亢進し、さらにP2X4受容体とP2X7受容体からのカルシウムイオンの流入によって、細胞死シグナルが活性化し、免疫原性細胞死が誘導されるという事です。
【パイロトーシス(Pyroptosis)は炎症性のプログラム細胞死】
体を構成する正常細胞は毎日多数の細胞がアポトーシスで死滅し、組織幹細胞が細胞分裂して組織の細胞を供給しています。
このような生理的な死に対して、体がいちいち反応して炎症や免疫応答を行えば、大変なことになります。しかし、このような生理的な細胞死は、炎症や免疫応答を引き起こさない死に方をするので、問題は起こりません。アポトーシスは炎症反応を引き起こさない細胞死です。
がん細胞を死滅させるときに、アポトーシスの細胞死を誘導すると、炎症反応や免疫応答が起こりにくいので、がん抗原の認識やがん抗原をターゲットにした免疫応答を誘導できません。
つまり、抗がん剤や放射線治療でがん細胞を死滅させるとき、アポトーシスの誘導では抗腫瘍免疫を活性化できません。
近年、アポトーシス(apoptosis)以外にも、ネクローシス(necrosis)、フェロトーシス(ferroptosis)、パイロトーシス(pyroptosis)など、さまざまな異なる形態の細胞死が報告され、非アポトーシス性細胞死(non-apoptotic cell death)と呼ばれています。
アポトーシス(Apoptosis)はミトコンドリアのチトクロームCやタンパク分解酵素のカスパーゼが関与する細胞死です。カスパーゼは、基質であるタンパク質をアスパラギン酸残基の後で切断するシステインプロテアーゼの総称です。アポトーシスの実行や炎症性サイトカインの活性化に関与するタンパク分解酵素です。
カスパーゼは初め不活性型の前駆体のプロ・カスパーゼ(pro-Caspase)として発現しますが、Fas などの細胞死受容体や各種の傷害刺激などに反応して速やかに切断され、活性型となります。
アポトーシスの過程においては、誘導型カスパーゼ(Initiator caspase)と実行型カスパーゼ(Executioner caspase/Effector caspase)に大別されます。
誘導型カスパーゼ(Caspase-2、8、9、10)は実行型カスパーゼ(Caspase-3、6、7)を切断・活性化することによりアポトーシスのシグナルをスタートさせます。実行型カスパーゼは、多くの細胞内タンパク質を分解し、アポトーシスの実行へと導きます(下図)。これらのカスパーゼの阻害剤はアポトーシスによる細胞死を阻止します。

図:細胞死受容体(Fas と TNFR)のリガンド(FasLとTNF)による活性化(外因性経路)は、カスパーゼ8 および カスパーゼ10を活性化する(①)。ダメージを受けたミトコンドリアから放出されるシトクローム c はカスパーゼ-9 を活性化する(内因性経路②)。これらのカスパーゼはイニシエーターカスパーゼ(Initiator caspase)と呼ばれ、下流のエクセキューショナーカスパーゼ(Executioner caspase)のpro-caspase3とpro-caspase 7を切断して活性化する(③)。活性化したカスパーゼ3とカスパーゼ7は細胞内タンパク質を消化してアポトーシスを実行する。
一方、脳梗塞や心筋梗塞の様な虚血や、火傷や毒物による細胞傷害では、壊死(ネクローシス)という細胞死を起こして、細胞が崩壊して炎症反応が引き起こされます。炎症反応を引き起こすことによって、生体に異常事態を知らせ、防御や修復を促進することができます。
フェロトーシス(Feroptosis)は、鉄依存的な活性酸素種の発生と過酸化した脂質の蓄積によって細胞死が起こります。細胞内の鉄に依存する機構であり,ほかの金属類には依存しません。「フェロ(Ferro)」は「鉄」という意味です。
カスパーゼ阻害剤はアポトーシスの細胞死を阻止できますが、フェロトーシスは阻止できません。
鉄に結合して反応性を阻害するキレート剤や、フリーラジカルを消去する抗酸化剤(ビタミンEなど)はフェロトーシスを阻止しますが、アポトーシスは阻止できません。
つまり、フェロトーシスは鉄のキレート剤や抗酸化剤で阻止され、カスパーゼ阻害剤では阻止できない点でアポトーシスと区別される細胞死です。

図:鉄はトランスフェリンに結合して全身を循環している。1分子のトランスフェリンは3価の鉄イオン(Fe3+)を2個運搬できる(①)。ほとんどの細胞の細胞膜に存在するトランスフェリン受容体に3価鉄イオンを結合したトランスフェリンが結合すると、この複合体はエンドサイトーシスによって細胞内に取り込まれる(②)。エンドソーム内の酸性の環境では、鉄イオンはトランスフェリンから離れ、3価の鉄イオン(Fe3+)は2価の鉄イオン(Fe2+)に還元される(③)。2価の鉄イオンはエンドソームを出て細胞質に移行し、細胞内の様々な機能に使用される不安定鉄プールに入り、DNA合成に必要な酵素(リボヌクレオチド還元酵素など)の補因子、ヘム合成、鉄-イオウクラスターの形成など、細胞内の様々な目的で使用される(④)。余剰の鉄イオンは鉄貯蔵タンパク質のフェリチンの中に3価の鉄イオン(Fe3+)として貯蔵される(⑤)。細胞質の2価鉄イオンはフェントン反応によって酸化作用の強いヒドロキシルラジカルや脂質ラジカルを発生させ、過酸化脂質の蓄積を引き起こし(⑥)、フェロトーシスによる細胞死を誘導する(⑦)。鉄のキレート剤や抗酸化剤はフェロトーシスを阻害する(⑧)。
パイロトーシス(Pyroptosis)は病原体の感染に応答して起こる「プログラムされたネクローシス(壊死)」とも言える細胞死で、Caspase-1 やCaspase-4 などの各種カスパーゼ(Caspases)が関与します。パイロトーシスを起こした細胞(pyroptotic cells)は形態学的には、細胞の膨張および急速な細胞膜溶解が認められ、炎症を伴います。
IL-1βやIL-18等の炎症性サイトカインの誘発と細胞外への遊離が、アポトーシスにはみられない特徴です。
pyroはギリシャ語の炎や熱に由来します.つまり、炎症を引き起こすプログラム細胞死と言えます。
さて、前述の論文ではイベルメクチンが「非アポトーシス性および炎症性の形態のがん細胞死(non-apoptotic and inflammatory form of cancer cell death)」を誘発すると報告しています。この細胞死は「アポトーシスと壊死の混在したカスパーゼ-1の活性化と関連する細胞死を引き起こし、この細胞死形態はパイロトーシス(pyroptosis)と一致する」と、パイロトーシスであると考察しています。
つまり、イベルメクチンはがん細胞に、炎症反応を引き起こす細胞死(パイロトーシス)を誘導することによって死滅したがん細胞の免疫原性を高めるということです。

図:P2X4(①)とP2X7(②)は細胞外のATPにより活性化されるリガンド作動性のイオンチャネルで、ATPにより活性化されたP2X4とP2X7によるイオンの流入は、膜電位の変化やCa2+の濃度上昇を引き起こす(③)。P2X4/P2X7はパネキシン-1 (Pannexin-1)チャネルの開口部の拡大を誘導し(④)、ATPの放出を亢進する(⑤)。駆虫薬のイベルメクチンはP2X4受容体をアロステリックに調節し、P2X4/P2X7/パネキシン-1によるATP放出を増強する(⑥)。細胞内へのカルシウム(Ca2+)の流入は、NLRP3インフラマソームを活性化する(⑦)。これによってprocaspase-1は自己切断されて活性型カスパーゼ-1(caspase-1)を形成し(⑧)、この活性化したカスパーゼー1はIL-1β前駆体のpro-IL-1β とIL-18前駆体の pro-IL-18を切断して成熟型(活性型)のIL-1βとIL-18を生成する(⑨)。IL-1βとIL-18は炎症応答を引き起こすパイロトーシス(pyroptosis)による免疫原性の高い細胞死を引き起こし(⑩)、抗腫瘍免疫増強する(⑪)。
【イベルメクチンは様々なイオンチャネルや受容体に作用する】
イベルメクチンは、無脊椎動物の神経・筋細胞に存在するグルタミン酸作動性クロール(Cl)チャネルに選択的かつ高い親和性を持って結合します。その結果、クロール(Cl)に対する細胞膜の透過性が上昇して神経又は筋細胞の過分極が生じ、寄生虫が麻痺を起こし、死に至ります。哺乳類ではグルタミン酸作動性Cl−チャネルの存在が報告されていないので、安全性は極めて高いと言えます。
イベルメクチンはグルタミン酸作動性クロール(Cl)チャネル以外にも様々なイオンチャネルや受容体に作用することが明らかになっています。
以下のような報告があります。
Ivermectin and its target molecules: shared and unique modulation mechanisms of ion channels and receptors by ivermectin.(イベルメクチンとそのターゲット分子:イベルメクチンによるイオンチャネルと受容体の共有されたユニークな制御メカニズム。)J Physiol. 2018 May 15; 596(10): 1833–1845.
【要旨】
イベルメクチンは世界中で使用されている抗寄生虫薬で、オンコセルカ症やリンパ系フィラリア症から何億人もの人々を救っている。 これは、2015年ノーベル生理学医学賞を受賞した大村智とウィリアムC.キャンベルによって発見された。
グルタミン酸依存性Cl-チャネルを活性化することで寄生虫を殺し、Cys-loop受容体、P2X4受容体、フェルネソイドX(fernesoid X)受容体などのいくつかのリガンド依存性イオンチャネルと受容体も標的にする。
最近、我々はイベルメクチンが新しいターゲットであるGタンパク質依存性内向き整流K +チャネルも活性化することを発見し、活性化の構造決定因子も同定した。
このレビューでは、分子構造、キメラ、部位特異的変異誘発、分子ドッキングおよびモデリングの研究を通じて、イベルメクチンのターゲットの同定における最新の進歩とその変調メカニズムの概要を提供することを目的としている。
イベルメクチンが様々なイオンチャネルや受容体と相互作用するということです。
この総説にも言及されているように、イベルメクチンはATP作動性のイオンチャネルのP2X4をアロステリックに制御してP2X4の働きを促進します。そして、P2X4/P2X7シグナル伝達系を亢進することによってパイロトーシスという炎症性の細胞死を誘導し、抗腫瘍免疫を高めるということです。
P2X受容体は、ATPをリガンドとする細胞表面受容体であり、Na+、Ca2+およびK+のいずれも通すリガンド依存性非選択的陽イオンチャネルです。
P2X4受容体は、他のP2X受容体よりカルシウム透過性が高いことが特徴で、駆虫薬イベルメクチンによりアロステリックにATPの作用が増強されることはWikipediaにも記載されているくらい知られています。
P2X4/P2X7によってパナキシン-1が開口してATPの細胞外放出が亢進しますが、イベルメクチンはP2X4に作用してアロステリック調節によって、ATPの細胞外放出を亢進し、免疫原性細胞死を引き起こすということです。つまり、イベルメクチンは免疫原性細胞死の誘導剤と言えます。
「がん細胞にアポトーシスを誘導する」という作用は、一見良いように見えますが、免疫療法の観点では、そうではないということです。
アポトーシスでは炎症応答も免疫応答も起こらないので、ただ静かにがん細胞が死滅するだけです。
免疫原性細胞死というのは、免疫細胞に異常細胞の存在を知らしめるがん細胞死であり、炎症応答と免疫応答を誘導して、抗腫瘍免疫を増強します。
いくつかの抗がん剤が免疫原性細胞死を引き起こしますが、これはパイロトーシスによる細胞死を誘導していると考えられています。
【短期間歇的な抗がん剤投与による免疫原性細胞死の誘導】
通常の抗がん剤治療はがん細胞を死滅させることを第一の目標とし、がん組織の縮小(奏功率)を指標にして効果を評価しています。
その結果、殺細胞作用の強い抗がん剤や複数の抗がん剤の組合せが行われるようになり、がん細胞の増殖を抑えるために、抗がん剤治療でがん細胞を攻撃し続けるという戦略を取ります。その結果、がんが存在する限り、抗がん剤治療を行うことになります。
しかし、作用の強い抗がん剤治療で一時的に腫瘍が縮小しても、その効果は長続きせず、いずれがん細胞が耐性を獲得したり、患者側の体力低下などで、抗がん剤治療自体が行えない状況になります。
放射線照射やある種の抗がん剤は、抗腫瘍免疫を刺激できる細胞死(免疫原性の高い細胞死)を引き起こします。しかし、免疫原性細胞死を誘導しても、最大耐用量の抗がん剤を使用し続ければ、リンパ球や樹状細胞も増殖を阻害されるので、抗腫瘍免疫は発動も活性化もできません。
そこで、免疫原性細胞死を引き起こす抗がん剤投与を短期間で間歇的に行いながら、抗がん剤の休薬期間に樹状細胞やリンパ球(ヘルパーT細胞やキラーT細胞)を活性化し、免疫抑制性の因子(骨髄由来抑制細胞、制御性T細胞、プロスタグランジンE2など)を抑制する治療を行って積極的に抗腫瘍免疫を活性化すれば、がん組織の消滅も不可能ではありません。
通常の抗がん剤治療は体の治癒力や免疫力を犠牲にしている点が最も問題だと思います。免疫細胞ががん細胞を攻撃しやすい条件と微小環境を作るという治療法も検討する価値があります。つまり、放射線照射や短期間の抗がん剤治療によってがん細胞の免疫原性細胞死を誘導し、その後に抗腫瘍免疫を高める治療法を行うという治療法です。
このような短期間の間歇的な抗がん剤治療としては、昔から使用されて比較的安価で経口投与されるシクロフォスファミドが有用です。通常は、1日50mgを毎日あるいは週に2から4日という量で有効です。
さらに、2-デオキシ-D-グルコースが糖タンパクのN-グリコシル化を阻害して小胞体ストレスを引き起こし免疫原性細胞死を誘導することは前回(693話)紹介しました。
また、糖尿病治療薬のメトホルミンも小胞体ストレスを高めて免疫原性細胞死を誘導します。
抗がん剤でシスプラチンやカルボプラチンなどの白金製剤を使用しているときはビタミンB6のピリドキシンの併用が有効です(653話)。
がん組織における免疫抑制性の微小環境の改善にはシメチジン、セレコックス、メベンダゾールなども有効です(652話)。
これらをまとめると、例えば次のような治療法が考えられます。
① シクロフォスファミドを低用量(50mg/日または週3〜4回)、2−デオキシ-D-グルコース(1日に体重1kg当たり40から60mg)、イベルメクチン(12mg/日)、メトホルミン(500から1500mg/日)を服用してがん細胞に免疫原性細胞死を誘導する。白金製剤を使った抗がん剤治療中はピリドキシンを1日90mgを服用、
② ナイーブヘルパーT細胞のTh1への分化を抑制し、骨髄由来抑制細胞を誘導するプロスタグランジンE2の産生を抑制するCOX-2阻害剤のセレコックスを1日200〜400mg服用(朝と夕の食後)
③ 骨髄由来抑制細胞を抑制し、抗腫瘍免疫を増強するシメチジンを1日800mg服用する。
④ がん細胞に対する直接的な抗がん作用とM1型マクロファージ誘導作用のあるメベンダゾールを服用(10mg/kg/日)
⑤ がん組織の酸性化を抑制するジクロロ酢酸ナトリウム、重曹あるいはTris塩基を服用
⑥ T細胞からTh1サイトカイン産生を増やし、キラーT細胞やナチュラルキラー細胞の働きを高める漢方薬(特に紅参、黄耆、川芎などを多く使用)を服用する。
⑦ IL-12の産生を増やし、樹状細胞の成熟を促進するためにピドチモドを1日400〜800mgを服用。
⑧ さらに、オプションとして骨髄由来抑制細胞を分化誘導して抑制活性を減らすレチノイド(イソトレチノイン 10〜20mg/日)とビタミンD3(2000〜4000 IU/日)を併用する。
⑨ 皮膚転移や表層部のリンパ節があるときはイミキモドクリームを病変近くに塗布する。
【がん代替療法の費用についての考察】
駆虫薬のメベンダゾールやイベルメクチンを使ったがん治療を正規品で行うとかなり高価になります。
日本で使用されているメベンダゾール(ヤンセンファーマ)100mgの薬価は366円です。
現在薬価差益はほとんど無いので、医薬品の卸やメーカーから購入してもほぼ同じ価格です。
寄生虫疾患の治療では1日200mgを3日間服用するだけで治療が終了するので、600mgの価格の2200円で終了するので、寄生虫疾患の治療費としては高くはありません。
しかし、がん治療の場合は、1日400から600mgを連日服用するので1ヶ月分が4万円から6万円以上になります。
イベルメクチンは日本の正規品は3mgが677円です。成人では1回に12mgを服用するので、1回分が2700円です。イベルメクチンは12mgを1回あるいは2回で寄生虫を死滅するので、治療の薬代は2700円から5400円で済むので、高いとは言えません。
しかし、がん治療の場合は12mgを連日服用するので、正規品を使用すると医薬品の原価が1ヶ月分は81,000円になります。
日本ではジェネリック(後発品)は販売されていませんが、海外ではメベンダゾールとイベルメクチンのジェネリックは多数販売されています。
メベンダゾールもイベルメクチンもWHOの必須医薬品のリストに入っている薬で、アフリカや東南アジアや中南米などで多くの患者に使用されています。イベルメクチンは家畜にも使われています。
したがって、インドなどで販売されているジェネリックは極めて安価です。
メベンダゾール(100mg)もイベルメクチン(12mg)も1錠が数十円程度です。
がん治療に必要量を連日服用しても、30日分がメベンダゾールもイベルメクチンも数千円レベルの費用です。
メトホルミン、シメチジン、シクロホスファミドは日本で販売されているジェネリックを使えば、1ヶ月分の費用は薬価ベースでいずれも1000円以下です。
セレコキシブ(日本ではセレコックス)は200mgが1錠の薬価が106円なので、30日分は3000円から6000円程度です。
イミキモドクリームは日本の正規品を使うと1回分が1177円なので、1ヶ月分が3万円以上になりますが、インドのジェネリックだとその数分の1です。
上記のプロトコールでは2-デオキシグルコースと漢方薬は1ヶ月分が3万円程度し、安価な製品は入手できませんが、その他の薬は1ヶ月分が1000円から6000円のレベルです。
ジェネリックだと効果が大丈夫かという懸念がありますが、実際にがん治療に使用して有効な症例を多数経験しているので、費用対効果からいえば、10倍以上の費用を出して正規品にこだわる必要はないと考えています。
1ヶ月分が数十万円する新薬より、上記のような安価な薬を組み合わせた代替療法の方がより有効な場合も、最近はよく経験しています。
| « 693)免疫原性... | 695)駆虫薬イ... » |



