がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
597)低酸素誘導因子-1(HIF-1)の活性化を阻害する方法
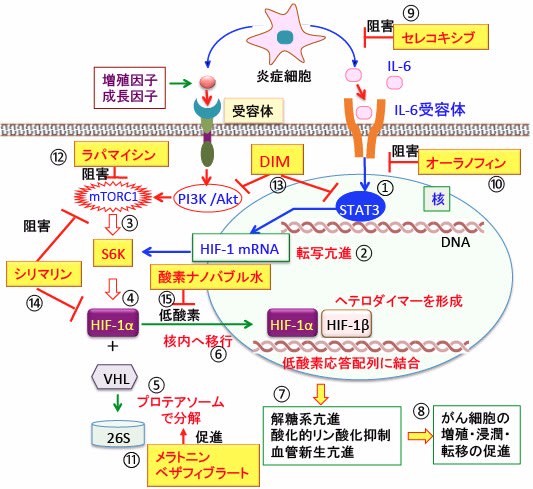
図:炎症細胞から産生されるIL-6は受容体を介してSTAT3を活性化し(①)、低酸素誘導因子-1(HIF-1)の転写を亢進する(②)。増殖因子や成長因子によるシグナルはPI3K/Aktシグナル伝達系を介してmTORC1(哺乳類ラパマイシン標的タンパク質複合体1)を活性化する(③)。mTORC1はリボソームの生合成を促進するS6Kをリン酸化して活性化して蛋白質合成を促進し、HIF-1タンパク質の産生を増やす(④)。酸素濃度が高い状態では、HIF-1αは酸素濃度感受性タンパク質のプロリル・ヒドロキシラーゼによって水酸化され、VHL(von Hippel-Lindau)タンパク質が結合して26Sプロテアソームで分解される(⑤)。低酸素状態ではプロリル・ヒドロキシラーゼの活性が低下してHIF-1αの分解が阻止されるので、蓄積したHIF-1αは核内に移行し(⑥)、HIF-1βとヘテロダイマー(ヘテロ二量体)を形成して遺伝子の低酸素応答配列に結合し、低酸素状態の適応に必要な様々な遺伝子の発現を誘導する(⑦)。その結果、解糖系が亢進し、酸化的リン酸化が抑制され、血管新生を促進されて、がん細胞の増殖・浸潤・転移が促進される(⑧)。シクロオキシゲナーゼ-2(COX-2)阻害剤のセレコキシブ(celecoxib)は炎症細胞の活性を抑制し(⑨)、オーラノフィンはSTAT3の活性化を抑制する(⑩)。メラトニンとベザフィブラートはHIF-1αの分解を促進してHIF-1活性を抑制し(⑪)、ラパマイシンはmTORC1を直接的に阻害する(⑫)。ジインドリルメタン(DIM)はSTAT3とAkt活性を阻害し(⑬)、シリマリンはmTORC1とHIF-1活性を阻害する(⑭)。酸素ナノバブル水はがん組織の低酸素を軽減する(⑮)。これらを組み合せると、がん細胞における低酸素と低酸素誘導因子−1(HIF-1)の活性を抑制してがん細胞の増殖を抑制できる。
597)低酸素誘導因子-1(HIF-1)の活性化を阻害する方法
【肺機能が低下したがん患者は予後が悪い】
がん組織の微小環境における低酸素は、がん細胞の悪性度を高め、患者の予後を悪くする要因となっています。高圧酸素療法や酸素吸入などによってがん組織の低酸素状態を軽減すると、生存期間が延びるという動物実験の報告もあります。
人間でも、呼吸器機能ががん患者の予後と関連することが報告されています。以下のような報告があります。
Pulmonary function impairment predicted poor prognosis of patients with hepatocellular carcinoma after hepatectomy.(肺機能障害は、肝切除後の肝細胞がん患者の不良予後を予測した)Oncotarget. 2017 Sep 12;8(43):75326-75335.
【要旨】
腫瘍組織の低酸素は、肝細胞がんを含む様々ながんの進行および転移に影響を及ぼす。
高圧酸素療法が肝細胞がん患者の予後を改善し、合併症を軽減する可能性があることが複数の臨床試験で示されている。しかし、肺機能が肝細胞がんの予後に影響を与えるかどうかは不明のままである。
この研究では、肺機能が、喫煙、肝硬変、腫瘍サイズ、Edmondson-Steinerグレード、手術時の出血量および手術前後の輸血などの臨床病理学的特徴と関連していることを明らかにした。
Cox比例ハザード回帰分析により、喫煙、腫瘍の数、腫瘍サイズ、肝硬変、手術時の出血量および肺機能は、全生存期間および無病生存期間の独立した危険因子であった。
さらに、肺機能の低下は、患者の生存期間の短縮および肝細胞がんの再発の増加と独立に関連していた。特に、肝硬変を有する肝細胞がんは予後が悪化することも予測した。
要約すると、我々の研究は肺機能が肝細胞がんの進行に影響を与える可能性があることを見出した。肺機能を改善することで、肝細胞がん患者の全生存期間および無病生存期間が向上する可能性が示唆された。
低酸素は固形がんでは一般的な特徴です。低酸素状態はがん細胞の増殖や浸潤や転移を促進し、抗がん剤や放射線治療に対する抵抗性を亢進し、患者の予後を悪くする要因となっています。
さらに、低酸素は解糖系を亢進して、乳酸の産生を増やし、ミトコンドリアでの酸素呼吸を抑制して活性酸素の産生を低下させ、アポトーシスを起こしにくくします。
乳酸産生の亢進はがん組織における水素イオンの量を増やして、がん組織を酸性化します。がん組織の酸性化は、がん細胞の浸潤や転移を促進し、血管新生を亢進し、免疫細胞の働きを阻害します(下図)。
低酸素ががん患者の予後を悪くすることは肝臓がんだけでなく、他の多くのがんで当てはまります。体内に取込む酸素の量を増やし、がん組織の低酸素状態を改善することが、がん細胞の悪性度を低下させ、増殖や浸潤や転移を抑制する手段として有効と言えます。
貧血も、がん組織の低酸素状態を悪化させ、がん細胞の悪性度を高める可能性があります。

図:正常組織は整然とした血管網で栄養と酸素供給が行われている(①)。一方、がん組織では血管網が不完全で、血液が十分に行き渡らない低酸素領域が多く存在する(②)。酸素は血液から拡散によって組織に広がるので、血管から離れた領域のがん細胞は低酸素になっている(③)。低酸素のがん細胞は浸潤性や転移能を亢進し、細胞死(アポトーシス)に抵抗性になり、放射線や抗がん剤に対する感受性が低下する。その結果、低酸素のがん細胞の悪性度と治療抵抗性が亢進する(④)。さらに、解糖系亢進が亢進する結果、乳酸とプロトン(水素イオン)の産生増加によってがん組織の酸性化が起こる(⑤)。組織の酸性化は免疫細胞の働きを阻害し、がん細胞の浸潤性と血管新生を亢進する(⑥)。
【低酸素はがん幹細胞を増やす】
組織の細胞には幹細胞(stem cell)と成熟した体細胞が存在します。組織の幹細胞とは、組織固有の多分化能を有して各臓器・組織を構成する細胞の供給源となる細胞です。
組織幹細胞は自己複製によって幹細胞を維持すると同時に、不均等分裂により一部が自己複製のサイクルから逸脱して成熟細胞へと分化して、組織を構成する細胞(体細胞)を作り出しています。
組織幹細胞は、分裂して自分と同じ細胞を作り出すことができ(自己複製能)、いろいろな細胞に分化できる(多分化能)という二つの重要な性質を持ち、この性質により、限られた寿命のある体細胞を絶えず供給し、傷ついた組織を修復することができるのです。
がん組織においても正常組織における幹細胞システムに類似した階層性が存在し、その中にがん幹細胞 (cancer stem cells)と呼べるような細胞が存在して通常のがん細胞を供給しながらがん組織を構成していることが明らかになっています。
すなわち、無限に自己複製を行うがん幹細胞ががん組織中に少数存在し、不均等分裂により一部が自己複製のサイクルから逸脱して分化し通常のがん細胞となっているのです。多くの場合、このがん幹細胞の起源は通常の組織幹細胞と考えられています。

図:(左)正常組織の細胞には幹細胞と成熟した体細胞が存在する。幹細胞は組織固有の多分化能を有して各臓器・組織を構成する細胞の供給源となる。組織幹細胞は自己複製によって幹細胞を維持すると同時に、不均等分裂により一部が自己複製のサイクルから逸脱して成熟細胞へと分化して、組織を構成する細胞(体細胞)を作り出している。
(右)がん組織にはがん幹細胞 (cancer stem cells)と呼ばれる細胞が存在して、通常のがん細胞(成熟がん細胞)を供給しながらがん組織を構成している。がん幹細胞は自己複製を行う一方、不均等分裂により一部が自己複製のサイクルから逸脱して分化し通常のがん細胞となっている。
がん幹細胞(cancer stem cell)は腫瘍始原細胞(tumor initiating cell)とも呼ばれ、がん細胞を生み出すもとになる細胞であり、がん組織中に少数(数%程度)存在しています。そして、がん幹細胞は正常な組織幹細胞と同様、特別な微小環境中に存在し、周りの細胞から分泌される液性因子などによって、多分化能の維持や分裂増殖が制御されていると考えられています。
生体内で幹細胞がその性質を維持するために必要な微小環境を幹細胞ニッチ (stem cell niche)と言います。
ニッチ(niche)とは、もともと西洋建築で彫像などを置くために設けられた窪みの部分を指し「隙間」を意味します。経済分野で使われる「ニッチ産業」は「隙間産業」とも呼ばれ、他の企業が進出していない、小さな分野や市場に対して使われていますが、このニッチ(niche)と同じ用語です。
幹細胞を単離して培養すると、幹細胞の自己複製能や未分化性が次第に無くなって来ます。つまり、幹細胞がその性質を維持するためには適切な環境が必要であると考えられており、この環境のことを幹細胞ニッチと言います。
この微小環境は細胞毒性のある薬剤から幹細胞を防御する盾としても機能します。したがって、がん幹細胞の性状を維持し、がん幹細胞を薬剤などから守っている微小環境はがん治療の有力なターゲットになります。
【低酸素はがん幹細胞を増やす】
がん組織を構成するがん細胞をばらばらに単離して、それを同じ種類の動物に植えても、多くのがん細胞は腫瘍を形成できません。腫瘍を形成するのは、がん幹細胞と言われる一部のがん細胞です。
腫瘍を形成するがん細胞は分化度が低く、無限に増殖する能力を持っています。
低酸素は細胞分化を阻止します。がん細胞を低酸素状態(1% O2)で培養すると、脱分化の遺伝子の発現が増え、分化の遺伝子の発現は抑制されます。
低酸素状態ががん幹細胞の性状の獲得促進や維持にも重要であることが報告されています。以下のような報告があります。
The hypoxic tumor microenvironment in vivo selects the cancer stem cell fate of breast cancer cells(生体内での低酸素腫瘍微小環境は、乳がん細胞のがん幹細胞の性状を選択する)Breast Cancer Res. 2018; 20: 16.
【要旨の抜粋】
研究の背景:腫瘍組織の低酸素は、患者の予後不良と関連する独立した予後決定因子である。正常幹細胞およびがん幹細胞の両方の幹細胞表現型を、低酸素状態が潜在的に維持または増強し得ることが多くの研究で示されている。しかしながら、生体内におけるがん細胞の性状が、腫瘍微小環境における低酸素状態によって調節されるかどうかは明らかになっていない。
方法:ヒト乳がん細胞株MDA-MB-231およびMCF7を用いて、低酸素腫瘍細胞を生体内(in vivo)で同定する低酸素感知異種移植モデルを確立した。低酸素の腫瘍細胞は、緑色蛍光タンパク質の蛍光によって同定された。低酸素腫瘍細胞は、移植腫瘍からフローサイトメトリーによって選別され、その幹細胞特性の詳細な分析が行われた。
結果:移植腫瘍組織から新たに単離された低酸素腫瘍細胞には、がん幹細胞様の性状を有する腫瘍細胞が多く含まれていた。低酸素腫瘍細胞のがん幹細胞特性は、マウスへの再移植によってさらに増強された。PI3K / AKT経路は、低酸素腫瘍細胞において強力に増強され、がん幹細胞様表現型を維持するために必要であった。
重要なことに、低酸素腫瘍細胞と非低酸素腫瘍細胞との間の細胞性状の違いは、in vivoで低酸素腫瘍微小環境から単離された腫瘍細胞においてのみ見られ、細胞培養(in vitro)で低酸素状態にされた腫瘍細胞では見られない。
結論:これらの結果は、腫瘍微小環境における低酸素状態が、腫瘍細胞におけるがん幹細胞様性状を誘導し、この性状の選択および維持を促進することによって、がん細胞の悪性進展および治療抵抗性を促進することを示唆している。
低酸素はがん細胞の分化度や幹細胞性(stemness)といったがん細胞の性状に影響を及ぼすことが明らかになっています。
通常の抗がん剤治療や放射線治療に対して、成熟したがん細胞は死滅しやすいのですが、がん幹細胞は様々な機序で抵抗性を示します。がん幹細胞が生き残れば、がんはいずれ再燃・再発するので、がん幹細胞の放射線感受性や抗がん剤感受性を高める方法の開発が重要と考えられています。

図:成熟がん細胞は抗がん剤や放射線で死滅しやすいが、がん幹細胞は死滅しにくいので抗がん剤治療や放射線治療で生き残る(①)。がん幹細胞は腫瘍形成能を持つので、生き残ったがん幹細胞が増殖して再発や再燃が起こる(②)。治療を繰り返すと治療抵抗性のがん幹細胞が増え、治療抵抗性が亢進する(③)。
この論文では、腫瘍組織の微小環境における低酸素が、がん幹細胞の性状を持ったがん細胞の数を増やすことを示しています。
低酸素の腫瘍組織から採取したがん細胞は、分化度が低く、がん幹細胞の性状に関連した遺伝子の発現が亢進していることが報告されています。つまり、「がん細胞は低酸素になると分化度が低下し、がん幹細胞の性状を発現し、悪性度が亢進する」ということです。
低酸素の領域のがん細胞はPI3K/AKT 経路が強度に亢進し、これはがん幹細胞の性状を維持するために必要と言っています。
つまり、がん組織の低酸素の改善と同時に、PI3K/AKT 経路の阻害を併用することが、がん幹細胞の維持を阻止する手段として重要だと言えます。
【低酸素誘導因子-1の発現亢進ががん幹細胞を維持する】
低酸素の環境は、がん幹細胞を育てる最適な環境と考えられています。
低酸素は低酸素誘導因子-1(Hypoxia Inducible Factor-1: HIF-1)という転写因子を活性化します。このHIF-1は何百という遺伝子の発現を亢進し、その中には細胞を幹細胞化させる遺伝子が含まれます。たとえば、HIF-1はNANOGという遺伝子の発現を亢進しますが、このNANOG遺伝子は幹細胞の多能性を安定化させる因子として働きます。
幹細胞の維持に必要な遺伝子としてNANOG, OCT-4, SOX-2, KLF4 , C-MYCなどが知られています。細胞を初期化してiPS細胞を作る時に導入されるいわゆる山中因子というのは、Oct3/4、Sox2、Klf4、c-Mycの四つです。この4つはがん幹細胞の維持にも必要です。NANOG は多能性を安定化させる因子と見られています。
生物は外界の酸素濃度を認識する巧みな仕組みを保持しています。
酸素濃度が低下すると、生物は低酸素シグナルを活性化し低酸素状態に適応します。
この低酸素応答の中心的分子が低酸素誘導因子-1(Hypoxia inducible factor-1: HIF-1) およびプロリル・ヒドロキシラーゼ(prolyl hydroxylase )と呼ばれるタンパク質です。
HIF-1は、細胞が酸素不足に陥った際に誘導されてくる転写因子です。αとβの2つのサブユニットからなるヘテロ二量体であり、βサブユニットは定常的に発現して細胞核にいますが、 HIF-1αは細胞質で酸素濃度依存的な分解を受けます。(HIFのαサブユニットにはHIF-1α, -2α and -3α、βサブユニットにはHIF-1β, -2β and -3βのそれぞれ3種類が知られていますが、低酸素誘導因子として中心になっているのはHIF-1αとHIF-1βであるため、HIF-1をHIFの同義語として使用しています。)
HIF-1αは、正常酸素濃度下では、HIF-1αタンパク質中の2カ所のプロリン残基がプロリル・ヒドロキシラーゼにより水酸化されることによりVHL(von Hippel-Lindau)タンパク質が結合します。VHLが結合するとHIF-1αのユビキチン化が促進されて26Sプロテアソームで分解されます。したがって、酸素が十分にある状況ではHIF-1は不活性の状態に維持されます。
プロリル・ヒドロキシラーゼは酸素濃度感受性のタンパク質で、酸素濃度が低下するとプロリル・ヒドロキシラーゼの酵素活性が著しく低下します。すると、HIF-1αのプロリン残基の水酸化が起きないので、HIF-1αは分解を受けずに安定化します。
安定化したHIF-1αは核内に移行し、HIF-1βと二量体を形成して低酸素応答配列(Hypoxia Responsive Element)に結合して、低酸素応答に必要な様々な遺伝子の発現を活性化します。
すなわち、HIF-1は各種解糖系酵素、グルコース輸送蛋白、血管内皮増殖因子(VEGF)、造血因子エリスロポイエチンなど多くの遺伝子の発現を転写レベルで制御し、細胞から組織・個体にいたる全てのレベルの低酸素適応反応を制御しています(下図)。

図:酸素濃度が高い状態では、HIF-1αは酸素濃度感受性タンパク質のプロリル・ヒドロキシラーゼによって水酸化され、VHL(von Hippel-Lindau)タンパク質が結合して26Sプロテアソームで分解される。低酸素状態ではプロリル・ヒドロキシラーゼの活性が低下してHIF-1αの分解が阻止されるので、蓄積したHIF-1αは核内に移行してHIF-1βとヘテロダイマー(ヘテロ二量体)を形成して遺伝子の低酸素応答配列に結合し、低酸素状態の適応に必要な様々な遺伝子の発現を誘導する。
【がん細胞では低酸素でなくてもHIF-1が恒常的に活性化している】
がん細胞の代謝の特徴は、酸素が十分に利用できる状況でも、酸素を使わない解糖系が亢進し、ミトコンドリアでの酸素を使ったエネルギー産生(酸化的リン酸化)が抑制されていることです。つまり、酸素があっても、あたかも低酸素のような代謝を行っているわけです。
このような代謝の特徴の根本的なメカニズムは、がん細胞では酸素濃度とは関係なく、恒常的にHIF-1が活性化しているためです。つまり、がん細胞では恒常的に低酸素シグナルがオンになっているということです。その理由は、がん細胞で活性化されているmTORやSTAT3がHIF-1の産生を促進するからです。
がん細胞の増殖シグナル伝達系であるPI-3キナーゼ/Akt/mTORC1シグナル伝達系においてmTORC1はHIF-1のタンパク質の産生(mRNAからタンパク質の翻訳)を促進します。また、増殖因子やサイトカインで活性化されるSTAT3という転写因子はHIF-1遺伝子の転写を亢進します。
mTORC1(哺乳類ラパマイシン標的タンパク質複合体1)はリボソームの生合成を促進するS6Kをリン酸化して活性化する作用によって蛋白質合成を促進し、HIF-1タンパク質の産生を増やします。
一方、STAT(signal transducer and activator of transcription;シグナル伝達兼転写活性化因子)は、様々な増殖因子やサイトカインを中心とする細胞外からの刺激によって活性化されたJAKなどのチロシンキナーゼによってリン酸化を受けると2量体を形成し、核内に移行してさまざまな遺伝子の発現を誘導します。STAT転写ファミリーには7種類が存在しますが、特にSTAT3はほとんどすべての固形がんで活性化されており、細胞のがん化に重要な働きをすることが分かっています。
STAT3はHIF-1の遺伝子発現(転写)を促進することが知られています。つまり、がん細胞で活性が亢進しているmTORC1とSTAT3はHIF-1タンパク質の産生量を相乗的に高めることが報告されています(下図)。
HIF-1αタンパク質の発現量が増えても、HIF-1αの分解に関与するプロリル・ヒドロキシラーゼやVHL(von Hippel-Lindau)タンパク質が正常に働けばHIF-1の活性亢進を抑制できますが、がん細胞ではプロリル・ヒドロキシラーゼやVHLの発現低下や遺伝子変異によってHIF-1αの分解過程に異常を起こしていることも多いことが報告されています。

図:増殖刺激や遺伝子変異などによってがん細胞で恒常的に活性が亢進しているSTAT3(シグナル伝達兼転写活性化因子)はHIF-1遺伝子の転写(mRNAの産生)を促進し、mTORC1はリボソームの生合成を促進するS6Kを活性化してHIF-1タンパク質の合成を促進する。
【HIF-1活性が高いがん細胞は浸潤・転移しやすい】
急速に増大するがん組織の中で、がん細胞は常に低酸素と低栄養による細胞死の危険にさらされています。そこで、低酸素や低栄養による細胞死を起こさないようにするメカニズムとしてがん細胞はHIF-1活性を高めています。これは、HIF-1活性が亢進しているほど、がん細胞は低酸素や低栄養で生存できる(死ににくい)ということを意味しています。
HIF-1はピルビンン酸脱水素酵素キナーゼ(下図のPDK:ピルビン酸脱水素酵素を阻害する)の発現を促進してピルビン酸脱水素酵素(ピルビン酸からアセチルCoAへの変換)の活性を低下させ、さらにピルビン酸から乳酸への嫌気性解糖系に働く乳酸脱水素酵素(LDH)の発現を促進する作用があります。
つまり、HIF-1はピルビン酸からアセチルCoAへの変換を阻害してTCA回路と酸化的リン酸化での代謝を抑制し、嫌気性解糖系(ピルビン酸から乳酸の変換)を亢進します。さらに、HIF-1は腫瘍特異的なピルビン酸キナーゼ-M2の発現を促進し、解糖系の途中におけるグルコース代謝産物から核酸や脂肪酸やアミノ酸の合成を促進する作用(ペントースリン酸経路の亢進)もあります。
また、HIF-1はがん幹細胞の幹細胞として能力を維持させる作用、上皮-間葉移行や細胞接着因子の遺伝子発現を誘導する作用、VEGFを介する血管新生によりがん細胞の遠隔転移を促進する作用なども知られています。
つまり、HIF-1活性が亢進するとグルコースの取込みと解糖系とペントースリン酸経路が亢進し、ミトコンドリアでの酸化的リン酸化の活性が抑制され、さらに、血管新生が促進され、乳酸の産生が増えると免疫細胞が抑制され、結合組織の分解も促進されて転移や浸潤が起こりやすくなるので、HIF-1活性が高いがんほど予後が悪いと言えます。(下図)

図:低酸素誘導因子(HIF-1)によって発現誘導や活性亢進される因子を図中の黄色地で赤字で示している。HIF-1はグルコース・トランスポーター(GLUT)の量を増やしてグルコースの取込みを増やす。ヘキソキナーゼ(HK)の量を増やして解糖系を亢進しグルコース-6-リン酸脱水素酵素(G6PD)を増やしてペントース・リン酸経路を活性化する。乳酸脱水素酵素(LDH)の量を増やしてピルビン酸から乳酸への変換を促進し、ピルビン酸脱水素酵素キナーゼ(PDK)を誘導してピルビン酸脱水素酵素を阻害して、ピルビン酸からアセチルCoAへの変換を阻害してミトコンドリアでの酸化的リン酸化を抑制する。乳酸を細胞外に排出するモノカルボン酸トランスポーター-4(MCT4)や血管新生を促進する血管内皮細胞増殖因子(VEGF)の発現を誘導する作用もある。これらの作用によって、がん細胞では解糖系が亢進し、ミトコンドリアでの酸化的リン酸化を抑制され、血管新生や免疫抑制や結合組織の分解などによって、増殖や浸潤や転移が促進される。
【ジインドリルメタンはAkt活性を阻害する】
今までの解説から、mTORC1(あるいは上流のPI3K/Aktシグナル伝達系)とSTAT3を同時に阻害し、さらにがん組織の低酸素状態を軽減すると、HIF-1の活性を低下させることができます。
PI3K/Akt/mTORC1経路とSTAT3経路の阻害には、ジインドリルメタン(STAT3阻害+HIF-1阻害)、セレコキシブ(COX-2阻害+IL-6/STAT3阻害)、ラパマイシン(mTORC1阻害)、オーラノフィン(IL-6/STAT3阻害)などが使用できます。
ブロッコリーやケールなどのアブラナ科の植物や野菜には抗がん作用のある成分が多く含まれていますが、その代表的な成分がGlucobrassicin(グルコブラシシン)です。グルコブラシシンは加水分解してインドール-3-カルビノール(Indole-3-carbinol)になり、さらに胃の中の酸性の条件下では、インドール-3-カルビノールが2個重合したジインドリルメタン(3,3'-diindolylmethane, DIM)になります(下図)。

図:アブラナ科の植物(ブロッコリーやケールなど)には多くの抗がん作用が知られている。アブラナ科植物に含まれるグルコブラシシンは加水分解してインドール-3-カルビノールになり、さらに胃の中の酸性の条件下でインドール-3-カルビノールが2個重合したジインドリルメタンになる。このジインドリルメタンに様々なメカニズムによる抗がん作用が報告されている。
ジインドリルメタンは消化管から容易に吸収され、体中の臓器や組織に移行することが知られています。ジインドリルメタン(DIM)には様々なメカニズムによる抗がん作用が報告されています。
例えば、乳がんや前立腺がんをはじめ、多くのがん細胞の増殖を抑え、細胞死(アポトーシス)を誘導することが報告されています。
Akt活性を阻害する作用も複数報告されています。
Akt (プロテインキナーゼBまたはPKBとしても知られている) はセリン/スレオニンキナーゼです。多くのシグナル伝達経路のネットワークの中心的存在で、下流の幅広いターゲット分子や相互作用分子を介してさまざまな細胞内反応を引き起こします。
以下のような報告があります。
Regulation of YAP through an Akt-dependent process by 3, 3'-diindolylmethane in human colon cancer cells.(ヒト大腸がん細胞における3,3’ジインドリルメタンによるAkt依存性機序を介するYAPの制御)Int J Oncol. 2013 Dec;43(6):1992-8.
この論文では、ジインドリルメタンはヒト大腸がん細胞において、Hippo経路を活性化してPI3K/Akt経路を阻害するメカニズムでアポトーシスを誘導することを報告しています。
3,3'-Diindolylmethane exhibits antileukemic activity in vitro and in vivo through a Akt-dependent process.(3,3’ジインドリルメタンはAkt依存性機序によってin vitroとin vivoにおいて抗白血病活性を示す)PLoS One. 2012;7(2):e31783.
ジインドリルメタンは白血病細胞に対して、細胞培養(in vitro)とマウスの移植腫瘍(in vivo)の実験系で、抗腫瘍作用を示し、その作用メカニズムとしてAkt活性の阻害が重要であることを報告しています。
Diindolylmethane suppresses ovarian cancer growth and potentiates the effect of cisplatin in tumor mouse model by targeting signal transducer and activator of transcription 3 (STAT3)(ジインドリルメタンはSTAT3を標的にすることによってマウスの移植腫瘍の実験モデルにおいて卵巣がんの増殖を抑制し、シスプラチンの抗腫瘍効果を増強する)BMC Med. 2012; 10: 9.
【要旨】
研究の背景:Signal transducer and activator of transcription 3 (STAT3:シグナル伝達兼転写活性化因子3)は卵巣がんの多くにおいて活性化されており、卵巣がんのシスプラチンに対する抵抗性獲得に関与している。我々は、以前の研究において、ジインドリルメタンが卵巣がん細胞の増殖を阻害することを報告している。しかし、ジインドリルメタンの増殖抑制作用の作用機序については明らかにされていない。本研究では、ジインドリルメタンの作用機序を検討した。
実験方法:ヒト卵巣がん細胞株6種類を用いた培養細胞の実験系と、マウスに卵巣がん細胞を移植した動物実験モデルを用い、ジインドリルメタン単独の効果とシスプラチンとの併用効果について検討した。
結果:ジインドリルメタンは培養細胞の実験系で、6種類のヒト卵巣がん細胞全てに対してアポトーシス(細胞死)を誘導した。STAT3のTyr-705(チロシン705)とSer-727(セリン727)におけるリン酸化は、ジインドリルメタンによって用量依存的に抑制された。
さらに、ジインドリルメタンはSTAT3の核内への移行とDNA結合と転写活性を阻害した。インターロイキン-6によって誘導されるTyr-705におけるSTAT3のリン酸化もジインドリルメタンによって顕著に阻害された。
遺伝子導入によってSTAT3を過剰発現させると、ジインドリルメタンによって誘導されるアポトーシスは阻止された。さらに、卵巣がん細胞および卵巣がん組織におけるインターロイキン-6の発現量はジインドリルメタンによって減少した。
ジインドリルメタンは低酸素誘導性因子1α(HIF-1α)と血管内皮細胞増殖因子の発現を抑制してがん細胞の浸潤と血管新生を阻害した。
さらに重要なことは、ヒト卵巣がん細胞SKOV-3細胞におけるシスプラチンの作用をSTAT3を介する機序で増強した。
1日に3mgのジインドリルメタンの経口投与とシスプラチンの投与は移植腫瘍の増殖を著明に抑制した。腫瘍組織におけるアポトーシスの増加と、STAT3活性の抑制が認められた。
結論:以上の実験結果より、ジインドリルメタン単独あるいは抗がん剤との併用の有用性について卵巣がんの臨床例を対象に検討する価値がある。
前述のように、STAT3は、STAT (Signal Tranducer and Activator of Transcription:シグナル伝達兼転写活性化因子) ファミリーに属する蛋白質で、その名の通り、シグナル伝達と遺伝子転写活性化の両方において働きます。STAT3は非活性化状態においては細胞質に存在しますが、Janusキナーゼ(JAK)が活性化されることによってリン酸化を受け、核内へ移行して目的遺伝子を活性化する転写因子として機能します。
IL-6ファミリーのサイトカインあるいはEGF等の成長因子がそれらの受容体に結合することによりJanusキナーゼ(JAK)が活性化されると、活性化されたJAKがSTAT3のチロシン705をリン酸化します。
チロシン705がリン酸化されたSTAT3二分子のSH2ドメインがそれぞれ他方の分子のリン酸化チロシンと相互作用することにより二量体を形成して核内に移行し、核内に移行したSTAT3二量体は標的となるDNAに結合する事で転写を活性化します。これをJAK-STAT経路と言います。STAT3は種々の腫瘍に恒常的に発現しておりますが、STAT3の機能を阻害するとアポトーシスが誘導されることから、STAT3阻害剤は新たな抗がん剤のターゲットとして着目されています。
さて、この論文では、ジインドリルメタンは卵巣がんに対するシスプラチンの効果を増強し、その機序としてSTAT3の活性化を抑制する効果を示唆しています。STAT3活性を抑制することはHIF-1の活性抑制にも効果があります。
ジインドリルメタンがHIF-1の発現量を減少させるという実験結果も報告されています。以下のような論文があります。
3,3'-diindolylmethane reduces levels of HIF-1alpha and HIF-1 activity in hypoxic cultured human cancer cells.(ジインドリルメタンは低酸素で培養したヒトがん細胞におけるHIF-1αの量とHIF-1活性を減少させる)Biochem Pharmacol 75(9):1858-67, 2008
この論文では、がん細胞が低酸素状態になったときに活性化される転写因子のHIF-1の発現をジインドリルメタンが阻害することを培養がん細胞を使った実験で報告しています。HIF-1は血管内皮細胞増殖因子(VEGF)などの血管新生に関与する蛋白質の発現を誘導します。したがって、ジインドリルメタンは、腫瘍の血管新生を阻害してがん細胞の増殖を抑制する効果が示唆されたという内容です。
ジインドリルメタンに関しては、Akt/NF-κBシグナル伝達系を阻害する作用によって、がん細胞の細胞死(アポトーシス)を誘導する作用や、抗がん剤に対する感受性(抗がん剤が効きやすくなること)を高める効果が報告されています。
例えば、乳がん細胞に対するタキソールの効果、前立腺がん細胞の対するタキソテールの効果、膵臓がんに対する抗がん剤(シスプラチン、ジェムシタビン、オキサリプラチン)やタルセバ(erlotinib)の効果を高めることが報告されています。
さらに、NF-κBの活性を阻害することによって、NF-κBによって調節を受け、血管新生やがん細胞の浸潤や転移に関与しているVEGFやIL-8やMMP-9やuPAなどの遺伝子発現を抑え、がん細胞の増殖や転移を抑える効果も報告されています。
様々な機序によって抗がん剤感受性を高める効果が報告されていますので、ジインドリルメタンは抗がん剤治療と併用するサプリメントとして極めて有用だと言えます。
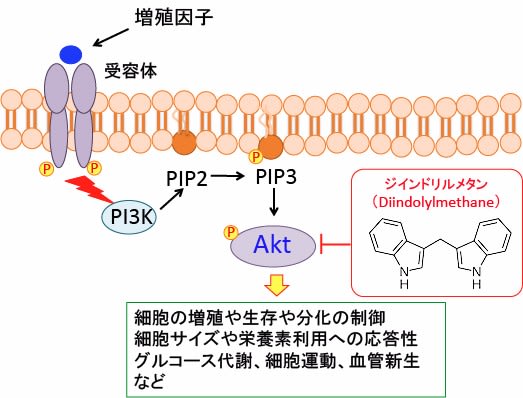
図:PI3キナーゼ-AKT経路は,細胞外からのシグナルを細胞内に伝える主要な経路の一つで、増殖因子やインテグリンを介した細胞接着など、様々な刺激により活性化され、細胞の生存促進,細胞増殖・大きさの制御、細胞運動、代謝の制御など多くの細胞機能に関与している。ホスファチジルイノシトール3-キナーゼ(PI3K)は,細胞膜の構成成分であるイノシトールリン脂質をリン酸化する酵素で,産生したPI3,4,5-三リン酸(PIP3)がAktをリン酸化する。Aktは多くのがん組織で活性しておりAKTシグナル伝達系は、細胞増殖や生存、細胞サイズや栄養素利用への応答性、グルコース代謝、組織浸潤および血管新生など多くの細胞プロセスを制御している。がん細胞の生存と増殖はAKTシグナル伝達系の活性に依存度が高いので、AKTシグナル伝達系の阻害はがん細胞の増殖抑制やアポトーシス誘導を引き起こす。ジインドリルメタンはAKT経路を阻害する。
【シリマリンはがん細胞のワールブルグ効果を阻害する】
ミルクシスルは学名をSilybum marianum と言い、マリアアザミ、オオアザミ、オオヒレアザミなどと呼ばれます。原産は地中海沿岸で、ヨーロッパ全土、北アフリカ、アジアに分布しています。日本においても帰化植物として分布しています。
葉に白いまだら模様があるのが特徴で、この模様はミルクがこぼれたようにみえるためmilk thistle(thistleはアザミの意味)と言い、ミルクを聖母マリアに由来するものとしてマリアアザミの名があります。
このミルクシスルの種子には、シリビニン(silibinin), シリジアニン(silydianin), イソシリビン(isosilybin), シリクリスチン(silychristin)などのフラボノリグナン(flavonolignan)が含まれています。ミルクシスル種子に含まれるフラボノリグナンを総称してシリマリン(silymarin)と呼ばれています。このシリマリンの主成分(含有量は50~60%程度)がシリビニンです。
つまり、ミルクシスルの種子の薬効成分はシリマリン(多種類のフラボノリグナン類の総称)であり、シリマリンの主成分がシリビニンということです(下図)。

図:ミルクシスルの葉の縁は尖った波形で、葉脈に沿って白い縞模様がある。この模様がミルクがこぼれたように見えるため、ミルクシスル(シスルはアザミのこと)と言い、ミルクを聖母マリアに由来するものとしてマリアアザミの名前がついている。種子が薬用として利用され、その薬効成分はシリマリンと呼ばれるフラボノリグナン類で、シリマリンの主成分がシリビニンで、シリビニンは最も生物活性の高いシリマリンと考えられている。
シリマリンには、グルコ-スの取り込みの阻害作用、低酸素誘導因子-1(HIF-1)活性の阻害作用、PI3K/Akt/mTORシグナル伝達系の阻害作用、抗酸化作用などによって転写因子のNF-κB活性を阻害する作用、がん細胞の浸潤や転移を抑制する効果など多彩な抗がん作用が報告されています(図)。

図:シリマリンはワールブルグ効果に中心的に関わっている低酸素誘導因子-1 (HIF-1)の活性阻害、グルコース取り込みの阻害、HIF-1を活性化するシグナル伝達系の阻害、HIF-1による遺伝子発現誘導の阻害など複数の作用点においてがん細胞のワールブルグ効果を阻害する作用が報告されている。
以下のような報告があります。
Silibinin inhibits hypoxia-induced HIF-1α-mediated signaling, angiogenesis and lipogenesis in prostate cancer cells: In vitro evidence and in vivo functional imaging and metabolomics(シリビニンは前立腺がん細胞における低酸素によって誘導されるHIF-1α介在性のシグナル伝達、血管新生および脂肪酸合成を阻害する:in vitroの証拠およびin vivoの機能的イメージングおよびメタボロミクス)Mol Carcinog. 2017 Mar; 56(3): 833–848.
この論文では、ヒト前立腺がん細胞を用いて、シリビニンが低酸素によって誘導されるHIF-1の発現を阻害し、血管新生と脂肪酸合成を抑制して、がん細胞の増殖を抑制する効果を報告しています。
ミルクシスルはヨーロッパにおいて古くから肝障害の治療薬として民間療法として利用されており、シリマリンの肝細胞保護作用や肝機能改善作用の有効性は多くの動物実験や臨床試験で確かめられています。
抗がん剤による肝臓のダメージを軽減し、傷害を受けた肝細胞の再生を促進する作用が確かめられています。
シリマリンは毒性が極めて低く、抗がん剤治療による副作用を軽減する効果が多くの臨床試験で確認されており、抗がん剤や放射線治療の効果を高める作用や、直接的な抗がん剤作用も報告されています。サプリメントとして販売されています。比較的安価で、がん治療に利用するメリットの大きいサプリメントです。
伝統的な使用法は、1日3~9g程度の潰した種子をお湯で煎じて、これを1日数回に分けて服用しています。しかし、シリマリンは水に難溶性であるため、煎じ液を服用する方法では十分にシリマリンを摂取できないと考えられています。薬効を高める目的では、すり潰した種子を料理や飲み物に混ぜて摂取する方法が推奨されています。
ミルクシスル種子は4~6%のシリマリンを含有します。9gの種子にはシリマリンが360~540mg程度含まれている計算になります。
サプリメントとして商品化されているものは、70-80%のシリマリンを含有するように調整されており、臨床試験の多くはこのようなスタンダードな製品を用いています。
臨床試験では、シリマリンを1日に140mgを3回(420 mg/日)の用量で行われています。抗がん作用を目的とする場合は1日1000mg以上のシリマリンを使うこともあります。
ミルクシスルやその成分のシリマリンにはほとんど副作用が無いことが多くの臨床試験で示されています。副作用としては、便が軟らかくなることが稀にあるくらいです。胆汁の分泌が多くなって軟便や下痢の原因になる場合があるからです。
ドイツのコミッションEによると、通常の量を摂取した場合にはミルクシスルによる副作用は報告されていません。米国ハーブ協会の分類では、適切に使用される場合、安全に摂取できるハーブに分類されています。長期投与でも全く毒性は認められていません。
抗がん剤治療の副作用軽減の目的でもよく使用されています。抗がん剤の多くは肝臓で代謝され、肝臓にダメージを与えます。このような抗がん剤治療による肝臓障害に対しても、ミルクシスルの有効性が報告されています。
肝機能障害を発症した急性リンパ性白血病の50人の子供を対象に、ミルクシスルのサプリメントの治療効果がランダム化二重盲検試験で検討されています。その試験結果によると、ミルクシスルの投与によって、肝機能が著明に改善し、副作用によって抗がん剤を減らす必要があった症例の率が低下し、抗がん剤の効き目には差はなかった(抗がん剤の効き目を妨げない)ことが報告されています。
ミルクシスルは肝臓保護作用の他にも、抗がん剤による腎臓や心臓のダメージを軽減する効果も報告されています。放射線による腎臓のダメージにもミルクシスルは保護作用を示します。ラットを使った実験で、ドキソルビシンの心臓毒性と肝臓毒性に対して保護作用を示すことが報告されています。
全身麻酔による副作用や合併症を予防するために、手術前にミルクシスルの服用を推奨する意見があります。シリマリン(420mg/日)の投与によって全身麻酔による肝障害が予防できることが臨床試験で示されています。シリマリンは肝細胞の蛋白質合成能を高め、ダメージを受けた肝細胞の修復や再生を促進します。
ラットを使った実験ではγ線照射の1時間前にシリマリンを投与すると脾臓や肝臓や骨髄のダメージが緩和することが報告されています。
がん組織の低酸素状態の改善には、有酸素運動と酸素ナノバブル水が利用できます(588話参照)。
HIF-1の活性阻害には、ジインドリルメタンとミルクシスル(シリマリン)の他に、メラトニンやラパマイシン、セレコキシブ、オーラノフィンなども有効です(トップの図)。
このような副作用の少ない方法を組み合せて、がん組織の低酸素状態を緩和し、低酸素誘導因子-1(HIF-1)の活性化を阻害する治療法は、がんとの共存を目指す治療において有用だと思います。
| « 596)腫瘍微小... | 598)アポトー... » |



