がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
598)アポトーシス細胞ががん幹細胞の再増殖を促進する:フェニックス・ライジング(不死鳥復活)経路とCOX-2阻害剤
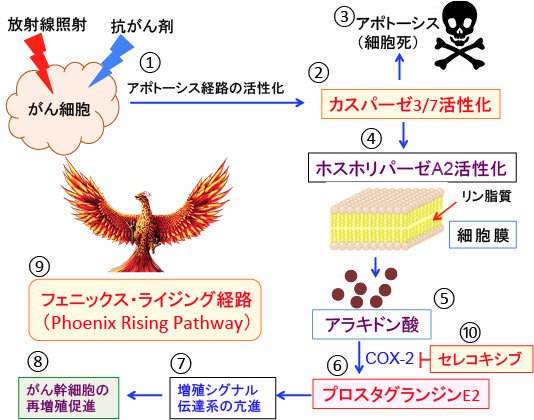
図:がん細胞が放射線照射や抗がん剤で強いダメージを受けるとアポトーシス経路が活性化され(①)、最終的にアポトーシスを実行するカスパーゼ3と7が活性化されて(②)、細胞死(アポトーシス)が誘導される(③)。活性化したカスパーゼ3と7は細胞のホスホリパーゼA2を切断して活性化し(④)、細胞膜のリン脂質からアラキドン酸を産生し(⑤)、がん細胞に過剰に発現しているシクロオキシゲナーゼ-2(COX-2)によってプロスタグランジンE2が産生され、細胞外に分泌される(⑥)。プロスタグランジンE2はがん細胞の増殖シグナル伝達系を強力に刺激して増殖を亢進する(⑦)。そのため、プロスタグランジンE2によって、生き残ったがん幹細胞の再増殖が促進され、がん組織は増大する(⑧)。アポトーシス(細胞死)を起こしたがん細胞によって生き残ったがん幹細胞の再増殖が促進される経路はフェニックス・ライジング(不死鳥復活)経路と呼ばれている。COX-2阻害剤であるセレコキシブ(celecoxib)はフェニックス・ライジング経路を阻害して、放射線治療や抗がん剤治療後の再増殖を阻止する(⑩)。
598)アポトーシス細胞ががん幹細胞の再増殖を促進する:フェニックス・ライジング(不死鳥復活)経路とCOX-2阻害剤
【創傷治癒を促進するフェニックス・ライジング(Phoenix Rising)経路】
フェニックス(Phoenix)というのは、死んでも蘇ることで永遠の時を生きるといわれる伝説上の鳥です。500~600年程生きた後、自ら火中に入って焼かれて死にますが、その灰の中から幼鳥の姿となって再び蘇って永遠の時を生きるとされています。「不死鳥」や「火の鳥」とも呼ばれます。
何度もよみがえる不死鳥にあやかって「フェニックス」という名称は多く使われています。
最近社会問題になっている日本大学アメリカンフットボール部のチーム名もフェニックスです。(このニュースでフェニックス・ライジング経路を思い出しました)
フェニックス・ライジング(Phoenix Rising)というのは「不死鳥復活」という意味です。
創傷治癒に関与するシグナル伝達系にも「Phoenix Rising Pathway」というシグナル伝達系が提唱されています。以下のような論文があります。
Apoptotic cells activate the "phoenix rising" pathway to promote wound healing and tissue regeneration.(アポトーシス細胞がフェニックス・ライジング経路を活性化し、創傷治癒と組織再生を促進する)Sci Signal. 2010 Feb 23;3(110):ra13. doi: 10.1126/scisignal.2000634.
米国のコロラド大学医学部の放射線腫瘍学部門などの研究グループからの論文です。
【要旨】
損傷を受けた組織を再生する能力は、多細胞生物に共通する特徴である。我々は、マウスの創傷治癒と組織再生を促進する際にアポトーシス細胞が果たす役割について報告する。
アポトーシス細胞は、前駆細胞(幹細胞から最終分化細胞へと分化する途中の細胞)または幹細胞の増殖を促進する増殖シグナルを放出した。この過程における重要なタンパク質は、細胞死(アポトーシス)の実行段階に活性化されるプロテアーゼ(タンパク分解酵素)のカスパーゼ3とカスパーゼ7であった。
この2つのカスパーゼのいずれか一方を欠失したマウスでは、皮膚の創傷治癒と肝臓再生が不十分であった。
幹細胞または前駆細胞の増殖と組織再生の促進因子であるプロスタグランジンE2は、この2つのカスパーゼの下流で作用した。
我々は、アポトーシスの実行者であるこれらのカスパーゼが多細胞生物における創傷治癒と組織再生を促進する経路を、「フェニックス・ライジング(phoenix rising)」経路と呼ぶことを提唱する。
組織や臓器が損傷を受けると、残った細胞が増殖して、損傷を修復するメカニズムが作動します。
創傷治癒や組織再生は、多くの細胞が協調的に働く極めて複雑なプロセスです。
一般的には、炎症細胞が組織傷害部位の最初の応答者であると考えられています。マクロファージや好中球のような炎症細胞が、創傷治癒や組織再生プロセスの開始と進行の制御において決定的に重要であるという考えが長くありました。
しかし、マクロファージおよび好中球を欠くノックアウトマウスでも創傷治癒は正常に行われるので、いずれの細胞タイプも皮膚切除創傷治癒には必要でないことが示されています。
損傷した組織の中および周囲の幹細胞は、創傷治癒および組織再生において重要な役割を果たしています。
一般に、損傷組織から放出された因子が、これらの幹細胞および前駆細胞を動員して傷害部位に補充し、それらが増殖し、分化し、最終的に損傷組織を再生すると考えられています。
組織損傷から生じる炎症過程の間に産生される様々な炎症性サイトカインや増殖因子が、創傷治癒や組織再生のシグナル伝達に関与しています。
さらに、この論文では、傷ついた組織の死細胞(アポトーシス細胞)が、組織再生および創傷治癒のプロセスを開始する幹細胞または前駆細胞(幹細胞から最終分化細胞へと分化する途中の細胞)の増殖を刺激するシグナルを送信することを示し、「フェニックス・ライジング(phoenix rising)」経路と呼ぶことを提唱しています。
【カスパーゼ3および7の遺伝子欠損マウスでは創傷治癒過程が阻害される】
カスパーゼは、基質であるタンパク質をアスパラギン酸残基の後で切断するシステインプロテアーゼの総称です。アポトーシスの実行や炎症性サイトカインの活性化に関与するタンパク分解酵素です。
カスパーゼは初め不活性型の前駆体のプロ・カスパーゼ(pro-Caspase)として発現しますが、Fas などの細胞死受容体や各種の傷害刺激などに反応して速やかに切断され、活性型となります。
アポトーシスの過程においては、誘導型カスパーゼ(Initiator caspase)と実行型カスパーゼ(Executioner caspase/Effector caspase)に大別されます。
誘導型カスパーゼ(Caspase-2、8、9、10)は実行型カスパーゼ(Caspase-3、6、7)を切断・活性化することによりアポトーシスのシグナルをスタートさせます。実行型カスパーゼは、多くの細胞内タンパク質を分解し、アポトーシスの実行へと導きます(下図)。

図:細胞死受容体(Fas と TNFR)のリガンド(FasLとTNF)による活性化(外因性経路)は、カスパーゼ8 および カスパーゼ10を活性化する(①)。ダメージを受けたミトコンドリアから放出されるシトクローム c はカスパーゼ-9 を活性化する(内因性経路②)。これらのカスパーゼはイニシエーターカスパーゼ(Initiator caspase)と呼ばれ、下流のエクセキューショナーカスパーゼ(Executioner caspase)のpro-caspase3とpro-caspase 7を切断して活性化する(③)。活性化したカスパーゼ3とカスパーゼ7は細胞内タンパク質を消化してアポトーシスを実行する。
カスパーゼ3および7の遺伝子欠損マウスでは創傷治癒過程が阻害されることが報告されています。つまり、創傷を起こしても、カスパーゼ3および7が活性化しないと幹細胞と前駆細胞(幹細胞から最終分化細胞へと分化する途中の細胞)の増殖を刺激しないのです。
そこで、先ほどの論文では、アポトーシスを実行する際に最終的に作用するカスパーゼ3と7が、組織幹細胞の増殖を促進するメカニズムが検討されています。
アポトーシスを起こした細胞の中で、カスパーゼ3とカスパーゼ7がカルシウム非依存性ホスホリパーゼA2(calcium-independent phospholipase A2 :iPLA2)を活性化して脂肪膜のリン脂質からアラキドン酸の合成を亢進し、さらにシクロオキシゲナーゼの作用によってプロスタグランジンE2が産生されます。
プロスタグランジンE2は組織幹細胞の増殖を刺激し、組織の再生や創傷治癒過程を促進する作用があります。
カスパーゼが正常な細胞に放射線照射を行うとアラキドン酸の産生が亢進しますが、カスパーゼ3の遺伝子欠損細胞に放射線照射を行ってもアラキドン酸は増えませんでした。
カルシウム非依存性ホスホリパーゼA2(iPLA2)は活性化したカスパーゼ3によって切断されることによって活性化することが示されています。
プロスタグランジン(Prostaglandins; PGs)はアラキドン酸からシクロオキシゲナーゼ(Cyclooxygenase; COX)の働きにより合成される生理活性物質で、炎症の代表的なメディエーターです。PGsはいわゆる「アラキドン酸カスケード」によって産生されます。
すなわち、細胞外から種々の刺激に反応して生体膜のリン脂質がホスホリパーゼA2 (PLA2)により、まず不飽和脂肪酸のアラキドン酸に変換されます。この遊離したアラキドン酸を基質として、脂肪酸酸化酵素であるCOXの作用により、PGG2, PGH2へと変換され、さらに各種細胞に存在する特異的な合成酵素により生理的に重要な4種類のPGs (PGD2, PGE2, PGF2a, PGI2)とトロンボキサン(thromboxane; TX)A2が合成されます。
COXにはCOX-1とCOX-2の2種類のアイソザイムが知られています。この2つのCOXは約60%のアミノ酸配列の相同性をもっていますが、それぞれ生体内での役割が異なることが明らかになっています。
COX-1は胃や腸などの消化管、腎臓、卵巣、精嚢、血小板などに存在し、胃液分泌、利尿、血小板凝集などの生理的な役割を担います。
一方、COX-2はサイトカインや発がんプロモーター、ホルモンなどの刺激により、マクロファージ、線維芽細胞、血管内皮細胞、癌細胞などで誘導され、炎症反応、血管新生、アポトーシス、発癌、排卵、分娩、骨吸収などに関与しています(下図)。

図:ホスホリパーゼA2(PLA2)の働きで、細胞膜のリン脂質からアラキドン酸が生成される。シクロオキシゲナーゼ(COX)はアラキドン酸からプロスタグランジンを合成するときに最初に働く酵素で、COX-1とCOX-2の2種類がある。COX-1から合成されるプロスタグランジンは生体の生理機能に必要なものであるが、炎症性の刺激でCOX-2から合成される大量のプロスタグランジンは細胞の増殖を促進する。
アポトーシスを起こしている細胞内で、実行型カスパーゼのカスパーゼ3と7がホスホリパーゼA2を切断して活性化し、アラキドン酸を産生し、さらにシクロオキシゲナーゼ1および2によってプロスタグランジンE2が産生され、このプロスタグランジンE2が組織幹細胞の増殖を促進し、創傷治癒過程を開始し促進するというメカニズムを明らかにして、この経路をフェニックス・ライジング(不死鳥復活)経路と呼ぶことを提唱しています。この論文のまとめの図を以下の示しています。

図:損傷を受けた組織(①)では、アポトーシスを起こしている細胞内では、カスパーゼ9が関与する内因性経路やカスパーゼ8が関与する外因性経路(②)によって、カスパーゼ3とカスパーゼ7が活性化され(③)、アポトーシスが実行される。活性化したカスパーゼ3と7は不活性型のホスホリパーゼA2(PLA2)を切断して活性型にする(④)。活性化したPLA2は細胞膜のリン脂質からアラキドン酸を産生する(⑤)。アラキドン酸はシクロオキシゲナーゼ-1と2(COX-1とCOX-2)によってプロスタグランジンH2(PGH2)に変換され(⑥)、PGH2はプロスタグランジンE2(PGE2)合成酵素によってPGE2が産生される(⑦)。産生されたPGE2は組織幹細胞の増殖を促進して、正常組織の再生を進める(⑧)。
【放射線治療や抗がん剤治療でアポトーシスを起こしたがん細胞はがん幹細胞の再増殖を刺激する】
正常組織では、フェニックス・ライジング経路は損傷組織の修復や再生を促進します。
がん組織では、この経路は放射線治療や抗がん剤治療後の生き残ったがん細胞の再増殖を促進するように作用します。
正常組織もがん組織も、「アポトーシス細胞は残った幹細胞の増殖を促進するシグナルを残して死ぬ」というのがフェニックス・ライジング経路なのですが、この経路の存在はがん治療が失敗する原因にもなります。
放射線治療や抗がん剤治療や放射線治療によってDNAがダメージを受けると、がん細胞は細胞分裂を中止し、ダメージを受けたDNAの修復を開始します。
しかし、ダメージが修復不可能なレベルに大きいと、アポトーシスが実行されます。
このアポトーシスの実行の最終段階で働くのがカスパーゼ3と7です。
このカスパーゼはホスホリパーゼA2を切断して活性化し、アラキドン酸を合成して、さらにPGE2の産生を増やします。がん組織ではがん細胞や炎症細胞がCOX-2を過剰に発現しているので、PGE2の産生量は正常組織より高度になります。
プロスタグランジンE2(PGE2)は生き残ったがん細胞の増殖を促進する増殖因子になります。特に、がん幹細胞の増殖を促進します。
つまり、ダメージを受けたがん細胞はアポトーシスを起こすときに、生き残ったがん幹細胞の増殖活性を高めるようなシグナルを残して死ぬのです。
そこで、放射線治療や抗がん剤治療を行うときにCOX-2阻害剤のセレコキシブ(celecoxib)を併用するとプロスタグランジンE2の産生を抑制して、がん幹細胞の再増殖を阻止できる可能性が指摘されています。
以下のような報告があります。フェニックス・ライジング経路を最初に提唱した研究者からの総説論文です。
Cyclooxygenase-2: A Role in Cancer Stem Cell Survival and Repopulation of Cancer Cells during Therapy(シクロオキシゲナーゼ-2:がん治療中のがん幹細胞の生存とがん細胞の再増殖における役割)Stem Cells Int. 2016; 2016: 2048731.
【要旨】
シクロオキシゲナーゼ-2(COX-2)は、プロスタグランジンE2を含むプロスタグランジン類を合成する誘導型の酵素である。プロスタグランジンE2は炎症や血管新生の主要な化学伝達物質として働く。
COX-2はがん細胞において過剰に発現しており、がん細胞の進行性の増殖と、抗がん剤治療や放射線治療に対するがん細胞の抵抗性の要因になっている。
抗がん剤治療も放射線治療も多数の回数に分けて投与される。これは治療の間にダメージを受けた正常細胞を回復させるためである。
しかし、がん治療を中断している間に生き残ったがん細胞も増殖し、腫瘍の再増殖を引き起こし、治療の有効性を低下させている。
このようながん細胞の再増殖が治療の失敗の主な原因になっている。
通常の抗がん剤治療や放射線治療では、抵抗性の高いがん細胞が選択的に生き残るので、がん細胞の再増殖が起こる。
COX-2の過剰発現とプロスタグランジンE2の産生と放出が、腫瘍の再増殖と患者の予後不良の原因となっていることを示す十分なエビデンスが存在する。
この総説では、がん幹細胞の生物学におけるCOX-2の役割と、がん細胞の再増殖のメディエーターとしての役割を考察し、がん治療に対する抵抗性を克服するターゲットになることを示す。
抗がん剤でがん組織が縮小しても、多くは一時的で、しばらくして再増殖し、転移します。
組織のダメージが組織修復を開始するシグナルになるとき、フェニックス・ライジング経路というシグナル伝達系が働き、その際にプロスタグランジンE2(PGE2)が重要な役割を担っています。
放射線照射やDNA傷害性の抗がん剤ががん細胞にアポトーシスを誘導するとき、アポトーシスを起こしている細胞からPGE2が放出されます。PGE2は強力な増殖因子となって、生き残ったがん幹細胞の増殖を刺激します。その結果、がん細胞の再増殖が起こります。
つまり、PGE2の産生を増やすCOX-2ががんの再増殖や再発を促進するのです。
したがって、COX-2の選択的阻害剤のセレコキシブ(celecoxib)は放射線治療や抗がん剤治療によって引き起こされるがん幹細胞の再増殖を抑制する効果が期待できます。放射線治療や抗がん剤治療にセレコキシブ(商品名:セレコックス)を併用する価値はあると思います。

図:放射線照射や抗がん剤で損傷を受けたがん細胞(①)は、カスパーゼ9が関与する内因性経路やカスパーゼ8が関与する外因性経路(②)によって、カスパーゼ3とカスパーゼ7が活性化され(③)、アポトーシスが実行される。活性化したカスパーゼ3と7は不活性型のホスホリパーゼA2(PLA2)を切断して活性型にする(④)。活性化したPLA2は細胞膜のリン脂質からアラキドン酸を産生する(⑤)。アラキドン酸はシクロオキシゲナーゼ-1と2(COX-1とCOX-2)によってプロスタグランジンH2(PGH2)に変換され(⑥)、PGH2はプロスタグランジンE2(PGE2)合成酵素によってPGE2が産生される(⑦)。産生されたPGE2はがん幹細胞の増殖を促進して、がん細胞の再増殖を促進する(⑧)。
| « 597)低酸素誘... | 599)乳がんと... » |



