がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
596)腫瘍微小環境の低酸素と酸性化を改善する重曹とプロトンポンプ阻害剤とメトホルミンと酸素ナノバブル水
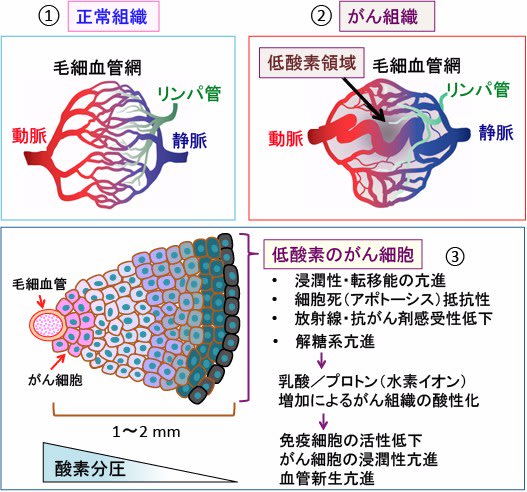
図:正常組織は動脈と静脈と毛細血管が整然とした血管網を形成し、組織全体に血液が均一に行き渡っている(①)。一方、がん組織では血管網が不完全で、血液が十分に行き渡っていない低酸素領域が多く存在する(②)。血管から離れた領域のがん細胞は高度に低酸素になっている(③)。低酸素のがん細胞は浸潤性や転移能を亢進し、細胞死(アポトーシス)に抵抗性になり、放射線や抗がん剤に対する感受性が低下する。さらに、解糖系亢進が亢進する結果、乳酸とプロトン(水素イオン)の産生増加によってがん組織の酸性化が起こる。組織の酸性化は免疫細胞の働きを阻害し、がん細胞の浸潤性と血管新生を亢進する。以上のような多くのメカニズムによって、低酸素はがん細胞の悪性化と転移を促進する。腫瘍組織の低酸素と酸性化を阻止すると、がん細胞の悪性化や転移を防げる。
596)腫瘍微小環境の低酸素と酸性化を改善する重曹とプロトンポンプ阻害剤とメトホルミンと酸素ナノバブル水
【腫瘍組織の間質細胞ががん細胞の生存と増殖をサポートしている】
がん細胞は無限の「自律増殖能」を持つため、がん細胞だけで増殖や転移が可能と思われるかもしれません。しかし、がん細胞だけでは生存も増殖も転移もできません。
がん細胞が生存し増殖していくためには、がん細胞に酸素や栄養を与える血管や、生存や増殖を支持する因子(成長因子など)を産生する線維芽細胞や炎症細胞の存在が必要です。
転移するためには、ケモカインやケモカイン受容体や増殖因子などの働きが必要です。がん細胞が血管壁を通るときには、血管内皮細胞の接着を解離する血管周囲マクロファージの手助けが必要です。
がん組織は、がんの実質細胞である「がん細胞」とそのがん細胞を養う「間質組織」の相互作用によって成り立ちます。間質組織には血管やマクロファージなどの炎症細胞や結合組織を作る線維芽細胞などが存在し、これらの細胞ががん細胞の生存や増殖を維持するために様々な働きを行っています(下図)。

図:がん組織はがん細胞だけでなく、間質に存在する様々な正常細胞から構成されている。がん細胞の増殖や転移は、がん細胞と間質細胞の相互作用によって決められる。がん細胞だけでは増殖も転移もできない。血管内皮細胞や炎症細胞や線維芽細胞や骨髄由来細胞など様々な細胞ががん細胞の増殖や浸潤や転移に関わっている。(参考:Transl Cancer Res. 2013 August 1; 2(4): 309–319のFig1)
正常組織とがん組織はどちらも上皮細胞と間質細胞の相互作用によって形態や機能が維持されています。
がん細胞は様々なケモカインや増殖因子を分泌して、血管内皮細胞や炎症細胞や線維芽細胞などの間質細胞をがん組織に動員しています。一方、動員された線維芽細胞やマクロファージやリンパ球も様々な因子を産生・分泌してがん細胞の増殖や浸潤や転移を促進しています。つまり、がん組織内ではがん細胞と間質の細胞の相互作用によって増殖や転移が制御されているのです。

図:がん細胞は間質の炎症細胞(マクロファージなど)や線維芽細胞や血管によって生存や増殖が維持され刺激されている。がん細胞と間質細胞は密接に相互作用を行うことによってがん組織は増大する。したがって、がん治療においてより効果的な抗腫瘍効果を得るためには、がん細胞と同時に、間質細胞や間質組織もターゲットにすることが重要。
がん細胞は正常な細胞をがん組織内に動員して、がん細胞の生存と増殖に役立つように利用しています。一部の間質細胞(NK細胞やT細胞など)はがん細胞を排除しようとしますが、その抗腫瘍免疫を抑制する細胞(制御性T細胞や骨髄由来抑制細胞など)を動員して、抗腫瘍免疫を抑えています。つまり、がん細胞の増殖や生存に都合の良いように、がん細胞は微小環境を作り、抗腫瘍免疫を抑制するように制御しているのです。

図:がん組織では、マクロファージなどの炎症細胞やがん細胞が産生するケモカインやプロスタグランジンE2(PGE2)や乳酸やプロトン(水素イオン)など様々な刺激やメカニズムによって骨髄由来抑制細胞が増えている(①)。骨髄由来抑制細胞は制御性T細胞を誘導する作用もある(②)。これらの細胞はがん細胞を攻撃・排除する細胞傷害性T細胞(キラーT細胞)やナチュラルキラー細胞(NK細胞)や樹状細胞の働きを阻害している(③)。その結果、がん細胞を排除する免疫応答が十分に行われなくなっている。
免疫力を高めてがん細胞を死滅させる治療を行うときは、ケモカインやプロスタグランジンE2や乳酸や水素イオン(プロトン)の産生を阻止する治療法や、骨髄由来抑制細胞や制御性T細胞の働きを抑制することが重要になります。
例えば、がん組織の酸性化はがん細胞の浸潤や転移を促進し、免疫細胞の活性を低下させます。炭酸水素ナトリウム(重炭酸ナトリウム、重曹)を経口摂取するとがん細胞の浸潤や転移を抑制でき、免疫療法の効果を高めることができることが報告されています(528話参照)。
このような腫瘍組織の微小環境をターゲットにしたがん治療法の重要性が認識されています。
【腫瘍微小環境には細胞性因子と化学的因子がある】
がん細胞の増殖・浸潤・転移などは、がん細胞の性質だけによって規定されるのではなく、がん細胞とその周囲組織から作られる微小環境が重要な役割を果たしていることが明らかになってきています。
腫瘍微小環境は2種類の因子に大別されます。
一つは細胞性因子で、がん細胞と間質細胞とそれらによって作られる細胞外マトリックスが含まれます。間質細胞には、血管やリンパ管の内皮細胞、線維芽細胞、リンパ球、マクロファージ、好中球、骨髄由来抑制細胞などがあります。
二つ目は化学的因子です。これには水素イオン指数(pH)、酸素分圧(pO2)、代謝産物(グルコース、グルタミン、乳酸など)などが含まれます。
がん細胞は解糖系が亢進し、乳酸の産生が増えます。乳酸はイオン化して水素イオン(プロトン)を増やします。グルコース1分子が解糖で2分子の乳酸になるときに2分子のプロトン(H+)が産生されます(下図)。

図:解糖系ではグルコースからピルビン酸とATPが作られる。嫌気性解糖系(乳酸発酵)では、NADH + H+を還元剤として用いてピルビン酸を還元して乳酸にする。乳酸に変換する反応によってNAD+を再生することによって無酸素状態で解糖系での代謝が続けられる。乳酸はイオン化して水素イオン(プロトン)を増やす。その結果、解糖系が亢進すると、細胞内で乳酸とプロトン(H+)が増える。
水素イオン(H+)が蓄積して細胞内のpHが低下して酸性になると細胞内のタンパク質の活性や働きは阻害され、pH低下が顕著になれば細胞は死滅します。そこで、がん細胞は乳酸や水素イオン(プロトン)を細胞外に積極的に排出しています。
乳酸はモノカルボン酸トランスポーター(MCT)という輸送担体で細胞外に排出され、水素イオンは液胞型プロトンATPアーゼ(vacuolar H+-ATPases)、モノカルボン酸輸送体(monocarboxylate transporter:乳酸-プロトン共輸送体)、Na+-H+ 交換輸送体1(Na+-H+ exchanger 1:NHE1)などによって細胞外に放出されます。
がん組織の酸性化した微小環境は、がん細胞の生存にとって様々なメリットを与えます。
組織が酸性化すると正常な細胞が弱り、結合組織を分解する酵素の活性が高まるため、がん細胞が周囲に広がりやすくなり、さらに血管新生が誘導されるので、がん細胞の浸潤や転移が促進されます。
組織が酸性になるとがん細胞を攻撃しにきた免疫細胞の働きが弱ります。
さらに乳酸には、がん細胞を攻撃する細胞傷害性T細胞の増殖や、免疫細胞の働きを高めるサイトカインの産生を抑制する作用があり、がんに対する免疫応答を低下させる作用もあります。
抗がん剤の多くは塩基性なので、酸性の組織には抗がん剤が到達しにくくなり、活性が低下するということも指摘されています。
したがって、がん組織の酸性化を改善できれば、抗がん剤治療や免疫療法の効き目を高めることができることになります。
例えば、胃酸分泌阻害剤として使用されているプロトンポンプ阻害剤がV型ATPアーゼを阻害する作用があることが知られています。動物の移植腫瘍を使った実験などで、プロトンポンプ阻害剤が腫瘍組織の酸性化を改善して抗がん剤や免疫療法の効果を高める作用が報告されています(527話参照)。
炭酸水素ナトリウム(重曹)の摂取ががん組織をアルカリ化して、免疫療法の効き目を高めることが報告されています(528話参照)。

図:がん細胞は解糖系によるグルコース代謝が亢進して乳酸と水素イオン(プロトン、H+)の産生量が増える。細胞内の酸性化は細胞にとって障害になるので、細胞はV型ATPアーゼ(vacuolar ATPase:液胞型ATPアーゼ)やモノカルボン酸トランスポーター(MCT)やNa+-H+ 交換輸送体1(Na+-H+ exchanger 1:NHE1)などの仕組みを使って、細胞内の乳酸や水素イオン(プロトン)を細胞外に排出する。その結果、がん細胞の周囲はpHが低下してがん組織は酸性化している。組織が酸性化すると、免疫細胞の働きが抑制され、血管新生が促進し、がん細胞の浸潤や転移も促進される。
【がん組織は低酸素になりやすい】
正常な組織では、血液の供給が不足して低酸素や低栄養の領域ができないように整然とした血管網が構築されています。
一方、がん組織では、血管網の整備が細胞の増殖に追いつかないので、血液供給が途絶えた低酸素の領域が至る所に存在します。
がん細胞が増殖し、がん組織が大きくなるためには腫瘍組織を養う血管の新生が必要です。血管内皮細胞の増殖速度はがん細胞の増殖に追いつかないので、不完全な血管網が形成されます。
正常組織のような整然とした血管網ではなく、血管壁構造は不完全(血管周皮細胞や基底膜がない、血管平滑筋が不完全、細胞の受容体が無いなど)で、血管のネットワークも不規則でいびつです。
血管抵抗が高く、血流も滞りやすく、血管自体がもろく、漏れ易い状況です。
リンパ管の発達も不完全で、がん組織では組織液の圧が高くなっています。
酸素と栄養素は血管から拡散によって細胞に到達するので、血管から離れたがん細胞は低酸素と低栄養状態に陥っています(下図)。

図:正常組織は整然とした血管網で栄養と酸素供給が行われている(①)。一方、がん組織では血管網が不完全で、血液が十分に行き渡らない低酸素領域が多く存在する(②)。酸素は血液から拡散によって組織に広がるので、血管から離れた領域のがん細胞は低酸素になっている(③)。
血液は肺胞(酸素分圧100mmHg程度)の毛細血管を通過する間に平衡に達して動脈血の酸素分圧は80〜100mmHgとなります。組織の酸素分圧は20~30mmHg程度であり、動脈血と酸素分圧に差があるため、末梢の毛細血管では組織液と血液が平衡に達しようとして酸素が血液から組織液に移ります。酸素を運び終えた静脈血の酸素分圧は40mmHg程度です。
ステンレス針のなかに小さな電極を入れて、腫瘍組織内の酸素分圧を測定する装置(pO2 Histograph)を使ってがん組織内の酸素分圧を測定した報告は数多くあります。例えば、以下のような報告があります。
Detection and characterization of tumor hypoxia using pO2 histography.(酸素分圧ヒストグラフィー法を用いた腫瘍低酸素の検出と特徴付け)Antioxid Redox Signal. 2007 Aug;9(8):1221-35.
この論文では、がん組織の酸素分圧をpO2ヒストグラフィー法で測定した125の論文の研究データをまとめています。
子宮頚がんと頭頚部がんと乳がんのがん組織における酸素分圧(pO2)の中央値は10mmHgで、pO2が2.5 mmHg以下の低酸素領域が25%を占めていると報告しています。転移巣の腫瘍組織の酸素分圧も同様の値でした。
患者のヘモグロビン濃度(8〜15g/dL)は正常組織では組織の酸素分圧に影響しませんが、がん組織では貧血が組織の低酸素状態をより増強することが明らかになっています。
がん組織の低酸素状態は、がん細胞の悪性化を進行し、治療に抵抗性になるため、患者の予後を不良にします。
したがって、がん組織の低酸素状態を評価することは、患者の予後を予測し、治療法を選択するときに役立つと言っています。
正常組織の酸素分圧は20~30mmHgですが、がん組織の酸素分圧の平均は10 mmHg程度で、2.5 mmHg以下の高度に低酸素の領域が25%を占めるというのが、がん組織一般の状態のようです。
酸素分圧(pO2)が10mmHg以下のがん組織は予後不良という報告もあります。低酸素のがん組織は抗がん剤や放射線治療に抵抗性を示すからです。
【がん組織の低酸素状態はがん細胞の悪化を促進する】
低酸素の状態では弱いがん細胞は死滅し、強いがん細胞(死ににくいがん細胞)が選択的に生き残るという選択圧がかかります。
例えば、がん抑制遺伝子のp53が正常ながん細胞は、低酸素状態では死滅します。しかし、p53に変異のあるがん細胞は細胞死(アポトーシス)に抵抗性を示すので、低酸素状態でも生き残ります。
つまり、低酸素状態はアポトーシスを起こしにくい強いがん細胞を選別して増やす推進力になっています。以下のような報告があります。
The Hypoxic Tumor Microenvironment: A Driving Force for Breast Cancer Progression(低酸素腫瘍微小環境:乳がん進行のための推進力)Biochim Biophys Acta. 2016 Mar; 1863(3): 382–391.
【要旨】
腫瘍組織内の低酸素状態は乳がんで共通に認められ、転移リスクと患者死亡率の有意な増加に関連している。
低酸素誘導因子は、原発腫瘍の血管新生および増殖、間質細胞の動員、細胞外マトリクスの再編成、転移を促進する微小環境形成、細胞運動、局所組織浸潤、転移部位における血管外浸入、および転移腫瘍を形成するのに必要ながん幹細胞の性状の維持などを促進するタンパク質をコードする大量の遺伝子の転写を活性化する。
最近の前臨床試験の結果は、細胞毒性薬剤による化学療法と低酸素誘導因子を阻害する薬剤との組み合わせが、トリプルネガティブ乳がんの女性の転帰を改善する可能性があることを示唆している。
低酸素状態で活性化される低酸素誘導因子-1(HIF-1)は多くの遺伝子の発現を誘導して、がん細胞の増殖や転移を促進し、治療抵抗性を引き起こしています。したがって、通常の抗がん剤治療にHIF-1の発現や活性を阻害する治療法を併用することは抗腫瘍効果を高めることができます。
HIF-1活性を抑制する方法については364話と487話で紹介しています。ジインドリルメタン、ジクロロ酢酸ナトリウム、メラトニン、セレコキシブ、オーラノフィン、ラパマイシンなどがあります。
腫瘍組織の低酸素状態は、進行がん患者における独立した予後因子であることが明らかになっています。つまり、腫瘍組織の低酸素状態は、がん細胞の増殖や浸潤や転移を促進する要因となり、他の要因とは独立した予後因子ということです。
したがって、がん組織の低酸素状態を改善することは、がん細胞の悪性化の促進を阻止する重要な方法になります。
【腫瘍組織の低酸素は免疫療法の効き目を阻害する】
腫瘍組織微小環境における低酸素は、抗腫瘍免疫を減弱させる要因として重視されています。腫瘍の低酸素を軽減することはがん細胞に対する免疫療法の効き目を高めることになります。
以下の論文は、米国のピッツバーグ大学がん研究所(University of Pittsburgh Cancer Institute)の腫瘍微小環境センター(Tumor Microenvironment Center)とピッツバーグ大学の免疫学講座(Department of Immunology, University of Pittsburgh)からの報告です。
Efficacy of PD-1 blockade is potentiated by metformin-induced reduction of tumor hypoxia(PD-1遮断の有効性は、メトホルミンによる腫瘍組織の低酸素の軽減によって増強される)Cancer Immunol Res. 2017 Jan; 5(1): 9–16.
【要旨】
免疫チェックポイント分子PD-1の遮断は、多くのがんに対して顕著な効果を発揮し、有効な治療法として注目されている。しかしながら、臨床での成功にもかかわらず、ほとんどの患者はPD-1遮断に応答しない。
代謝の異常はがんにおいて共通して認められるが、異常の程度や性状は患者や腫瘍によって不均一である。
腫瘍組織における低酸素微小環境は抗腫瘍免疫を阻害しており、したがって、腫瘍組織の低酸素状態の正常化は免疫療法に対する有効性を高める可能性がある。
2種類のマウス腫瘍株B16およびMC38は、酸素消費量が異なり、がん組織の低酸素の程度も異なる。そして、この違いがチェックポイント遮断に対する感受性と関連することを我々は明らかにした。
II型糖尿病治療剤として広く使用されているメトホルミンは、インビトロ(細胞培養)およびインビボ(動物実験)でのがん細胞の酸素消費を阻害し、腫瘍内低酸素症を減少させた。
メトホルミン単独での治療は、悪性度の高い腫瘍ではほとんど治療効果がなかったが、メトホルミンとPD-1遮断との組み合わせは、腫瘍内T細胞機能を高め、がん細胞の排除を亢進した。我々のデータは、腫瘍低酸素症が免疫療法に対する障壁として作用することを示唆し、低酸素腫瘍微小環境を改造することは、免疫療法抵抗性の患者を臨床的利益を受ける患者に変換する可能性を示唆している。
細胞傷害性T細胞(キラーT細胞)は抗原提示細胞(樹状細胞やマクロファージ)から抗原を提示されると活性化されて、敵(病原菌やがん細胞など)を攻撃します。
細胞傷害性T細胞にはPD-1やCTLA-4という受容体が存在します。PD-1はプログラム細胞死1(programmed death-1)CTLA-4は細胞傷害性Tリンパ球抗原-4 (cytotoxic T-lymphocyte-associated protein 4)の略です。
これらの受容体のリガンド(受容体に結合して作用する物質)となるPD-L1やB7(B7-1, B7-2)を抗原提示細胞が持つことによって細胞傷害性T細胞の働きを抑制しています。
つまり、PD-1受容体やCTLA-4受容体がリガンドによって刺激されると、T細胞の増殖が停止し細胞死を来すことになります。このようにして細胞傷害性T細胞の過剰な応答を制御しています。
細胞傷害性T細胞の働きを阻害するPD-L1やB7はがん細胞にも発現しています。つまり、がん細胞は免疫系の制御システムを利用して、がん組織内の細胞傷害性T細胞の働きを阻止しています。
PD-1受容体やCTLA-4受容体は細胞傷害性T細胞を死滅させるスイッチなようなものなので、これらのスイッチが入らないようにすれば、細胞傷害性T細胞は生き残ってがん細胞の攻撃力を高めることができます。
CTLA-4に対する抗体(ヒト型抗ヒトCTLA-4モノクローナル抗体)のイピリブマブ(ipilimumab、米国での販売名 : YERVOY)はT細胞のCTLA-4の働きを阻止することで、腫瘍抗原特異的なT細胞の活性化と増殖を促して腫瘍増殖を抑制する作用を発揮します。
PD-1の阻害薬としてはヒト型抗PD-1モノクローナル抗体のニボルマブ(nivolumab商品名「オプジーボ(Opdivo)」)があります。
これらは免疫チェックポイント阻害剤と言います。
体に備わったがん細胞に対する攻撃力を高めてがんを治療しようというのが「がんの免疫療法」の理論です。「免疫細胞を活性化する」という従来の免疫療法では、十分な効果が得られなかったのですが、その大きな理由は免疫応答にブレーキをかける仕組みの存在であることが明らかになってきました。このブレーキを解除して免疫細胞に100%の力でがん細胞を攻撃させようというのが、CTLA-4やPD-1/PD-L1をターゲットにした治療法です。(下図)

図:①抗原提示細胞上にはMHCクラスII(MHC-II)といわれる分子があり、抗原を介してT細胞上のTCR(T細胞受容体)と反応して細胞傷害性T細胞を活性化する。②T細胞上にはCD28とCTLA-4があり、CD28は恒常的に発現し、抗原提示細胞からのB7-1やB7-2というリガンドによってT細胞活性化に作用する。③一方、CTLA-4はT細胞活性化にともなって発現が誘導され、B7-1やB7-2によって刺激されるとT細胞を抑制する。CTLA-4はCD28よりもB7に対する親和性が強いので、活性化したT細胞の過剰な応答を抑制する。④同様に、PD-1(Programmed death-1)は抗原提示細胞のPD-L1(別名B7-H1)と結合することによって抑制型の免疫調節シグナルを活性化させる。がん細胞もB7-1やB7-2やPD-L1が発現しており、細胞傷害性T細胞の働きを抑制している。⑤T細胞のCTLA-4とPD-1の働きを特異抗体で阻害すると、がん細胞に対する細胞傷害性T細胞の働きを高めることができる。
しかし、がん組織が低酸素や酸性化している微小環境だと、細胞傷害性T細胞の働きは低下します。低酸素や酸性化(pHが低い)という状況が細胞の働きを弱めるからです。
【酸素ナノバブル水はがん組織の低酸素を改善する】
酸素ナノバブル水ががん組織の低酸素を改善することが複数の研究グループから報告されています。以下の論文は英国のオックスフォード大学の医用生体工学研究所(Oxford Institute of Biomedical Engineering)の研究グループからの報告です。
Reducing Tumour Hypoxia via Oral Administration of Oxygen Nanobubbles(ナノバブル酸素の経口投与による腫瘍低酸素の軽減)PLoS One. 2016; 11(12): e0168088.
【要旨】
低酸素症は固形腫瘍に対する治療効果を阻害する重要な要因であることが示されている。しかしながら、低酸素症を減少させるための既存の方法は有効性が限られており、有害な副作用が問題なものもある。
この研究の目的は、界面活性剤で安定化された酸素ナノバブル水の経口投与によって、腫瘍の低酸素状態を低下させる可能性を調べることである。
実験は、オスのSCIDマウス(重度複合免疫不全マウス)にヒト膵臓がん細胞(BxPc-3細胞)を移植するマウス異種移植片腫瘍モデルで行った。
100μLの酸素飽和水、酸素ナノバブル水またはアルゴンナノバブル水の単回投与を経口より投与した。
それぞれの水を投与して30分後に腫瘍を切除して(1群3匹づつ)、腫瘍組織内の低酸素誘導因子-1α(HIF-1α)のmRNAとタンパク質の発現レベルをリアルタイム定量的ポリメラーゼ連鎖反応およびウエスタンブロット分析によって測定した。
酸素飽和水もアルゴンナノバブル水も、転写レベル(mRNAレベル)でHIF1α発現に統計的に有意な変化を生じなかった。
対照的に、酸素ナノバブル水の投与を受けたマウスの腫瘍組織では、HIF1αの転写(mRNA)および翻訳(タンパク質)の発現量は、それぞれ75%および25%の減少が見られた(p <0.001)。
このHIF-1α発現の減少レベルは、放射線治療と化学療法の治療効果を改善できるレベルであることが以前の研究において示されている。
加えて、酸素ナノバブル水投与群では、腫瘍組織内の血管内皮細胞増殖因子(VEGF)の発現レベルが有意に減少し、arrest-defective protein 1 homolog A (ARD1A)の発現は増加を示した。
この論文で重要なのは、「酸素ナノバブル水の投与を受けたマウスの腫瘍組織では、HIF1αの転写(mRNA)および翻訳(タンパク質)の発現量が減少した」ということです。
この実験では、腫瘍組織の酸素分圧が上がったことを評価する指標として「HIF-1αの発現レベル」を使っています。
酸素濃度が高い状態では、HIF-1αは酸素濃度感受性タンパク質のプロリル・ヒドロキシラーゼによって水酸化され、VHL(von Hippel-Lindau)タンパク質が結合して26Sプロテアソームで分解されます。
つまり、酸素ナノバブル水を投与して、がん組織の酸素分圧が高くなり、低酸素が改善されると、HIF-1αは急速に分解されます。したがって、HIF-1αのタンパク質が減少したことは、がん組織の酸素分圧が上昇したことを意味します。
血管内皮細胞増殖因子(VEGF)はHIF-1によって転写が促進されるので、VEGFはmRNAもタンパク質も減少します。
以下のような報告もあります。
Oxygen nanobubbles revert hypoxia by methylation programming(酸素ナノバブルはメチル化プログラミングによって低酸素状態を改善する)Sci Rep. 2017; 7: 9268.
【要旨】
低酸素の腫瘍微小環境をターゲットにすることは、がんのエピジェネティクスおよび治療に広範な影響を及ぼす。
ナノサイズのカルボキシメチルセルロースで酸素を封入した酸素ナノバブルは、腫瘍の低酸素状態を軽減することによって、低酸素シグナル伝達系を抑制し、腫瘍成長を阻害することを目的に開発された。
我々は、腫瘍の低酸素領域における5-メチルシトシン(5mC)の低メチル化が、インビトロおよびインビボの両方において、100nm未満のサイズの酸素ナノバブルを使用して、エピジェネティクスによる制御によってがん治療に対する抵抗性を軽減できることを示す。
酸素ナノバブルは、マウスモデルにおける腫瘍進行の有意な遅延および生存率の改善に有効であった。
さらに、BRCA1のプロモーターDNA領域には、酸素ナノバブル(ONB)処理により有意な過剰メチル化が観察された。
ナノバブルはまた、超音波造影剤として機能することに加えて、MAT2AやPDK-1などのいくつかの低酸素関連および腫瘍抑制遺伝子を再プログラムすることもできる。
メチル化逆転のための超音波造影剤としてのナノサイズの酸素封入気泡を開発する我々のアプローチは、エピジェネティックプログラミングおよびがん治療のアジュバントとして重要な影響を及ぼすと予想される。
エピジェネティクス(epigenetics)というのは、DNAのメチル化やヒストン(DNAと結合しているタンパク質)のアセチル化など、クロマチン(DNAとタンパク質の複合体)の後天的な修飾によって遺伝子発現が制御されることです。
DNAの遺伝情報に基づいてメッセンジャーRNA(mRNA)が転写され、さらにmRNAからタンパク質が合成されます。このように遺伝子情報がタンパク質の合成を介して、細胞の構造や機能に変換される過程を「遺伝子発現」と言います。
遺伝子にはその発現を調節する部分があり、これをプロモーターと言います。遺伝子を使うか使わないかを制御している領域のことです。
遺伝子が発現するためには、DNAからRNAを作るRNAポリメラーゼという酵素や遺伝子発現を調節する転写因子がこのプロモーター領域に結合することが必要です。このプロモーター領域には、CpG(C はシトシン、Gはグアニン)という配列が繰り返された部分があり、DNAメチル化とは、DNAのCpGという配列の部分でC(シトシン)にメチル基(-CH3)いう分子がつくことです。
プロモーター領域のDNAにメチル化が起こると、RNAポリメラーゼや転写因子が結合できなくなり、遺伝子からmRNAが転写される段階が阻害され、遺伝子発現のスイッチがオフになるのです。このように、エピジェネティクスによって遺伝子発現のスイッチが切られることを「遺伝子のサイレンシング(silencing)」と呼ばれています。(249話、250話参照)
この論文では、腫瘍組織の低酸素はがん細胞の遺伝子のエピジェネティクスに影響し、酸素ナノバブルによって変化を及ぼすことができるという結果を報告しています。
肺呼吸による酸素吸入でなくても、酸素ナノバブル水でもがん組織の低酸素状態を改善することができるようです。この論文では、酸素ナノバブル水は100 µL を腫瘍内に注射する方法で投与しています。
この論文では、腫瘍を移植されたマウスの平均生存期間が、コントロール群が23.5日に対して酸素ナノバブル水を投与された群では31.5日でした。
抗がん剤のドキソルビシンを投与された群の平均生存期間は31.5日で、酸素ナノバブル水を投与されたマウスと同じでした。
しかし、ドキソルビシンを投与されたマウスは体重が15から20%ほど減少し、毒性による副作用も強く出ていました。しかし、酸素ナノバブル水の投与を受けたグループでは毒性や副作用は全く無かったということです。
肺での呼吸によって吸入される酸素の量に比べれば、酸素ナノバブル水から供給される酸素の量は極めて少ないように思いますが、酸素ナノバブル水の経口投与で腫瘍組織の低酸素が軽減するという報告が複数あるので、効くのかもしれません。
あるいは、単に酸素の運搬体というだけでなく、酸素ナノバブル自体が物理的性状によって何らかの薬効を有するのかもしれません。
いずれにしても、酸素ナノバブル水はがん治療に役立つ可能性はあるように思います。
腫瘍組織の微小循環における低酸素と酸性化を改善することは、がん細胞の増殖抑制や、免疫療法や抗がん剤治療の効き目を高める方法として有用です。
この目的のために、重曹(炭酸水素ナトリウム)、プロトンポンプ阻害剤、メトホルミン、酸素ナノバブル水の併用は有効かもしれません。
◎ 酸素ナノバブル水の詳細はこちらへ:
◎ がんのアルカリ療法(重曹療法)についてはこちらへ:
| « 595) Hippo経... | 597)低酸素誘... » |



