がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
593) 若い女性の肺腺がんは予後が悪い:エストロゲンは肺がんの発生と進行を促進する
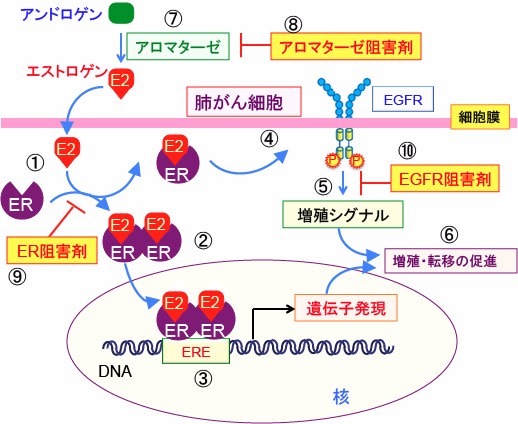
図:女性ホルモンのエストロゲンは肺がん細胞の増殖・転移を促進する。エストロゲン(E2)はエストロゲン受容体(ER)と細胞質内で結合し(①)、二量体を形成して(②)、核内に移行し、遺伝子のエストロゲン応答エレメント(ERE)に結合して(③)、エストロゲン依存性の遺伝子発現を促進する。また、エストロゲンが結合したエストロゲン受容体(ER)は上皮成長因子受容体(EGFR)を活性化し(④)、細胞増殖を促進する(⑤)。このエストロゲン受容体経路とEGFR経路のクロストークによって肺がん細胞の増殖・転移は促進される(⑥)。したがって、血中のエストロゲン濃度の高い若い女性は肺がんの進行が早い。閉経後女性や男性でもアロマターゼによってアンドロゲンからエストロゲンが産生される(⑦)。肺がん組織ではアロマターゼ活性が高いことが明らかになっている。したがって、アロマターゼ阻害剤(⑧)やエストロゲン受容体(ER)阻害剤(⑨)を用いて、肺がん細胞のエストロゲン経路を阻害し、さらにGefitinibやErlotinibのEGFR阻害剤(⑩)を用いると、肺がん細胞の増殖を有効に阻止できる。
593) 若い女性の肺腺がんは予後が悪い:エストロゲンは肺がんの発生と進行を促進する
【肺がんは女性のがん死亡原因の第2位】
肺がんは1998年に、それまで日本人のがん死亡原因のトップだった胃がんを抜いて第1位となりました。男性ではがん死亡原因の第1位、女性では大腸がんに次いで第2位です。(下表)
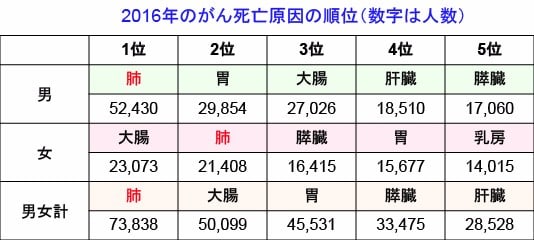
肺がんは、男性では1993年に胃がんを抜いて第1位になり、女性では2007年に胃がんを抜いて第2位(大腸がんは2003年に胃がんを抜いて第1位)になっています。
平成28年(2016年)の統計では、日本人の肺がん死亡者は73,838名(男52,430, 女21,408)です。2016年のがん死亡数は372,986人ですので、がん死亡の約20%が肺がんです。
肺がんはヘビースモーカーの男性に多いがんという印象が強く、女性のがんの死亡原因として2番目に多いという事実は、あまり知られていないようです。(膵臓がんが第3位というのもあまり問題にされていない印象です。)
厚生労働省国民健康栄養調査によると、日本人女性の喫煙率は2013年で8.2%、男性は32.2%です。
つまり、女性の大半は喫煙していないのにも拘らず、肺がんで死亡する人が2番目に多いことから、受動喫煙や大気汚染の影響などが指摘されていますが、このような発がん要因以外に、女性では男性とは異なるリスク要因が存在することが指摘されています。
それは女性ホルモンのエストロゲンです。エストロゲンが肺がんの発生と進行を促進することが、多くのエビデンスで明らかになっています。
【女性は肺腺がんが多い】
肺がんは小細胞がんと非小細胞がん(腺がん、扁平上皮がん、大細胞がん)に分けられています。
小細胞がんは肺がん全体の約15%を占め、腺がんは約50%、扁平上皮がんは約30%、大細胞がんは約5%です。
喫煙で増えるのが扁平上皮がんと小細胞がんです。腺がんは喫煙とは関係なく、女性に多い肺がんです。
小細胞がんは早期より転移傾向が強く、増殖速度や悪性度が高いがんですが、化学療法や放射線に対する感受性が高く、治療の中心は化学療法になります。
一方、非小細胞肺がんは化学療法や放射線に対する感受性が低く、治癒を目指すには早期に発見し、手術によって病巣を取り除くことが一番と考えられています。
しかし現状は、発見時点で手術できるケースは全体の3~4割で、残りは手術ができない進行がんです。手術ができない場合は、抗がん剤と放射線療法で治療するのが基本です。
一般的に肺がんはヘビースモーカーの男性に多いがんです。喫煙と肺がん(扁平上皮がん)の関係は確立しています。
非喫煙の女性の肺がんはGefitinib(イレッサ)やErlotinib(タルセバ)のようなEGFR阻害剤が効く腺がんが多いという特徴があります。
【エストロゲンは肺がんの発生と進行を促進する】
非小細胞肺がんでは、その原因や進行において男性と女性の間の性差が存在することが指摘されており、肺がんの発生や進行においてエストロゲン・シグナル伝達系が関与していることが明らかになっています。
例えば、女性の肺がんは男性の肺がんより年齢が若くして発症しているという結果が報告されています。同じ喫煙者でも男性より女性の方が肺がんの発症年齢が若いことが報告されています。つまり、喫煙という共通の発がん要因の他に、女性には肺がん発生を促進する別の要因が存在する可能性を示唆しています。
エストロゲン補充療法を受けている女性は肺がんによる死亡率が高い、あるいは肺がんになると治療抵抗性で予後が悪いという報告があります。
逆に、ホルモン療法(アロマターゼ阻害剤など)を長期間受けている乳がん患者は肺がんの発生が少ない、あるいは肺がんになっても生存期間が長いという報告もあります。
つまり、エストロゲンは非小細胞肺がんの発生と進行を促進する作用があると考えられています。以下のような論文があります。
Targeting Aromatase and Estrogen Signaling in Human Non-Small Cell Lung Cancer(ヒト非小細胞肺がんにおけるアロマターゼおよびエストロゲンシグナル伝達の標的化)Ann N Y Acad Sci. 2009 Feb; 1155: 194–205.
【要旨】
肺がんは女性においてますます一般的になっており、この疾患の生理学および原因における性差がエストロゲンの役割を示唆している。
最近の研究では、肺がん組織内ではアロマターゼ酵素の作用によるアンドロゲン由来のエストロゲン産生が増え、周囲の正常な肺組織と比較して、肺がん組織内ではエストロゲンの濃度が高いことが示されている。
転移巣においても、原発腫瘍と同様にアロマターゼ発現は高いレベルで維持される。
これらの知見と一致して、臨床研究は、アロマターゼの発現レベルが非小細胞肺がんの予後の予測に有用なバイオマーカーであり得ることを示唆している。
低レベルのアロマターゼは、早期の非小細胞肺がんの高齢女性において長期生存の高い確率と関連する。
肺がん細胞をマウスに移植する動物実験において、アロマターゼ阻害剤(エキセメスタン)単独または標準的なシスプラチン化学療法と組み合わせた治療は、腫瘍増殖の有意な減少を引き起こす。
さらに、エストロゲンと成長因子シグナル伝達経路との複雑な相互作用によって、肺がん細胞の増殖ならびにがん組織の血管新生を促進することによって肺がんの進行が制御される。
我々は、多くの増殖因子受容体を阻害するバンデタニブ(vandetanib)とエストロゲン受容体アンタゴニストのフルベストラント(fulvestrant)の併用投与は、それぞれを単独で投与した場合よりも、より効果的に腫瘍成長を阻害することを見出した。
したがって、非小細胞肺がんの標準的な治療において、抗エストロゲン治療戦略を組み込むことは、患者の予後改善に寄与する可能性があり、臨床試験において試験されなければならない。
フルベストラント(Fulvestrant)はエストロゲン受容体完全拮抗薬で、エストロゲン受容体の活性を阻害します。商品名はフェソロデックスです。筋肉注射で投与され、エストロゲン受容体陽性の閉経後乳がんの治療薬として承認されています。
バンデタニブ(Vandetanib)はチロシンキナーゼ阻害剤で、上皮成長因子受容体(EGFR)や血管内皮細胞増殖因子(VEGFR)やRETチロシンキナーゼなど多くの増殖因子の受容体の活性を阻害する薬で、日本ではカプレルサ(錠剤)の商品名で根治切除不能な甲状腺髄様癌の治療薬として承認されています。
この論文では、ヒト非小細胞肺がん細胞株を用いて検討し、エストロゲンが肺がん細胞の増殖を促進することを示しています。
その作用はエストロゲン受容体アンタゴニストのフルベストラント(fulvestrant)で阻止されたので、エストロゲンはエストロゲン受容体が介在する機序で、増殖促進作用を示すことを明らかにしています。
【女性の肺腺がんが増えている】
日本では、喫煙率の低い女性で非小細胞肺がん(特に腺がん)が増加していることが指摘されています。
エストロゲンが増殖促進する乳がんも日本で増えています。
乳がん発生のリスクを高める要因としては、体内のエストロゲン濃度が高いこと、あるいは経口避妊薬の使用や閉経後の女性ホルモン補充療法など、体外からの女性ホルモン追加により、エストロゲン濃度が高くなることが重要です。
体内のエストロゲン濃度が維持されている期間が長いほど、ホルモン受容体陽性の乳がんの発症リスクがあがるといわれています。
体内のエストロゲン濃度が長期に高い状態(妊娠・出産歴がない、初潮年齢が低い、閉経年齢が高い、ピルなどのエストロゲン製剤を服用している、など)は乳がんの発生率を高めます。
日本人の女性の乳がんは高齢化とは関係なく、年齢調整罹患率も死亡率も増加しています。出産回数の減少や初潮年齢の低下、閉経年齢の上昇、不規則な生活など高齢以外の要因が乳がんリスクを高めているためと思われます。
近年、子宮体がんの罹患率も急激に増加しています。
子宮体がんの危険因子として肥満、糖尿病、食事の欧米化、晩婚化、出産回数の低下などが指摘されています。
子宮体がんもホルモン依存性であり、その増殖や発がんにエストロゲンが深く関与します。
つまり、日本では晩婚化、出産回数の低下、初潮年齢が低い、閉経年齢が高いなどの高エストロゲン状態が長期に続くことが、乳がんや子宮体がんのみならず、肺腺がんを増やしている可能性が指摘されています。
【エストロゲンは多彩な生理機能を有する】
エストロゲンは卵胞ホルモンや女性ホルモンとも呼ばれます。
乳腺の発達を促進し、子宮内膜を増殖させる作用があるため、乳がんと子宮体がんの進行を促進する作用があります。
エストロゲンは乳腺や子宮だけでなく、骨や神経や心血管系の生理機能や、脂質代謝や血液凝固や免疫システムにも重要な作用を担っています。男性においても重要なホルモンです。
エストロゲンの受容体は全身の細胞に存在し、多くの生理機能の制御に関与し、様々な疾患の発生にも関わっています。
例えば、エストロゲンは肝臓に働きかけて、悪玉コレステロールと言われるLDLコレステロール(low density lipoprotein cholesterol)の受容体を増やし、血中のLDLコレステロールの肝内取り込みを増やし、その結果血中のLDLコレステロールや総コレステロールの値が低下します。さらに、善玉のHDLコレステロールの合成を促進する作用もあります。
血管の内皮細胞や平滑筋細胞やマクロファージなどにも作用して動脈硬化抑制作用を示すことが知られています。したがって、エストロゲンの分泌が盛んな閉経前にはコレステロールは高くなりにくく、閉経後はエストロゲンの減少によって、高脂血症が起こり、動脈硬化が進行しやすくなるのです。
女性の場合、閉経までの間(血中のエストロゲン濃度が高い間)は男性に比べて動脈硬化になりにくく、動脈硬化による病気(狭心症や心筋梗塞や脳血管障害)になる確率も男性に比べて低いことが知られています。しかし、閉経後はこのエストロゲンが極端に低下するため、動脈硬化が進んでいきます。女性における虚血性心疾患の発症は、閉経を境に急激に上昇することが知られています。
エストロゲンは神経細胞死を抑制し、認知機能を良くし、アルツハイマー病やパーキンソン病の発症を予防する作用も報告されています。
脳卒中などによる神経傷害の回復を促進する作用もあります。
エストロゲンが低下すると骨粗しょう症になります。
つまり、エストロゲンは女性の性成熟だけでなく、より広範囲な生理機能に重要な働きを担っていて、男性でも重要な働きを担っているのです。
【エストロゲンは核内受容体に結合して遺伝子発現を調節する】
DNAの遺伝情報は、まずRNAポリメラーゼによってRNAに転写され、さらにRNAからリボソームでタンパク質に翻訳されます。
DNAにはプロモーターやエンハンサーといった転写を制御する領域があり、この領域に結合して遺伝子の転写を促進したり抑制したりするタンパク質を転写因子と言います。転写因子は単独で機能する場合もありますが、他のタンパク質と複合体を形成して転写活性を実行する場合もあります。
このようにして、遺伝子(DNA)の情報がmRNA(メッセンジャーRNA)に転写され、さらに蛋白質が合成されることによって細胞の構造や機能に変化が生じる過程を「遺伝子発現」と言います。つまり、転写因子というのは遺伝子発現を制御する機能を持つタンパク質です。

図:遺伝子がメッセンジャーRNA(mRNA)に転写されてタンパク質が作られるためには、RNAポリメラーゼや転写因子などの転写を促進する複数の因子が遺伝子の転写調節領域に結合する必要がある。
ホルモン(甲状腺ホルモンやステロイドホルモンなど)や脂溶性ビタミン(ビタミンAやビタミンD)や体内で生成される生理活性物質(脂肪酸やプロスタグランジンなど)によって遺伝子発現が調節される場合の転写因子として「核内受容体」というタンパク質があります。
核内受容体というのは、細胞核にあって、ホルモンなどが結合することでDNAの転写を調節している受容体タンパク質です。
核内受容体はリガンドが結合すると、構造の変化を起こして転写因子としての活性を持ちます。リガンド(ligand)というのは、特定の受容体(レセプター)に特異的に結合する物質のことです。
核内受容体群は,1つの原初遺伝子から分子進化した遺伝子スーパーファミリーを形成しており,そのメンバーはヒトゲノム解読の結果,48種存在すると推定されています。
ステロイドホルモンやビタミンAやビタミンDが特定の遺伝子の発現を調節できるのは、これらが特定の核内受容体への結合を介して、そのリガンド依存的な転写制御を発揮するからです。
核内受容体には、リガンドが結合していないときに細胞質にいるものと細胞核にいるものの2種類があります。
前者はリガンドが結合すると核内に移行して遺伝子の転写調節領域に結合します。このクラスに分類される受容体としては、グルココルチコイド、アンドロゲン、プロゲステロン、エストロゲンなどの受容体があります。
後者はリガンド結合には関係なしに核内に局在し、核内でリガンドが結合すると、構造の変化が起こり、標的遺伝子の転写を活性化します。甲状腺ホルモン、レチノイン酸、9-シスレチノイン酸、ビタミンDなどの受容体があります。
いずれにしても、体内の様々な生理活性物質がリガンドとして特定の受容体に結合することによって遺伝子発現が調節されることになります。
また、単なる栄養素を思われていた脂肪酸や、胆汁酸などの代謝産物も核内受容体に結合し、遺伝子転写を制御していることが明らかになっています。
リガンドと同じ働きをする薬をアゴニスト(agonist)、リガンドの働きを阻害する薬をアンタゴニスト(antagonist)と言います。つまり、核内受容体のアゴニストやアンタゴニストは特定の遺伝子の発現を調節する薬になります。

図:核内受容体にリガンドが結合すると受容体の構造に変化が起こり、核内に移行して遺伝子の転写調節領域に結合し、転写を調節する。
【エストロゲンは受容体に結合して遺伝子発現を制御する】
エストロゲンには、エストロン(E1)とエストラジオール(E2)とエストリオール(E3)の3種類があります。
エストラジオール(E2)は卵胞刺激ホルモンと黄体ホルモンの刺激によって卵巣で合成され、非妊娠時の主要なエストロゲンです。
エストロン(E1)は閉経後に産生され、エストリオール(E3)は妊娠時のエストロゲンです。
性ホルモンの前駆体のアンドロステンジオンと男性ホルモンのテストステロンから、アロマターゼという酵素でエストロゲンガが合成されます。(下図)

図:アンドロステンジオンは副腎や性腺(卵巣、精巣)で生産され、性ホルモンの前駆体となる。アンドロステンジオンおよびテストステロンからアロマターゼによってエストロン(E1)とエストラジオール(E2)が産生され、E1とE2はエストリオール(E3)に代謝される。エストロンとエストラジオールとエストリオールの3種類をまとめてエストロゲンと言う。
エストロゲン受容体(ER)にはERαとERβの2つがあります。
ERαは1986年に遺伝子がクローニングされ、乳房、卵巣、子宮内膜の組織に発現しています。
ERβは1996年にクローニングされ、骨、脳、大腸、子宮内膜、腎臓、肺、卵巣、前立腺、精巣などに広く発現しています。
両方ともエストラジオール(E2)に対しては同じような親和性を持ちます。
ERαはestrone(E1)に対する親和性が高く、ERβはestriol(E3)に対する親和性が高い特徴があります。
エストロゲン受容体(ER)がエストロゲンに結合すると、ホモダイマーかヘテロダイマーを形成して、ターゲット遺伝子のプロモーター領域にあるエストロゲン応答配列(estrogen responsive element)に結合して、ターゲット遺伝子の発現を亢進します(下図)。
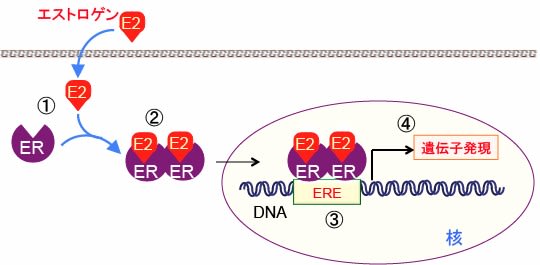
図:エストロゲン(E2)はエストロゲン受容体(ER)と細胞質内で結合し(①)、二量体を形成して(②)、核内に移行して遺伝子のエストロゲン応答エレメント(ERE)に結合して(③)、エストロゲン依存性の遺伝子発現を促進する(④)。
【エストロゲンは増殖シグナル伝達系を活性化する】
エストロゲン受容体としては、ERαとERβのほかに、GPR30が知られています。
GPR30は、7回膜貫通型のGタンパク質共役型受容体であり、Gタンパク質共役型エストロゲン受容体(G-protein-coupled estrogen receptor:GPER)とも言います。2005年に発見されています。ERαやERβと大きく異なる構造を持ち、細胞膜やゴルジ体や小胞体などに存在します。
エストロゲンとの結合によりMAPKやPI3Kなどの増殖シグナルを活性化します。このGPR30は、主に腫瘍の増殖や進展に関わっていると考えられています。
多くの肺がん細胞にGPR30の発現亢進が認められています。
通常のエストロゲン受容体であるERαやERβの働きを制御するアンタゴニスト/調整薬のタモキシフェン(tamoxifen)、ラロキシフェン(raloxifen)、フルベストラント(Fulvestrant)はGPERのアゴニスト(作動薬)として作用する場合がある点に注意が必要です。
つまり、肺がん細胞のエストロゲンによる細胞増殖を阻止するためには、通常のエストロゲン受容体拮抗薬(アンダゴニスト)ではなく、エストロゲン産生そのものを阻害するアロマターゼ阻害薬やLH-RHアゴニスト製剤を使うことが重要です。
閉経後であればアロマターゼ阻害剤だけで十分ですが、閉経前であれば、卵巣からのエストロゲン産生を阻害するLH-RHアゴニスト製剤の併用が有効です。
前述のように、エストロゲンは細胞膜を通過して細胞質内でエストロゲン受容体(ERα、ERβ)と結合したのち、核内に移動してDNAに結合して遺伝子の転写を亢進させます。 ゲノムDNAへ直接作用して転写を介して作用を示すという意味で、これをゲノム作用(genomic action)と呼びます。
これに対して、エストロゲンは細胞膜上のエストロゲン受容体と結合して、様々なシグナル(MAPKやPI3Kなど)を活性化することで細胞機能の調節を行うこともできます。
プロテインキナーゼの活性化、セカンドメッセンジャーの産生、イオンチャネルの制御などを介した作用です。(ERαとERβは疎水性のドメインが存在しないので、細胞膜を貫通して存在できませんが、何らかのメカニズムで細胞膜にも存在して、チロシンキナーゼのSRCファミリーを活性化するようです)
シグナルはリン酸化を介して、迅速に伝達されます。このような転写を直接には介さずに細胞機能を調節するこの作用を、非ゲノム作用(non-genomic action)と呼びます。
ゲノム作用では遺伝子の転写・翻訳を介するため、効果発現までに6〜12時間が必要ですが、非ゲノム作用はエストロゲン添加から数秒から数分で細胞反応が起こります。この非ゲノム作用には、GPR30のほかERαやERβも関わっていると考えられています。

図:エストロゲンの作用には、転写因子として作用するゲノム作用と、転写因子とは関係ない非ゲノム作用がある。エストロゲン(E2)はエストロゲン受容体(ER)と細胞質内で結合して二量体を形成して(①)核内に移行し、遺伝子のエストロゲン応答エレメント(ERE)に結合して(②)、エストロゲン依存性の遺伝子発現を促進する。また、細胞膜上でエストロゲンが結合したエストロゲン受容体(ER)は増殖シグナル伝達系を活性化する(③)。細胞膜および細胞質に存在する7回膜貫通型Gタンパク質共役型受容体のGPR30はエストロゲンと結合してシグナル伝達系を刺激し(④)、CREB(cAMP response element-binding protein)を介して遺伝子発現に作用する(⑤)。ゲノム作用は効果発現までに6〜12時間を有するが、非ゲノム作用は数秒から数分で作用が認められる。
【閉経前女性の肺がんは予後が悪い】
閉経後に発症する女性の肺がんは男性に比べて治療に対する感受性が高く、生存率が高いという特徴があります。
一方、閉経前の女性の肺がんは進行した状態で見つかることが多く、分化度の低い増殖速度の早いがんが多く、遠隔転移の頻度が高く、治療に抵抗性で予後不良のことが多いことが報告されています。
閉経前の女性の肺がん患者では、血中のエストロゲン濃度が高いほど予後が悪いというデータがあります。男性においても、血清中のエストラジオールのレベルが高いほど予後不良といデータがあります。
つまり男女とも、血中のエストロゲン濃度が高いほど、肺がんの予後が不良と言えます。
一方、乳がんでホルモン療法を受けている人は肺がんになっても生存期間が長いという疫学データがあります。
卵巣切除したメスのマウスとオスのマウスに肺がん細胞を移植する実験で、エストロゲンを投与すると、腫瘍の増大が促進されることが報告されています。
発がん物質で肺がんを発生させる発がん実験で、オスに比べてメスの方が腫瘍の数が多いという報告もあります。
相反する報告もありますが、多くの研究結果をまとめると、「エストロゲンは肺がん患者の予後を悪くする」というのがコンセンサスになりつつあります。最近の総説で以下のほうな論文があります。
Influence of estrogen in non-small cell lung cancer and its clinical implications.(非小細胞肺がんにおけるエストロゲンの影響とその臨床的意義)J Thorac Dis. 2018 Jan; 10(1): 482–497.
【要旨】
世界的に肺がんは男性のがん死のトップであり、女性でも最近は増加している。
男女の違いやホルモンの状態によって、肺がんの治療に対する反応や予後が異なることが知られており、肺がん患者の予後において、閉経前の女性は、閉経後女性および男性よりも予後不良というデータがある。
さらに、エストロゲン補充療法を受けている人は非小細胞性肺がんによる死亡率が高いという報告がある。これらは肺がんの発生にエストロゲンの関与を示唆している。
エストロゲンが肺がんの発生を促進するメカニズムがまだ十分に解明されていないが、エストロゲンはその受容体を介して、肺がん細胞の増殖、細胞死に対する抵抗性、血管新生、移動と転移を刺激する。
エストロゲンは炎症促進性のタンパク質や、増殖を亢進する因子の産生を誘導する。これはエストロゲンが腫瘍組織の微小環境や抗腫瘍免疫応答に影響することを示唆している。
肺腺がん細胞では、上皮成長因子受容体(epidermal growth factor receptor:EGFR)シグナル伝達系とエストロゲンシグナル伝達系の間に密接な関連があり、チロシンキナーゼ阻害剤と抗エストロゲン治療の併用の可能性が検討されている。
この総説では、肺がんの発生と予後におけるエストロゲンとエストロゲン受容体の役割を中心にして、性とホルモン状況による非小細胞肺がんの生物学的性状の違いに焦点を当てている。
非小細胞肺がんの発生と進行におけるエストロゲンの重要性から、肺がん治療における抗エストロゲン治療の可能性を考察し、前臨床および臨床試験の結果を紹介する。
実際に、非小細胞肺がんに対する抗エストロゲン剤の治療効果を検討する臨床試験は幾つか実施されており、有効性を認める結果が得られています。例えば、抗エストロゲン剤の併用がEGFR阻害剤(gefitinibやerlotinib)の抗腫瘍効果を増強する結果が報告されています。
【肺がん組織ではアロマターゼとエストロゲン受容体が発現している】
エストロゲンは胎生期における肺の発生や、肺の生理機能において重要な働きを担っています。以前は、肺が性ホルモンのターゲット器官とは考えられていなかったのですが、最近の研究は肺の生理機能にエストロゲン・シグナル伝達系が重要な働きをしていることが明らかになっています。
正常な肺組織では肺胞上皮細胞や気管支粘膜上皮細胞にERβが高度に発現しています。エストロゲンは肺組織の細胞外マトリックスの維持に重要な役割を担っています。
ERβ遺伝子を欠損させたマウスでは、肺胞の数が減少し、サーファクタントの量が少ないことが明らかになっています。ER-β欠損マウスは肺の構造の異常と全身の低酸素をきたすことが明らかになっています。
さらに肺がんの発生においても、エストロゲンの最も活性の高いエストラジオール(E2)が発がん促進性に働くことが明らかになっています。
肺腺がん細胞では主にERβが発現しています。
エストロゲンはオステオポンチンの発現を亢進させ、がん細胞の移動を亢進することが報告されています。
EBβはMEK/ERK シグナル経路を活性化します。
臨床例での非小細胞肺がんの免疫染色で、肺がんの原発部位や転移巣でアロマターゼが発現していることが確認されています。
アロマターゼはチトクロームP450酵素の一つで、アンドロゲンからエストロゲンを作る酵素です。
アロマターゼは卵巣、精巣、脳、骨、脂肪組織に発現しており、肺にも発現し、特に非小細胞肺がんに高度に発現していることが明らかになっています。
臨床例の検査で、女性と男性の非小細胞肺がンの86%にアロマターゼ活性が検出され、周囲の正常組織に比べて、がん組織ではアロマターゼ活性が高く、転移巣ではさらに高いことが報告されています。
移植腫瘍の実験で、アロマターゼ阻害剤のアナストロゾール(商品名:アリミデックス)が増殖を抑制することが報告されています。
ステロイド性アロマターゼ阻害剤のエキセメスタン(商品名:アロマシン)は肺がん細胞の増殖を抑制し、シスプラチンと併用すると、相乗的な増殖抑制を示すことが報告されています。
肺がんの化学療法で、男性や閉経後女性ではアロマターゼ阻害剤、閉経前女性ではアロマターゼ阻害剤+抗エストロゲン剤やエストロゲン受容体阻害剤やLH-RHアゴニストを併用して、体内および腫瘍組織内のエストロゲン産生を抑えることは、十分なエビデンスがあると思います。
【エストロゲンは炎症を悪化してがんの発生を促進する】
前述のように、エストロゲンが肺がんの発生と進展を促進することは多くのエビデンスが蓄積しています。肺がん発症リスクの高い喫煙者のがん予防法としてアロマターゼ阻害剤の可能性が検討されています。以下のような報告があります。
Preclinical Evidence for Combined Use of Aromatase Inhibitors and NSAIDs as Preventive Agents of Tobacco-Induced Lung Cancer. (タバコ誘発性肺がんの予防薬としてのアロマターゼ阻害剤と非ステロイド性抗炎症剤の併用使用の前臨床的証拠)J Thorac Oncol. 2018 Mar;13(3):399-412.
この論文の著者らは、以前の報告で、タバコに含まれる発がん物質で誘発したマウスの肺がん発がん実験モデルを用いて、アロマターゼ阻害剤が肺がんの発生を抑制することを明らかにしています。さらに、肺の炎症細胞においてアロマターゼとエストロゲン受容体が発現していることを明らかにしています。
この論文では、アロマターゼ阻害剤(アナストロゾール)と非ステロイド性抗炎症剤(アスピリンあるいはイブプロフェン)を併用使用すると、それぞれを単独で用いた場合に比べて、肺がん発生を抑制する効果が増強することを報告しています。
発がん物質を投与すると、肺組織では、βエストラジオールの増加、マクロファージの動員、IL-6やIL-17Aの発現亢進、活性化した(リン酸化した)分裂促進因子活性化タンパク質キナーゼ(MAPK)や活性化した(リン酸化した)シグナル伝達兼転写活性化因子3(STAT3)の増加など、炎症反応の亢進が認められ、アロマターゼ阻害剤(アナストロゾール)と非ステロイド性抗炎症剤(アスピリンあるいはイブプロフェン)を併用投与すると、これらの肺組織の炎症反応が抑制され、血中のβエストラジオール濃度が低下しました。
さらに発がん物質を投与した雄マウスに、βエストラジオールを飲水に混入して投与すると、肺のマクロファージや炎症マーカーが増加しました。つまり、エストロゲンは炎症を悪化させ、肺がんの発生を促進することを示しています。
非小細胞肺がんの予防のターゲットとしてエストロゲン・シグナル系と炎症反応の2つが重要で、アロマターゼ阻害剤と非ステロイド性抗炎症剤の併用使用は、エストロゲン濃度を低下させ、炎症性サイトカインの産生やマクロファージの動員を阻止して、肺がん発生を予防するメカニズムを示唆しています。
つまり、ヘビースモーカーの肺がん予防の方法として、アロマターゼ阻害剤と非ステロイド性抗炎症剤(NSAIDs)の併用の可能性を示唆しています。
【間質細胞のエストロゲンシグナルががん細胞の発生を促進】
がん細胞の発生に間質細胞のエストロゲン受容体が必要という報告があります。以下のような論文があります。
Requirement for stromal estrogen receptor alpha in cervical neoplasia.(子宮頚部腫瘍における間質細胞のエストロゲン受容体αの必要性)Horm Cancer. 2013 Feb;4(1):50-9.
【要旨】
子宮頚がんの主要な病因は、E6およびE7がん遺伝子をコードする高リスクヒトパピローマウイルス(HPV)である。しかしながら、子宮頚がんの発生にはHPVだけでは十分ではなく、エストロゲンが子宮頚がん発生を促進する因子として提案されている。
エストロゲン受容体アルファ(ERα)の遺伝子を欠損するマウスは、子宮頚がんが発生しにくいことが明らかになっているが、ERαの細胞特異的な必要性については明らかになっていない。
この研究では、間質細胞のERαの一時的な欠失が、K14E7マウスにおける子宮頚部異形成の完全な退縮を誘導したことを示す。
我々の結果は、HPV誘発子宮頚がんの発生に間質細胞におけるERαが必要であり、エストロゲン依存性子宮頚がんの発症にERαシグナル伝達を伴うパラクリン機序の存在を強く支持している。これは、女性生殖器のエストロゲン依存性腫瘍性疾患における間質ERαの重要性を支持する最初の証拠である。
乳がんや子宮体がんのようにエストロゲン依存性のがん以外でも、治療に抵抗する進行がんの場合、アロマターゼ阻害剤と非ステロイド性抗炎症剤(NSAIDs)の併用は試してみる価値があるかもしれません。
参考文献:Estrogen, Estrogen Receptor and Lung Cancer.(エストロゲンとエストロゲン受容体と肺がん) Int J Mol Sci. 2017 Aug; 18(8): 1713.
| « 592)抗がん剤... | 594) Hippo経... » |



