がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
876)オピオイド増殖因子を増やす低用量ナルトレキソン療法
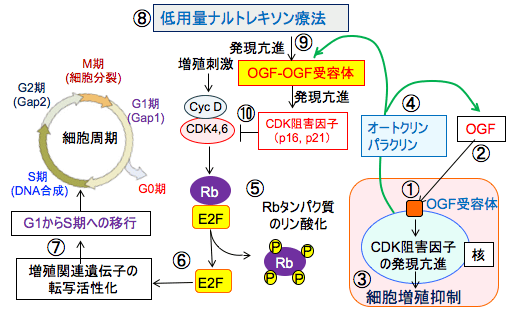
図:(右)オピオイド増殖因子受容体(OGF受容体)は細胞核の核膜の外側に存在し(①)、オピオイド増殖因子(OGF:メチオニン・エンケファリン)(②)と結合して核の中に移行し、サイクリン依存性キナーゼ(CDK)阻害因子の発現を亢進して細胞増殖を抑制する(③)。オピオイド増殖因子はオートクリン(自己分泌)あるいはパラクリン(傍分泌)の機序で細胞の増殖を抑制する因子として作用し(④)、発生や創傷治癒や血管新生や細胞増殖の調節を行っている。
(左)増殖刺激は、サイクリン(Cyc)というタンパク質で活性化されるサイクリン依存性キナーゼ(CDK)を活性化してRbタンパク質をリン酸化する(⑤)。Rbタンパク質は転写因子のE2Fと結合してE2Fの活性を阻害しているが、Rbがリン酸化されるとE2Fと結合できなくなってE2Fがフリーになる(⑥)。フリーになったE2Fは増殖関連遺伝子の転写を促進することによって細胞周期をG1からS期に移行させて細胞周期を回す(⑦)。低用量ナルトレキソン療法(⑧)は、OGF-OGF受容体の結合を断続的に阻害することによって、OGFとOGF受容体の発現量を増やす(⑨)。OGF-OGF受容体経路はサイクリン依存性キナーゼ阻害因子(CDK阻害因子)のp16やp21の発現を促進して量を増やす。その結果、サイクリン依存性キナーゼ(CDK)が阻害されて細胞周期がG1期で停止した状態に維持される(⑩)。
876)オピオイド増殖因子を増やす低用量ナルトレキソン療法
【体内にはモルヒネが結合する受容体がある】
オピオイド(Opioid)とはオピウム類縁物質という意味で、オピウム(opium)はアヘン(阿片)の英語名です。アヘンはケシ(芥子)の未熟果から得られる液汁を乾燥させたもので、モルヒネやコデインなどの麻薬を含みます。モルヒネやオキシコドンなどの麻薬性鎮痛薬をオピオイド鎮痛薬と言います。
モルヒネなどのアヘンアルカロイドが結合する細胞の受容体(オピオイド受容体)が1973年に発見され、このオピオイド受容体に作用する内因性の物質としてエンケファリンやベータ・エンドルフィンなどの内因性オピオイドが多数発見されました。
すなわち、内因性オピオイドとオピオイド受容体は体の苦痛を和らげるために体内にもともと存在し、モルヒネなどの麻薬はオピオイド受容体に結合することで、鎮痛作用や快感をもたらしていたのです。(下図)

図:オピオイド(オピウム類縁物質)にはアヘンアルカロイド(モルヒネなど)や内因性オピオイド(ベータ・エンドルフィンやエンケファリンなど)があり細胞のオピオイド受容体に結合して様々な作用(強い鎮痛作用、気分高揚・多幸感、抗ストレス作用、免疫調節作用など)を発揮する。
オピオイド(オピウム類縁物質)には、植物由来の天然のオピオイド、合成・半合成のオピオイド、体内で産生される内因性オピオイドがあります。
モルヒネなどの植物由来のオピオイドはアルカロイドという化合物ですが、内因性オピオイドはアミノ酸が数個から数十個つながったペプチドです。この内因性オピオイドは脳内に多く存在し、モルヒネと同様の作用を示します。鎮痛作用があり、また多幸感をもたらします。
アヘンの歴史は極めて古く、紀元前3000年以上前にメソポタミアではケシの栽培が行われており、古代エジプトでは紀元前1500年前に、すでにアヘンを鎮痛薬として使用していたという記録が残っています。
このようにモルヒネの鎮痛作用や麻薬作用は古くから知られていたのですが、脳内にモルヒネと結合する受容体が存在することが明らかになった時は衝撃的でした。そのモルヒネ受容体(オピオイド受容体)に作用する体内成分がもともと存在し、強い痛みや苦痛やストレスを和らげる体の抵抗力や治癒力となっていたのです。
【ベータ・エンドルフィンはストレス抵抗性や治癒力を高める】
強い痛みやストレスを受けると、生体はその苦痛を和らげるような作用をもつ物質を生成することが知られています。そのような物質の代表が内因性オピオイドの一種のベータ・エンドルフィンです。エンドルフィン(endorphin)は「体内で分泌されるモルヒネ」という意味で、アルファ、ベータ及びガンマの各エンドルフィンがあります。
ベータ・エンドルフィンは31個のアミノ酸からなるペプチドです。ベータ・エンドルフィンは鎮痛作用や快感をもたらすので脳内麻薬とも言われます。
ベータ・エンドルフィンは強力な鎮痛作用があり、女性が出産する際には、この物質が分泌されて痛みをやわらげると言われています。ベータ・エンドルフィンの鎮痛効果は、モルヒネの10倍以上と言われています。
マラソンなどで長時間走り続けると、最初は苦痛に感じていても次第に快感を得るようになるという「ランナーズハイ」は、ベータ・エンドルフィンの分泌によると言われています。肉体的な痛みや疲労が高まると、脳の下垂体部分からベータ・エンドルフィンが分泌され、肉体的・精神的な苦痛やストレスを抑えるのですが、同時に快感を与えるのです。
ベータ・エンドルフィンは気持ちがいい、楽しいと感じたときに分泌され、免疫力を強化し、自己治癒力を高める作用があります。瞑想や気功・太極拳をするとα波が出て体がリラックスした状態になります、このときにもベータ・エンドルフィンの産生が高まることがリラックス効果と関係することが報告されています。
がん治療におけるイメージ療法や気功や瞑想の有用性が報告されていますが、その作用機序としてベータ・エンドルフィンの関与が指摘されています。
鍼灸が効くメカニズムの一つに、鍼灸の刺激によって体内のベータ・エンドルフィンの分泌が高まることが報告されています。
漢方薬に使用される生薬の研究でも、ベータ・エンドルフィンの分泌との関連を指摘した報告があります。体力増強や抗ストレス作用などの効果の作用機序の一つに、ベータ・エンドルフィンの関与を指摘した意見もあります。
偽の薬であっても、薬を飲んだという暗示によって治癒効果が現れるプラセボ効果は、薬に対する期待感や、治療を受ける安心感、医師に対する信頼感などによって高くなりますが、プラセボ効果が最もよく現れるのが痛みに対する効果だと言われています。この痛みに対するプラセボ効果も、期待感や安心感によってベータ・エンドルフィンの産生が増えるためという意見もあります。

図:偽の薬であっても、薬を飲んだという暗示によって治癒効果が現れ、これをプラセボ効果という。プラセボ効果は、薬に対する期待感や、治療を受ける安心感、医師に対する信頼感などによって高くなる。さらに薬の値段が高いほどプラセボ効果が高くなる。期待感や安心感によって内因性オピオイドが増え、治癒力が高まる可能性がある。
ベータ・エンドルフィンは、免疫力を高める作用もあります。体内に侵入した病原菌や体内に発生したがん細胞を攻撃するナチュラルキラー細胞やリンパ球にはベータ・エンドルフィンに対するレセプター(受容体)が存在し、このレセプターにベータ・エンドルフィンが結合することによりこれらの免疫細胞が活性化します。鍼灸治療による鎮痛効果や免疫増強効果は、鍼灸の刺激によって体内のベータ・エンドルフィンの分泌が高まるためと考えられています。

図:βエンドルフィンに対するオピオイド受容体は神経細胞だけでなく、リンパ球にも存在し、免疫システムを調節する作用がある。βエンドルフィンは鎮痛作用だけでなく、ストレス抵抗性を高める作用、忍耐力増強作用、免疫増強作用など多彩な作用を発揮する。
【オピオイド受容体の断続的阻害ががん細胞の増殖を抑制する】
ナルトレキソン(naltrexone)はモルヒネに似た構造の化合物で、モルヒネなどのオピオイドとオピオイド受容体の結合を競合的に阻害するオピオイド受容体拮抗薬です。麻薬中毒など薬物依存症の治療薬として1984年に米国で認可されています。

図:ナルトレキソンはモルヒネと似た構造の化合物で、モルヒネとその受容体の結合を拮抗的に阻害する。
内因性オピオイドは神経系に対する作用だけでなく、免疫細胞の活性化やがん細胞の増殖を抑制する作用も知られています。
オピオイドの抗腫瘍効果を研究していたペンシルバニア州立大学のイアン・ザゴン(Ian Zagon)教授らは、マウスに神経芽細胞腫を移植した動物実験で、オピオイド受容体を持続的に阻害する高用量のナルトレキソンを投与すると腫瘍の増殖が促進され、オピオイド受容体を1日4〜6時間だけ断続的に阻害する低用量のナルトレキソンを投与すると腫瘍の増殖が著明に抑制される現象を発見し1983年にScienceに報告しています。
Naltrexone modulates tumor response in mice with neuroblastoma. Science. 1983 Aug 12;221(4611):671-3.
この報告では、神経芽細胞腫を移植したマウスに、モルヒネによる鎮痛効果を4〜6時間だけ阻害する用量(体重1kg当たり0.1ミリグラム)のナルトレキソンを毎日注射すると、腫瘍発生率が33%に低下し、腫瘍出現までの時間が98%遅延し、生存期間が33%延長しました。
一方、モルヒネによる鎮痛効果を24時間阻害する用量(体重1kgあたり10ミリグラム)のナルトレキソンを毎日注射すると、腫瘍発生率は100%で、腫瘍出現までの時間が27%短縮し、生存期間が19%短縮しました。
つまり、オピオイド受容体を24時間ブロックする高用量のナルトレキソンの投与はがん細胞の増殖を促進し、オピオイド受容体を毎日4〜6時間だけ阻害すると、がん細胞の増殖を抑える効果を得られることを示しています。
この論文に注目したニューヨークのバーナード・ビハリ(Bernard Bihari)博士は、多くの疾患の治療に低用量のナルトレキソンの投与を試してその効果を報告しています。その当時、ビハリ博士はアルコール中毒や薬物依存の治療に従事しており、ナルトレキソンを薬物中毒やアルコール中毒の治療に使っていました。
中毒の治療には1日50mg以上のナルトレキソンを服用しますが、ザゴン博士らの報告にヒントを得て、1日3〜5mg程度の低用量のナルトレキソンを使って、様々な病気の治療を行いました。
その結果、悪性腫瘍だけでなく、エイズや自己免疫疾患や神経変性疾患などの疾患に有効であることを発見しました。その後、エイズ患者の免疫不全や多発性硬化症、クローン病、線維筋痛症に対する低用量ナルトレキソン療法の有効性を示す臨床試験の結果が多数報告されています。がん治療における有効性も多くの臨床研究で確認されています。
【メチオニン・エンケファリンはがん細胞の増殖を抑制する】
低用量ナルトレキソン療法の抗がん作用は、なんらかの内因性のオピオイドががん細胞の増殖を抑える作用があることを示唆しています。このがん細胞の増殖を抑制する内因性オピオイドとして同定されたのが、メチオニン・エンケファリンです。
エンケファリン (enkephalin) は、5つのアミノ酸からなるペプチドで、C末端のアミノ酸がメチオニンのものとロイシンのものの2種類が存在します。メチオニン・エンケファリンはチロシン-グリシン-グリシン-フェニルアラニン-メチオニンの5つのアミノ酸からなり、ロイシン・エンケファリンは最後のメチオニンがロイシンになっています。
メチオニン・エンケフェリンは細胞(正常細胞とがん細胞)の増殖を抑制する作用が見つかってからはオピオイド増殖因子(Opioid growth factor)とも呼ばれています。
創傷部位にナルトレキソンを塗布してオピオイド増殖因子の作用を持続的に阻害すると細胞増殖を促進して創傷治癒が促進されることが報告されています。逆に、オピオイド増殖因子の働きを高めるとがん細胞の増殖を抑制することができます。
オピオイド増殖因子受容体は677個のアミノ酸から構成され、通常のオピオイド受容体(δ、κ、μ)とは異なる構造をしています。このオピオイド増殖因子受容体が膵臓がんや肝臓がん、乳がん、卵巣がん、頭頸部扁平上皮がんなど多くのがん細胞に発現しており、オピオイド増殖因子(=メチオニン・エンケフェリン)が結合すると、細胞の増殖がストップすることが報告されています。 (Interaction of opioid growth factor (OGF) and opioid antagonist and their significance in cancer therapy. Int Immunopharmacol. 2019 Oct:75:105785.)
膵臓がん細胞を移植した動物実験においてメチオニン・エンケフェリンを投与すると、がんの縮小や延命効果が得られることが報告されています。進行した膵臓がん患者を対象にした臨床試験でもメチオニン・エンケファリンの腫瘍縮小効果が確認されています。
細胞はその細胞自身あるいは近接する細胞の増殖を制御するような伝達物質や増殖因子を分泌しています。これをオートクリン(自己分泌:分泌された物質が分泌した細胞自身に作用する)やパラクリン(傍分泌:分泌された物質が、分泌した細胞の近隣の細胞に作用する)と言います。分泌された物質が血液に運ばれて離れた組織に作用することをエンドクリン(内分泌)といいます。(下図)
図:分泌された物質が分泌した細胞自身に作用するのをオートクリン(自己分泌)、分泌された物質が、分泌した細胞の近隣の細胞に作用するのをパラクリン(傍分泌)、分泌された物質が血液に運ばれて離れた組織に作用することをエンドクリン(内分泌)と言う。
オピオイド増殖因子はオートクリンあるいはパラクリンの機序で細胞の増殖を抑制する因子として作用し、発生や創傷治癒や血管新生や細胞増殖の調節を行っていると考えられています。
オピオイド増殖因子受容体は細胞核の核膜の外側に存在し、オピオイド増殖因子と結合して核の中に移行し、サイクリン依存性キナーゼ阻害因子の発現を亢進してDNA合成を止める作用を持つことが明らかになっています。(下図) 。

図:オピオイド増殖因子受容体は細胞核の核膜の外側に存在し、オピオイド増殖因子(メチオニン・エンケファリン)と結合して核の中に移行し、サイクリン依存性キナーゼ阻害因子の発現を亢進して細胞増殖を抑制する。オピオイド増殖因子はオートクリン(自己分泌)あるいはパラクリン(傍分泌)の機序で細胞の増殖を抑制する因子として作用し、発生や創傷治癒や血管新生や細胞増殖の調節を行っている。
1日のうち数時間だけオピオイドとオピオイド受容体の結合を阻害すると、がん細胞の増殖が抑制されるという現象の作用機序についてはまだ不明な点が多く残されていますが、オピオイド受容体の断続的な阻害によって内因性オピオイドの産生量とオピオイド受容体の量が増えることが関連していると考えられています。
すなわち、オピオイド増殖因子(OGF)とオピオイド増殖因子受容体(OGFR)の結合が断続的に阻害されると、受容体の方はより多くのOGFと結合しようと受容体の量を増やし、受容体の感受性を高めるようになります。さらに、OGF自体の産生量を増やして、OGFとOGFRのシグナル伝達を維持しようとします。その結果、OGFとOGFRの反応が増幅されることになるという説明です。
【オピオイド増殖因子はサイクリン依存性キナーゼ阻害因子の発現を増やす】
細胞が分裂して数を増やしていくとき、細胞周期は4つの段階に分けられます。すなわち、DNA複製前のG1(Gap1)期、DNA複製期(S期)、細胞分裂前のG2(Gap2)期、および最後の細胞分裂期(M) 期に分けられます。増殖を休止した状態の細胞はG0期にあると定義されます。
細胞周期がG1期からS期に移行するときがん抑制遺伝子のRbタンパク質がサイクリン依存性キナーゼでリン酸化されることが重要なステップになります。Rbタンパク質がサイクリン依存性キナーゼでリン酸化されると転写因子のE2Fと結合できなくなり、フリーになったE2Fは増殖に関連する遺伝子の発現を促進して細胞周期のG1期からS期への進行を促進します。
サイクリン依存性キナーゼはサイクリン依存性キナーゼ阻害因子というタンパク質によって機能が阻害されます。このサイクリン依存性キナーゼ阻害因子にはp21やp16などのタンパク質が知られています。
オピオイド増殖因子受容体は核膜の外側に存在し、オピオイド増殖因子が結合すると核内に入って、p16やp21などのサイクリン依存性キナーゼ阻害因子の産生を高めることが報告されています。その結果、細胞周期をG1/S期のチェックポイントで止めて細胞増殖を阻害します。
つまり、オピオイド増殖因子(OGF) は OGF 受容体と相互作用し、p16 および/または p21 の発現を亢進することにより DNA 合成を阻害します。これにより、細胞周期の G0/G1 から S 期への移行が遅延され、細胞増殖が阻害されます。(図)

図:増殖刺激は、サイクリン(Cyc)というタンパク質で活性化されるサイクリン依存性キナーゼ(CDK)を活性化してRbタンパク質をリン酸化する(①)。Rbタンパク質は転写因子のE2Fと結合してE2Fの活性を阻害しているが、Rbがリン酸化されるとE2Fと結合できなくなってE2Fがフリーになる(②)。フリーになったE2Fは増殖関連遺伝子の転写を促進することによって細胞周期をG1からS期に移行させて細胞周期を回す(③)。オピオイド増殖因子(OGF)はOGF受容体と結合すると核内に入ってサイクリン依存性キナーゼ阻害因子(CDK阻害因子)のp16やp21の発現を促進して量を増やす(④)。その結果、サイクリン依存性キナーゼ(CDK)が阻害されて細胞周期がG1期で停止した状態に維持される。
【オピオイド増殖因子の血管新生阻害作用】
がん組織が大きくなるためには、栄養や酸素を運ぶ血管を増やしていく必要があります。新しい血管が増生することを「血管新生」と呼びます。
がん細胞は自ら血管を増やす増殖因子を分泌して、血管を新生しています。がん細胞が腫瘍血管を新しく作るために、がん細胞は血管内皮細胞増殖因子というタンパク質を分泌して近くの血管の内皮細胞の増殖を刺激し、さらに周囲の結合組織を分解する酵素を出して増殖した血管内皮細胞をがん組織の方へ導き、血管の内腔を形成する因子を使って新しい血管を作っています。
がん細胞が100個くらいになると、それ以上大きくなるためにはがん組織専用の血管が必要になって、がん細胞が血管を新生するための増殖因子を産生しだすといわれています。腫瘍組織を養う自前の血管ができると、増殖が促進され、新生血管を使って転移が起こるようになります。
したがって、がん治療後に腫瘍の血管新生を阻害する薬を使用すれば、残ったがん細胞の増殖を抑制して再発を防ぐことができます。がんが大きい場合でも、がん細胞を死滅させる抗がん剤治療などと併用すれば、抗腫瘍効果を高めることができます。
オピオイド増殖因子(OGF)が血管新生の制御に関与していることが報告されています。 鶏卵漿尿膜アッセイ法(鶏卵の胚の成長に伴う漿尿膜上で起こる生理的な血管新生に対する阻害効果を調べるアッセイ法)を用いた実験で、OGFに顕著な血管新生阻害作用が確認されています。
この実験では、鶏卵漿尿膜にナルトレキソンを投与すると血管新生が促進されることが示されています。つまり、血管新生にOGF-OGF受容体が抑制系として作用していることを示しています。組織の免疫染色で、発育している鶏卵漿尿膜の血管の血管内皮細胞と血管壁の間質細胞にOGFとOGF受容体が存在することが示されています。(Opioid growth factor modulates angiogenesis. J Vasc Surg. 2000 Aug;32(2):364-73.)

図:がんが増大するために、がん細胞は血管内皮細胞増殖因子などの因子を産生して、既存の血管から新生血管が増生する。オピオイド増殖因子は血管新生を阻害する作用がある。
【オピオイド増殖因子はナチュラルキラー細胞およびTリンパ球の活性を増強する】
がん細胞を攻撃する免疫(腫瘍免疫)には特異的免疫と非特異的免疫が区別されます。
マクロファージや樹状細胞と呼ばれる細胞が、がん細胞からがん抗原ペプチドと呼ばれる小さな蛋白質を捕足し、その情報がヘルパーT細胞に伝えられ、その情報に従って特定のがん細胞に対する免疫応答が引き起こされるのが特異的免疫です。
一方、ナチュラルキラー(NK)細胞やマクロファージなどががんの種類に関係なく攻撃を仕掛けるようなものを非特異的免疫といいます。ナチュラルキラー細胞というのは、生まれつき(natural) の細胞障害性細胞(keller cell) という意味で名付けられ、略してNK細胞と呼ばれています。
細胞を死滅させるのに、T リンパ球は前もって攻撃相手であることを認識させておく(感作という)必要がありますが、NK細胞は腫瘍細胞やウイルス感染細胞を見つけると直ちに攻撃して異常細胞を殺します。 NK細胞の中に含まれるパーフォリンやグランザイムといったタンパク質が細胞障害の中心的役割を担っています。がんに対する第一次防衛機構として即戦力を持ち、特に初期段階でのがん細胞の排除において重要な役割を果たしています。
NK活性はストレスで低下し、笑いで上昇することが指摘されており、気持ちの持ちようが免疫力に影響を与える原因とも関連しています。 ナチュラルキラー細胞やリンパ球などの免疫細胞にもオピオイド受容体が見つかっており、オピオイドと免疫との関連が指摘されています。
メチオニン・エンケファリン(オピオイド増殖因子)がNK細胞活性やTリンパ球活性を高めることが報告されています。(Opioids: immunomodulators. A proposed role in cancer and aging. Ann N Y Acad Sci. 1988:521:312-22.)
マウスに悪声黒色腫細胞を移植する実験系で、メチオニン・エンケファリンががん細胞の転移を抑制し、脾臓のNK細胞活性を大幅に高める結果が報告されています。(Inhibition of pulmonary metastases and enhancement of natural killer cell activity by methionine-enkephalin. Brain Behav Immun. 1988 Jun;2(2):114-22.)
がん患者から採取したリンパ球にメチオニン・エンケファリンを添加するとNK活性活性が顕著に増強することが報告されています。(Neuroimmunomodulation with enkephalins: in vitro enhancement of natural killer cell activity in peripheral blood lymphocytes from cancer patients. Nat Immun Cell Growth Regul. 1987;6(2):88-98.)
さらに、がんやエイズの患者にメチオニン・エンケファリンを注射で投与する臨床試験で、NK細胞活性が増強し、T細胞の数が増えて活性が高まることが報告されています。
このように、免疫細胞に対する顕著な作用から、メチオニン・エンケファリンはサイトカインのような働きを行っていると考えられています。サイトカインというのはリンパ球や炎症細胞から分泌されて免疫に関与する細胞の増殖や活性を調節するタンパク質です。サイトカインは細胞表面の膜上にある受容体に結合することによって、受容体に特有の細胞内シグナル伝達の引き金となり、極めて低濃度で生理活性を示します。 メチオニン・エンケファリンはオピオイド受容体に作用するオピオイドの一種ですが、免疫系に対する作用はサイトカインと言っても間違いではないということです。(Methionine enkephalin: a new cytokine--human studies. Clin Immunol Immunopathol. 1997 Feb;82(2):93-101.)
【低用量ナルトレキソン療法は抗がん力を総合的に高める】
前述の内容からベータ・エンドルフィンやメチオニン・エンケファリンの産生量を高めれば、体の治癒力や抵抗力を高める効果や、がん細胞の増殖を抑える効果を得られることが理解できます。
ナルトレキソンはオピオイドとオピオイド受容体の結合を競合的に阻害します。オピオイド増殖因子とその受容体の結合も同様に阻害します。薬物依存症の治療に使用する量(1日50〜100mg)では、オピオイドとオピオイド受容体の結合を持続的に阻害しますが、この量の10分の1程度(1日3~5mg)の低用量を投与すると、その阻害作用は数時間しか続きません。
内因性オピオイドとオピオイド受容体の結合が断続的に1日数時間阻害される状況が続くと、体はその阻害されている状況を代償するためにより多くのベータ・エンドルフィンやエンケファリンなどの内因性オピオイドを産生するようになります。さらに、細胞のオピオイド受容体の量が増えることも報告されています。
体内でのベータ・エンドルフィンやエンケファリンの産生増加とオピオイド受容体の発現亢進は、免疫力増強や抗ストレス作用、鎮痛作用、がん細胞の増殖抑制などの効果を引き起こすことにつながります(下図)。

図:低用量ナルトレキソン療法は、ベータ・エンドルフィンやメチオニン・エンケファリン(オピオイド増殖因子)などの内因性オピオイドの産生とオピオイド受容体の両方を増やす作用がある。ベータ・エンドルフィンは強い鎮痛作用をもち、ストレスに対する抵抗力を高め免疫力を増強する。さらに低用量ナルトレキソン療法は、がん細胞のメチオニン・エンケファリンとその受容体の量を増やし、オートクリン(自己分泌)の機序でがん細胞の増殖を抑制する。
マウスを使った実験で、低用量ナルトレキソン療法が、DNA合成と血管新生を抑制し卵巣がん細胞の増殖速度を低下させることや、抗がん剤のシスプラチンの副作用(毒性)を軽減し、抗腫瘍効果を増強することが報告されています。例えば、以下のような報告があります。
Low-dose naltrexone suppresses ovarian cancer and exhibits enhanced inhibition in combination with cisplatin.(低用量ナルトレキソン療法は卵巣がんの増殖を抑え、シスプラチンの抗腫瘍効果を増強する)Exp Biol Med, 36(7): 883-895, 2011
【要旨の抜粋】
本研究では、培養ヒト卵巣がん細胞を使った試験管内実験と、マウスに卵巣がん細胞を移植した動物実験を用いて、オピオイド受容体阻害剤であるナルトレキソンによる内因性オピオイドの変化が、卵巣がん細胞の増殖にどのような影響を及ぼすかを検討し、さらに抗がん剤治療(タキソールやシスプラチン)との相乗効果について検討した。
培養細胞を使った実験で、2日置き6時間だけナルトレキソンを投与すると、卵巣がん細胞の増殖とDNA合成は抑制された。
さらに、ナルトレキソンを短時間投与すると、タキソールやシスプラチンの抗がん作用が増強された。
卵巣がん細胞を移植したマウスに低用量のナルトレキソンを投与してオピオイド受容体を短時間阻害すると、移植したがん細胞の生存率には影響せず、DNA合成と血管新生を抑制してがん細胞の増殖速度を低下させた。
マウスの移植腫瘍に対するシスプラチンの抗腫瘍効果は低用量のナルトレキオソンの投与によって相加的に増強したが、タキソールの抗腫瘍効果に対しては増強しなかった。
低用量ナルトレキソンの投与は、シスプラチンの副作用(体重減少など)を軽減した。
低用量ナルトレキソン療法は、オピオイド増殖因子(Opioid Growth Factor:OGF)であるメチオニン-エンケファリン(Met-enkephalin)とその受容体であるOGF受容体の発現を促進したOGFは卵巣がんに対してOGF受容体を介して増殖抑制効果を示すオピオイドであることが報告されている。
したがって、今回の実験で認めた低用量ナルトレキソン療法による卵巣がん細胞の増殖抑制は、OGFとOGF受容体を介した機序の関与が示唆された。このような基礎研究の結果は、低用量ナルトレキソン療法が、卵巣がんの治療において副作用が少なく有効性の高い治療法となる可能性を示している。
低用量ナルトレキソン療法によるがん細胞の増殖抑制の作用機序に関しては、脳下垂体や副腎からの内因性オピオイドの産生増加(エンドクリン機序)の他に、断続的なオピオイド受容体の阻害ががん細胞に直接的な増殖抑制効果をもたらすオートクリン機序をザゴン教授は重視しています。
すなわち、培養がん細胞を使った実験でも、持続的にナルトレキソンを作用させるとがん細胞の増殖が促進され、断続的にナルトレキソンを作用させると、がん細胞内でのオピオイド増殖因子(=メチオニン・エンケファリン)とオピオイド増殖因子受容体の産生が増え、オートクリンの機序でがん細胞の増殖が抑制されるという研究結果が報告されています。
ビハリ博士が低用量ナルトレキソン療法を行ったがん患者の多くは標準治療で効果が無くなった状態でしたが、約60%の患者に効果を認めたと報告しています。論文報告ではありませんが、24%の患者で75%以上の腫瘍縮小、35%の患者で病状安定あるいは腫瘍の縮小傾向を認めたと言っています。
がんの臨床例に関する有効性の検討は、症例報告や予備試験のレベルのものしかなく、信頼度の高い臨床試験の結果はまだ報告されていません。ナルトレキソン自体の特許が取れないため、がん治療薬として開発を行う製薬会社がなく、費用のかかる大規模な臨床試験が行われないという事情があります。
しかし、低用量ナルトレキソン療法は内因性オピオイドの産生増加によって体に備わった免疫力や治癒力を高め、さらにオピオイド増殖因子によってがん細胞の増殖を抑制するというユニークな作用機序と、副作用がほとんど無く安価な治療法であるので、がんの補完代替医療として世界中で利用者が増えています。
さらに、自己免疫疾患(クローン病など)や神経変性疾患、原因不明の疼痛(線維筋痛症)の治療に有効で、ストレス抵抗性を高めるので、病気の予防や健康増進にも有効です。
最近は、新型コロナ感染症の後遺症の治療にも効果があるという報告があります。しかも、比較的安価です。治療法が無い場合、試してみる価値はあります。
低用量ナルトレキソン療法は、体内におけるオピオイドとその受容体の作用を利用した副作用の少ない(ほとんど無い)がん治療であり、低用量ナルトレキソン療法にイメージ療法や瞑想、気功、鍼灸、漢方薬、適度な運動、入浴など内因性オピオイドの産生を高める方法を併用することはがん治療に役立つと言えます。
また、イミキモドがオピオイド増殖因子受容体の発現を亢進することが報告されています。
イミキモド(Imiquimod)は合成イミダゾキノリンで、樹状細胞やマクロファージなどに発現しているTLR7(Toll-like receptor 7)にリガンドとして直接結合し、シグナルを伝えることによって、I型インターフェロンを誘導し自然免疫を活性化します。
塗布薬(5% imiquimodクリーム)として販売され、基底細胞がんや尖圭コンジローマに対して使用され、日光角化症、ボーエン病など表在性の皮膚悪性腫瘍でも有効性が認められています。
腫瘍の周囲の皮膚に塗布して皮膚の樹状細胞を活性化すると、体内の腫瘍に対しても抗腫瘍免疫が活性化されます。
このイミキモドがオピオイド増殖因子受容体の発現を亢進することが報告されています。
Imiquimod upregulates the opioid growth factor receptor to inhibit cell proliferation independent of immune function(イミキモドはオピオイド増殖因子受容体を上方制御して、免疫機能とは独立して細胞増殖を阻害する)Exp Biol Med (Maywood). 2008 Aug;233(8):968-79
局所進行乳がんなど、がん組織の周囲の皮膚にイミキモドを塗布できる場合は、低用量ナルトレキソン療法とイミキモド塗布の併用を試してみる価値はあります。
● 低用量ナルトレキソン療法についてはこちらへ:
● イミキモドについてはこちらへ:
| « 875)抗がん剤... | 877)小胞体ス... » |



