がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
549)肝機能改善薬リバオールが乳がんのホルモン療法の効き目を高める?
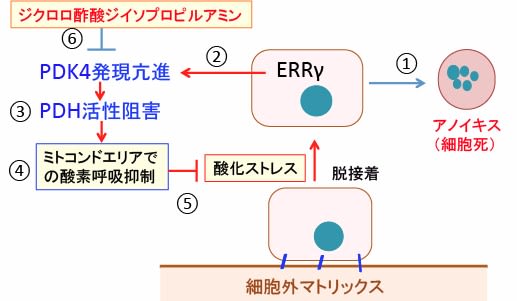
図:細胞外基質(細胞外マトリックス)からの接着が外れると、細胞は酸化ストレスが亢進してアノイキス(細胞死)が誘導される(①)。一方、細胞はアノイキスを避けるために、エストロゲン関連受容体γ(ERRγ)を介してピルビン酸脱水素酵素キナーゼ4(PDK4)の発現が亢進し(②)、ピルビン酸脱水素酵素(PDH)をリン酸化してPDH活性を阻害する(③)。PDH活性が阻害されるとピルビン酸からアセチルCoAへの変換が阻止され、ミトコンドリアでの酸素呼吸が抑制される(④)。その結果、活性酸素の産生が抑制され、酸化ストレスの亢進が阻止されて細胞死(アノイキス)が阻止される(⑤)。がん細胞では恒常的にミトコンドリアでの酸素呼吸が抑制されている(ワールブルグ効果)ので、アノイキスに抵抗性を示し、転移を起こすことができる。ジクロロ酢酸ジイソプロピルアミンはPDK4活性を阻害し、ミトコンドリアを活性化して酸素呼吸を増やして細胞内の酸化ストレスを高め、アノイキスを誘導してがん細胞の転移を抑制する作用が報告されている(⑥)。
549)肝機能改善薬リバオールが乳がんのホルモン療法の効き目を高める?
【がん細胞は足場が無くても生きていける】
細胞はインテグリンを介して細胞外基質(細胞外マトリックス)に接着しています。
インテグリンはαとβタンパク質から成るヘテロ二量体を形成する細胞膜タンパク質で、細胞内にある細胞骨格(アクチンフィラメントなど)と細胞外にある細胞外基質(コラーゲン、フィブロネクチン、ラミニンなど)をつなぐ働きを担っています。
α(17種)とβ(8種)の組み合わせにより多種の二量体、すなわちインテグリンファミリーを構成し、それぞれ固有の役割を担っています。
正常な上皮細胞が増殖・生存するためには、インテグリンを介した細胞外マトリックスとの接着が必要です。
上皮細胞は細胞や細胞外基質と接着して増殖し、浮遊状態では増殖できず細胞死が誘導されます。このような足場を失ったことで誘導される細胞死をアノイキス(anoikis)と呼びます。
正常細胞が足場を失うと、何らかのシグナル伝達系が活性化され、細胞内で活性酸素の産生が増え、酸化ストレスが亢進して細胞死(=アノイキス)を引き起こすというメカニズムが報告されています。
一方、がん細胞ではさまざまな分子メカニズムによりアノイキスに抵抗性となり、血管内などで細胞死を免れ,転移を促進すると考えられています。
がん細胞はミトコンドリアでの酸素呼吸を抑制することによって酸化ストレスの亢進を防いでいるので、転移の過程で細胞が足場を失っても、アノイキスによる細胞死が起こりにくくなっていると考えられています。そのため、死滅せずに血管内で移動して、他の場所に転移することができると考えられています。
そこで、がん細胞のミトコンドリアを活性化して酸化ストレスを高めると、がん細胞でもアノイキスが起こり易くなって、転移が抑制できる可能性が検討されています。

図:細胞はインテグリンを介して細胞外マトリックス(コラーゲンなど)と接着している。この接着が外れると、細胞は酸化ストレスが亢進してアノイキスのメカニズムで死滅する。がん細胞はミトコンドリアでの酸素呼吸を抑制するなどのメカニズムで酸化ストレスが亢進しないようにしている。そのため、細胞外マトリックスとの接着が外れても細胞死を起こさないので、転移することができる。
【ミトコンドリアの酸素呼吸を阻害するピルビン酸脱水素酵素キナーゼ】
細胞が低酸素状態に置かれると低酸素誘導因子-1(Hypoxia-inducible Factor-1:HIF-1)という転写因子の発現が誘導されます。
転写因子というのは特定の遺伝子の発現(DNAの情報を蛋白質に変換すること)を調節している蛋白質です。
HIF-1のターゲット遺伝子は100種類以上知られており、エネルギー代謝、血管新生、細胞増殖、アポトーシスなど細胞の機能と深く関連している遺伝子の発現を制御しています。細胞が低酸素状態で生存するために必要な遺伝子の発現を促進します。
正常細胞ではHIF-1は細胞が低酸素状態におかれた場合しか活性化されません。
一方、多くのがん細胞では、低酸素状態でなくてもHIF-1の活性が亢進しています。がん細胞では、がん遺伝子のc-Mycの活性や増殖のシグナル伝達系のPI3K/Akt/mTORC1が恒常的に亢進しており、その結果としてHIF-1の活性が恒常的に亢進しているからです。
がん細胞の代謝の特徴である「解糖系の亢進とミトコンドリアでの酸化的リン酸化の抑制」というワールブルグ効果(Warburg effect)を根本で制御しているのがHIF-1と言っても過言ではありません。
HIF-1は乳酸脱水素酵素(LDH)などの解糖系酵素の発現を亢進し、一方、ピルビン酸脱水素酵素キナーゼ(PDK)の発現を亢進して、ミトコンドリアでの酸素呼吸を抑制します。
解糖系で産生されたピルビン酸がミトコンドリアで代謝されるとき、その第一ステップとしてピルビン酸脱水素酵素(PDH)によってピルビン酸がアセチルCoAに変換されます。
このピルビン酸脱水素酵素(PDH)をリン酸化して不活性化するのがピルビン酸脱水素酵素キナーゼ(PDK)です。このピルビン酸脱水素酵素キナーゼはHIF-1によって発現が亢進します。
つまり、がん細胞では、HIF-1によってピルビン酸脱水素酵素キナーゼ(PDK)の発現が亢進し、PDKがピルビン酸脱水素酵素(PDH)の活性を阻害し、ピルビン酸からアセチルCoAへの変換が阻害されるので、ミトコンドリアでの酸素を使った代謝が抑制されることになります。(下図)

図:がん細胞では低酸素やPI3K/Akt/mTORシグナル伝達系の活性化によって低酸素誘導因子-1(HIF-1)の活性が恒常的に亢進している。HIF-1はピルビン酸脱水素酵素キナーゼ(PDK)や乳酸脱水素酵素などの解糖系酵素の発現を誘導する。PDKはピルビン酸脱水素酵素(PDH)をリン酸化してその活性を阻害する。その結果、ピルビン酸からアセチルCoAへの変換が阻止されてミトコンドリアでの糖代謝(酸化的リン酸化)は抑制される。
【ミトコンドリアを活性化すると転移が抑制される】
ミトコンドリアでのエネルギー代謝(酸素呼吸)を増やすと、がん細胞のアノイキスが亢進し、転移が抑制されることが報告されています。以下のような論文があります。
Glucose Oxidation Modulates Anoikis and Tumor Metastasis(グルコース酸化はアノイキスとがん細胞転移を制御する)Mol Cell Biol. 2012 May; 32(10): 1893–1907.
【要旨】
がん細胞のグルコース代謝は、酸素が利用できる場合でも解糖系が亢進し、ミトコンドリアでの酸素呼吸は抑制されている。これを好気性解糖あるいはワールブルグ効果という。細胞が細胞外マトリックスの接着から離れるとアポトーシスによる細胞死が誘導され、これをアノイキス(anoikis)という。このアノイキスはがん細胞の転移を阻止する。
がん細胞の代謝がアノイキスと転移に影響するかどうかに関しては不明な点が多い。
この研究では、正常な乳腺上皮細胞が細胞外マトリックスの接着から離れる過程で、エストロゲン関連受容体γ(estrogen-related receptor gamma; ERRγ)によってピルビン酸脱水素酵素キナーゼ4(pyruvate dehydrogenase kinase 4; PDK4)の発現が顕著に亢進し、その結果、ピルビン酸脱水素酵素が阻害されて、ミトコンドリアでの酸素呼吸が抑制されるようにグルコース代謝の再プログラム化が起こることを示す。
この代謝の変化の重要性を明らかにするために、浮遊培養した細胞でPDK4遺伝子を欠損させたり、あるいはピルビン酸脱水素酵素(PDH)の活性を亢進すると、ミトコンドリアでの酸素呼吸が亢進し、酸化ストレスが亢進し、アノイキスが高度に引き起こされる。
逆に、浮遊培養した細胞にピルビン酸脱水素酵素キナーゼを過剰発現させると、細胞の生存を延長した。
これは、細胞の遊離によって引き起こされるグルコースの酸化的リン酸化の抑制は、アノイキスに抵抗性にさせることを示している。
正常細胞と異なり、多くのがん細胞は、細胞外マトリックスに接着した状態でもミトコンドリアでの酸素呼吸が減少しており、浮遊状態で培養してもアノイキスを起こさずに生存できる。
がん細胞においてピルビン酸脱水素酵素の活性を刺激してグルコース代謝を正常化することは、アノイキスに対する感受性を高め、転移能を減弱させることができる。
これらの実験結果は、ミトコンドリアでの酸素呼吸の減少(ワールブルグ効果)はアノイキス抵抗性を亢進し、転移を促進することを示している。ピルビン酸脱水素酵素キナーゼは転移を阻止する治療法のターゲットになる。
エストロゲンと結合したエストロゲン受容体(ER)はプロモーター上のエストロゲン応答(ERE)配列を認識することで、増殖や発がんに関与するさまざまな遺伝子の転写を制御しています。
エストロゲン関連受容体(ERR)はER と非常に類似した構造を有しますが、リガンド未知のオーファン核内受容体として発見され、その作用機序については十分にわかっていません。
ERR はこれまでにα、β、γの3 種のサブタイプが発見されています。
ERRαとERRγは心臓や腎臓、骨格筋、褐色脂肪組織などエネルギー代謝の活発な組織に発現しています。ERRβは胎盤や絨毛組織に発現し胎盤形成に関与しています。
ERRαやERRγはミトコンドリア生合成や酸化的リン酸化などの細胞内代謝機能を制御していると考えられています。
寒冷刺激や運動負荷のような低酸素状態、飢餓、感染などにより標的組織内のERRαやERRγが急激に上昇し、エネルギー代謝に関わるさまざまな遺伝子を活性化することが知られています。
この論文では、正常な乳腺上皮細胞が、細胞外基質からの接着が外れると核内受容体のエストロゲン関連受容体γ (ERRγ)を介してピルビン酸脱水素酵素キナーゼ4(PDK4)の発現が亢進することを報告しています。
PDK4はピルビン酸脱水素酵素(PDH)をリン酸化して不活性化します。
ピルビン酸脱水素酵素はピルビン酸をアセチルCoAに変換する酵素で、この酵素活性が阻害されると、ピルビン酸はミトコンドリアでのTCA回路に入ることができず、ミトコンドリアでの酸素呼吸が抑制されることになります。
これは、活性酸素の産生を抑制して酸化ストレスが高まるのを抑えるための反応です。
つまり、細胞が浮遊すると、ミトコンドリアでの酸素呼吸を抑制するように再プログラム化されるということです。
このグルコース代謝の変更はミトコンドリアにおける活性酸素の産生を減らし、細胞外マトリックスとの接着がない状態での細胞の生存を延長することになります。
がん細胞のように、グルコースの解糖での代謝を亢進し、ミトコンドリアの活性を抑制することは、アノイキスに対する抵抗性を高めることになります。
がん細胞の酸化ストレスを高めると増殖や転移を抑えられることは505話で解説しています。

図:細胞外基質(細胞外マトリックス)からの接着が外れると、細胞は酸化ストレスが亢進してアノイキス(細胞死)が誘導される(①)。一方、細胞はアノイキスを避けるために、エストロゲン関連受容体γ(ERRγ)を介してピルビン酸脱水素酵素キナーゼ4(PDK4)の発現が亢進し(②)、PDK4はピルビン酸脱水素酵素(PDH)をリン酸化してPDH活性を阻害する(③)。PDH活性が阻害されるとピルビン酸からアセチルCoAへの変換が阻止され、ミトコンドリアでの酸素呼吸が抑制される(④)。その結果、活性酸素の産生が抑制され、酸化ストレスの亢進が阻止されて細胞死(アノイキス)が阻止される(⑤)。
【肝機能改善薬リバオールがPDK4の活性を阻害する】
ピルビン酸脱水素酵素キナーゼ(pyruvate dehydrogenase kinase; PDK)にはPDK1〜4の4種類のアイソフォームが存在します。
PDK1は低酸素で活性化されます。PDK2はPDHの産物であるアセチルCoAとNADHで活性化され、ADPとピリビン酸で阻害されます。
PDK3はATPで活性化されます。ATPが過剰に産生されるとフィードバックでPDK3を活性化してミトコンドリアでのATP産生を阻害することになります。
PDK4はホルモンやレチノイン酸や副腎皮質ホルモンで転写が活性化され、インスリンで抑制されます。
HIF-1で誘導されるのはPDK1とPDK3です。
ジクロロ酢酸ナトリウムはPDK1を阻害します。がん細胞のミトコンドリアを活性化する目的では通常はジクロロ酢酸ナトリウムを使います。最近は、PDK4もがん治療のターゲットとして注目されています。
前述の論文でアノイキスを阻止するPDK(ピルビン酸脱水素酵素キナーゼ)としてPDK4が同定されています。
がん細胞では恒常的にミトコンドリアでの酸素呼吸が抑制されている(ワールブルグ効果)ので、アノイキスに抵抗性を示し、転移を起こすことができます。
PDK4活性を阻害してミトコンドリアを活性化して酸素呼吸を増やして細胞内の酸化ストレスを高めると、がん細胞にアノイキスを誘導して、転移を抑制できる可能性があります。
PDK4の選択的阻害剤としてジクロロ酢酸ジイソプロピルアミンがあります。これは肝機能改善剤のリバオール錠として使用されています。以下のような論文があります。
Diisopropylamine Dichloroacetate, a Novel Pyruvate Dehydrogenase Kinase 4 Inhibitor, as a Potential Therapeutic Agent for Metabolic Disorders and Multiorgan Failure in Severe Influenza.(重症インフルエンザにおける代謝異常と多臓器不全の治療薬として可能性がある新規のピルビン酸脱水素酵素キナーゼ4阻害剤のジクロロ酢酸ジイソプロピルアミン)PLoS One. 2014; 9(5): e98032.
ジクロロ酢酸ジイソプロピルアミンは第一三共からリバオール(Liverall)という商品名で販売されています。
50年以上前から慢性肝疾患の治療薬として使用されています。
ジクロロ酢酸ジイソプロピルアミンは、ビタミン様物質として知られるパンガミン酸(ビタミンB15)の活性成分で肝機能改善に効果があります。
健康ドリンクのリゲインにも含有されています。
この論文は徳島大学と第一三共研究所からの論文です。
ジクロロ酢酸ジイソプロピルアミンが代謝活性作用や臓器保護作用によって重症インフルエンザの治療に役立つという結果です。
その機序としてピルビン酸脱水素酵素キナーゼ4(PDK4)を阻害することを報告しています。
健康ドリンクのリゲインにはリバオールとビタミンB1が入っています。
この組合せはミトコンドリアの酸素呼吸を活性化するので体力を高める効果があることが医学的に納得できます。
【PDK4は乳がんのホルモン療法抵抗性を亢進する】
乳がんでホルモン療法を行っていると、効き目が次第に弱くなることがあります。このようなホルモン療法抵抗性にPDK4(ピルビン酸脱水素酵素キナーゼ4)の過剰発現が関与しているという報告があります。PDK4阻害剤のリバオールが乳がんのホルモン療法の効き目を高める可能性が示唆されます。
PDK4とホルモン感受性との関連に関して以下のような報告があります。
Altered regulation of PDK4 expression promotes antiestrogen resistance in human breast cancer cells (ヒト乳がん細胞において、PDK4発現の制御異常は抗エストロゲン抵抗性を促進する)Springerplus. 2015; 4: 689. Published online 2015 Nov 10. doi: 10.1186/s40064-015-1444-2
【要旨】
選択的エストロゲン受容体調節薬であるタモキシフェンとフルベストラントに対する獲得耐性あるいは元からの耐性は、乳がんの治療効果を妨げる重要な要因となっている。
タモキシフェン耐性の乳がん細胞(TamR-MCF-7)とタモシキフェン感受性の親細胞(MCF-7L)の遺伝子発現パターンを比較し、その違いを比較検討した。
TamR-MCF-7はフルベストラントとドキソルビシンにも耐性を示し、ミトコンドリアDNAの増加を認めた。
MCF-7L細胞に比較してTamR-MCF-7では遺伝子発現パターンに少しの違いを認めた。発現に差があった遺伝子の一つがピルビン酸脱水素酵素キナーゼ4(PDK4)であった。PDK4はピルビン酸脱水素酵素(PDH)をリン酸化して不活性化する。
PDK4遺伝子の発現はTamR-MCF-7細胞で亢進していた。抗エストロゲン治療に耐性を獲得した別の実験モデルでもPDK4発現亢進を認めた。
PDK4遺伝子の発現はPDK4遺伝子のプロモーター領域に存在するグルココルチコイド応答エレメントによって部分的に制御されている。
MCF-7L細胞では、グルココルチコイド受容体アゴニストによってPDK4mRNA発現は誘導されなかったが、TamR-MCF-7細胞ではデキサメサゾンはPDK4発現を顕著に亢進した。
グルコースを枯渇した培養液で培養してもフルベストラントに対する感受性は変化しなかったが、siRNAを用いてPDK4遺伝子発現を阻害すると、フルベストラントに対するamR-MCF-7細胞の感受性は亢進した。
TamR-MCF-7細胞はMCF-7L細胞に比べてPDK4mRNAレベルは高かったが、TamR-MCF-7細胞のPDH活性は亢進していた。
ワイルドタイプのMCF-7細胞は、PDK4たんぱく質の活性部位近くのアラニンがスレオニンに変化する変異を持っていることが報告されている。TamR-MCF-7細胞ではPDK4遺伝子は正常である。
これらのデータは、ヒト乳がん細胞における薬剤耐性の発生において、PDK4によるPDH制御の異常が関与していることを示唆している。
この研究結果の細かな解釈は難しい点がありますが、要点は「ピルビン酸脱水素酵素キナーゼ4(PDK4)の発現亢進はホルモン療法に抵抗性になり、PDK4の阻害はホルモン療法の感受性を高める」ということです。
乳がんの治療では、エストロゲン受容体(ER)は重要なターゲットであり、ER陽性の乳がんはホルモン療法が有効なので、その予後は良好です。
ホルモン療法には選択的エストロゲン受容体モジュレーター(elective estrogen receptor modulators ;SERMs)のタモキシフェン(エストロゲン受容体に対してエストロゲンと競合的に結合して抗エストロゲン作用を示す)やフルベストラント(エストロゲン受容体に結合してその作用を阻害し、さらに 受容体量を低下させる)、ERのリガンドのエストラジオールの産生を抑制するアロマターゼ阻害薬などがあります。
乳がんの患者さんがPDK4阻害を目的にジクロロ酢酸ジイソプロピルアミン(商品名:リバオール)を日頃から摂取するメリットはありそうです。ジクロロ酢酸ジイソプロピルアミンに直接的な抗腫瘍効果も報告されています。以下のような報告があります。
Superior anti-tumor efficacy of diisopropylamine dichloroacetate compared with dichloroacetate in a subcutaneous transplantation breast tumor model.(皮下に移植した乳がんの実験モデルにおいて、ジクロロ酢酸に比べてジクロロ酢酸ジイソプロピルアミンはより優れた抗腫瘍活性を示す)Oncotarget. 2016 Oct 4;7(40): 65721-65731.
【要旨】
ジクロロ酢酸はピルビン酸脱水素酵素キナーゼの阻害剤で、多くの種類のがんの実験モデルにおいて抗腫瘍作用を示す。
ジクロロ酢酸ジイソプロピルアミン(Diisopropylamine dichloroacetate)はジクロロ酢酸の誘導体で、慢性肝疾患の治療薬として薬局でも購入できる。
今までに、乳がん細胞に対するジクロロ酢酸ジイソプロピルアミンの抗腫瘍効果の検討はほとんど行われていない。
この研究においては、乳がん細胞株のMDA-MB-231を用いた培養細胞(in vitro)と動物実験(in vivo)の実験系にて、ジクロロ酢酸ジイソプロピルアミン(DADA)とジクロロ酢酸(DCA)の抗腫瘍活性を比較した。
MDA-MB-231細胞に対する50%増殖阻止濃度(IC50)は、DADA(7.1 ± 1.1 mmol/L)の方がDCA(15.6 ± 2.0 mmol/L)より有意に低かった。
マウスの皮下にがん細胞を移植する実験系において、体重1kg当たり100mgを投与した場合の抗腫瘍効果はDADAの方が強かった。
腫瘍組織の組織検査において、DCAとDADAは共に、腫瘍組織の壊死と炎症と線維化を引き起こしていた。
DADA投与は腫瘍組織のKi67(細胞分裂のマーカー)発現を阻害した。培養細胞を使った実験において、DADAは10 mmol/Lの濃度でMDA-MB-231細胞の乳酸産生とグルコース取り込みを阻害し、その作用はDCAより強かった。
結論として、乳がんの実験モデルでジクロロ酢酸ジイソプロピルアミン(DADA)はジクロロ酢酸(DCA)より強い抗腫瘍活性を示した。
【腫瘍組織の酸性化はホルモン療法の効き目を弱める】
ホルモン療法を行っているときに、ホルモン剤に抵抗性の乳がん細胞が出現することが、ホルモン療法が効かなくなる主な理由です。
ホルモン剤抵抗性のメカニズムにがん細胞の代謝がどのような関与をしているかが研究されています。
解糖系が亢進しがん組織が酸性化すると、ホルモン療法に感受性が低下するという報告があります。
Prolactin-Stat5 signaling in breast cancer is potently disrupted by acidosis within the tumor microenvironment(乳がん細胞におけるプロラクチン-Stat5シグナル系は腫瘍組織の微小環境内の酸性化によって阻害される)Breast Cancer Res. 2013; 15(5): R73.
プロラクチン-Stat5シグナル伝達系は乳腺細胞の分化の維持を促進し、このシグナル伝達系が阻害されるとホルモン療法に抵抗性になることが知られています。
がん組織における細胞外のpHは6.5から6.9と酸性化していることが知られているので、プロラクチン-Stat5シグナル伝達系に対するpHの影響を検討しています。
pHを6.8にすると、上皮細胞増殖因子(EGF)やオンコスタチンMやIGF1やFGFや増殖因子など増殖促進系の因子と受容体のシグナル系には影響せず、プロラクチンとその受容体によるシグナル伝達系は強く阻害されることを明らかにしています。
その結果、がん組織の酸性化がホルモン療法抵抗性の原因になっているという結論です。
エストロゲン関連受容体γ(ERRγ)はPDK4発現を亢進します。ERRγはタモキシフェン代謝産物である4-ヒドロキシタモキシフェンによって直接的に阻害されます。タモキシフェンは乳がんのホルモン療法だけでなく、他のがんにもPDK4発現抑制などの機序によって抗腫瘍効果を示す可能性が示唆されています。
グリオブラストーマ(膠芽腫)や前立腺がんでもPDK4の阻害が抗腫瘍効果を示すことが報告されています。
PDK4は心筋細胞や骨格筋や肝臓や膵臓や腎臓など代謝的に活性な細胞で多く発現しています。食事の後の血糖上昇は、ピルビン酸脱水素酵素(PDH)活性を亢進させ、グルコースの酸化的代謝と脂肪酸合成が亢進します。
飢餓のときには、PDH活性は低下しグルコースの代謝は制限され、脂肪組織から脂肪酸が遊離して脂肪酸の酸化が亢進します。
PDK4の発現は多くの組織で代謝のストレス状態に応答して誘導されます。
飢餓や断食やグルコース枯渇はPDK4レベルを上昇します。
PDK4発現は食事からの脂肪や様々なホルモンによって亢進し、インスリンは抑制します。
つまり、飢餓状態になって低血糖になるのを防ぐために、ミトコンドリアでの糖代謝を減らすためにPDK4の発現が誘導されるのです。
【ジクロロ酢酸もタモキシフェンの効果を高める】
ジクロロ酢酸はピルビン酸脱水素キナーゼ1(PDK1)を阻害して、ピルビン酸脱水素(PDH)を活性化し、ミトコンドリアでの酸素呼吸を亢進します。がん細胞ではミトコンドリアでの酸素呼吸(酸化的リン酸化)が抑制されていますが、がん細胞のミトコンドリアを活性化すると、様々なメカニズムでがん細胞の増殖を抑制します。
以下のような論文があります、
Dichloroacetate potentiates tamoxifen-induced cell death in breast cancer cells via downregulation of the epidermal growth factor receptor(ジクロロ酢酸は上皮成長因子受容体の発現抑制によって乳がん細胞におけるタモキシフェン誘導性細胞死を増強する)Oncotarget. 2016 Sep 13; 7(37): 59809–59819.
【要旨】
がん細胞における代謝の再プログラム化は細胞のがん化の必須の特徴と認識されている。がん細胞における代謝の特徴をターゲットとした様々な薬物が、前臨床試験で有望な効果が得られている。
最近の複数の研究で、ピルビン酸脱水素酵素キナーゼの選択的阻害剤であるジクロロ酢酸が、多くの種類の腫瘍細胞に対して抗腫瘍効果を発揮することが示されている。
しかしながら、ジクロロ酢酸を臨床で使用する場合に重要な、正確な作用機序は十分に解明されていない。
今回の研究において、MCF7乳がん細胞においてジクロロ酢酸は上皮成長因子受容体(EGFR)の発現を減少させ、タモキシフェンによる細胞死を増強することを明らかにした。
EGFRの発現抑制はEGFRタンパク質の分解によって引き起こされていた。さらに、p38マイトジェン活性化プロテインキナーゼ(p38-MAPキナーゼ)が、DCAによるタモキシフェン誘導性EGFR発現抑制に重要な役割を担っていた。
最後に、 タモキシフェン存在下で長期に培養して得たタモキシフェン耐性のMCF7細胞に対しても、DCAはタモキシフェン誘導性細胞死を亢進した。
以上の結果から、ジクロロ酢酸は、乳がん細胞においてEGFR発現を抑制する機序で、タミキシフェン誘導性細胞死の感受性を高め、さらにタモキシフェン抵抗性を阻止する抗がん剤としての可能性を持っていることが示唆された。
がん細胞ではHIF-1の発現と活性が亢進しています。
HIF-1はグルコースの取込みと解糖を亢進し、さらに、PDK1とPDK3の発現を亢進します。
PDK4はエストロゲン関連受容体γ(ERRγ)や副腎皮質ホルモンなどによって発現が誘導されます。
ピルビン酸脱水素酵素キナーゼ(PDK)を阻害してピルビン酸脱水素酵素(PDH)を活性化してミトコンドリアを活性化すると、乳酸とプロトン(水素イオン)の産生を低下させてがん組織の酸性化を軽減します。
PDK1を阻害するジクロロ酢酸とPDK4を阻害するジクロロ酢酸ジイソプロピルアミン(リバオール)の併用は、がん細胞のミトコンドリアでの酸素呼吸を活性化し、酸化ストレスを高めてがん細胞の転移を抑制し、細胞死を誘導させる効果が期待できるかもしれません。
いずれにしても、がん細胞のミトコンドリアを活性化すると、がん細胞は死に易くなると言うことです。(506話参照)
| « 548) シンバス... | 550)カンナビ... » |



