がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
550)カンナビジオール(CBD)はドキソルビシンの心臓毒性を軽減する
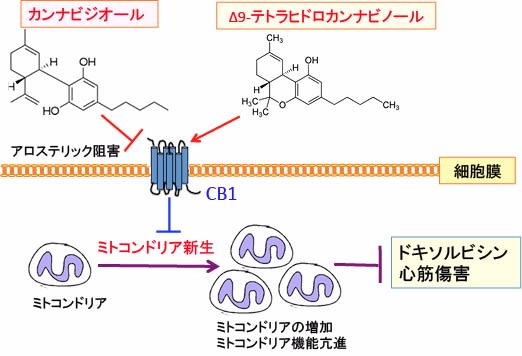
図:抗がん剤のドキソルビシンは心筋にダメージを与える。カンナビノイド受容体CB1はミトコンドリアの新生や機能を低下させることによってドキソルビシンによる心筋傷害を増悪させる。CB1は大麻成分のΔ9-テトラヒドロカンナビノールによって活性化される。カンナビジオールはCB1受容体をアロステリック機序で阻害する。したがって、カンナビジオールはCB1の活性を低下させ、ミトコンドリア新生を亢進し、ミトコンドリア機能を高めて、ドキソルビシン心筋傷害を軽減する。
550)カンナビジオール(CBD)はドキソルビシンの心臓毒性を軽減する
【カンナビノイド受容体はGタンパク質を介して外部の情報を細胞内に伝える】
受容体(レセプター)は脂質二重層の細胞膜を貫通するように存在し、細胞外の刺激や情報を細胞膜で囲まれた細胞内部に使える役割を担っています。
受容体の細胞外側には、特定のシグナル分子(ホルモンや増殖因子や医薬品など)が結合できる「鍵穴」のような構造が存在し、その鍵穴にシグナル分子が結合すると、それが引き金になって様々な化学反応を細胞内で引き起こす働きを持っています。
この連鎖的な反応を通じて情報が細胞内に伝達され、最終的に特定の機能をもったタンパク質の遺伝子発現を促進したりして、細胞の生理機能の変化を引き起こします。このような一連の経路をシグナル伝達経路と呼びます(下図)。

図:細胞は脂質二重層から成る細胞膜によって細胞外と細胞内が分けられている。細胞膜を貫通するように存在する受容体に特有に結合するシグナル分子(リガンド)が結合する(①)と、その受容体は活性化し(②)、連鎖的な化学反応を引き起こす(③)。このようなシグナル伝達によって細胞外の情報が細胞内に伝達され、最終的に特定の機能を持った遺伝子の発現や酵素の活性化などによって、細胞機能に変化が生じる。
細胞膜受容体には多くの種類が知られていますが、そのうちもっとも大きなグループを構成しているのがGタンパク質共役型受容体(G protein coupled receptor : 略してGPCR)です。
α-ヘリックスというらせん構造で親油性の部分が、細胞膜(脂質二重層)を内外に行ったり来たりを7回繰り返しているので「7回膜貫通型受容体」という名称でも呼ばれます。
GPCRが活性化されると、細胞内のGタンパク質と呼ばれるタンパク質を介してシグナルを細胞内に伝達するために、「Gタンパク質共役型受容体」という名前がつけられています。
Gタンパク質はグアニンヌクレオチド結合タンパク質の略称です。Gタンパク質はα、β、γの3つのサブユニットから構成される複合体(三量体)を形成しています。
Gタンパク質は通常、GDPが結合した状態で存在していますが、この状態のGタンパク質は不活性型であり、作用を現しません。GPCRにリガンドが結合して活性化されると、GDP(グアノシン二リン酸)が遊離してGTP(グアノシン三リン酸)が結合して活性型となって細胞内のシグナル伝達を引き起こします。
Gタンパク質の活性化は数百種類にも及ぶセカンド・メッセンジャーの産生を制御します。例えば、アデニル酸シクラーゼに作用してATPからセカンド・メッセンジャーのサイクリックAMP(cAMP)への合成を制御します。ホスフォリパーゼCに作用して細胞膜脂質のホスファチジル・イノシトールからセカンド・メッセンジャーとして働くジアシルグリセロールやインシトール三リン酸の産生を制御します。
これらの作用は活性化されるGPCRの種類によって活性化される場合と阻害される場合があり、刺激されるGPCRの種類によって多様な作用を示します(図)。

図:Gタンパク質共役型受容体(GPCR)は細胞膜を7回貫通する特徴的な構造から7回膜貫通型受容体とも呼ばれている。細胞膜を貫通する部分をつなぐ細胞外のループ状の部分にシグナル分子(リガンド)が特異的に結合する鍵穴様の領域が存在する。Gタンパク質は細胞膜の細胞内側に存在し、α、β、γの3つのサブユニットから構成される三量体を形成している。αサブユニットはGTP(グアノシン三リン酸)あるいはGDP(グアノシン二リン酸)のどちらかを結合できる。三量体のGタンパク質はGDPが結合した不活性な状態で細胞膜に存在している。GPCRにリガンドが結合するとGPCRの構造が変化して三量体Gタンパク質のαサブユニットのGDPが外れてGTPが結合する。GTPが結合して活性化状態になったGタンパク質αサブユニットは、受容体(GPCR)やβサブユニットやγサブユニットと解離して、酵素やイオンチャネルなどに作用して、その下流のシグナル伝達経路を活性化する。
GPCRは多くの種類の細胞に分布しており、光・匂い・味などの外来刺激や、神経伝達物質・ホルモン・イオンなどの内因性の刺激を感知して細胞内に伝達する役割を担っています。
例えば、光を感じて視覚に関わるロドプシン、におい物質に作用する嗅覚受容体、さまざまな生理現象を司る神経伝達物質(アドレナリン、ヒスタミン、セロトニンなど)の受容体などは全てGPCRの仲間です。
GPCRは酵母や原虫など単細胞の真核細胞でも外界の情報伝達に重要な働きを担っています。多細胞生物では進化の過程でさらに多くの種類のGPCRを持つようになっています。
人間ではGPCR遺伝子は1000種類以上が見つかっており、個々のGPCRは特定のシグナルに特異的に反応して生理機能を引き起こします。
GPCRはそのリガンド(受容体に結合して活性化する分子)に基づいて分類されますが、そのリガンドが特定されていないGPCRも多く知られています。これらをオーファン受容体(orphan receptor)と言います。orphanは「孤児」という意味です。
大麻草の成分のカンナビノイドが結合するカンナビノイド受容体はGタンパク質共役型受容体(GPCR)です。このカンナビノイド受容体に作用するシグナル分子(リガンド)は何らかの薬効や毒性を示すことになり、医薬品開発のターゲットとして可能性を持っています。
【大麻成分の相互作用(アントラージュ効果)】
大麻(Cannabis sativa)の成分として、現在までに500を超える化合物が分離・同定されています。
カンナビノイドというのは、大麻草固有の成分の総称で、Δ9-テトラヒドロカンナビノール(THC)、カンナビジオール(CBD)、テトラヒドロカンナビヴァリン、カンナビゲロール、カンナビクロメンなど80種類以上が見つかっています。
その他に、特有の香りと機能を持つ精油成分のテルペン類(リモネン、ミルセン、α-ピネン、リナロール、β-カリオフィレン、カリオフィレン・オキサイドなど多数)やフラボノイド、脂肪酸、ステロイドなどが含まれています。
大麻の薬効は多くの成分の総和として理解する必要がありますが、そのうちでも含有量と薬効の関係からカンナビノイドではΔ9-テトラヒドロカンナビノール(THC)とカンナビジオール(CBD)が重要で、テルペン類ではβカリオフィレンが中心に研究されています。
大麻の薬効成分の主体は、Δ9-テトラヒドロカンナビノール(THC)とカンナビジオール(CBD)ですが、この2つは全く異なる作用機序を有し、相乗的に一部の効果を高めたり、一部の効果を相殺する場合もあります。
さらに、他のカンナビノイドや精油成分のテルペン類などもTHCやCBDの薬効に影響していることが指摘されています。このように大麻に含まれる複数の成分が大麻の薬効を調整していることを、アントラージュ効果(Entourage effect)と呼んでいます。「Entourage」というのは「側近」や「取り巻き」という意味です。
大麻からは500以上の天然成分が分離され、そのうち80以上がカンナビノイドに分類されています。THCとCBD以外に多くのカンナビノイドが存在し、さらにテルペン、アミノ酸、タンパク質、酵素、フラボノイド、ビタミン、ミネラル、脂肪酸など多くの成分が含まれています。これらの全てが薬効に関与しているので、大麻の治療効果はこれら全ての成分の相互作用で成り立っているという考えです。
医療大麻の場合、使用する大麻に含まれるTHCとCBDの比率によって現れる薬効が違ってくるという複雑さがあります。さらに、THCとCBD以外のカンナビノイドだけでなく、テルペン類などの他の成分の薬効も関与してくるので、さらに複雑になります。 このような複雑さが、大麻を薬として認めない理由の一つになっています。しかし、この複雑さが、大麻全体を利用する医療大麻が一部の成分を利用する合成カンナビノイドより有用性が高い理由でもあります。

図: Δ9-テトラヒドロカンナビノールはカンナビノイド受容体CB1とCB2のアゴニスト(作動薬)として作用し、テルペンのβ-カリオフィレンはCB2受容体の選択的アゴニストとしての作用を持つ。カンナビジオールはCB1の働きを阻害する作用があり、さらに5-HT1A、PPARγ、TRPV、TRPAなどの受容体やイオンチャネルなどに作用して効果を発揮する。大麻はこれらの複数の成分の相乗効果によって薬効を発揮する。また、これらの成分の比率の違いによって薬効も変化する。
【CBDはTHCの作用を阻害する】
カンナビノイド受容体(CB1、CB2)のアゴニスト(受容体に結合して作用を発揮する作動薬)になるΔ9-テトラヒドロカンナビノール(THC)や合成THC製剤(ドロナビノール、ナビロン)や内因性カンナビノイド(アナンダミド、2-アラキドノイルグリセロール)は、カンナビノイド受容体に作用して精神作用や免疫調整作用や抗炎症作用など多彩な薬効を示します。
一方、THCと並んでカンナビノイドの主要な成分であるカンナビジオールは、カンナビノイド受容体(CR1、CR2)には結合しません。逆に、カンナビノイド受容体とそのリガンドの結合を阻害するアンタゴニスト(阻害剤)としての活性を持っています。
リガンド(受容体に結合して受容体を活性化する物質)と同じ働きをする薬をアゴニスト(agonist)、リガンドの働きを阻害する薬をアンタゴニスト(antagonist)と言います。
つまり、カンナビジオールはTHCや内因性カンナビノイドの働きを阻止する作用があります。その結果、カンナビジオールはTHCの精神作用を減弱させて副作用を軽減する効果があります。
カンナビノド研究の初期にはカンナビジオールは大麻の薬理作用には関与しない成分と考えられていました。THCの薬効を邪魔するだけの作用しかないと思われていたのです。しかし、2000年代の研究によって、カンナビジオールがCB1やCB2以外の様々な受容体(5-HT1A, TRPV1, GPR55など)に作用して多彩な薬理作用を発揮することが明らかになっています。
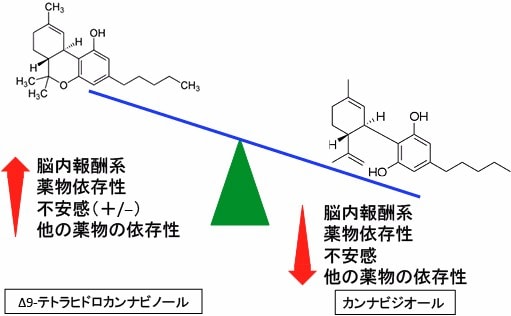
図:脳内報酬系や薬物依存性や不安感や他の薬物の依存性において、Δ9-テトラヒドロカンナビノール(THC)はこれらを高める作用があり、カンナビジオール(CBD)は逆に抑える作用がある。したがって、この2種類のカンナビノイドの量の比率によって、脳内報酬系や依存性への効果が異なってくる。
【アゴニスト、アンタゴニスト、アロステリック制御とは】
アゴニスト(agonist)は生体内の受容体分子に結合してリガンド(神経伝達物質やホルモンなど、特定の受容体に特異的に結合する生体内物質)と同様の機能を示す物質です。作動薬と訳されます。
一方、アンタゴニスト(antagonist)はアゴニストの反対の作用を示す物質です。生体内の受容体分子に結合してリガンド(神経伝達物質やホルモンなど、特定の受容体に特異的に結合する生体内物質)の働きを阻害する物質です。拮抗薬や遮断薬などと訳されます。

図:アゴニストは受容体に結合してシグナルを発生する。アンタゴニストは受容体に結合する力(親和性)を有するがシグナルを起こし得ない薬物であり、アゴニストと併用するとアゴニストの効果を減弱させる。
アンタゴニストがアゴニスト部位への結合でリガンドと競合する場合、競合的アンタゴニスト(competitive antagonist)と呼ばれます。アゴニストとアンタゴニストが受容体の同一の結合部位を競い合い、かつ可逆的な反応で、質量作用の法則に従います。
アゴニストの濃度を増していくと、競合的アンタゴニストは受容体から追い出されて、アゴニストが受容体を100%占有できるようになります。つまり、高濃度のアゴニストは競合的拮抗阻害を克服できます。

図:競合的アンタゴニストはアゴニストと受容体の同じ結合部位を可逆的に競い合う。結合部位における親和性と量によって占拠率が決まる。
一方、非競合的アンタゴニスト(noncompetitive antagonist)は、アゴニスト部位に高い親和性で結合したり共有結合したりするため、高濃度のアゴニストでも受容体を活性化することはできません。ある濃度の非競合的アンタゴニストが共存すると、アゴニストの最大効果は頭打ちになって、いくらアゴニストの濃度を上げても最大効果(100%)に達しません。
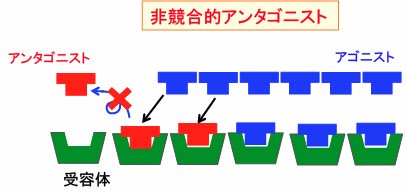
図:アンタゴニストが受容体のリガンド(アゴニスト)結合部位に強く結合するので、アゴニストの濃度を増しても、アゴニストの最大反応は100%に達しない。
「アロステリック」とは 「別の形」 を意味する用語です。酵素や受容体の形が変わることで酵素活性や受容体活性が変化することを「アロステリック調節」といいます。
酵素や受容体の構造の変化によって、活性が阻害される場合(アロステリック阻害)と促進される場合(アロステリック促進)があります。
阻害剤の場合は、非競合的阻害になります。
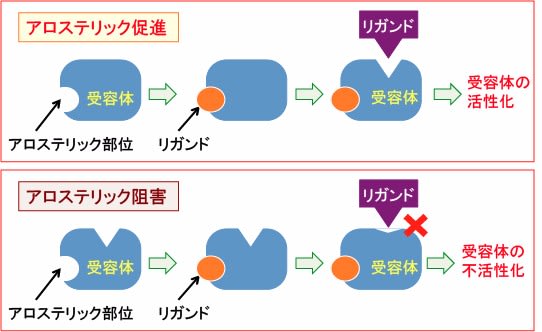
図:受容体のアロステリック部位にリガンドが結合して受容体とリガンドの結合が促進する場合を「アロステリック促進」と言う。一方、受容体のアロステリック部位にリガンドが結合して受容体とリガンドの結合が阻害される場合を「アロステリック阻害」という。
【カンナビジオールはCB1受容体のアロステリック阻害剤】
受容体に作用する薬の多くは、受容体の活性部位をターゲットにしており,生体分子(リガンド)に代わって活性部位に結びつくことで,シグナル伝達を阻害したり増強したりする作用を発揮します。
このタイプの薬はシグナル伝達のオン・オフのスイッチの役割をします。
一方、アロステリック制御をターゲットにした薬は受容体作用の微妙な調節が可能なため、近年注目されています。
前述のように、アロステリック制御薬は受容体の活性部位とは別の場所に取りつき、受容体の形状を変化させることで活性の度合いを調節します。
カンナビジオールはカンナビノイド受容体CB1の非競合的阻害剤として作用しますが、カンナビノイド受容体CB1のアロステリック阻害剤であることが明らかになっています。
以下のような報告があります。
Cannabidiol is a negative allosteric modulator of the cannabinoid CB1 receptor(カンナビジオールはカンナビノイド受容体CB1の負のアロステリック調節剤である)
Br J Pharmacol. 2015 Oct; 172(20): 4790–4805.
【要旨】
研究の背景と目的:カンナビジオールはカンナビノイド受容体CB1のアンタゴニストとして作用することが報告されている。この研究では、カンナビジオールがCB1受容体の負のアロステリック調節によってCB1アゴニストの活性を阻害する可能性を検討した。
実験法:CB1受容体を異種発現するHEK293A細胞およびCB1受容体を内在的に発現する線条体ニューロンのSTHdh Q7 / Q7細胞モデルにおいて、CB1受容体の内在化、アレスチン2動員、PLCβ3およびERK1 / 2のリン酸化を定量した。
細胞は2-アラキドノイルグリセロールまたはΔ9-テトラヒドロカンナビノールをそれぞれ単独、あるいは異なる用量のカンナビジオールとの併用で処理した。
主な結果:CB1受容体を異種性(HEK 293A)あるいは内在性(STHdh Q7/Q7)に発現している細胞において、カンナビジオールは、2-アラキドノイルグリセロールとΔ9-テトラヒドロカンナビノールの有効性と活性を、PLCβ3および ERK1/2依存性のシグナル伝達系を介して減少させた。
CB1受容体へのアレスチン2の動員を減弱させることによって、カンナビジオールはCB1受容体の内在化を阻害した。
カンナビジオールのアロステリック調節の活性は、CB1受容体の細胞外部分のアミノ基末端部の98と107番の極性アミノ基に依存した。
結論と考察:カンナビジオールはCB1受容体に対して、非拮抗性の負のアロステリック調節剤として作用する。アロステリック調節は、CB1受容体とは関連ない効果と併せて、カンナビジオールの生体内での作用を説明できる。
CB1受容体のアロステリック調節は、オルソステリック物質(内因性基質と同一部位に結合する化合物)によるCB1受容体の活性化や阻害に関連する有害作用を回避でき、中枢神経系および末梢神経系の障害を治療する可能性を有する。
THCは食欲増進作用があり、この作用はCB1の作用によります。そこでCB1のアンタゴニスト(阻害薬)が食欲を低下させて肥満の治療薬となるという考えでリモナバン(Rimonabant)が開発され、発売になりました。
予想通りに食欲減退と体重減少の効果はあったのですが、抑うつや自殺企図の副作用が問題になって発売中止になっています。つまり、CB1の働きを阻害することは食欲を低下させる目的では有効ですが、脳内報酬系の抑制などで幸福感や快感を得ることができなくなるようです。
このリモナバンはCB1受容体の働きを完全に阻害するインバース・アゴニストです。
アンタゴニストは受容体に結合するだけで何も作用しない薬物です。
インバースアゴニスト(inverse agonist)は受容体を抑制するように刺激します。つまり、インバースアゴニストはアンタゴニストよりも強力に受容体を阻害します。
CB1は報酬系を活性化して幸福感を感じる作用があります。食欲を高める作用もあります。
そこでCB1受容体の働きを完全に阻害するインバース・アゴニストを使うと、食欲が低下してダイエットに成功します。しかし、報酬系が働くなくなるので、生きる意味も無くなって抑うつや自殺が増えることになります。
カンナビジオールはCB1受容体に対してアロステリック制御で抑制します。この場合は、リモナバンでCB1を阻害するような副作用は避けられると考えられています。
CB1受容体の活性化は食欲増進や吐き気止めや脳内報酬系の活性化や幸福感など良い効果が得られますが、肝臓や心臓の障害を促進する作用があります。
CB1受容体の働きを阻害する薬が肝臓や心臓の障害を防ぐ効果が知られています。その場合、リモナバンのようなインバースアゴニストだと、CB1活性を完全に阻害するので、抑うつや自殺企図のような副作用がでます。
一方、カンナビジオールはCB1に対してアロステリック制御で抑制するので、抑うつや自殺企図のような副作用は起こらないようです。
【CB1阻害はドキソルビシンによる心臓毒性を軽減する】
抗がん剤の副作用としては、白血球や血小板が減少する骨髄抑制と、吐き気や下痢などの消化器毒性がよく知られていますが、その他に、心臓、肝臓、腎臓、肺、神経系などの主要臓器に障害をきたすこともあります。
心臓毒性を示す抗がん剤としては、ドキソルビシン(アドリアマイシン)などのアントラサイクリン系抗がん剤がよく知られています。
その他、シクロフォスファミド、5-フルオロウラシル、パクリタキセル、ハーセプチンなども心臓毒性の発現が報告されています。
ドキソルビシンによる心毒性は、1)投与後数時間以内に発現し、可逆性の不整脈などが主体の急性毒性、2)投与の数日後から数週間以内に発現する心筋炎や心外膜炎などの亜急性毒性、3)投与後数週間から数ヶ月以上して発現する慢性毒性の3種類に分類されます。
一般的には、ドキソルビシンの心臓毒性とは3)の慢性毒性を指し、心筋障害による致死的なうっ血性心不全を来すことが知られています。
この慢性毒性(心筋症)はドキソルビシンの総投与量が多くなるほど発症率が高まります。450mg/m2を超えると発現頻度が高くなり、1000mg/m2を超えると50%に達すると言われています。
うっ血性心不全を発現すると、利尿剤やジギタリス製剤などの治療に対する反応が悪く、死亡率が30~60%と極めて高いと言われています。
高齢者や心疾患を持っていたり、縦隔へ放射線照射との併用や、心臓毒性を持つ他の抗がん剤との併用の場合は、特に心臓毒性に対する注意が必要です。
カンナビノイド受容体CB1はドキソルビシンの心臓毒性を亢進し、CB1の阻害はドキソルビシンの心臓毒性を軽減することが報告されています。以下のような報告があります。
Pharmacological Inhibition of CB1 Cannabinoid Receptor Protects Against Doxorubicin-Induced Cardiotoxicity.(カンナビノイド受容体CB1の薬理学的阻害はドキソルビシンによって誘導される心臓毒性を軽減する)J Am Coll Cardiol. 2007 August 7; 50(6): 528–536.
【要旨】
研究の目的;ドキソルビシンによって引き起こされる心臓毒性のin vivo(動物を使った生体内での実験)およびin vitro(細胞培養の系での実験)を用いて、カンナビノイド受容体1(CB1)の阻害剤の効果を検討した。
研究の背景:ドキソルビシンは非常に有効性の高い抗がん剤の一つであるが、強い心臓毒性の副作用があるため、臨床での使用には制限がある。様々な生理的および病的な状況において、内因性カンナビノイドはCB1受容体を介して心臓機能を低下させる作用があり、このような作用はCB1アンタゴニスト(拮抗薬)によって阻止できる。
方法:心臓左室機能、アポトーシスの指標、CB1/CB2受容体の発現量、内因性カンナビノイド濃度などを種々の方法で解析した。
結果:マウスを用い、体重1kg当たり20mgのドキソルビシンを腹腔内に1回投与してから5日後の検査で、左心室収縮期圧や左室駆出分画(ejection fraction)や心伯出量など様々な心機能の指標は顕著に低下した。内因性カンナビノイドのアナンダミドの心筋内濃度はコントロール群に比較して上昇を認めた。しかし、カンナビノイド受容体CB1とCB2の発現量には変化は認めなかった。
CB1のアンタゴニスト(受容体に結合してその働きを阻害する薬:拮抗薬)であるrimonobantやAM281を投与すると、ドキソルビシンによって引き起こされる心筋細胞のアポトーシスが阻止され、心機能低下が顕著に改善した。
培養心筋細胞株H9c2細胞を用いたin vitroの実験で、ドキソルビシンは培養心筋細胞の生存率を低下させ、アポトーシスを引き起こしたが、心筋細胞をCB1の拮抗薬で前処理すると、心筋細胞のアポトーシスは阻止された。
この阻害作用は、CB1とCB2のアゴニスト(受容体に働いて機能を示す作動薬)やCB2のアンタゴニスト(拮抗薬)では認められなかった。
結論:以上の結果は、ドキソルビシンによって引き起こされる心臓毒性に対して、カンナビノイド受容体CB1の拮抗薬や阻害剤が有効な治療薬となる可能性を示唆している。
CB1受容体の働きを阻害することはドキソルビシンの心臓毒性を軽減できるという報告です。
以下のような報告もあります。
Cannabidiol Protects against Doxorubicin-Induced Cardiomyopathy by Modulating Mitochondrial Function and Biogenesis(カンナビジオールはミトコンドリアの機能と新生を制御することによってドキソルビシン誘発性心筋障害を防ぐ)Mol Med. 2015; 21(1): 38–45.
【要旨】
ドキソルビシンは広く使用されている抗腫瘍活性の高い抗がん剤であるが、その用量依存的な心臓毒性によって臨床使用に限界がある。
ドキソルビシンの心臓毒性には活性酸素や一酸化窒素による酸化ストレスの亢進や、心筋細胞や血管内皮細胞のミトコンドリア機能の障害や細胞死が関与している。
カンナビジオールは大麻に含まれる精神活性を持たない成分であり、有害作用は少なく、抗酸化作用や抗炎症作用を有し、さらに最近は抗腫瘍活性も報告されている。
ドキソルビシン誘発性の心筋障害のマウスの実験モデルを用いて、カンナビジオールの効果を検討した。
ドキソルビシン誘発性心筋障害は心筋細胞のダメージのレベル(血清中のクレアチニンキナーゼと乳酸脱水素酵素の値)、活性酸素や一酸化窒素による細胞傷害のレベル(細胞内のグルタチオン量、グルタチオンペルオキシダーゼ1活性、脂質過酸化、3-ニトロチロシン形成、誘導性一酸化窒素合成酵素mRNAレベル)、心筋細胞死(アポトーシス、ポリADPリボースポリメラーゼ1依存性)、心筋機能(心拍出機能と左室内径短縮率)で評価した。
ドキソルビシンはミトコンドリア新生を抑制し、ミトコンドリア機能を低下させ(呼吸酵素複合体IとIIの活性低下)、心筋細胞における脱共役たんぱく2と3(uncoupling protein 2 and 3)とmedium-chain acyl-CoA dehydrogenase mRNAの発現を低下させた。
カンナビジオールの投与は、これらのドキソルビシン誘発性の心筋機能の障害を改善し、活性酸素や一酸化窒素による細胞ストレスと細胞死を軽減した。
カンナビジオールは障害されたミトコンドリア機能をミトコンドリア新生を改善した。
これらの実験結果は、ドキソルビシンによる心筋障害に対する新たな治療法をしてカンナビジオールの有用性を示唆しており、ミトコンドリアの機能や新生に対するカンナビジオールの作用は、他の多くの組織障害の実験モデルでのカンナビジオールの作用機序を説明できるかもしれない。
CB1の刺激はミトコンドリア新生を阻害することが報告されています。以下のような報告があります。
Cannabinoid Receptor Stimulation Impairs Mitochondrial Biogenesis in Mouse White Adipose Tissue, Muscle, and Liver: The Role of eNOS, p38 MAPK, and AMPK Pathways(カンナビノイド受容体の刺激はマウスの白色脂肪組織と筋肉と肝臓におけるミトコンドリア新生を阻害する:eNOSとp38MAPKとAMPK経路の役割)Diabetes. 2010 Nov; 59(11): 2826–2836.
【要旨】
研究の目的:カンナビノイド受容体1(CB1)は体全体と細胞レベルのエネルギー代謝に関与している。高脂肪食で飼育した肥満マウスを使って、活発な代謝を行っている組織において、CB1受容体の刺激がミトコンドリア新生を減らすかどうかを検討した。
実験デザインと方法:マウスおよびヒトの白色脂肪細胞を培養する実験系において、血管内皮型一酸化窒素合成酵素(eNOS)発現とミトコンドリアDNA量とミトコンドリア新生の指標に対するCB1の選択的アゴニストのアラキドニル-2-クロロエタノールアミド(arachidonyl-2-chloroethanolamide)と内因性カンナビノイドのアナンダミド(anandamide)と2-アラキドノイルグリセロール(2-arachidonoylglycerol)の作用を検討した。
これらの測定項目(eNOS発現、ミトコンドリアDNA量、ミトコンドリア新生)は、アラキドニル-2-クロロエタノールアミドを長期間投与したマウスの白色脂肪組織と筋肉と肝臓でも測定した。
さらに、白色脂肪組織と、eNOS遺伝子欠損マウス由来の成熟脂肪細胞と、正常マウス由来の成熟脂肪細胞において、p38分裂促進因子活性化タンパク質キナーゼ(p38 mitogen-activated protein kinase :MAPK)のリン酸化を検討した。
アラキドニル-2-クロロエタノールアミドを長期投与された高脂肪飼育マウスの白色脂肪組織と筋肉と肝臓においてeNOSとp38MAPKとAMP活性化キナーゼ(AMPK)とミトコンドリア新生を検討した。
結果:白色脂肪細胞において、アラキドニル-2-クロロエタノールアミドはミトコンドリア新生とeNOS発現とp38MAPK活性化を減少させ、AMPKのリン酸化を低下させた。
ミトコンドリア新生に対するアラキドニル-2-クロロエタノールアミドによる抑制作用は一酸化窒素ドナーやp38MAPK阻害によって阻止された。
eNOS遺伝子欠損(eNOS−/−)マウスから採取した白色脂肪細胞は、正常マウスのものと比較してp38MAPKリン酸化の亢進を認めた。
eNOS遺伝子欠損の脂肪細胞では、アラキドニル-2-クロロエタノールアミドのミトコンドリア新生抑制作用は認められなかった。
さらに、高脂肪食で飼育され、アラキドニル-2-クロロエタノールアミドを長期投与されたマウスの白色脂肪組織と筋肉組織と肝臓において、ミトコンドリア新生は低下し、p38MAPKのリン酸化は亢進し、AMPKリン酸化は低下していた。
結論:カンナビノイド受容体CB1の刺激は、eNOS発現の抑制とp38MAPKの活性化を介して白色脂肪細胞のミトコンドリア新生を低下させ、高脂肪食で肥満にしたマウスの代謝的に活性化している組織において、ミトコンドリア機能を低下させた。
つまり、カンナビノイド受容体CB1の刺激はミトコンドリア機能を低下させる作用があり、カンナビジオールはCB1の働きを阻害して、心臓機能を高める作用があり、ドキソルビシンによる心筋傷害を予防・治療する効果があると言えます。
CB1活性をアロステリック機序で抑制するカンナビジオールは、抗がん剤による心臓や肝臓のダメージによる副作用に対して抑制効果を発揮する可能性があります。
抗がん剤の副作用予防のサプリメントとしてカンナビジオール・オイルは多くの報告があります。(詳しくはこちらへ)
副作用軽減の目的でカンナビジオール・オイルの使用は有用だと考えられますが、どの程度の量が必要かはまだ不明です。
小児てんかんに対する使用量などから体重1kg当たり数mg〜10mgを試してみて、効果があるかどうか試すしかありません。1ヶ月ほど試してみて、効果がなければ中止し、効果が実感できれば継続するという試行錯誤で利用するしかありません。
◯ 漢方漢方煎じ薬についてはこちらへ)
| « 549)肝機能改... | 551)カンナビ... » |






