カンナビノイド受容体が存在することは、体内にカンナビノイド受容体に作用する体内成分が存在することを意味しています。カンナビノイド受容体と反応する体内に存在する物質を内因性カンナビノイドと言います。
内因性カンナビノイドとしてアナンダミド(アラキドノイルエタノールアミド)と2-アラキドノイルグリセロールが知られています。この2つは細胞膜のリン脂質を分解してできるアラキドン酸から合成されます。
アナンダミドは脂肪酸アミドハイドロラーゼ(fatty acid amide hydrolase)によって分解され、2-アラキドノイルグリセロールはモノアシルグリセロール・リパーゼ(monoacylglycerol lipase)などによって分解されます。
内因性カンナビノイド・システムというのは、カンナビノイド受容体のCB1とCB2、内因性のリガンドである内因性カンナビノイド(アナンダミド、2−アラキドノイルグリセロール)、内因性カンナビノイドの合成酵素と分解酵素から構成されています。
この内因性カンナビノイド・システムは、神経系や免疫系だけでなく、消化器系や内分泌系や循環器系や呼吸器系など、ほぼ全ての生体機能の制御に関わっており、体の治癒力の根幹にもなっていることが近年の研究で明らかになっています。
大麻が様々な薬効を示すのは、大麻に含まれるカンナビノイドという成分が結合する受容体が神経系や免疫系など体内に広く分布し、様々な生理機能の制御に重要な役割を果たしているからです。
図:内因性カンナビノイドのアナンダミドと2−アラキドノイルグリセロールはシグナルを受けてオンデマンド(要求に応じて)に合成酵素が活性化されて細胞膜などの脂肪酸から合成される。アナンダミドと2−アラキドノイルグリセロールはカンナビノイド受容体のCB1とCB2や、Gタンパク共役型受容体のGPR55やCa透過性の陽イオンチャネルの一種であるTRPV1などに作用して細胞機能を制御している。アナンダミドは脂肪酸アミドハイドロラーゼ(fatty acid amide hydrolase: FAAH)によってアラキドン酸とエタノールアミンに分解され、2-アラキドノイルグリセロールはモノアシルグリセロール・リパーゼ(monoacylglycerol lipase; MGL)によってアラキドン酸とグリセロールに分解される。このような、受容体と内因性のリガンドのアナンダミドと2DGとこれらを合成あるいは分解する酵素からなる体内システムを内因性カンナビノイドシステムという。
【内因性カンナビノイドシステムはがん治療のターゲットとして注目されている】
内因性カンナビノイドシステムはがんの発生や進展において様々な関与を行っています。その作用機序はまだ十分に解明されておらず、がん細胞の種類によって作用は異なるのですが、一般的には「カンナビノイド受容体のCB1とCB2のアゴニスト(作動薬)はがん細胞の増殖を抑制する」と考えられています。
動物実験では、Δ9-テトラヒドロカンナビノール(THC)やその他のカンナビノイドの投与が抗腫瘍効果を示すことが多く報告されています。
カンナビノイド受容体CB1とCB2のアゴニスト(作動薬)はがん細胞の増殖を抑制し、アポトーシスを誘導し、血管新生を阻害するという実験結果が多数報告されています。
がん治療における大麻製剤やカンナビノイド製剤の効果は大きく2つに分けられます。
①症状の緩和と②抗がん作用(がん細胞の増殖抑制やアポトーシス誘導)です。
①がん患者の症状を緩和する作用として、食欲を増進し、体重減少を抑制し、抑うつ状態を軽減して気分を楽にする作用があります。抗がん剤治療における吐き気や嘔吐の抑制や痛みを和らげる効果もあります。しかも、副作用はほとんどありません。
実際に、ドロナビノール(商品名はマリノール)やナビロン(商品名:セサメット)といった合成THC製剤ががん治療における症状の緩和の目的で認可されています。
大麻抽出エキス製剤のサティベックス(Sativex)はカナダではがん性疼痛の治療に認可されています。
医療大麻ががん患者の様々な症状を改善することが報告されています。
②カンナビノイドには直接的な抗がん作用が報告されています。その作用機序は極めて多彩です。一つの作用機序ではなく、複数の作用機序で総合的に抗腫瘍効果を示すと考えるのが妥当です。
抗腫瘍作用として、がん細胞の増殖抑制、アポトーシスの誘導、転移や浸潤の抑制、血管新生の阻害などが報告されています。
その作用メカニズムとして、がん細胞の増殖シグナル伝達を阻害する作用、細胞周期を停止させる作用、小胞体ストレスを誘導してオートファジーを亢進して細胞死を引き起こす作用など多くの報告があります。
カンナビノイド受容体のCB1とCB2に作用する大麻成分としてΔ9-テトラヒドロカンナビノール(THC)があります。
医療大麻を使ったがん治療は、THCやカンナビジオール(CBD)の抗がん作用を利用しています。
カンナビジオール(CBD)にはCB1やCB2のアゴニスト作用はなく、むしろTHCのCB1への作用を阻害する作用があります。しかし、カンナビジオールはCB1やCB2以外の受容体やイオンチャネルやシグナル伝達系に作用するので、THCとカンナビジオールの併用は、それぞれ単独では起こし得ない新規なシグナル伝達系を制御して抗腫瘍効果を発揮する可能性が示唆されています。
内因性カンナビノイドのアナンダミドや2-アラキドノイルグリセロールの分解を阻害する薬も同様の目的で検討されています。
内因性カンナビノイドの分解を阻害すれば内因性カンナビノイドの濃度が高くなって、がん細胞の増殖を阻害できると考えられています。このような治療にパルミトイルエタノールアミドが注目されています(後述)。
CB1とCB2以外にも、TRPV1(Transient receptor potential cation channel subfamily V member 1)やGPR55(G protein-coupled receptor 55)やPPAR(peroxisome proliferator-activated receptor)も内因性カンナビノイドの受容体として働くことが報告されており、抗腫瘍的に作用しますが、まだそのメカニズムは十分に明らかになっていません。
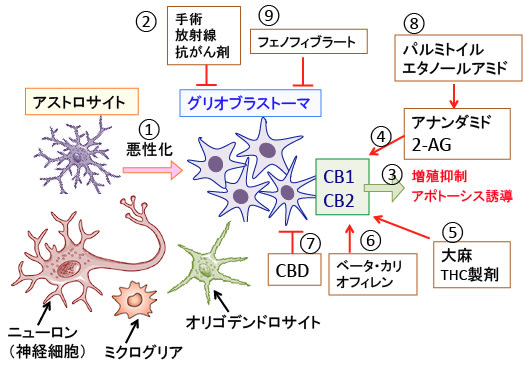
【グリオブラストーマ(膠芽腫)は神経膠細胞から発生する】
脳や脊髄など神経組織には大きくわけて2種類の細胞が含まれています。神経細胞(ニューロン)とそれを支える神経膠細胞(グリア細胞)です。その他に血管を構成する細胞もあります。
ニューロンは感覚や運動などの情報を処理する主体で、そのニューロンに栄養を与え、神経組織を健全に維持するのがグリア細胞の役目です。グリア細胞は主に3種類あり、アストロサイト、オリゴデンドロサイト、ミクログリアと呼ばれています。
アストロサイト(星状膠細胞)は多数の突起があり、星のように見えることからこの名があります。神経組織の形態維持、血液脳関門、神経伝達物質の輸送などの役割を担っています。オリゴデンドロサイト(乏突起膠細胞)は神経細胞の軸策に巻き付いて髄鞘の形成や栄養補給の機能を持っています。
ミクログリア(小膠細胞)は骨髄系のマクロファージに由来し、病原菌の排除や死細胞の除去や傷害を受けた神経組織を修復する働きを担っています。
グリオブラストーマ(膠芽腫)はアストロサイト(星状膠細胞)から発生する悪性腫瘍で、非常に悪性度が高く、増殖や浸潤性が強く、ヒトの悪性腫瘍の中で最も予後不良の腫瘍の一つです。
手術や放射線治療や抗がん剤治療などが行われますが、このような集学的治療を受けても平均生存期間は12~14カ月程度であり,治療成績はここ30年以上ほとんど改善していないと言われています。
【大麻はグリオブラストーマの抗がん剤治療の効果を高める】
グリア細胞の制御にカンナビノイド受容体が重要な働きを行っていることが明らかになっています。カンナビノイド受容体のCB1とCB2がグリオブラストーマの増殖を抑制する作用があることが近年の研究で明らかになり、グリオブラストーマの治療における医療大麻の有効性が報告されています。
カンナビノイド受容体CB1とCB2のアゴニスト(作動薬)のΔ9-テトラヒドロカンナビノール(THC)は、グリオブラストーマ細胞の増殖を抑制し、アポトーシスを誘導することが培養細胞や動物に移植した実験モデルで示されています。
人間での臨床試験はまだ少数例の報告があるだけで、本格的な臨床試験が最近始まっているという状況です。
医療大麻の抗がん作用に関して、最も研究が行われているのがグリオブラストーマです。グリオブラストーマの治療成績が極めて悪いので、新規で有効性の高い治療法が求められているからです。
グリオブラストーマの移植腫瘍の実験モデルで、THCはテモゾロマイド(グリオブラストーマの治療に使う抗がん剤で商品名はテモダール)の抗腫瘍効果を増強することが報告されています。膵臓がんの実験では、THCとジェムザールの相乗効果が報告されています。
また、THCとカンナビジオール(CBD)を併用すると、それぞれを単独で使用した場合と比べて顕著な増殖抑制効果が認められています。CBDがTHCの抗腫瘍効果を増強すると考えられています。
グリオーマ細胞をマウスに移植する実験モデルで、THCとCBDとテモゾロマイドの併用で顕著な腫瘍縮小効果が認められています。
テモゾロマイドで抵抗性のグリオーマの患者にTHCとCBDを併用するとテモゾロマイドの効き目が高くなることが報告されています。
グリオーマの移植腫瘍の実験モデルで、THCとCBDは放射線照射の効果を増強しました。
【パルミトイルエタノールアミドはアナンダミドの分解を阻止して抗腫瘍効果を発揮する】
内因性カンナビノイドのアナンダミドはアラキドン酸とエタノールアミンが結合した脂肪酸エタノールアミドの一種です。
脂肪酸エタノールアミドは,脂肪酸とエタノールアミンが縮合して生成する化合物で、神経伝達物質として生理学的に重要な機能を有するものがあり、その代表がアラキドン酸にエタノールアミンが結合したアナンダミドと言えます。
アラキドン酸は4つの2重結合を含む炭素数20の脂肪酸で、ω6系多価不飽和脂肪酸です。細胞膜中のリン脂質として存在し、ホスホリパーゼA2によってリン脂質から遊離し、プロスタグランジンやトロンボキサンやロイコトリエンなどの化学伝達物質が作られます。
アナンダミドも細胞間のシグナル伝達のセカンドメッセンジャーとして、刺激に応じて産生され、内因性カンナビノイドシステムで働いています。
アナンダミドは最初に発見された内因性カンナビノイドで、化学合成したものがCB1とCB2に親和性を示すことで内因性カンアビノイドであることが証明されました。
アナンダミドと同じような脂肪酸エタノールアミドは哺乳動物で多く見つかっています。
炭素数16の脂肪酸のパルミチン酸にエタノールアミンが結合した構造のパルミトイルエタノールアミドは、古くから鎮痛作用や抗炎症作用が知られています。
パルミトイルエタノールアミドはCB1とCB2には親和性を有しませんが、CPR55に作用することや、アナンダミドの分解酵素の活性を阻害してアナンダミドの濃度を高める効果があり、内因性カンナビノイドの一種という意見もあります。
パルミトイルエタノールアミドがアナンダミドの分解を阻止して抗腫瘍効果を示すことが報告されています。以下のような報告があります。
Palmitoylethanolamide inhibits the expression of fatty acid amide hydrolase and enhances the anti-proliferative effect of anandamide in human breast cancer cells.(パルミトイルエタノールアミドは脂肪酸アミドハイドロラーゼの発現を阻害してヒト乳がん細胞に対するアナンダミドの増殖抑制効果を増強する)Biochem J. 358: 249-255, 2001年
【要旨】
パルミトイルエタノールアミド(PEA)は、カンナビノイド受容体のCB1やCB2に対するアゴニスト活性(受容体に結合して活性化させる作用)はないが、CB1の内因性アゴニストであるアナンダミドの作用を増強することが示されている。
この研究では、ヒト乳がん細胞に対するアナンダミドの増殖抑制作用をPEAが強力に促進することを示した。その作用機序として、アナンダミドを分解する主要な酵素である脂肪酸アミドハイドロラーゼ(FAAH)の発現を阻害する作用が関与していることを示した。
PEA(1-10 microM)は、それ単独では細胞増殖を抑制する効果は示さなかったが、乳がん細胞のベースの増殖および神経増殖因子(NGF)で誘導される増殖に対するアナンダミドの増殖抑制作用を用量依存的に増強した。
PEA(5 microM)は乳がん細胞の増殖を50%に抑制するアナンダミドの濃度(IC50)を3~6倍に減少させた。
アナンダミドはNGFチロシンキナーゼ受容体の発現を阻害し、PEAはこの作用を亢進した。
乳がん細胞(MCF-7)にPEA(5 microM)を投与すると、FAAHの発現量と活性が30~40%の減少を認めたので、アナンダミドの増殖抑制作用に対するPEAの増強作用の一部は、アナンダミドの分解の阻害が関与していることが示唆された。
PEAはCB1やCB2の発現量や、カンナビノイド受容体と内因性リガンド(アナンダミド)の親和性や、シグナル伝達系には影響しなかった。
PEAの長期投与は、アナンダミドの分解酵素のFAAHの発現を阻害することによってアナンダミドの薬理効果を高める作用が示唆された。
大麻草に含まれるΔ9−テトラヒドロカンナビノール(THC)やカンナビジオール(CBD)やベータカリオフィレンやフェノフィブラートなどを併用するとグリオブラストーマの治療成績を高めることができます。(トップの図参照)
【すべての薬には副作用がある】
「毒にも薬にもならない」という言葉があります。これは「害にならない代わりに、役にも立たない」ということで、「居ても居なくても何の影響もない」人や、「あってもなくてもどうでもいい」物のたとえとして使われます。
「毒にならないものは薬にはならない」ということは「薬は毒にもなる」ことを意味しています。つまり、体の機能に作用して薬効を示す「薬」は、場合によっては、体に対して「毒」として作用して様々な副作用を引き起こすのです。
薬の作用は、それが治療目的に対応する効果であれば「薬効(主作用)」になり、不都合な作用になれば「毒(副作用)」になります。
例えば、副腎皮質ホルモンは免疫細胞や炎症細胞の働きを強力に抑制する薬効を持っています。この作用は自己免疫疾患やアレルギー性疾患を治療する目的で使えば薬効になります。しかしこの作用は免疫力を低下させるので、感染症を発症しやすくなり(易感染性)、感染症の治りが悪くなります。
抗がん剤は、細胞分裂している細胞を死滅させます。がん細胞に作用すれば腫瘍縮小効果になりますが、白血球やリンパ球など骨髄細胞の増殖も抑えるので、白血球減少やリンパ球減少などの副作用になります。
免疫抑制作用のあるシクロスポリンは臓器移植の拒絶反応の抑制に使用されますが、感染症やがんの発症率を増やす副作用があります。
成長ホルモンやインスリン様成長因子は、細胞を活性化し増殖を促進して老化した体を若々しくする作用があるのでアンチエイジング(抗加齢)の領域で使用されていますが、このような増殖因子はがんの発生や成長を促進する作用があります。
包丁や金槌や自動車など生活を便利にする道具も、使い方次第で凶器にもなります。
表:薬が効能を発揮する作用は、場合によっては有害作用(副作用)にもなる。
さて、「大麻が有害であるのは公知の事実」ということを主な理由にして、最高裁は麻取締法が合憲であるという判決を1985年に下しています。
しかし、この「大麻の有害性」の理屈は、医療目的の場合は禁止する理由として適用できないことは明らかです。全ての医薬品は基本的に毒性(有害性)を有し、副作用のリスクを伴うのは常識(公知の事実)だからです。
したがって、有害性があるからという理由で、医療大麻の使用を禁じる法律(大麻取締法)が合憲という理由にはなりません。
大麻には確かに副作用はありますが、疾患によっては特効薬的な効果を発揮します。適切に使用すれば、抗がん剤やモルヒネより安全な薬であることは確かです。
公益財団法人「麻薬・覚せい剤乱用防止センター」のホームページでは、大麻は以下のように解説されています。
『大麻を乱用すると気管支や喉を痛めるほか、免疫力の低下や白血球の減少などの深刻な症状も報告されています。また「大麻精神病」と呼ばれる独特の妄想や異常行動、思考力低下などを引き起こし普通の社会生活を送れなくなるだけではなく犯罪の原因となる場合もあります。また、乱用を止めてもフラッシュバックという後遺症が長期にわたって残るため軽い気持ちで始めたつもりが一生の問題となってしまうのです。社会問題の元凶ともなる大麻について、正確な知識を身に付けてゆきましょう。』
確かに、カンナビノイド受容体のCB1とCB2は共に免疫系を抑制する作用があり、大麻の主成分のΔ9-テトラヒドロカンナビノール(THC)はCB1とCB2のアゴニストであるので、大麻成分を摂取すれば免疫が抑制されます。
そして、この作用があるから、大麻は炎症性腸疾患(潰瘍性大腸炎やクローン病)や様々な自己免疫疾患(関節リュウマチなど)や慢性炎症性疾患に対して顕著な治療効果を示します。副腎皮質ホルモンと同じ作用です。
THCはCB1受容体に作用して精神作用を示し、過剰になれば不都合な症状の原因になる可能性はありますが、適度に使用すれば抗うつ作用や抗不安作用を発揮し、ストレスに対する抵抗力を高め、うつ病や不安症状や心的外傷後ストレス障害(PTSD)の治療に役立つことが報告されています。
「社会問題の元凶になる」のが事実であれば、アメリカ合衆国ではコロラド州やワシントン州などで嗜好用大麻が合法化されていることが説明できません。
大麻の有害性だけを誇張して、その効能を過小評価するのは医学的に間違っています。
疼痛性疾患やがんの治療における医療大麻の有用性は高く、適切に使用すれば患者に対する恩恵は大きいので、日本でも医療大麻の認可を早急に検討する必要があると思います。
そろそろ日本でも、医療大麻の認可に向けて具体的行動しないといけないと思っている次第です。