がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
892)ドコサヘキサエン酸とプニカ酸はペルオキシソーム増殖因子活性化受容体γ(PPARγ)の内因性リガンド

図:ペルオキシソーム増殖因子活性化受容体γ(PPARγ)とレチノイドX受容体(RXR)はヘテロダイマー(PPAR-RXR)を形成し、それぞれの受容体にリガンドが結合するとコアクチベーターが結合して、標的遺伝子のDNAのペルオキシソーム増殖因子応答配列(AGGTCAの塩基配列が1塩基をはさんで同方向に並んだAGGTCA-n-AGGTCA のダイレクトリピート構造)に結合して転写を亢進する。この転写因子で誘導される遺伝子群は、がん細胞の増殖を抑制し、細胞の分化やアポトーシス(細胞死)を誘導する作用がある。オールトランスレチノイン酸(All-trans RA)から変換されて生成する9-cisRA(9-cisレチノイン酸)はレチノイドX受容体(RXR)のリガンドとなり、ドコサヘキサエン酸とプニカ酸はPPARγのリガンドとなる。
892)ドコサヘキサエン酸とプニカ酸はペルオキシソーム増殖因子活性化受容体γ(PPARγ)の内因性リガンド
【遺伝子発現を調節する核内受容体とリガンド】
核内受容体のペルオキシソーム増殖因子活性化受容体γ(PPARγ)は遺伝子転写を制御し、がん細胞の増殖や転移を抑制します。ドコサヘキサエン酸(DHA)はPPARγの内因性リガンドであり、PPARγの活性化を介して抗がん作用を発揮します。PPARγによる遺伝子転写活性を亢進する効果はDHAの抗腫瘍効果のメカニズムの一つとして重要です。まず、PPARγについて解説します。
DNAの遺伝情報は、まずRNAポリメラーゼによってRNAに転写され、さらにRNAからリボソームでタンパク質に翻訳されます。DNAにはプロモーターやエンハンサーといった転写を制御する領域があり、この領域に結合して遺伝子の転写を促進したり抑制したりするタンパク質を転写因子と言います。転写因子は単独で機能する場合もありますが、他のタンパク質と複合体を形成して転写活性を実行する場合もあります。
このようにして、遺伝子(DNA)の情報がメッセンジャーRNAに転写され、さらにタンパク質が合成されることによって細胞の構造や機能に変化が生じる過程を「遺伝子発現」と言います。転写因子というのは遺伝子発現を制御する機能を持つタンパク質です。(図)

図:細胞の遺伝情報は核の中の染色体に記録されている(①)。遺伝子の本体はデオキシリボ核酸(DNA)で、一つの細胞には46個の染色体があり、合計で約30億塩基対の塩基配列情報がDNAに記録されている(②)。遺伝子DNAがメッセンジャーRNA(mRNA)に転写されてタンパク質が作られるためには、RNAポリメラーゼや転写因子などの転写を促進する複数の因子が遺伝子の転写調節領域に結合する必要がある(③)。mRNAはリボソームでタンパク質に翻訳されてタンパク質が生成される(④)。このようにして遺伝子情報からmRNAとタンパク質が合成されて細胞の構造や機能に変化が生じる過程を「遺伝子発現」という(⑤)。
ホルモン(甲状腺ホルモンやステロイドホルモンなど)や脂溶性ビタミン(ビタミンAやビタミンD)や体内で生成される生理活性物質(脂肪酸やプロスタグランジンなど)によって遺伝子発現が調節される場合の転写因子として「核内受容体」というタンパク質があります。
核内受容体というのは、細胞核にあって、ホルモンなどが結合することでDNAの転写を調節している受容体タンパク質です。核内受容体はリガンドが結合すると、構造の変化を起こして転写因子としての活性を持ちます。リガンド(ligand)というのは、特定の受容体(レセプター)に特異的に結合する物質のことです。
核内受容体群は、1つの原初遺伝子から分子進化した遺伝子スーパーファミリーを形成しており、そのメンバーはヒトゲノム解読の結果,48種存在すると推定されています。ステロイドホルモンやビタミンAやビタミンDが特定の遺伝子の発現を調節できるのは、これらが特定の核内受容体への結合を介して、そのリガンド依存的な転写制御を発揮するからです。
体内の様々な生理活性物質がリガンドとして特定の受容体に結合することによって遺伝子発現が調節されています。また、単なる栄養素と思われていた脂肪酸や、胆汁酸などの代謝産物も核内受容体に結合し、遺伝子転写を制御していることが明らかになっています。
リガンドと同じ働きをする薬をアゴニスト(agonist)、リガンドの働きを阻害する薬をアンタゴニスト(antagonist)と言います。つまり、核内受容体のアゴニストやアンタゴニストは特定の遺伝子の発現を調節する薬になります。(図)
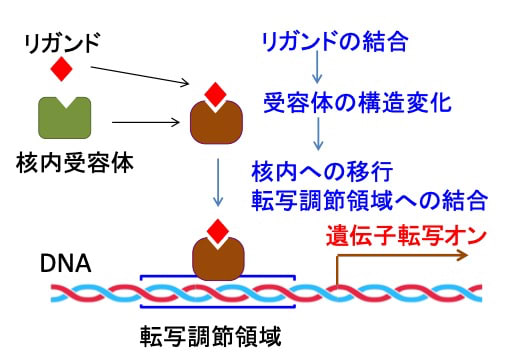
図:核内受容体にリガンドが結合すると受容体の構造に変化が起こり、核内に移行して遺伝子の転写調節領域に結合し、転写を調節する。
【糖や脂質の代謝に関与するペルオキシソーム増殖因子活性化受容体】
ペルオキシソーム(Peroxisome)は酵母から哺乳動物までのほぼ全ての真核細胞が持つ直径0.1〜2マイクロメートルの単層の膜で囲まれた球状の細胞小器官です。哺乳類の細胞では1個の細胞に数百から数千個が存在し、多様な物質の酸化反応を行っています。ペルオキシソームでは、脂肪酸のベータ酸化、コレステロールや胆汁酸の合成、アミノ酸やプリン体の代謝などが行われています。
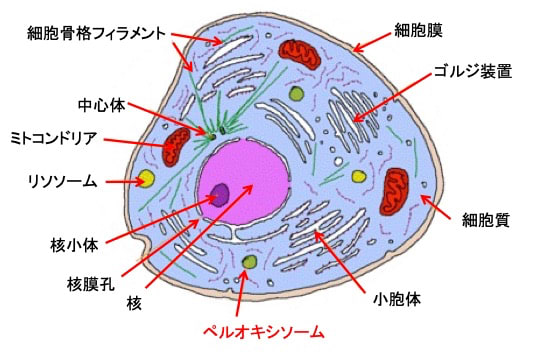
図:真核細胞には様々な細胞内小器官が存在し、細胞内機能が分担されている。ペルオキシソームは、物質を酸化する様々な酸化酵素と、酸化反応によって生じる過酸化水素を消去するカタラーゼが多く存在する。
ペルオキシソームを増やす作用がある物質が古くから多数見つかっており、ペルオキシソーム増殖因子と呼ばれていました。これらの物質がどのようにしてペルオキシソームを増やすのかという研究の結果、ペルオキシソーム増殖因子が結合する核内受容体が見つかり、「ペルオキシソーム増殖因子で活性化される受容体」という意味で「ペルオキシソーム増殖因子活性化受容体(Peroxisome proliferator-activated receptor:PPAR)」という長い名前になっています。
このようにペルオキシソーム増殖因子活性化受容体(PPAR)は細胞内のペルオキシソームの増生を誘導する受容体として発見されましたが、その後の研究で、糖質や脂質やタンパク質などの物質代謝や細胞分化に密接に関連している転写因子群であることが明らかになりました。脂質や糖質の代謝を促進するので、PPARを活性化する物質は高脂血症や糖尿病の治療薬として臨床で使用されています。
歴史的には、フィブラートのような抗高脂血症薬やインスリン抵抗性を改善するチアゾリジン系の抗糖尿病薬は作用機序が不明なまま臨床的有効性が認められて使用されていました。その後、これらの薬が細胞のペルオキシソームの数を増やすことが見つかり、PPARを活性化することによって薬効を示すことが明らかになりました。
さらに、PPARの活性化はがん細胞の増殖抑制やアポトーシスや分化の誘導作用などの抗がん作用を示すことが明らかになっています。PPARの活性化剤は糖尿病や高脂血症の治療薬として多くの種類が販売されているので、これらをがんの治療に応用する研究が行われています。
【PPARには3つのサブタイプがある】
ペルオキシソーム増殖因子活性化受容体(PPAR)には3種類のサブタイプがあります。主に肝臓や心臓や腎臓や消化管の細胞にあるアルファ型(PPARα)と、脂肪細胞に主にみられるガンマ型(PPARγ)、多くの組織で発現し脂肪酸燃焼とインスリン感受性を高めるデルタ型(PPARδ)です。
PPARαは大量のATPを必要とし脂肪酸酸化の盛んな臓器(肝臓・心臓・腎臓・消化管など)に多く存在します。PPARαは脂肪酸のβ酸化や細胞内外での脂質輸送に関与する多くの遺伝子の発現を誘導するので、高脂血症改善薬のターゲットになっており、フェノフィブラート、ベザフィブラート、クロフィブラートなどのいわゆるフィブラート系の薬剤が高脂血症治療薬として使用されています。
PPARγは脂肪組織でインスリン感受性を高めるアディポネクチン遺伝子の発現を促進し、インスリン抵抗性を高める炎症性サイトカインのTNF-αの産生を抑制する作用があります。これらのインスリン抵抗性を改善する作用によって糖尿病を治療する効果を発揮します。薬としてはピオグリタゾンなどが使用されています。
PPARδは多くの組織で発現し、リノール酸やリノレン酸やアラキドン酸などの多価不飽和脂肪酸やアラキドン酸由来物質などが内因性のリガンドとなっています。インスリン抵抗性の改善や脂肪酸のβ酸化の亢進などの作用があります。
PPARはレチノイドX受容体(RXR)とヘテロダイマー(ヘテロ二量体)を形成して遺伝子のペルオキシソーム増殖因子応答配列に結合します。リガンドが結合していない状態ではPPAR-RXRヘテロダイマーに核内受容体コリプレッサーが結合して転写活性が抑制されています。コリプレッサー(co-repressor)というのは、核内受容体に結合してその転写活性を抑制する因子です。
PPARとRXRにそれぞれのリガンドが結合するとPPAR-RXRヘテロダイマーからコリプレッサーが分離し、転写活性を促進するコアクチベーター(co-activator)が結合します。コアクチベーターはヒストンアセチル化を促進する作用があり、DNAとヒストンの結合を緩めて、他の転写因子やRNAポリメラーゼが標的遺伝子のプロモーター領域に結合しやすくなり、転写が開始されます。このようにPPAR の活性化から遺伝子発現まで様々な因子が複雑に関与しています。(図)

図:ペルオキシソーム増殖因子活性化受容体(PPAR)とレチノイドX受容体(RXR)はヘテロダイマー(PPAR-RXR)を形成して、コリプレッサーが結合してDNA結合は阻止されている。それぞれの受容体にリガンドが結合すると受容体の構造に変化が生じてコリプレッサーが離れ、コアクチベーターが結合して、標的遺伝子のDNAのペルオキシソーム増殖因子応答配列(AGGTCAの塩基配列が1塩基をはさんで同方向に並んだAGGTCA-n-AGGTCA のダイレクトリピート構造)に結合して転写を亢進する。
【ドコサヘキサエン酸とプニカ酸はPPARγのアゴニスト】
ペルオキシソーム増殖因子活性化受容体γ(PPARγ)は細胞の生存に重要な役割を果たしており、これはがん治療の標的となる可能性があります。実際に、PPARγの活性化によってがん細胞の増殖や転移が抑制される効果が、培養がん細胞や動物に移植した腫瘍を使った実験で報告されています。
PPARγのアゴニストとしてチアゾリジン系抗糖尿病薬のロシグリタゾンやピオグリタゾンを使うことはがん治療に有効です。しかし、チアゾリジン系抗糖尿病薬には心臓障害や発がん性など安易に使用できない副作用があります。
ドコサヘキサエン酸(DHA)がPPARγのリガンドになり、しかもPPARγの発現を亢進することが明らかになっています。例えば、マウスに肺がんを移植した実験系で、DHAがPPARγの発現と活性を亢進し、炎症反応を促進するNF-κB経路を抑制し、NF-κBを介した抗アポトーシス因子(Bcl-2やBcl-XL)細胞外マトリックス分解酵素の発現を抑制することが示されています。その結果、肺がん細胞のアポトーシスを促進し、転移を抑制しました。
DHA/EPA-Enriched Phosphatidylcholine Suppresses Tumor Growth and Metastasis via Activating Peroxisome Proliferator-Activated Receptor γ in Lewis Lung Cancer Mice.(DHA / EPAに富むホスファチジルコリンは、ペルオキシソーム増殖因子活性化受容体γの活性化を介してルイス肺がんマウスの腫瘍の成長と転移を抑制する)J Agric Food Chem. 2021 Jan 20;69(2):676-685.
ドコサヘキサエン酸(DHA)とエイコサペンタエン酸(EPA)によるがん細胞のアポトーシス誘導はPPARγの活性を阻害するPPARγアンタゴニストによって阻害されることから、DHAとEPAの抗腫瘍効果がPPARγの活性化を介することが明らかになっています。また、この効果はEPAよりDHAの方が強いことが示されています。
Docosahexaenoic Acid Induces Growth Suppression on Epithelial Ovarian Cancer Cells More Effectively than Eicosapentaenoic Acid.(ドコサヘキサエン酸はエイコサペンタエン酸より、より効果的に上皮性卵巣がん細胞の増殖を抑制する)Nutr Cancer. 2016;68(2):320-7.
さらに、ザクロ種子油に含まれる共役リノレン酸のプニカ酸がDHAと同様にPPARγのアゴニストであることは多くの研究で明らかになっています。プニカ酸については890話で解説しています。
ドコサヘキサエン酸(DHA)と共役リンレン酸のプニカ酸をそれぞれ1日に5g程度摂取すると、PPARγを活性化する機序によって、がんと老化の予防に効果が期待できます。
DHAは微細藻類や魚油に含まれ、プニカ酸はザクロ種子油に多く含まれます。

図:微細藻類や魚の油に多く含まれるドコサヘキサエン酸(DHA)とザクロ種子油に多く含まれるプニカ酸はPPARγ(ペルオキシソーム増殖因子活性化受容体γ)のリガンドとなってPPARγの転写活性を更新する。PPARγは細胞増殖や細胞死に関与する遺伝子の発現を制御して、がん細胞の増殖抑制や細胞分化と細胞死の誘導など抗がん作用を発揮する。
| « 891)抗がん剤... | 893)ザクロ種... » |



