がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
338)2-デオキシ-D-グルコース+メトホルミン+牛蒡子+糖質制限/ケトン食の抗がん作用
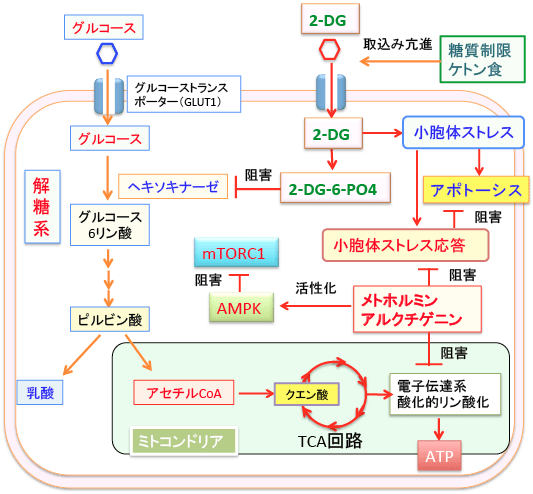
図:2-デオキシ-D-グルコース(2-DG)はヘキソキナーゼを阻害してグルコースの解糖系での代謝を阻害し、さらにペントース・リン酸経路でのNADPH や核酸合成も阻害する。2-DGは糖タンパクの糖鎖にグルコースやマンノースの代わりに取り込まれると糖鎖の異常によって小胞体ストレスが生じる。過剰の小胞体ストレスは細胞死(アポトーシス)を引き起こすが、がん細胞は小胞体ストレス応答によってアポトーシスを阻止しようとする。経口糖尿病薬のメトホルミンと牛蒡子に含まれるアルクチゲニンは小胞体ストレス応答を阻害する作用があり、2-DGによるアポトーシス誘導作用を増強する。メトホルミンとアルクチゲニンは電子伝達系の呼吸酵素を阻害してATP産生を阻害する作用があり、AMP活性化プロテインキナーゼ(AMPK)を活性化する。活性化したAMPKは哺乳類ラパマイシン標的蛋白質複合体-1(mTORC1)を阻害してがん細胞の増殖を抑制する。糖質制限食やケトン食は、がん細胞における2-DGの細胞内取込みを高める。したがって、ケトン食と2-DGとメトホルミンと牛蒡子(あるいはアルクチゲニン)の併用は、がん細胞の増殖抑制に相乗的に作用する。
338)2-デオキシ-D-グルコース+メトホルミン+牛蒡子+糖質制限/ケトン食の抗がん作用
【ケトン食の抗腫瘍効果を高める方法】
ここ数年、がん細胞のエネルギー産生の異常、いわゆるワールブルグ効果(Warburg effect)を利用したがん治療に注目が集まっています。
ワールブルグ博士が、「がん細胞ではグルコース(ブドウ糖)の取込みが多い」、「酸素が利用できる条件でも酸素を使うミトコンドリアでのエネンルギー産生は抑制され、酸素を使わない嫌気性解糖系によるエネルギー産生が亢進している」というがん細胞のエネルギー産生や物質代謝の特徴を指摘したのは80年以上も昔のことで、これをワールブルグ効果と言います。(168話、302話参照)
がん細胞の代謝の特徴であるワールブルグ効果は、「増殖の早いがん細胞は低酸素になりやすいので、低酸素に適応するために酸素を使わない代謝が亢進している」というように、単なる結果と長い間理解されていたため、がん研究の領域では最近まであまり注目されていませんでした。
しかし、最近のがん研究領域では、このワールブルグ効果が細胞のがん化に極めて重要な役割を果たしている、つまり、「細胞のがん化の結果」ではなく、「細胞のがん化の原因」と理解されるようになってきたのです。
医学の研究では、重要なことが注目されないまま、長い間忘れ去られている場合もあります。ワールブルグ効果もその一つです。
ケトン食の抗がん作用については、マウスの移植腫瘍を使った実験では1987年頃から報告があります。人間での最初の論文は1995年の小児の脳腫瘍の報告です。その後、基礎研究が進められ、数年前から米国のピッツバーグ大学やオハイオ大学などで、ケトン食の抗がん作用に関する臨床試験が進められています。
ケトン食が抗がん剤や放射線治療の効き目を高める効果が指摘されています。 抗がん剤治療や放射線治療を行うときにケトン食によってがん細胞のエネルギー産生を阻害しておけば、治療効果が高まります。
しかし、ケトン食だけでは十分な効果が得られないことも多く経験します。
「グルコース(ブドウ糖)が利用できなければがん細胞は死滅する」というのは正しいのですが、ケトン食だけではがん細胞のグルコース取り込みを完全に阻害することが困難だからです。 一部のアミノ酸や乳酸などから肝臓ではグルコースが生成されます(糖新生)。
したがって、糖質摂取をゼロにしても、血糖は正常値下限くらいで維持されます。がん細胞はこのわずかな血糖からグルコースをできるだけ取り込むために、グルコース・トランスポーターのGLUT1を過剰に発現しています。つまり、グルコースの供給が少なくなれば、GLUT1を過剰に発現させて、グルコースの取込みを増やして生き延びようとしています。
ケトン食単独では抗腫瘍効果に限界があることから、ケトン食の抗腫瘍効果を高める様々な治療法が検討されています。それらの中で有力なものが2-デオキシ-D-グルコースやメトホルミンや牛蒡子に含まれるアルクチゲニンなどがあります。
【2-デオキシ-D-グルコースの抗がん作用】
2-デオキシ-D-グルコース(2-Deoxy-D-glucose:以下2-DG)は、グルコース(ブドウ糖)の2-ヒドロキシル基が水素原子に置換された物質(グルコース誘導体)です。この抗がん作用のメカニズムについては337話にて解説しました。
2-DGはグルコース(ブドウ糖)と同じグルコース輸送担体(グルコース・トランスポーター)のGLUT1を利用して細胞内に取り込まれ、解糖系の最初のステップのヘキソキナーゼによって2-DG-6リン酸に変換されます。
リン酸化されて2-DG-6リン酸になるとGLUT1を通過できなくなり、2-DG-6リン酸はその次の解糖系酵素では代謝できないため細胞内でどんどん蓄積します。
2-DG-6リン酸はヘキソキナーゼを阻害するので、正常のグルコースの代謝も阻害されます。
2-DGを取り込んでエネルギー産生が低下するとそのストレス応答によってグルコーストランスポーター(GLUT1)の発現がさらに増え、2-DGの取り込みをさらに増やすことになります。したがって、がん細胞には正常細胞に比べてより多くの2-DGが取込まれ、エネルギー産生と物質合成の阻害による影響はがん細胞で大きくなります。
つまり、糖質制限やケトン食のときに2-DGを併用すると、2-DGが優先的にがん細胞に取り込まれ、「トロイの木馬」のように、がん細胞の中に入って、解糖系やペントース・リン酸経路を阻害して、がん細胞を内部から崩壊させることができるのです。
2-DGががん細胞の増殖を抑制する効果が指摘されたのは1950年代です。「細胞のエネルギー源であるグルコースの誘導体を取り込ませれば、がん細胞の増殖を抑制できる」というアイデアは、もう60年も前に研究されており、グルコースの誘導体の抗腫瘍活性が検討され、2-DGに強い抗腫瘍効果があることが証明されています。
しかし、2-DGを使ったがん治療は、その後あまり注目されなかったようです。その理由の一つは、がんの治療においては、「強い毒性をもった化合物を使ってがん細胞を一掃するような治療法」が1950年代以降は主流になっていたからだと思います。
最初の抗がん剤はナイトロジェンマスタードで、第一次世界大戦に化学兵器として使われたマスタードガスのイオウ原子を窒素に置き換えた化合物です。DNAをアルキル化することによって核酸の合成を阻害して細胞の増殖を抑えます。白血病や悪性リンパ腫の治療薬として効果を認められましたが、その作用機序から明らかなように正常細胞に対する毒性による副作用が強いのが問題です。
その後毒性を弱めたナイトロゲンマスタード誘導体が開発され、シクロフォスファミドやメルファランといった抗がん剤が現在も使用されています。これらはアルキル化剤という抗がん剤に分類されています。
ナイトロジェンマスタードが最初にがん患者に使用されたのは1946年です。 1950年代以降のがん治療法の研究領域では、「がんはいかなるコストを払っても抹殺すべき」という考えが主流で、「がん細胞を死滅させる細胞毒を見つけて抗がん剤にする」ような研究が重要と考えられていたため、「がん細胞のエネルギー産生経路を阻害してがん細胞の増殖を低下させる」というようなアイデアは注目されなかったのかもしれません。
しかし、ワールブルグ効果が再評価されるようになり、がん細胞のエネルギー産生と物質合成を阻害する方法として、2-DGにも注目が集まるようになり、多くの動物実験で抗腫瘍効果が証明され、人間での臨床試験も実施されるようになったということです。
【2-デオキシ-D-グルコースとメトホルミンの相乗効果】
2-デオキシ-D-グルコースは解糖系を阻害することによってATP産生を阻害します。経口糖尿病薬のメトホルミンはミトコンドリアの呼吸酵素を阻害してATPの産生を阻害する作用が知られています。
がん細胞のエネルギー産生経路を2-デオキシ-D-グルコースとメトホルミンで二重阻害すると抗腫瘍効果が増強することがマウスを使った移植腫瘍の実験で示されています。以下のような報告があります。
Dual inhibition of Tumor Energy Pathway by 2-deoxy glucose and metformin Is Effective Against a Broad Spectrum of Preclinical Cancer Models(2-デオキシグルコースとメトホルミンによる腫瘍細胞のエネルギー産生経路の2重の阻害は、多くの前臨床の動物実験モデルにおいて効果がある) Mol Cancer Ther. 10(12): 2350-2362, 2011年
この研究はテキサス大学のMDアンダーソンがんセンターの研究グループからの報告です。
様々な種類のがん細胞をマウスに移植した実験モデルを用いて、2-デオキシグルコース(2-DG)とメトホルミンを同時に投与すると、抗腫瘍効果が相乗的に高まることを報告しています。
2-DGとメトホルミンはそれぞれ単独では抗腫瘍効果は強くはありませんが、併用すると強い抗腫瘍効果が得られるという結果です。
培養がん細胞を用いた実験では、2-DGで解糖系を阻害しても、がん細胞を死滅させるだけの効果はありませんが、メトホルミンを同時に投与すると、がん細胞は死滅しました。
マウスの移植腫瘍の実験系でも、2-DGとメトホルミンを同時に投与すると、がん組織が著明に縮小しました。
がん細胞が増殖するためには、増殖のシグナルと、エネルギー産生と物質合成のための材料が必要です。
増殖シグナル伝達系は、インスリン/インスリン様成長因子-1(IGF-1)とそれらの受容体の結合によって刺激されるPI3K/Akt/mTORC1伝達系 が重要です。
メトホルミンはミトコンドリアの呼吸鎖(電子伝達系)を阻害してATP産生を阻害する作用がありますが、さらにAMP活性化プロテインキナーゼ(AMPK)を活性化してmTORC1(哺乳類ラパマイシン標的蛋白質複合体-1)の活性を阻害することによってがん細胞の増殖を阻害します。
一方、2-DGはグルコースの解糖系とペントース・リン酸経路での代謝を阻害することによって、エネルギー産生と物質合成を抑制し、その結果、がん細胞の増殖が抑えられます。
すなわち、2-DGとメトホルミンの同時投与は、がん細胞のエネルギー産生と物質合成と増殖シグナル伝達を効率的に阻害することによって、がん細胞の増殖を阻害することができるのです。(トップの図)
【メトホルミンはAMPKを活性化してがん細胞の増殖を抑制する】
メトホルミン(metformin)は2型糖尿病の治療薬(ビグアナイド系経口血糖降下剤)ですが、がんの予防や治療の分野でも注目されており、がん予防効果やがん細胞の抗がん剤感受性を高める効果などが数多くの論文で報告されています。
メトホルミンは、AMP活性化プロテインキナーゼ(AMPK)を介した細胞内信号伝達系を刺激することによって糖代謝を改善します。すなわち、筋・脂肪組織においてインスリン受容体の数を増加し、インスリン結合を増加させ、インスリン作用を増強してグルコース取り込みを促進します。さらに肝臓に作用して糖新生を抑え、腸管でのブドウ糖吸収を抑制する作用があります。これらの作用はインスリンの血中濃度を低下させます。
インスリンはがん細胞の増殖を促進するので、インスリンの血中濃度を減らすだけで、がん細胞の増殖を抑制する効果があります。
さらに、AMPKはインスリンおよびインスリン様成長因子-1(IGF-1)によって活性化されるPI3K/Akt/mTORC1シグナル伝達系のmTORC1(哺乳類ラパマイシン標的タンパク質複合体1: mammalian target of rapamycin complex 1)の活性を阻害します。
また、HMG-CoA還元酵素とアセチルCoAカルボキシラーゼを阻害することによって脂質合成を阻害します。(308話、328話参照)
【グルコース枯渇によって誘導される小胞体ストレス応答を阻害する牛蒡子のアルクチゲニン】
がん細胞はグルコース枯渇などの栄養飢餓の状態になると、細胞死を起こさないようにするメカニズムが活性化します。そのようなメカニズムの一つとして「小胞体ストレス応答」があります。
小胞体ストレス応答が活性化すると、がん細胞は栄養飢餓の状態でも生き残ることができます。 このような栄養飢餓に対する抵抗性を阻害する物質として牛蒡子に含まれるアルクチゲニンが知られています。(298話参照)
アルクチゲニンが2-デオキシ-D-グルコースとの併用で抗腫瘍効果を高めるという報告もあります。以下のような報告があります。
① アルクチゲニんはがん細胞の栄養飢餓に対する耐性を抑制する。
Identification of arctigenin as an antitumor agent having the ability to eliminate the tolerance of cancer cells to nutrient starvation.(がん細胞の栄養飢餓に対する耐性を取り除く能力を持つ抗がん成分としてのアルクチゲニンの同定)Cancer Res. 66(3):1751-1757. 2006年
がん細胞は急速に増殖するため、酸素や栄養素の需要は高くなるのですが、血液の供給が追いつかない場合は、がん細胞は酸素や栄養素が不足しがちになります。しかし、がん細胞にこのような栄養飢餓の状態に対して、エネルギー代謝を変え、栄養や酸素が不足した状態でも死なないで増殖を続けようとします。このような栄養飢餓に対する耐性のメカニズムを阻害してやれば、がん細胞は死にやすくなり、抗がん剤の効き目を高めることができます。この論文では、アルクチゲニンは、がん細胞がグルコース不足の状態に耐えるために活性化されるAktという酵素の活性を阻害するメカニズムによって、栄養飢餓に対する耐性の獲得を阻止する可能性が示唆されています。
② アルクチゲニンは小胞体ストレス応答を阻害することによって、グルコースの枯渇によるがん細胞死を促進する。
Arctigenin blocks the unfolded protein response and shows therapeutic antitumor activity.(アルクチゲニンは小胞体ストレス応答を阻害し、抗腫瘍活性を示す)J Cell Physiol. 224(1): 33-40, 2010年
Arctigenin suppresses unfolded protein response and sensitizes glucose deprivation-mediated cytotoxicity of cancer cells.(アルクチゲニンは小胞体ストレス応答を抑制しグルコース枯渇によるがん細胞死の感受性を高める)Planta Med. 77(2):141-5. 2011年
がん細胞はグルコース要求が高いので、グルコース飢餓への適応は腫瘍内での細胞生存に大変重要な役割を担っています。グルコース飢餓に対する適応応答を阻害することががん治療に役立つと考えられています。
細胞内のリボソームで作られた蛋白質は、小胞体で修飾を受けて高次構造(折り畳み)を形成し、さらにゴルジ体で糖鎖の結合などによって成熟蛋白質となって細胞外へ搬出、あるいは細胞内で利用されます。低酸素やグルコース枯渇や栄養飢餓状態が起こると、折り畳みに異常をきたした不良蛋白質が小胞体に蓄積し、これを『小胞体ストレス』といいます。小胞体ストレスに対して細胞はGRP78などのシャペロン蛋白の発現が亢進して小胞体ストレスを回避し、アポトーシス(細胞死)が起こらないようにしています。これを小胞体ストレス応答 (unfold protein response: UPR)と言います。
この小胞体ストレス応答を阻害するとがん細胞はグルコース枯渇や栄養飢餓や低酸素によって死にやすくなります。アルクチゲニンはGRP78の発現を阻害して小胞体ストレス応答を阻害する作用が報告されています。
③ アルクチゲニンはグルコースを枯渇させたがん細胞の細胞死を促進する。
Arctigenin preferentially induces tumor cell death under glucose deprivation by inhibiting cellular energy metabolism.(アルクチゲニンは細胞のエネルギー代謝を阻害することによってグルコース枯渇下においてがん細胞に選択的に細胞死を誘導する)Biochem Pharmacol. 84(4):468-76.2012年.
この論文では、グルコース類似体の2-デオキシグルコースとアルクチゲニンを同時に投与すると、がん細胞に特異的に細胞死を誘導することが報告されています。2-デオキシグルコースはグルコースと類似の構造で、グルコースと同じように細胞に取り込まれますが、解糖系で代謝されず、解糖系の酵素を阻害する作用があります。つまり、グルコースを枯渇させ、がん細胞のグルコース取り込みを阻害しているのと同じような作用です。このような状況でアルクチゲニンを併用すると、がん細胞が特異的に死滅するという報告です。
④ アルクチゲニンはAMPK(AMP活性化プロテインキナーゼ)を活性化する。
Arctigenin, a natural compound, activates AMP-activated protein kinase via inhibition of mitochondria complex I and ameliorates metabolic disorders in ob/ob mice.(天然成分のアルクチゲニンはミトコンドリアの呼吸酵素複合体を阻害することによってAMP活性化プロテインキナーゼを活性化し、ob/obマウスにおける代謝異常を軽減する) Diabetologia. 55(5):1469-81.2012年
グルコース代謝のセンサーはグルコースそのものを検知するのではなく、代謝によって産生されたATPを介してグルコース量をモニターしています。その代表的な因子がAMP活性化プロテインキナーゼ(AMP-activated protein kinase:AMPK)です。AMPKはAMP(Adenosine Monophosphate:アデノシン-1-リン酸)で活性化されるタンパクリン酸化酵素で、低グルコース、低酸素、虚血、熱ショックのような細胞内 ATP供給が枯渇する状況において、AMPの増加に反応して活性化され、異化の亢進(ATP産生の促進)と同化の抑制(ATP消費の抑制)を誘導し、ATPのレベルを回復させる効果があります。すなわち、AMPKが活性化すると、糖や脂肪や蛋白質の合成は抑制され、一方、糖や脂肪や蛋白質の分解(異化)が亢進してATPが産生されます。
アルクチゲニンはミトコンドリアの呼吸酵素複合体Iの働きを阻害することによってATPを低下させ、その結果、AMPKが活性化されます。解糖やTCA回路によりNADH2+やFADH2の形で捕捉された水素は,ミトコンドリアのクリステにおいて,順次エネルギーが低くなるような一連の酵素系(複合体 I~IV)の連鎖を経て,最終受容体である酸素(O2)に渡されて水 H2Oになります。
複合体 I~IVの段階は,ミトコンドリア内膜のタンパク質や補酵素間で電子のやり取りが起こる過程であるため電子伝達系と呼ばれます。アルクチゲニンはこの複合体-Iの働きを阻害する作用があると言うことです。
AMPKを活性化するメトホルミンとベルベリンもこの電子伝達系の複合体-Iを阻害することによってATPを低下させ、AMPKを活性化することが報告されています。
メトホルミンがグルコース飢餓環境下で小胞体ストレス応答を抑制するという報告もあります。つまり、アルクチゲニンとメトホルミンは同様のメカニズムによる抗腫瘍効果があるようです。
【参考:小胞体ストレス応答とは】
細胞内のリボソームで合成された蛋白質は、小胞体で修飾を受け、高次構造(折り畳み)を形成しながら成熟蛋白質となって細胞外へ搬出されます。正常な折り畳みがなされた蛋白質はゴルジ体へ送られますが、折り畳みに失敗した異常な蛋白質は小胞体にとどまります。このような正常な高次構造に折り畳まれなかった異常蛋白質が小胞体内に蓄積して、細胞への悪影響(=ストレス)が生じることを小胞体ストレス(ERストレス:Endoplasmic reticulum stress)と言います。
小胞体ストレスは細胞の機能を妨げるため、細胞にはその障害を回避する仕組みが備わっています。この小胞体ストレスに対する細胞反応を小胞体ストレス応答 (unfold protein response: UPR) と言います。
小胞体ストレスの原因となる変性蛋白質は、遺伝子変異、ウイルス感染、炎症、有害化学物質、栄養飢餓、低酸素(虚血)などにより生じます。
変性蛋白質は小胞体ストレスセンサー(IRE1alpha, ATF6, Perk など)によって感知され、小胞体ストレス応答を誘導します。
小胞体ストレス応答は、蛋白質の産生量を低下させることで小胞体における蛋白質の折りたたみを軽減したり、分子シャペロンの量を増やすことで折りたたみ機能を向上させたり、変性蛋白質の除去効率をあげることで小胞体ストレスを取り除くように働きます。
変性蛋白質が過剰に蓄積し、小胞体ストレスの強さが細胞の回避機能を越えると、細胞死(アポトーシス)が誘導されます。
小胞体ストレスはアルツハイマー病などの神経変性疾患などさまざまな疾患の原因となると考えられています。
分子シャペロン (Molecular chaperone) とは、他の蛋白質分子が正しい折りたたみ(3次元構造)をして機能を獲得するのを助ける蛋白質の総称です。
分子シャペロンには多くの種類がありますが、小胞体ストレスが負荷されたときに特異的に発現が誘導される分子シャペロンの一つがGRP78です。GRP78とは78-kDa glucose-regulated proteinのことで、分子量が78000のグルコース制御性蛋白質という意味の蛋白質で、その発現量は小胞体ストレス応答 (unfold protein response: UPR)の指標となります。
固形がんは生体内において低酸素・低栄養という環境に適応するための様々なストレスに対する耐性を獲得しています。その中でも小胞体 (ER) 内で分子シャペロンとして働くGRP78の発現亢進は、ストレス耐性において最も大きな役割を担っていることが明らかになっています。
すなわち、本来であれば、低酸素・低栄養の環境で、小胞体ストレスの増大によってがん細胞は死滅するのですが、がん細胞内ではGRP78の発現が亢進してERストレス応答が増強しているために死ななくなっていると考えられています。
つまり、GRP78はグルコース欠乏など細胞にストレスがかかった際に細胞死を避けるために誘導されるたんぱく質と言え、 したがって、GRP78の発現誘導などの小胞体ストレス応答を特異的に阻害する物質は、抗がん剤治療が困難な固形癌に対して抗がん作用を発揮することが期待されています。また、抗がん剤の効き目(感受性)を高めることも報告されています。
牛蒡子に含まれるアルクチゲニンにはがん細胞の小胞体ストレス応答を阻害してがん細胞を死滅させやすくすることが報告されています。
以上のことから、糖質制限やケトン食でグルコースの供給を減らし、さらに2-デオキシ-D-グルコースをがん細胞に多く取り込ませれば、解糖系の阻害によるエネルギー産生低下と糖タンパク質の糖鎖異常によって、小胞体ストレスが増大します。このとき、牛蒡子のアルクチゲニンやメトホルミンによって小胞体ストレス応答を阻害すれば、栄養飢餓に陥ったがん細胞は死滅することになります。

ブドウ糖を絶てばがん細胞は死滅する
今あるがんが消えていく「中鎖脂肪ケトン食」
 (詳しくはこちらへ)
(詳しくはこちらへ)
画像をクリックするとサイトに移行します。
| « 337)2-デオ... | 339)膠芽腫(... » |





