がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
913)膵臓がんはなぜ抗がん剤が効きにくいのか:K-RasとNrf2の活性化とがん幹細胞

図:抗がん剤や放射線治療はがん細胞内の活性酸素の産生を増やし(①)、細胞増殖を抑制し、細胞死を誘導する(②)。膵臓がん細胞はがん遺伝子のK-Rasが高頻度に変異して活性化し、活性化したK-Rasは転写因子のNrf2の活性を高める(③)。Nrf2は活性酸素消去酵素や抗酸化物質の産生を増やし(④)、活性酸素の有害性を軽減する(⑤)。シンバスタチンとイベルメクチンはK-Rasの活性を抑制し(⑥)、メトホルミンと2-デオキシ-D-グルコース(2-DG)はNrf2の活性を阻害する(⑦)。ジスルフィラムは抗酸化システムを阻害し抗酸化力を低下する(⑧)。アルテスネイト、5-アミノレブリン酸、ジクロロ酢酸ナトリウムはがん細胞のミトコンドリア内で活性酸素の産生を高める(⑨)。がん細胞内の活性酸素の産生を高めると同時に、がん細胞の抗酸化システムを弱体化すると、がん細胞を死滅できる。
913)膵臓がんはなぜ抗がん剤が効きにくいのか:K-RasとNrf2の活性化とがん幹細胞
【膵臓がんは結合組織が多いので、抗がん剤や放射線治療や免疫療法が効きにくい?】
「膵臓がん細胞は、なぜ抗がん剤や放射線や免疫療法が効かないのか」という、膵臓がんの生物学的な理由を理解する必要があります。
がん細胞自体が他の種類のがん細胞より強いのかというとそうではありません。がん細胞の性質より、間質の性質の方が重要であることが指摘されています。つまり、膵臓がん組織は「強い間質反応による結合組織の増生」という組織学的特徴があります。
間質反応とは、がん細胞の周りに炎症細胞や線維芽細胞が増殖し、コラーゲンやヒアルロン酸が分泌されて結合組織ができ、その中に様々な間質細胞や血管が複雑に絡み合った構造ができる状態です。
この結合組織の増生はがん細胞への抗がん剤や免疫細胞への到達を妨げているから、治療効果が出ないという考えです。総説論文として以下のようなものがあります。
Shattering the castle walls: Anti-stromal therapy for pancreatic cancer(城壁を粉砕する:膵がんの抗間質療法)World J Gastrointest Oncol. 2018 Aug 15; 10(8): 202–210.
【要旨の抜粋】
様々な強力な化学療法が行なわれているが、転移のある膵臓がんにおける治療成果は依然として低い。
膵臓がんにおける豊富な線維性間質の存在が、抗がん剤治療が効きにくいという状態の決定的な要因であると考えられている。
明らかに、腫瘍間質は細胞傷害性薬物の腫瘍組織内への浸透を制限する物理的障壁として作用し、放射線療法の有効性を低下させる低酸素環境を作り出す。さらに、腫瘍間質は、がん細胞の増殖や進行において重要な支持的役割を果たしているので、腫瘍間質を構成する細胞性因子(例えば、膵星細胞)や非細胞性因子(例えば、ヒアルロナン)をターゲットにした薬剤の開発に研究者は注目している。
膵臓がんの病理所見の特徴の一つは間質における結合組織の増生です。結合組織の豊富な間質(desmoplastic stroma)が膵臓がんの病理所見の最大の特徴と言っても過言ではありません。(下図)

図:膵臓がん組織では、がん細胞(膵臓腺管がん細胞)を多量の結合組織が取り囲んでいる。結合組織や細胞外マトリックスは線維芽細胞や活性化した膵星細胞から産生される。
全てのがん組織にはがん細胞(実質細胞)の他に間質が存在します。間質には線維芽細胞や炎症細胞や免疫細胞のような細胞成分の他に、ヒアルロン酸(ヒアルロナン)やコラーゲン線維のような非細胞成分や、血管やリンパ管などが存在します。このような間質は、がん細胞を支持し、生存や増殖を促進する役割を担っています。
膵臓がんの間質も、その構成する細胞や非細胞成分は他のがんと基本的には同じです。ただ、間質組織の占める割合が他の固形がんに比べて極めて大きいという特徴があります。一般に、多くの膵臓がんでは間質ががん組織の80%以上を占めていると言われています。そのため、がん組織は硬くなります。
膵臓がん組織の結合組織増生には線維芽細胞の一種の膵星細胞の活性化が関与しています。この膵星細胞の活性化はビタミンD3とレチノイン酸で抑制できます。(下図)

図:膵星細胞は膵臓中の主な線維芽細胞で、組織修復を促進する細胞外マトリックス・タンパク質の合成および分解に関与し、膵腺房細胞に隣接して小膵管および血管周辺に分布している。正常状態ではビタミンA含有脂肪滴を多く含んで、静止状態になっている(①)。組織傷害や炎症反応で膵星細胞が活性化されると、脂肪滴は消失し、α平滑筋アクチンを発現して収縮性を持つ筋線維芽細胞様の形態を示す(②)。活性化した膵星細胞は増殖因子を産生してがん細胞の増殖や生存を促進し(③)、サイトカインやケモカインを産生して炎症反応を亢進する(④)。さらに、線維形成を誘導する細胞外マトリクス・タンパク質を多量に分泌する(⑤)。膵臓がん組織では間質において多量の結合組織の存在が、抗がん剤や免疫細胞の到達を阻害している(⑥)。ビタミンD3と全トランス・レチノイン酸は活性化した膵星細胞を静止状態に戻す作用がある(⑦)。
さらに、メトホルミンが膵星細胞の活性化を抑制することが報告されています。
つまり、メトホルミン、抗炎症剤、ビタミンD3は膵臓癌の結合組織増生の抑制に有効です(618話参照)
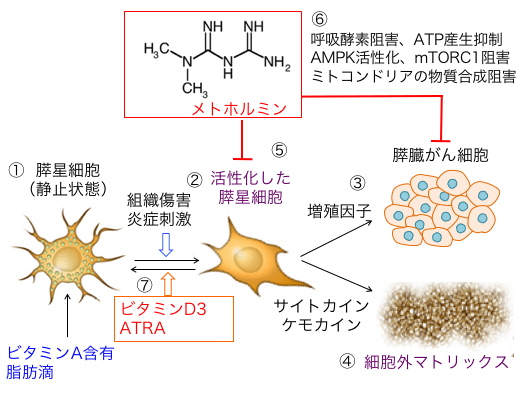
図:膵星細胞は正常状態ではビタミンA含有脂肪滴を多く含んで静止状態になっている(①)。組織傷害や炎症刺激で膵星細胞が活性化されると、脂肪滴は消失し、α平滑筋アクチンを発現して収縮性を持つ筋線維芽細胞様の形態を示す(②)。活性化した膵星細胞は増殖因子を分泌して膵臓がん細胞の増殖や生存を促進し(③)、サイトカインやケモカインを分泌して炎症反応を亢進し、さらに線維形成を誘導する細胞外マトリックス・タンパク質を多量に産生する(④)。糖尿病治療薬のメトホルミンは膵星細胞の活性化を阻害して、がん組織の微小環境における増殖因子や炎症性サイトカインや細胞外マトリックスの産生を抑制する(⑤)。さらにメトホルミンは、ミトコンドリアの呼吸酵素複合体Iの阻害によるATP産生抑制、AMP活性化プロテインキナーゼ(AMPK)活性化、mTORシグナル伝達系の抑制、がん細胞のミトコンドリアでのグルコースとグルタミンの利用を阻害して物質合成を阻害す効果も報告されている(⑥)。ビタミンD3と全トランス・レチノイン酸(ATRA)は活性化した膵星細胞を静止状態に分化誘導する(⑦)。
膵臓がんの間質ではヒアルロン酸(ヒアルロナン)が増えています。ヒアルロン酸はN-アセチルグルコサミンとグルクロン酸の二糖単位が連結した構造で、極めて高分子量で、水分を保持し、弾力性を高めるので、シワを消す目的で美容整形で注射されている成分と同じです。水との親水性が高い為、保水力が高く、肌のハリや弾力を保つ為には必要な成分です。変形性膝関節症などで痛みを軽減する目的で関節に注入する場合もあります。

図: ヒアルロン酸(ヒアルロナン)はN-アセチルグルコサミンとグルクロン酸の二糖単位が連結した構造で、分子の間に水分子(H2O)を保持するので、保水力が高く、膨潤性を示す。
このように水分を多量に保持する作用があるので、がん組織の間質にヒアルロン酸が増えると、がん組織の体積が増え、組織に圧力が高まります。その結果、がん組織内の血管を押しつぶして、抗がん剤や免疫細胞の到達を阻害すると考えられています。さらに、低酸素状態が強くなると放射線治療の効き目を弱めます。
結合組織の多いがんの治療成績が不良であることは、スキルス胃がんや乳がんの硬がんなどでも知られています。結合組織が増えているがんは予後不良と一般的に考えられています。したがって、がん組織の結合組織(特にヒアルロン酸)を減らす方法ががん治療法として研究されています。
例えば、ヒアルロン酸を分解するヒトのヒアルノニダーゼをポリエチレングリコールに結合した薬(PEGylated rHuPH20:PEGPH2)を、ヒアルロン酸が多いステージ4の膵臓がん患者に投与すると、ゲムシタビンとnab-パクリタキセルを併用した抗がん剤治療の効果を高めることが示されています。(Future Oncol. 2018 Jan;14(1):13-22.)
つまり、がん組織のヒアルロン酸を分解して除去すると、組織圧が低下して、血管が拡張して抗がん剤の浸透が亢進するので、抗がん剤治療が効くようになるという理由です(図)。

図:膵臓がん組織は間質のヒアルロン酸が多く、水分を保持して組織圧が高くなって血管を押しつぶしている。そのため、抗がん剤のがん組織への到達が妨げられている。ヒアルロン酸を分解するヒアルノニダーゼをポリエチレングリコールに結合した薬(PPEGPH2)でヒアルロン酸を分解すると、組織圧が低下して血管が拡張し、抗がん剤ががん細胞に到達しやすくなる。その結果、抗がん剤の効果が高まる。
しかし、このPEGPH2と作用の強い抗がん剤レジメのmFOLFIRINOX療法を併用すると全生存期間が短縮するという報告もあります。この報告では、全身状態の良好な138例の膵臓がん患者(転移あり)を対象に、mFOLFIRINOX 単独群とmFOLFIRINOX +PGEPH20併用療法群に無作為に1:1で割り当て、全生存期間を比較しています。
その結果、生存期間中央値は、mFOLFIRINOX 単独群が14.4ヶ月でmFOLFIRINOX +PGEPH20併用療法群が7.7ヶ月という結果でした。しかも、PGEPH20併用の方が副作用が強かったという結果でした。
この臨床試験は第IB/II 相試験ですが、この研究の報告者は、mFOLFIRINOX にPGEPH2を併用する第III相臨床試験は行うべきでないと結論しています。(J Clin Oncol. 2019 May 1;37(13):1062-1069.)
間質をターゲットにしたがん治療の研究は、結合組織を減らす治療法は抗がん剤の効き目を高めるという結果が多いのですが、一方で、結合組織を減らすとがんの進行が早くなるという報告も多くあります。結合組織はがん細胞の増殖を抑えるバリアー(防壁)の作用をしており、結合組織が減ると、血流が良くなって増殖が促進されるという考えです。
膵臓がん細胞が分泌するソニック・ヘッジホッグ(Shh)が間質反応の引き金役であるという発見に基づいて、この分子を欠損させた膵臓がんを作成し、間質反応がShhで誘導されるか調べる研究報告があります。結果は予想通りで、Shh欠損がんでは間質反応が強く抑えられました。しかし、予想に反してがん細胞の増殖は亢進しました。この効果は血管新生を抑制すると消えるので、間質反応は血管新生を抑制してがん細胞の増殖を抑えると結論しています。(Cancer Cell. 2014 Jun 16;25(6):735-47.)
間質の活性化線維芽細胞を薬剤で除去できるようにしたマウスを使って、がん細胞の増殖に及ぼす線維芽細胞の役割を調べると線維芽細胞を除去すると膵臓がん細胞の増殖が亢進するという報告もあります。(Cancer Cell. 2014 Jun 16;25(6):719-34.)
結合組織増生が、抗がん剤のがん組織への送達を妨げる物理的な障壁となり、これが膵臓がんの抗がん剤治療が効きにくい理由なっています。しかし、膵臓がんの組織の間質反応は、正常組織をがん細胞の浸潤から守る反応とも考えられます。間質の結合組織を減らす治療を行うときには、血管新生を阻害する治療を併用する方が良いということになります。
また、結合組織を増やして、がん細胞を結合組織の中に閉じ込めて増殖を抑えるという反対のアイデアもあります。
つまり、結合組織を減らす治療がプラスになるのか、結合組織を増やす方が増殖抑制にプラスになるのか、まだ結論が出ない状況です。がんの種類によるケースバイケースかもしれません。
したがって、膵臓がんの間質をターゲットにした治療もまだ実用的な段階とは言えないようです。
結合組織が多くて、血管が圧迫されて薬剤が癌組織に到達されにくいと、毒性の強い抗がん剤投与は、がん細胞には作用せず、正常細部にダメージを与えるだけという結果になります。
膵臓がんの抗がん剤治療が副作用だけで効果がでないのは、がん細胞に抗がん剤が到達しないのが一つの原因かもしれません。
その場合、正常細胞にダメージが及びにくい癌治療が有効です。アルテスネイト+5-アミノレブリン酸+ジクロロ酢酸ナトリウムをベースにしたフェロトーシス誘導は正常細胞にはダメージを与えず、むしろ正常細胞の働きを活性化して元気にします。
また、膵星細胞の活性化を抑制することは、がん細胞の増殖を抑えるので、メトホルミンとビタミンD3は有効です。メトホルミンとビタミンD3は多くの機序で膵臓がんの増殖を抑えるので、膵臓がん治療では必須です。
【がん幹細胞は抗酸化力を高めて治療抵抗性になっている】
「がん幹細胞を死滅できればがんは消滅できる」というのは、がん研究者のコンセンサスを得ていると思います。
膵臓がんに限らず、多くの種類のがんには「がん幹細胞」と呼ばれる、がんの進行や再発を引き起こす可能性が高い特別な細胞集団が存在します。がん幹細胞は、通常のがん細胞に比べて抗がん剤に対する耐性を持っていることが多く、この細胞集団を完全に除去することが困難です。そのため、抗がん剤による治療が一時的に効果を示しても、がん幹細胞が再発を引き起こす原因となります。
がん幹細胞 (cancer stem cells)は、通常のがん細胞を供給しながらがん組織を構成しています。
従来は、がん組織に存在する全てのがん細胞が無限の自己複製能(分裂能)を有し、がん組織を形成する能力を獲得していると考えられてきました。
しかし最近の考え方は、無限の分裂能を有しがん組織を形成できるのはがん幹細胞だけであり、大部分のがん細胞は、限定された分裂能を有するか、あるいはすでに分裂能を失っていると考えられています。
また、がん幹細胞は抗がん剤や放射線治療に抵抗性であり、抗がん剤や放射線治療によって腫瘍が縮小しても、死滅しているのは分化したがん細胞だけで、がん幹細胞は生き残ることが多いことが指摘されています。
治療によって大部分のがん細胞を除いても、ごく少数のがん幹細胞が生き残っていれば再発が起こりうることになり、これが、抗がん剤治療後にしばしば再発が起きる理由だと考えられています。
現行の抗がん剤治療のほとんどは、分化したがん細胞を標的として開発されており、がん幹細胞に対してはあまり効果が無い可能性が指摘されています。
抗がん剤治療によって腫瘍が縮小しても、多くは一時的な縮小であって、がん幹細胞が生き残っているかぎり、いずれ再増殖してきます。
臨床的な奏功率(腫瘍の縮小率)が生存期間の延長に必ずしも結びつかないのは、通常の抗がん剤治療ではがん幹細胞が治療に抵抗して生き残るからだと言えます。
成熟したがん細胞が限定した分裂能しか有しないのであれば、これらは放置しておいても自然に死滅することになります。しかし、がん幹細胞が生き残っていれば、がん組織は増大し、転移も広がることになります。
つまり、がん幹細胞を効率的に死滅できないとがんは治せないということになります(下図)。
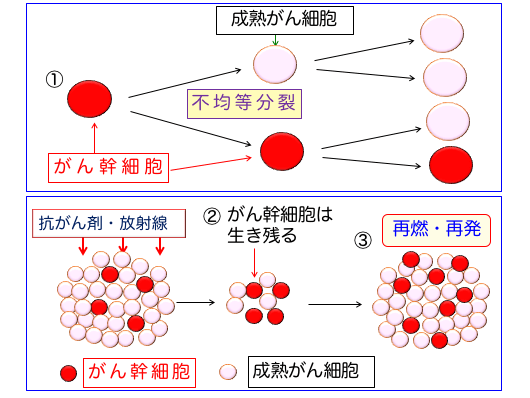
図:がん組織にはがん幹細胞 (cancer stem cells)と呼ばれる細胞が存在して、通常のがん細胞(成熟がん細胞)を供給しながらがん組織を構成している。がん幹細胞は自己複製を行う一方、不均等分裂により一部が自己複製のサイクルから逸脱して分化し通常のがん細胞となっている(①)。成熟がん細胞は抗がん剤や放射線で死滅しやすいが、がん幹細胞は死滅しにくいので抗がん剤治療や放射線治療で生き残る(②)。がん幹細胞は腫瘍形成能を持つので、生き残ったがん幹細胞が増殖して再発や再燃が起こる(③)。がん幹細胞がアポトーシス抵抗性になっているメカニズムを阻害すれば抗がん剤や放射線治療の効果を高めることができる。
がん幹細胞が分化したがん細胞よりも抗がん剤や放射線治療に対する感受性が低い理由は数多くあります。
例えば、がん幹細胞は抗がん剤の排出能力や解毒能力が高いことが指摘されています。つまり、細胞内の薬剤を排出するABC(ATP-binding cassette) transporterが高発現しているために抗がん剤が効きにくいことや、活性酸素などのフリーラジカルを消去する活性(グルタチオンやNrf2活性など)が高いために抗がん剤や放射線治療が効きにくいことが報告されています。
さらに、がん幹細胞はダメージを受けたDNAを修復する能力が高くなっているので、抗がん剤や放射線で遺伝子がダメージを受けても簡単には死ににくい性質を持っています。
がん幹細胞では、分化したがん細胞よりも、活性酸素種の量が少ないことが示されています。
通常のがん細胞よりがん幹細胞は、グルタチオンやチオレドキシンのような強力な抗酸化物質の量が多いので、その結果として細胞内の活性酸素種のレベルが低下していると考えられています。その理由はがん幹細胞ではNrf2活性が亢進しているからです。
がん幹細胞は細胞内の抗酸化物質の量が多く、そのため活性酸素種によって誘導されるアポトーシスに抵抗性を持つことになると考えられています。

図:転写因子のNrf2はがん幹細胞の酸化還元恒常性を制御することにより、細胞内の活性酸素量、造腫瘍性、抗がん剤感受性、幹細胞特性などを調節している。がん組織内には成熟したがん細胞とがん幹細胞が共存している。それらの細胞の特性はNRF2 活性化の程度と密接に関連している。がん幹細胞 は、NRF2 含有量が高く、活性酸素を消去する活性が高いので細胞内の活性酸素のレベルが低く、腫瘍形成性が高く、抗がん剤感受性が低い(抗がん剤に耐性)という幹細胞特性を強く有している。逆に、Nrf2含有量が低いがん細胞は、細胞内活性酸素含有量が高く、分化度が高く腫瘍形成性が低く、抗がん剤感受性が高く、幹細胞特性は乏しい。抗がん剤治療では、Nrf2の活性が高いがん幹細胞特性を強く有するがん細胞が生き残り、再発の原因となる。
したがって、がん幹細胞における抗がん剤や放射線治療に対する感受性を低下させているメカニズムを阻止すると、がん幹細胞が死滅し、がん組織を消滅できます。その重要なターゲットの一つがNrf2と言えます。(下図)

図:がん組織は成熟がん細胞(①)と少数のがん幹細胞(②)から構成される。抗がん剤や放射線治療で成熟がん細胞は死にやすいが、がん幹細胞は死ににくい性質を持つので生き残る。生き残ったがん幹細胞から成熟がん細胞が産生されるので、治療後に再燃や再発が起こる(③)。Nrf2活性を抑制すると、抗酸化力やDNA修復力の抑制によってがん幹細胞を死滅でき、がん組織を消滅できる(④)。
がん幹細胞は成熟がん細胞よりも細胞内の活性酸素量が低いと考えられています。これは正常細胞の幹細胞と非幹細胞で観察される結果と一致します。
つまり、正常細胞もがん細胞も、幹細胞は複数の抗酸化システムの活性を高めて細胞内の活性酸素のレベルを低く保つことで、がん幹細胞は幹細胞性特性を維持しています。さらに、活性酸素消去酵素の発現が増加すると、がん幹細胞は酸化ストレスに対してより抵抗性になり、その結果、抗がん剤や放射線治療に対する抵抗性が生じます。
まずNrf2について解説します。
【がん細胞はNrf2を活性化して抗酸化力を増強する】
細胞には、抗酸化酵素や解毒酵素の発現を誘導することによって、活性酸素や有毒物質による害から細胞自身を守る手段や仕組みが備わっています。
例えば、細胞内で活性酸素の発生量が増えると、細胞は活性酸素を消去する酵素(スーパーオキシド・ディスムターゼ、カタラーゼ、グルタチオン・ペルオキシダーゼなど)の発現や活性を高めたり、フリーラジカルを消去するグルタチオンやチオレドキシンなどの抗酸化物質の合成を高めたりして、活性酸素の害を軽減しようとします。
また、グルタチオンSトランスフェラーゼ(GST)などのフェースII(第2相) 解毒酵素と言われる代謝酵素は、様々な発がん物質や有害物質を無毒化する作用があります。
細胞が活性酸素や発がん物質や有害な成分(抗がん剤や放射線も含む)によって攻撃を受けると、これらの活性酸素消去酵素や抗酸化物質(グルタチオンやチオレドキシン)やフェースII解毒酵素が細胞内に誘導され(遺伝子の発現が増えたりタンパク質の産生量が増える)、細胞を守るシステムが働きます。
このような細胞内の防御システムの活性化に中心的な働きを行っているのがNrf2(Nuclear factor erythroid 2-related factor 2)という転写因子です。
抗酸化酵素やグルタチオンの産生に関する酵素やフェース2解毒酵素の遺伝子の発現調節領域には、抗酸化反応エレメント(antioxidant response element:ARE)という領域があって、この部分にNrf2が結合するとこれらの遺伝子の転写が促進されるのです。
NRF2 は非常に不安定なタンパク質であり、半減期が約 20 分と極めて短いのが特徴です。その活性化は主にタンパク質の安定性のレベルで制御され、これは最終的にユビキチン-プロテアソーム システムによる NRF2 分解によって制御されます。
すなわち、正常細胞において酸化ストレスの無い状況では、Nrf2はKeap1(Kelch-like ECH-associated protein 1)というタンパク質に結合することによりユビキチン化を受けて分解しています。
しかし、酸化ストレスにさらされるとKeap1のシステイン残基が修飾を受けて構造が変化し、Keap1からNrf2が離れてNrf2は核へ移行します。
核内でNrf2は遺伝子上流に存在する抗酸化剤応答配列(antioxidant response element: ARE)に結合することによって、このARE配列をもつ様々な遺伝子(抗酸化酵素やグルタチオンの合成に関与する酵素やフェースII解毒酵素など)の発現を誘導し、抗酸化や解毒に関するタンパク質や因子の合成を高めます。
このような作用によって、正常細胞においては、Nrf2の活性を亢進するNrf2活性剤は発がん過程を抑制するので、がん予防物質として認識されています。
しかし、がん細胞においては、Nrf2活性は抗がん剤や放射線治療に対する抵抗性の原因になっています。(下図)

図:転写因子のNrf2は細胞質でKeap1によって分解が促進されることによって活性が抑制されている(①)。酸化ストレス(②)が加わるとKeap1の構造が変化してNrf2から離れ(③)、フリーになったNrf2が核内に移行して(④)、抗酸化酵素や解毒酵素の遺伝子の上流に存在する抗酸化剤応答配列ARE(antioxidant response element)に結合し(⑤)、これらの遺伝子の発現を亢進する(⑥)。その結果、細胞内の防御機構が増強される(⑦)。細胞内防御機構の増強は、正常細胞の発がんを予防する効果があるが(⑧)、がん細胞の放射線や抗がん剤に対する抵抗性の亢進の原因となる(⑨)。
がん細胞は、細胞増殖を促進するために物質合成やエネルギー産生を高める結果、さらにミトコンドリアにおける機能異常の結果として、正常細胞と比較して大量の細胞内活性酸素種を生成することが示唆されています。
この増加した活性酸素種の産生に抵抗し、細胞毒性を防ぐために、がん細胞は酸化ストレスを軽減するために様々な適応メカニズムを進化させてきました。総合すると、これらのシステムは最終的にがん細胞の抗酸化能の増加につながります。
抗酸化力の増強という表現型の変化は、多種多様な固形腫瘍や血液腫瘍で広く観察されており、現在ではがん細胞の重要な特徴として認識されています。重要なことに、NRF2シグナル伝達の活性化は、がん幹細胞の生物学にも大きな影響を与え、腫瘍形成能、幹細胞性、生存に影響を及ぼす可能性があります。
放射線治療も抗がん剤治療もフェロトーシス誘導療法も活性酸素の産生を高め、細胞を死滅します。しかし、がん細胞は細胞に備わった抗酸化システムを利用して酸化ストレスを軽減し、細胞死から免れようとします。
したがって、Nrf2の活性を阻害できれば、抗がん剤や放射線治療やフェロトーシス誘導療法の効果を高めることができます。
逆に言うと、がん細胞の抗酸化力を低下できないと、抗がん剤や放射線治療やフェロトーシス誘導療法の効果は出ない可能性が高くなります。
【K-Ras変異はNrf2活性化を亢進する】
膵臓がん細胞ではK-Rasの変異が高頻度で起こっています。K-Ras(Kirsten rat sarcoma viral oncogene homolog)は、細胞増殖シグナルを制御するGTP結合タンパク質であり、変異によって恒常的に活性化されると、制御不能な細胞増殖やがんの発生を引き起こします。
K-Rasは通常、GTPとGDPの結合の切り替えによって活性と不活性を制御されます。変異型K-RasではGTP加水分解活性が低下し、常に活性化状態になり、細胞増殖シグナルが止まらなくなります。
K-Ras変異は膵臓がん、肺がん、大腸がんなどで高頻度で見られます。
K-Rasの異常活性化は、MAPK経路(RAF-MEK-ERK)やPI3K-AKT-mTOR経路など、がん細胞の増殖と生存を促進するシグナル伝達系を亢進します。
K-Ras変異があるがんは、抗がん剤だけでなく、分子標的薬(EGFR阻害剤など)も効きにくい傾向があります。
さらにK-RasはNrf2のシグナル伝達系の上流にあります。つまり、膵臓がんではK-Ras変異によって高度にNrf2活性が亢進しています。(下図)

図:抗がん剤や放射線やフェロトーシス誘導療法は活性酸素の発生を増やし(①)、細胞の酸化傷害を引き起こして細胞増殖を抑制し、細胞死を誘導する(②)。膵臓がん細胞はがん遺伝子のK-Rasが変異して活性化しており(③)、転写因子のNrf2の活性を亢進している(④)。Nrf2の活性化は活性酸素消去酵素や抗酸化物質の産生を高めて活性酸素による傷害を軽減する(⑤)。
【転写因子Nrf2はペントースリン酸経路を亢進する】
ペントースリン酸経路を阻害すると物質合成と抗酸化力が低下します。Nrf2はペントース・リン酸経路を亢進して、物質合成と抗酸化力を高めます。
ペントースリン酸経路とは、解糖系の中間体のグルコース6リン酸から分岐し、同じく解糖系の中間体 グリセルアルデヒド3リン酸に戻る経路(回路)です。解糖系と同様に細胞質に存在する経路で、補酵素の一つであるNADPHを産生し、核酸の原料となるリボース5リン酸などの5単糖 (ペントース) を産生します(図)。

図:グルコース6リン酸から派生するペントースリン酸経路では、還元剤のNADPHが産生され、グルタチオン還元や脂肪酸合成など還元力を必要とする生合成反応に使われる。さらに、核酸合成の材料になるリボース5リン酸が産生される。がん細胞ではグルコースの取込みが増え、解糖系とペントースリン酸経路が亢進して、細胞分裂のためのエネルギー(ATP)と物質合成(核酸、脂肪酸、NADPHなど)が亢進している。
NADPHは還元剤です。脂肪酸やステロイドの合成、抗酸化物質のグルタチオンやチオレドキシンの還元剤として使用されます。解糖系はATPを産生します。ペントースリン酸経路はATP産生には関与せず、核酸の原料や還元剤(NADPH)の産生を行っています。
細胞が増殖するにはエネルギー(ATP)だけでなく、核酸や脂肪酸などの物質合成や、酸化ストレスを軽減する還元剤の需要も増えます。したがって、がん細胞では、解糖系とペントースリン酸経路が亢進しています。
活発に増殖するがん細胞では同化反応が活性化されています。同化とは高分子の物質を合成することです。細胞が分裂して数を増やすには、新たな細胞成分を合成して増やす必要があります。細胞を構成するさまざまな物質の生合成が亢進しており、グルコースやグルタミンなどの栄養分が大量に消費されています。
転写因子Nrf2は生体における酸化ストレス応答において重要な役割をはたしていますが、さらにNrf2はペントースリン酸経路の酵素の遺伝子や、NADPHの産生に関与する酵素の遺伝子を直接的に活性化することが明らかになっています。また、核酸の新規合成に関与する酵素の遺伝子の発現にも関与してます。
つまり、Nrf2は同化反応を促進します。
増殖シグナル伝達系のPI3K-Aktシグナル伝達経路の活性化状態がNrf2の核への蓄積を促進し、さらに、Nrf2とPI3K-Aktシグナル伝達経路とが相互の活性を増強しあうという正のフィードバックの関係があることも示されています。
がん細胞においてNrf2はストレス応答能の増強にくわえ同化反応を促進し、さらに増殖シグナル自体の増強をもたらすことでがんの悪性化の駆動力となっているものと考えられています。
したがって、Nrf2活性の阻害はがん細胞の増殖を抑制します。
【2-デオキシ-D-グルコースとメトホルミンはがん細胞特異的にNrf2活性を阻害する】
Nrf2の転写活性を介した抗酸化酵素や解毒酵素の発現にはグルコースの供給が必要であるという報告があります。
Glucose availability is a decisive factor for Nrf2-mediated gene expression.(グルコースの供給がNrf2を介した遺伝子発現のための決定的な要因である)Redox Biol. 2013 Jun 21;1(1):359-65.
この論文では、スルフォラファンでNrf2を活性化する方法や、Nrf2を阻害するKeap1遺伝子を機能欠損させる方法(遺伝子ノックアウト)でNrf2の活性を亢進する方法で実験しています。
Nrf2を活性化するとグルコースの取込みが増え、ペントースリン酸経路でのNADPHの産生が増えることが示されています。
そして、グルコースの供給や取込みを阻害するか、あるいはペントースリン酸経路を阻害してNADPHの産生を阻害すると、Nrf2を介した遺伝子発現が抑制され、抗酸化酵素や解毒酵素の発現が抑制されることが示されています。
つまり、糖質制限やケトン食や2−デオキシグルコースや5-アミノレブリン酸(解糖系を阻害する)などで、がん細胞におけるグルコースの取込みやペントースリン酸経路を抑制する方法は、グルコースの取込みが亢進しているがん細胞に選択的にNrf2の活性を阻害できる可能性があります。
さらに、メトホルミンががん細胞のNrf2活性を抑制して抗腫瘍作用を示すことが明らかになっています。
メトホルミン(metformin)は、世界中で1億人以上の2型糖尿病患者に使われているビグアナイド系経口血糖降下剤です。
メトホルミンはミトコンドリアの呼吸鎖の最初のステップである呼吸酵素複合体Iを阻害することが明らかになっています。その結果、ミトコンドリアでのATP産生が減少し、AMP:ATPの比が上昇し、AMP活性化プロテインキナーゼ(AMPK)が活性化されます。活性化したAMPKは、肝臓の糖新生を抑制し、解糖を亢進し、骨格筋でのグルコース利用を促進して血糖を低下させます。
すなわち、メトホルミンの血糖降下作用はミトコンドリアにおけるATP産生の阻害によって体内のATP量が減少するためです。体はATPを増やすために、グルコースの分解(異化)を促進し、糖新生(同化)を抑制するので、血糖が低下します。
さらに、AMPKの活性化は細胞増殖を促進するmTORC1(哺乳類ラパマイシン標的蛋白質複合体-1)の活性を阻害することによってがん細胞の増殖を抑制します。
メトホルミンががん細胞のNrf2活性を抑制して抗腫瘍作用を示すことが報告されています。以下のような報告があります。
Metformin inhibits heme oxygenase-1 expression in cancer cells through inactivation of Raf-ERK-Nrf2 signaling and AMPK-independent pathways.(メトホルミンはRaf-ERK-Nrf2 シグナル伝達系とAMPK非依存的経路の阻害によってがん細胞のヘムオキシゲナーゼ-1を阻害する)Toxicol Appl Pharmacol. 2013 Sep 1;271(2):229-38.
ヘムオキシゲナーゼ-1は、ヘム(heme)をビリベルジン(biriverdin)と一酸化炭素(CO)と遊離鉄(Fe)に分解する酵素です。ビリベルジン(緑色の色素)は、ビリベルジン・リダクターゼ(biriverdin reductase)により、ビリルビン(bilirubin:黄疸の時の黄色の色素)に分解されます。このヘム分解により産生れるビリベルジンとビリルビンには強力な抗酸化作用があり、酸化ストレスによる細胞傷害を抑制します。 この論文では、メトホルミンはRaf-ERKシグナル伝達系を抑制しNrf2の発現量を減らす効果があることを報告しています。以下のような報告もあります。
Metformin Sensitizes Non-small Cell Lung Cancer Cells to an Epigallocatechin-3-Gallate (EGCG) Treatment by Suppressing the Nrf2/HO-1 Signaling Pathway.(メトホルミンは、Nrf2 / HO-1シグナル伝達経路を抑制することにより、非小細胞肺がん細胞をエピガロカテキン-3-ガレート治療に感受性にする。)Int J Biol Sci. 2017 Nov 27;13(12):1560-1569.
【要旨の抜粋】
緑茶中の主要ポリフェノールであるエピガロカテキン-3-ガレート(EGCG)は、潜在的な抗がん作用を有するがん化学予防剤として広く研究されている。
NF-E2関連因子2(Nrf2)/ヘムオキシゲナーゼ-1(HO-1)シグナル伝達経路の活性化は、EGCGに対する細胞抵抗性を引き起こす。古典的抗糖尿病薬であるメトホルミンは、がんの進行を抑制することが示されている。メトホルミンがEGCGの抗がん効果を増強するかどうかは報告がない。
この研究では、メトホルミンはHO-1発現を阻害し、EGCGの抗腫瘍効果を増強することを明らかにした。メトホルミンはまた、EGCG(100μM)によって誘導される活性酸素種の産生を増やし、アポトーシスを誘導した。さらに移植腫瘍を用いた動物実験で、メトホルミンとEGCGの併用投与は腫瘍の縮小効果を相乗的に増強した。
メカニズム的には、EGCGで活性化されたNrf2 / HO-1経路を、メトホルミンはNrf2のSIRT1依存性脱アセチル化によって阻害した。さらに、メトホルミンは、部分的にNF-kB経路を介してSIRT1発現を亢進した。
これと比較して、EGCGとメトホルミンとの組み合わせは正常な肺上皮細胞BEAS-2Bに対してほとんど影響を与えなかった。
以上の結果から、メトホルミンは、Nrf2 / HO-1シグナル伝達経路を抑制することにより、非小細胞性肺がん細胞のEGCGの抗がん作用に対する感受性を高める。
エピガロカテキン-3-ガレート(EGCG)は緑茶中の主要なポリフェノールです。EGCGはがん細胞に作用して酸化ストレスを引き起こして、抗がん作用を発揮します。
ポリフェノールはがん細胞に対して酸化剤として作用して増殖抑制や細胞死誘導の作用を発揮するという考えが最近は主流になりつつあり、これに関しては512話で解説しています。
EGCGの抗腫瘍作用に対して、がん細胞はNrf2/ヘムオキシゲナーゼ-1(HO-1)シグナル伝達経路の亢進によって抵抗しようとします。それに対抗して、メトホルミンはNrf2/HO-1シグナル伝達経路を抑制してHO-1発現を阻害し、EGCGの抗腫瘍効果を増強することを示しています。
【ジスルフィラムは還元型グルタチオンを枯渇する】
ジスルフィラム(Disulfiram)はアルデヒド脱水素酵素を阻害する作用があり、断酒薬としてアルコール中毒の治療薬として60年以上前から処方薬として使用されています。アルコールを飲むと強い副作用が出ますが、アルコールさえ飲まなければ、ジスルフィラムは極めて副作用の少ない薬です。
アルデヒド脱水素酵素(ALDH)はアルデヒド(CHO)を酸化してカルボン酸(COOH)にする反応を触媒する酵素です。アルデヒト脱水素酵素はがん幹細胞のマーカーとしても知られています。つまり、アルデヒト脱水素酵素はがん幹細胞に過剰に発現し、その生存や増殖や自己複製に何らかの重要な働きを行っていることが指摘されています。細胞にとってアルデヒドは毒性があるので、アルデヒドを早く代謝するために必要なのです。
ALDH活性を阻害するとがん細胞の増殖や転移を抑制でき、抗がん剤の効き目を高めることができます。ジスルフィラムと銅の組合せ(複合体)はプロテアソーム(proteasome)におけるタンパク質の分解機能を強力に阻害する作用があります。
プロテアソームはタンパク質分解活性を持った巨大な酵素複合体で、ユビキチンにより標識されたタンパク質をプロテアソームで分解する系はユビキチン-プロテアソーム・システムと呼ばれ、細胞周期やシグナル伝達やアポトーシスなど細胞内の様々な機能の制御に関わっています。プロテオソームの働きが阻害されると細胞内タンパク質の恒常性に異常が起こり、ユビキチン化されたタンパク質が細胞内に増え、毒性の強い凝集したタンパク質によってがん細胞に対して致死的に作用します。
つまり、ジスルフィラムはプロテアソーム阻害作用による抗がん作用もあるということです。
ジスルフィラムはタンパク質のシステインに反応して活性を阻害する機序によって、プロテインキナーゼCやP糖蛋白質やDNAメチルトランスフェラーゼなど様々ながん促進性のタンパク質を阻害します。
ジスルフィラムの代謝物は銅イオンや亜鉛イオンと複合体を形成するため、細胞内の重金属イオンの貯蔵量を減らし、その結果、スーパーオキシド・ディスムターゼ(酸化ストレスから細胞を保護する)やマトリックス・メタロプロテイナーゼ(がん細胞の浸潤や転移を促進する)のような酵素活性に亜鉛や銅が必須の酵素の活性を阻害する作用があります。
ジスルフィラムの抗腫瘍効果は二価重金属の存在下で強く現れます。がん細胞内には正常細胞よりもこのような二価の重金属(銅や亜鉛)が多く存在するので、ジスルフィラムの毒性はがん細胞に強くでます。
ジスルフィラムと銅イオンの複合体内における一価の銅イオンCu(I)と二価の銅イオンCu(II)の酸化還元サイクルは、グルタチオンの酸化と過酸化水素の産生を引き起こし、細胞内の酸化ストレスを高めることになります。

図:ジスルフィラムの代謝産物のジエチルジチオカルバミン酸は二価の重金属(銅や亜鉛)と複合体を形成する。その結果、細胞内の重金属イオンの貯蔵量を減らし、酵素活性に亜鉛や銅が必須の酵素の活性を阻害する作用がある。また、ジスルフィラムと銅イオンの複合体内における一価の銅イオンCu(I)と二価の銅イオンCu(II)の酸化還元サイクルは、グルタチオン(GSH)の酸化と過酸化水素(H2O2)の産生を引き起こし、細胞内の酸化ストレスを高める。がん細胞内には正常細胞よりもこのような二価の重金属が多く存在するので、ジスルフィラムの毒性はがん細胞に強く出る。
シンバスタチンとイベルメクチンはK-Rasの活性を抑制します。メトホルミンと2-デオキシ-D-グルコース(2-DG)はNrf2の活性を阻害します。ジスルフィラムは抗酸化システムを阻害し抗酸化力を低下します。アルテスネイト、5-アミノレブリン酸、ジクロロ酢酸ナトリウムはがん細胞のミトコンドリア内で活性酸素の産生を高めます。このように、がん細胞内の活性酸素の産生を高めると同時に、がん細胞の抗酸化システムを弱体化すると、がん細胞を死滅できます。(トップの図)
| « 912)5-アミノ... |



