がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
776)がん細胞のワールブルグ効果を阻害するがん治療
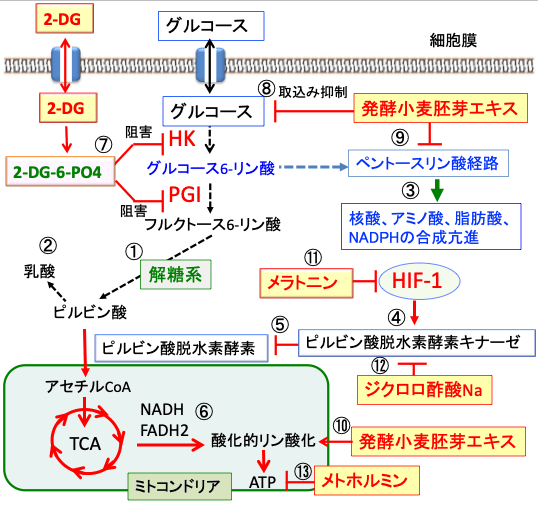
図:がん細胞はグルコースの取り込みと解糖系が亢進し(①)、乳酸産生が亢進している(②)。さらにペントース・リン酸経路が亢進し、核酸やアミノ酸や脂肪酸やNADPHの合成が亢進している(③)。がん細胞では低酸素誘導因子-(HIF-1)の活性が亢進し、ピルビン酸脱水素酵素キナーゼの発現を亢進する(④)。ピルビン酸脱水素酵素キナーゼはピルビン酸脱水素酵素の活性を阻害し(⑤)、ミトコンドリアでの酸化的リン酸化は抑制されている(⑥)。2−デオキシ-D-グルコース(2-DG)はヘキソキナーゼ(HK)によって2-DG-6リン酸(2-DG-6-PO4)に変換され、2-DG-6リン酸はヘキソキナーゼ(HK)とホスホグルコースイソメラーゼ(PGI)を阻害する(⑦)。その結果、解糖系とペントースリン酸経路を阻害する。発酵小麦胚芽エキス(Avemar)はグルコースの取り込み(⑧)とペントースリン酸経路(⑨)を阻害して、物質合成と抗酸化力を低下させる。さらに、発酵小麦胚芽エキスは酸化的リン酸化を促進する(⑩)。メラトニンはHIF-1を阻害する(⑪)。ジクロロ酢酸ナトリウムは、ピルビン酸脱水素酵素キナーゼの活性を阻害する(⑫)。その結果、ピルビン酸脱水素酵素を活性化してピルビン酸からアセチルCoAの変換を亢進してミトコンドリアでの代謝を亢進する。メトホルミンは呼吸鎖の呼吸酵素複合体Iを阻害して、ATP産生を低下し、活性酸素の産生を高める(⑬)。以上の組合せは、がん細胞のワールブルグ効果を是正することによって、がん細胞に選択的に、ATP産生と物質合成を抑制し、酸化ストレスを高めて、増殖を抑制し、細胞死を誘導する。
776)がん細胞のワールブルグ効果を阻害するがん治療
【がん細胞では解糖系でのグルコース代謝が亢進している】
正常細胞とがん細胞ではエネルギー産生の状況に大きな違いがあります。
正常細胞ではミトコンドリアで酸素を使って効率的にエネルギー(ATP)を産生しているのに対して、がん細胞では酸素が十分に存在する状況でもミトコンドリアでの酸素を使ったエネルギー産生(酸化的リン酸化)は抑制され、細胞質における解糖系によるATP産生が亢進しています。
つまり、がん細胞ではグルコース(ブドウ糖)の取り込みと解糖系が亢進し、ピルビン酸から乳酸への変換が亢進しています。酸素が十分に利用でき、ミトコンドリアの機能が正常でも、酸素を使わない解糖でエネルギーを産生するため、好気的解糖(aerobic glycolysis)と言います。
がん細胞でなくても、増殖の早い細胞は同様のエネルギー代謝を行っています。つまり、細胞を増やすためには、エネルギー産生と物質合成を両立させる必要があり、そのために好気的解糖を行う必要があるのです。

図:解糖系ではグルコース(ブドウ糖)1分子当たり2分子のATPが産生される(①)。ミトコンドリアで酸素を使った酸化的リン酸化ではグルコース1分子当たり32分子のATPが産生される(②)。がん細胞ではグルコースの取込みと解糖系が亢進し、乳酸の産生が増えている(③)。取り込まれたグルコースは核酸や脂肪酸やアミノ酸の合成にも利用される(④)。がん細胞では、酸素が十分に利用できる状況でも、ピルビン酸からアセチルCoAへの変換が阻害され、ミトコンドリアでのTCA回路と酸化的リン酸化によるATP産生は低下している(⑤)。
がん細胞における解糖系の亢進(好気的解糖)は90年以上前にドイツのオットー・ワールブルグ(Otto Warburg、1883年~1970年)により発見され、ワールブルグ効果とも呼ばれています。
ワールブルグ博士のグループは1923年頃から、「がん組織では、ミトコンドリアでの酸化的リン酸化が低下し、酸素がある状態でも解糖系でのエネルギー産生が主体である」という現象について一連の論文を発表しています。
このワールブルグ効果は、様々なメカニズムで、がん細胞の増殖や生存に有利に働いています。
ワールブルグ博士自身は、ミトコンドリアにおける酸化的リン酸化の機能欠損が細胞のがん化の原因だと考えていました。しかし、その後の研究で、多くのがん細胞においてミトコンドリアの機能自体は障害されていないことが明らかになっています。
がん細胞におけるワールブルグ効果(好気的解糖)は20年くらい前までは、がん研究においてほとんど注目されていませんでした。しかし、この10年間はワールブルグ効果に関する論文が急激に増えています。(下図)
がん細胞が解糖系を好む理由とそのメカニズムの解明が、がん研究における重要なテーマになっています。様々ながん遺伝子の異常や活性化が、がん細胞のワールブルグ効果の成り立ちに関与していることが明らかになっています。

図: PubMed(アメリカ国立医学図書館の国立生物工学情報センターが運営する医学・生物学分野の学術文献検索サービス)で「Warburg effect」を検索すると3700件以上の論文がヒットする(2021年9月末時点)。Otto Warburgの最初の論文が出た1924年から2000年頃までは、ワールブルグ効果に関する論文は年間10報以下であった。2010年に年間100報を超え、2013年に200報、2015年に300報、2019年に400報を超えている。ワールブルグ効果はこの10年間に急速に注目されるようになったことを示している。
【オットー・ワールブルグ博士とアルベルト・セント-ジョルジ博士】
オットー・ワールブルグ(Otto Warburg:1883年~1970年)博士は呼吸酵素(チトクローム)の発見で1931年にノーベル生理学・医学賞を受賞したドイツの生化学者です。細胞生物学や生化学の領域で重大な基礎的発見を次々に成し遂げ、呼吸酵素以外の研究でも何回もノーベル賞候補になった偉大な科学者です。
そのワールブルグ博士が最も力を注いだのががん細胞のエネルギー代謝の研究です。がん細胞の異常な増殖を解明するためには、エネルギー生成の反応系を研究しなければならないということから、呼吸酵素を発見しています。
そして、がん細胞ではグルコースから大量の乳酸を作っていること、がん細胞は酸素が無い状態でもエネルギーを産生できること、さらに、がん細胞は酸素が十分に存在する状態でも、酸素を使わない解糖系でエネルギーを産生していることを見つけています。
しかし、前述のように、ワールブルグが発見したエネルギー代謝の異常(ワールブルグ効果)は70年以上もほとんど注目されませんでした。
アルベルト・セント-ジョルジ(Albert Szent-Gyorgyi:1893-1986)博士はハンガリー出身(1947年にアメリカ合衆国に移住)の生理学者です。
ビタミンCの発見で有名ですが、細胞の呼吸反応(後にTCA回路と呼ばれる)の研究を行い、細胞呼吸(生物学的燃焼)におけるビタミンCとフマル酸の触媒作用に関する発見で1937年にノーベル生理医学賞を受賞しました。
セント-ジョルジはその後筋肉の収縮の研究を行い、アクチンとミオシンとによる筋肉収縮のメカニズムを発見しています。さらに、1950年代末からはがんの研究を精力的に行っています。
1950年代からがん治療の研究に没頭したセント-ジョルジ博士も、ワールブルグと同様にがん細胞の代謝の異常に注目して増殖を抑える方法を見つけることを目標にしていました。
しかし、セント-ジョルジががんの研究を精力的に行っていたころ(1960年代から80年代)は、強い毒性をもった化合物を使ってがん細胞を一掃するような治療法が主流になっていました。
セント-ジョルジはそのような抗がん剤治療の考え方には反対で、より安全な治療法の開発を目指しました。がん細胞を直接死滅させるのではなく、がん細胞の代謝の異常に注目して増殖を抑える方法を見つけることを目標にしました。
しかし、当時は「がん細胞を死滅させる細胞毒を見つけて抗がん剤にする」ような研究が重要と考えられていたため、セント-ジョルジが提唱する「がん細胞の代謝の異常を正常化させて増殖を抑制する」ような方法論に基づいた研究は次第に忘れ去られていきました。
【セント-ジョルジのがん研究と発酵小麦胚芽エキス(Avemar)】
ワールブルグもセント-ジョルジも偉大な科学者で、二人とも、がん治療においてエネルギー代謝の異常をターゲットにしたがん治療の有効性を認識していた点で注目されます。しかし、その考え方はつい最近まで重要視されていませんでした。
がん細胞におけるエネルギー代謝の異常(ワールブルグ効果)は、最近まで長い間、がん細胞が嫌気的環境に順応するための変化にすぎないと考えられてきました。しかし、最近の研究で、このワールブルグ効果はがん発生の原因として再び脚光をあびるようになってきました。そして、ワールブルグ効果の正常化をターゲットにした治療法が検討されるようになりました。

図:がん細胞ではグルコースの取り込みと解糖系が亢進し(①)、ミトコンドリアでの酸化的リン酸化は抑制されている(②)。これをワールブルグ効果と言う。グルコースの取り込みが増えると、アミノ酸や核酸や脂肪酸の合成に必要な中間代謝産物を増やすことによって、細胞の増殖に必要な細胞成分を増やすことができる(③)。乳酸と水素イオン(④)はがん組織を酸性化し(⑤)、周囲正常組織にダメージを与え、がん細胞の増殖や浸潤や転移を促進する(⑥)。ミトコンドリアの酸化的リン酸化が抑制されるとアポトーシスが起こりにくくなる(⑦)。したがって、ワールブルグ効果はがん細胞の増殖に有利に働き、がん細胞のワールブルグ効果を阻害するとがん細胞の増殖や転移を抑制し、アポトーシスを誘導することができる。がん細胞の増殖や代謝に関するオットー・ワールブルグ(⑧)とアルベルト・セントジョルジ(⑨)の二人の偉大な科学者の理論は、体にやさしいがん治療を考える上で非常に重要となっている。
セント-ジョルジ博士は、がん細胞の代謝の異常に注目して増殖を抑える治療法の研究の中で、小麦胚芽に含まれるキノンの一種ががん細胞の増殖を阻止する作用があることを見つけています。
すなわち、2,6-dimethoxy-p-benzoquinone(2,6-DMBQ)などのメトキシ置換ベンゾキノン類(methoxy-substituted benzoquinones)といわれる物質が、がん細胞におけるグルコースの取り込みや解糖系を阻害し、さらにDNAやRNAの合成に必要なペントースリン酸経路の酵素やリボヌクレオチド還元酵素(Ribonucleotide reductase)を阻害する作用が報告されています。
2.6-DMBQなどの抗がん作用のあるベンゾキノンを含有するサプリメントとして発酵小麦胚芽エキスのAvemarが有名です。
発酵小麦胚芽エキス(Avemar)には、がん細胞に直接作用して増殖を抑えたりアポトーシスを誘導する作用のほか、免疫力増強、ナチュラルキラー細胞によるがん細胞の認識を助ける効果、がん性悪液質の改善、抗がん剤や放射線治療の副作用を軽減する効果、再発を予防する効果など多彩な抗腫瘍効果が報告され、複数の臨床試験でも有効性と安全性が確認されているサプリメントです。
Avemarは「小麦胚芽に含まれるメトキシ置換ベンゾキノンの抗がん作用」に関するセント-ジョルジ博士の研究をもとに、セント-ジョルジの祖国のハンガリーで開発されたサプリメントです。
セント-ジョルジのベンゾキノンの抗がん作用に関する研究や、Avemarの基礎研究や臨床試験の結果などは、権威ある学術論文に発表されており、がん治療に利用されているサプリメントとしては、かなり有効性の高いサプリメントです。

図:小麦胚芽を発酵させた抽出エキスは、それに含まれるメトキシ置換ベンゾキノンやその他の成分の相乗効果によって様々な抗がん作用を発揮し、欧米ではがん患者用の栄養補助食品として注目されている。
【発酵小麦胚芽エキスはミトコンドリアの酸化的リン酸化を亢進する】
発酵小麦胚芽エキスのAvemarにはミトコンドリアの酸化的リン酸化を活性化することが報告されています。以下のような報告があります。
Mito-oncology agent: fermented extract suppresses the Warburg effect, restores oxidative mitochondrial activity, and inhibits in vivo tumor growth(ミトコンドリア をターゲットにしたがん治療薬:発酵抽出物はワールブルク効果を抑制し、ミトコンドリアの酸化的リン酸化活性を回復し、in vivoでの腫瘍増殖を阻害する)Scientific Reports volume 10, Article number: 14174 (2020)
【要旨の抜粋】
がん細胞ではミトコンドリアの機能異常と代謝経路の顕著な変化が起こっている。正常なミトコンドリアは、シトクロムCを細胞質に放出することにより、内因性アポトーシスを引き起こす。一方、がん細胞はこの機能が抑制され、死ににくくなっている。
発酵小麦胚芽抽出物(fermented wheat germ extract :FWGE)の高度に精製された活性成分であるA250は、ミトコンドリアへの物質流入を亢進し、TCA回路や酸化的リン酸化に関与する成分の発現を亢進した。
呼吸鎖活性の亢進は、アポトーシスカスケードを引き起こすシトクロムCを細胞質に放出するミトコンドリアの能力を高める。
マウス黒色腫の実験では腫瘍増殖が68%阻害された。単離された腫瘍組織サンプルのプロテオミクス分析によりミトコンドリアのタンパク質の同様な変化(TCA回路や酸化的リン酸化に関与する成分の発現亢進)が観察された。
血球数の検査データから、この腫瘍抑制効果が一般的な毒性を伴わないことを示した。
この研究は、高濃度に濃縮された発酵小麦胚芽抽出物が正常なミトコンドリア機能を高める効果的な薬剤であることを示している。肝毒性および一般的な毒性作用がないため、A250はがん治療におけるミトコンドリア機能を標的とする優れた候補と考えられる。
発酵小麦胚芽エキス(Avemar)はグルコースの取り込みと解糖系と乳酸産生を阻害し、ペントースリン酸経路を阻害して、物質合成と抗酸化力を低下させ、ミトコンドリアの酸化的リン酸化を亢進します。その結果、がん細胞のワールブルグ効果を是正して、エネルギー代謝と物質合成を正常化します(下図)。

図:がん細胞はグルコースの取り込みと解糖系が亢進し(①)、乳酸産生が亢進している(②)。さらにペントース・リン酸経路が亢進し、核酸やアミノ酸や脂肪酸やNADPHの合成が亢進している(③)。ミトコンドリアでの酸化的リン酸化は抑制されている(④)。発酵小麦胚芽エキス(Avemar)はグルコースの取り込みと解糖系と乳酸産生を阻害し(⑤)、ペントースリン酸経路を阻害して、物質合成と抗酸化力を低下させ(⑥)、ミトコンドリアの酸化的リン酸化の抑制を阻害(=酸化的リン酸化を亢進)する(⑦)。その結果、がん細胞のワールブルグ効果を是正して、エネルギー代謝と物質合成を正常化する。
この研究では、発酵小麦胚芽抽出物(fermented wheat germ extract :FWGE)の高度に精製された活性成分であるA250を使って実験しています。この発酵小麦胚芽抽出物の活性成分を濃縮したFWGE-Super Concentrateは米国でMetatrolという製品名で販売されています。
さて、上記の論文の著者は以下のようになっています。
Gyula Bencze, Szilvia Bencze, Keith D. Rivera, James D. Watson, Mate Hidvegi, Laszlo Orfi, Nicholas K. Tonks, and Darryl J. Pappin
Mate HidvegiはAvemarの開発者でAvemarの特許を持っているハンガリーの研究者です。
James D. WatsonはDNAの二重螺旋構造を解明し、1962年にノーベル賞を受賞したワトソンです。
他の研究者は、ジャームズ・ワトソンがかつて所長をしていたコールドスプリングハーバー研究所(Cold Spring Harbor Laboratory)とハンガリーの研究者です。筆頭著者のGyula BenczeはAmerican Biosciences社とコールドスプリングハーバー研究所に所属しています。
American Biosciences社は発酵小麦胚芽エキス(Fermented Wheat Germ Extract)のサプリメントを製造・販売している会社です。
数年前まで、Mate Hidvegiが開発したAvemarを改良したAveULTRAを製造販売していましたが、最近はAveULTRAは製造中止して、この論文にあるFWGEを高度に精製した活性成分であるA250を使ったサプリメント(Metatrol)を製造販売しています。
このA250はAmerican Biosciences社がコールドスプリングハーバー研究所のジェームズ・ワトソンと6年前から共同研究して開発したそうです(関係者からの情報)。
このA250は、がん細胞のミトコンドリアを活性化してがん細胞を活性化してがん細胞の増殖を抑制する機序で抗がん作用を発揮します。
「がん細胞はミトコンドリアの機能が抑制され、死ににくくなっている」ので「がん細胞のミトコンドリアを活性化するとがん細胞が死滅する」という考えです。この考えには反論も多くありますが、オットー・ワールブルグ、アルベルト・セントジョルジ、ジェームズ・ワトソンの3人のノーベル賞受賞者が提唱しているので、信じてみる価値はあります。
【ジクロロ酢酸ナトリウムはピルビン酸脱水素酵素キナーゼを阻害する】
ジクロロ酢酸ナトリウム(sodium dichloroacetate)は酢酸(CH3COOH)のメチル基(CH3)の2つの水素原子が塩素原子(Cl)に置き換わったジクロロ酢酸(CHCl2COOH)のナトリウム塩です。構造式はCHCl2COONaになります。
ジクロロ酢酸ナトリウムはピルビン酸脱水素酵素キナーゼを阻害することによってピルビン酸脱水素酵素の活性を高める作用があります。
がん細胞ではHIF-1の活性亢進によってピルビン酸脱水素酵素キナーゼの活性が亢進し、ピルビン酸脱水素酵素の活性が低下し、ピルビン酸からアセチルCoAへの変換が阻止されているため、ミトコンドリアでのエネルギー産生が低下しています。
そこで、ジクロロ酢酸ナトリウムでがん細胞のピルビン酸脱水素酵素を活性化して、ピルビン酸からアセチルCoAへの変換を促進してTCA回路を回せば、乳酸の産生が抑えられます。さらに、酸化的リン酸化の過程で活性酸素の産生が増え、酸化ストレスの増大によってがん細胞を死滅できるという作用機序が報告されています。(図)。

図:低酸素誘導因子-1(HIF-1)はピルビン酸脱水素酵素キナーゼの発現を誘導して(①)、ピルビン酸脱水素酵素(ピルビン酸をアセチルCoAに変換する)の働きを阻害するので(②)、ミトコンドリアでの酸化的リン酸化によるATP産生が抑制されている。ジクロロ酢酸ナトリウムはピルビン酸脱水素酵素キナーゼの活性を阻害することによってピルビン酸脱水素酵素の活性を高め(③)、R体αリポ酸とビタミンB1はピルビン酸脱水素酵素の補因子として働き(④)、ピルビン酸脱水素酵素の活性を高めてピルビン酸からアセチルCoAの変換を促進し、TCA回路での代謝と酸化的リン酸化を亢進する(⑤)。ミトコンドリアでの酸化的リン酸化が亢進すると、活性酸素の産生が増え、乳酸産生が減少し、アポトーシスが起こりやすくなって、抗がん剤感受性が亢進する(⑥)。
【ジクロロ酢酸ナトリウムはペントースリン酸経路を阻害する】
ピルビン酸脱水素酵素キナーゼを阻害してミトコンドリアを活性化するジクロロ酢酸ナトリウムがペントースリン酸経路を阻害することが報告されています。以下のような論文があります。
Inhibition of the pentose phosphate pathway by dichloroacetate unravels a missing link between aerobic glycolysis and cancer cell proliferation(ジクロロ酢酸によるペントースリン酸経路の阻害は、好気性解糖とがん細胞増殖との間の失われた関連を明らかにする)Oncotarget.2016 Jan 19; 7(3): 2910–2920.
【要旨の抜粋】
がん細胞は酸素の存在下でも解糖によるグルコースの発酵を行っており、これはワールブルグ効果と呼ばれている。このワールブルグ効果は、がんの治療法の開発において魅力的なターゲットになっているがん細胞に共通の特徴である。
本研究は、6つのがん細胞株において、DNA合成量によって評価した細胞増殖能は、解糖の効率と相関することを見出した。
解糖と増殖の関係をさらに調べるために、ペントースリン酸経路の薬理学的阻害を使用した。
我々は、ペントースリン酸経路の活性の低下ががん細胞の増殖を減少させ、その作用はワールブルグ効果の代謝が強いがん細胞ほど大きな影響を及ぼすことを実証した。
ペントースリン酸経路の最初の律速酵素であるグルコース-6-リン酸脱水素酵素に対するsiRNAを用いて阻害する実験で、がん細胞の増殖を維持する上でのペントースリン酸経路の重要な役割が確認された。
さらに、ジクロロ酢酸が、がん細胞の解糖系優位の代謝からミトコンドリアでの酸化的リン酸化を亢進するように代謝を変換させ、それに応じて増殖能が減少することを見出した。
ジクロロ酢酸がペントースリン酸経路の活性を低下させたことを実証することにより、ジクロロ酢酸ががん細胞の増殖を制御する新しいメカニズムを提供する。
正常細胞では解糖と酸化的リン酸化が連動して働き、ATPを産生しています。
がん細胞では解糖と酸化的リン酸化が連動していません。解糖の最終産物のピルビン酸は乳酸に変換され、ミトコンドリアでの酸化的リン酸化は抑制されています。
増殖する細胞にとっては、エネルギー産生と物質合成を両立させるためにはグルコースの取込みを亢進し、解糖系とペントースリン酸経路を亢進する必要があります。
ジクロロ酢酸はミトコンドリアの酸化的リン酸化を促進し、その結果、解糖系とペントースリン酸経路を抑制する結果になります。(下図)

図:がん細胞では低酸素誘導因子-(HIF-1)の活性が亢進し、グルコースの取り込みと解糖系が亢進し(①)、乳酸産生が亢進している(②)。さらにペントース・リン酸経路が亢進し、核酸やアミノ酸や脂肪酸やNADPHの合成が亢進している(③)。HIF-1はピルビン酸脱水素酵素キナーゼの発現を亢進する(④)。ピルビン酸脱水素酵素キナーゼはピルビン酸脱水素酵素の活性を阻害し(⑤)、その結果、ミトコンドリアでの酸化的リン酸化は抑制されている。ジクロロ酢酸ナトリウムは、ピルビン酸脱水素酵素キナーゼの活性を阻害する(⑥)。その結果、ピルビン酸脱水素酵素を活性化してピルビン酸からアセチルCoAの変換を亢進してミトコンドリアでの代謝を亢進する。その結果、乳酸産生とペントースリン酸経路が抑制され、ワールブルグ効果が是正される。
【2-デオキシ-D-グルコース+ジクロロ酢酸+メトホルミンはがん細胞のワールブルグ効果を正常化する】
2-デオキシ-D-グルコース(2-DG)はグルコースの2位のOHがHになったグルコース類縁体です。
2−DGはヘキソキナーゼで2-DG-6リン酸に変換されたあと、それ以降の解糖系酵素で代謝されないので、細胞内に蓄積します。その結果、2-DG-6リン酸はフィードバックでヘキソキナーゼを阻害し、グルコースの代謝も阻害します。
また、2-DGは小胞体におけるたんぱく質の糖鎖結合(N-グリコシル化)を阻害して小胞体ストレスを引き起こします。これらの作用によって細胞死を誘導します。
2-DGは他の組織の代謝が低下する就寝時に服用すると、がん細胞に多く取込まれて、抗腫瘍効果を発揮します。
【2-デオキシ-D-グルコースは解糖を阻害する】
2-デオキシ-D-グルコース(2-Deoxy-D-Glucose:2-DG)はグルコース(ブドウ糖)の2位のOHがHに変わっているグルコース類縁物質です(下図)。

2-DGはグルコースと同じトランスポーター(輸送担体)で取り込まれるので、グルコースの取り込みが亢進しているがん細胞に多く取り込まれます。
細胞内では、ヘキソキナーゼによってリン酸化されて、2-デオキシグルコース-6リン酸(2-DG-6リン酸)に変換されますが、この2-DG-6リン酸は解糖系の先の代謝系には進めない(ヘキソキナーゼの先の解糖系酵素で代謝できない)ので、細胞内に蓄積します。
特に、がん細胞は2-DG-6リン酸を脱リン酸化して2-DGに戻すホスファターゼ活性が低下しているので、がん細胞内に2-DG-6リン酸が蓄積します。
蓄積した2-DG-6リン酸は解糖系酵素のヘキソキナーゼとホスホグルコースイソメラーゼ(グルコースリン酸イソメラーゼ)をフィードバックで阻害する作用があり、取り込まれたグルコースの解糖系での代謝を阻害し、ATP産生や物質合成を低下させます。
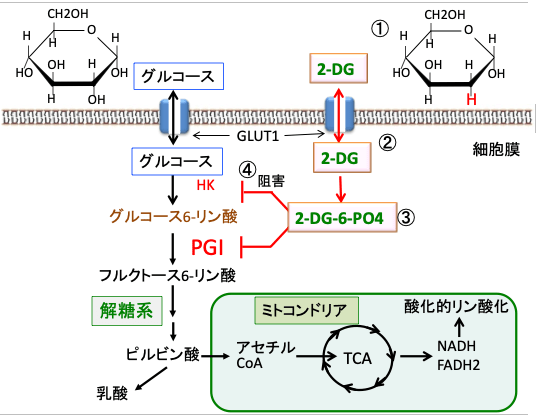
図:2-デオキシ-D-グルコース(2-DG)はグルコース(ブドウ糖)の2位のOHがHに変わっているグルコース類縁物質(①)で、グルコースと同様にグルコーストランスポーター(GLUT1)によって細胞内に取り込まれる(②)。細胞内のヘキソキナーゼで2-DG-6リン酸(2-DG-6-PO4)になるが、それから先の解糖系酵素では代謝できないので細胞内に蓄積する(③)。蓄積した2-DG-6リン酸はヘキソキナーゼ(HK)とホスホグルコースイソメラーゼ(PGI)をフィードバック的に阻害するので、グルコースの解糖系での代謝を阻害する(④)。
【2-DGはペントースリン酸経路を阻害する】
解糖中間体は多くの生合成系へと流れていきますが、その一つがペントースリン酸経路です。ペントースリン酸経路とは、解糖系の中間体のグルコース6リン酸から分岐し、同じく解糖系の中間体 グリセルアルデヒド3リン酸に戻る経路(回路)です。解糖系と同様に細胞質に存在する経路で、補酵素の一つであるNADPHを産生し、核酸の原料となるリボース5リン酸などの5単糖 (ペントース) を産生します。
NADPHは還元剤です。脂肪酸やステロイドの合成、抗酸化物質のグルタチオンやチオレドキシンの還元剤として使用されます。
解糖系はATPを産生します。ペントースリン酸経路はATP産生には関与せず、核酸の原料や還元剤(NADPH)の産生を行っています。
細胞が増殖するにはエネルギー(ATP)だけでなく、核酸や脂肪酸などの物質合成や、酸化ストレスを軽減する還元剤の需要も増えます。したがって、がん細胞では、解糖系とペントースリン酸経路が亢進しています。
2-デオキシ-D-グルコースはヘキソキナーゼとホスホグルコースイソメラーゼを阻害するので、グルコースの解糖系と同時にペントースリン酸経路を阻害してNADPHと5単糖 (ペントース)の産生を阻害します(下図)。

図:解糖系は1分子のグルコースが2分子のピルビン酸に分解される過程で2分子のATPが産生される(①)。グルコース6リン酸から派生するペントースリン酸経路(②)では、還元剤のNADPHが2分子産生され(③)、核酸合成の材料になるリボース5リン酸が産生される(④)。がん細胞ではグルコースの取込みが増え、解糖系とペントースリン酸経路が亢進して、細胞分裂のためのエネルギー(ATP)と物質合成(核酸、脂肪酸、NADPHなど)が亢進している。2-デオキシ-D-グルコース(2-DG)は、ヘキソキナーゼ(HK)で代謝されて2-DG-6リン酸(2-DG-6-PO4)に変換され(⑤)、2-DG-6-PO4はヘキソキナーゼ(HK)とホスホグルコースイソメラーゼ(PGI)を阻害する(⑥)ので、グルコースのペントース・リン酸経路での代謝を阻害する。
がん細胞ではHIF-1(低酸素誘導因子-1)の発現と活性が亢進しています。HIF-1はLDH(乳酸脱水素酵素)や解糖系の酵素の発現を亢進して、乳酸の産生を増やしています。
さらに、HIF-1はピルビン酸脱水素酵素キナーゼの発現を亢進します。ピルビン酸脱水素酵素キナーゼはピルビン酸脱水素酵素をリン酸化して活性を阻害します。
ピルビン酸脱水素酵素はピルビン酸をアセチルCoAに変換する酵素です。したがって、ピルビン酸脱水素酵素の阻害はミトコンドリアでの代謝を抑制します。
正常細胞では低酸素の状態にならないとHIF-1は活性化しませんが、がん細胞では低酸素でなくてもHIF-1は活性化しています。そのため、がん細胞ではピルビン酸脱水素酵素の活性が低下して、ミトコンドリアでの代謝が低下しています。
【メラトニンは低酸素誘導因子-1の活性化を阻止する】
HIF-1α誘導性の血管内皮増殖因子(VEGF)発現誘導をメラトニンが阻害することが多くの研究で示されています。
メラトニンには受容体とは非依存性の機序で、腎臓がん細胞において、HIF-1αの分解を促進してタンパク量を減らし、血管新生阻害作用を示すことが報告されています。
このHIF-1αとVEGFの発現を抑制するメラトニンの作用は、主に受容体非依存性の抗酸化作用が関連しています。抗酸化作用によって、メラトニンはHIF-1αたんぱく質の分解を促進します。
メラトニンはフリーラジカルを消去することによって、活性酸素によるPHD酵素の不活性化(PHD酵素の二価鉄イオンを酸化することによって)を阻止し、HIF-1αの分解を亢進してHIF-1αの量を減らします。すなわち、メラトニンはHIF-1αのmRNA量には影響せず、HIF-1αの核への移行を阻止し、HIF-1αとそのco-activatorであるCBPとp300の相互作用を阻害します。
メラトニンには免疫増強作用やがん細胞の直接的な抑制作用がありますが、がん細胞のHIF-1αの分解を促進してワールブルグ効果と血管新生を阻害する効果もメラトニンの抗腫瘍効果のメカニズムとして重要です。
血管内皮増殖因子(VEGF)の産生を抑制して血管新生を阻害する可能性も指摘されています。
メラトニンががん細胞の解糖系を抑制し、ミトコンドリアでの酸化的リン酸化を促進して、ワールブルグ効果を是正する効果が報告されています。
以下のような総説論文があります。いずれも、米国テキサス州のサン・アントニオ(San Antonio)のテキサス大学ヘルスサイエンス・センター(University of Texas Health Science Center)の研究者らのグループからの論文です。
Anti-Warburg Effect of Melatonin: A Proposed Mechanism to Explain its Inhibition of Multiple Diseases(メラトニンの抗ワールブルク効果:複数の疾患の抑制を説明するために提案されたメカニズム)Int J Mol Sci. 2021 Jan 14;22(2):764.
Melatonin inhibits Warburg-dependent cancer by redirecting glucose oxidation to the mitochondria: a mechanistic hypothesis.(メラトニンは、グルコース酸化をミトコンドリアに向け直すことにより、ワールブルグ依存性がんを阻害する:メカニズム的仮説)Cell Mol Life Sci 77(13), 2527–2542 (2020)
メラトニンは正常細胞のミトコンドリアで合成されますが、アセチルCoAはメラトニン合成の律速酵素であるアリルアルキルアミン-N-アセチルトランスフェラーゼ(arylalkylamine-N-acetyltransferase)に必要であり、がん細胞ではアセチルCoAが低下しているため、がん細胞のミトコンドリアではメラトニンの合成能力は低下しています。
この研究グループは、「メラトニンにはがん細胞における好気性解糖(ワールブルグ効果)を阻害し、正常細胞と同様にミトコンドリアにおける酸化的リン酸化によってATPを産生するように代謝を変化させる作用がある」と結論ずけています。
つまり、メラトニンにはがん細胞の好気性解糖(ワールブルグ効果)を是正して、がん細胞の増殖を抑え、死滅させる作用があるという報告です。
メラトニンは正常細胞のミトコンドリアで合成されます。アセチルCoAはメラトニン合成の律速酵素であるアリルアルキルアミン-N-アセチルトランスフェラーゼ(arylalkylamine-N-acetyltransferase)に必要です。
がん細胞ではピルビン酸をアセチルCoAに変換するピルビン酸脱水素酵素の活性が阻害されているため、アセチルCoAの産生が減少し、がん細胞のミトコンドリアではメラトニンの合成能力は低下しています。
メラトニンがグルコース酸化を細胞質(解糖)からミトコンドリア(酸化的リン酸化)に切り替える作用は、がん細胞内でのメラトニンの産生を高め、HIF-1の活性を阻害し、ワールブルグ効果の是正に寄与する可能性があります。

図:グルコースは解糖によってピルビン酸に分解され(①)、乳酸に変換される(②)。ピルビン酸はミトコンドリアに入ってピルビン酸脱水素酵素(③)によってアセチルCoAに変換され(④)、TCA回路で代謝され(⑤)、NADHとFADH2に捕捉された水素がミトコンドリア内膜の呼吸鎖(電子伝達系)に渡されて(⑥)、ATPが産生される(⑦)。このとき、ミトコンドリア内では活性酸素の産生も増える(⑧)。アセチルCoAはメラトニン合成の律速酵素であるアリルアルキルアミン-N-アセチルトランスフェラーゼ(arylalkylamine-N-acetyltransferase)に必要(⑨)。N-アセチルセロトニンはアセチルセロトニン・メチルトランスフェラーゼ(acetylserotonin methyltransferase)でメラトニンが生成される(⑩)。メラトニンは活性酸素種を消去する(⑪)。低酸素誘導因子-1(HIF-1)はピルビン酸脱水素酵素キナーゼ(PDK)の発現を亢進し、PDKはピルビン酸脱水素酵素の活性を阻害する(⑫)。メラトニンはHIF-1の発現を抑制する作用がある(⑬)。したがって、ミトコンドリアの活性化とメラトニンの補充はがん細胞のワールブルグ効果を是正して、がん細胞の増殖を抑える効果が期待できる。
以上から、発酵小麦胚芽エキス(Metatrol)、ジクロロ酢酸ナトリウム、2-デオキシ-D-グルコース、メラトニンの組み合わせは、がん細胞のエネルギー代謝を解糖系からミトコンドリアにおける酸化的リン酸化に移行させ、ワールブルグ効果(好気的解糖)を正常に是正し、がん細胞の増殖を抑える効果があります。
高用量のメラトニン摂取に関しては前回(775話)考察しています。
ラットを使った実験ではメラトニンは体重1kg当たり10mgから100mg程度で、腹腔内投与や静脈内投与が行われています。経口でのバイオアベイラビリティは15%程度です。
メラトニンの内服の場合、人間で体重1kg当たり10mgでも問題は少ないと言えます。体重60kgで600mgです。
実際に私自身が1日(就寝前1回)500mgを数日間服用していますが、副作用はありません。
これは自己責任ですが、進行がんで他に方法が無い状況で、1日100mgから1000mgのメラトニンを試してみる価値はあります。メラトニンは安価なので、原料で仕入れれば、1日1gでも1ヶ月1万円程度でできます。
試してみたい方がいればご連絡いただければ、対応できます。
ジクロロ酢酸に関しては、乳がんのホルモン療法中ではジクロロ酢酸ジイソプロピルアミンの有効性も報告されています。ジクロロ酢酸ジイソプロピルアミン(Diisopropylamine dichloroacetate)はPDK4(ピルビン酸脱水素酵素キナーゼ4)を阻害します。ジクロロ酢酸ジイソプロピルアミンは健康ドリンクのリゲインなどにも入っています。医薬品としてはリバオールがあります。極めて安価な薬です。(549話、738話参照)
ジクロロ酢酸ナトリウム、ジクロロ酢酸ジイソプロピルアミン、高用量メラトニンの組み合わせは試してみる価値はあります。費用も比較的安価です。
費用が問題なければ発酵小麦胚芽エキス(Metatrol)と2-デオキシ-D-グルコースとメトホルミンの併用はさらに抗腫瘍効果を高めます。
| « 775)高用量メ... | 777)ジクロロ... » |



