がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
857)SGLT2阻害剤カナグリフロジンの抗がん作用
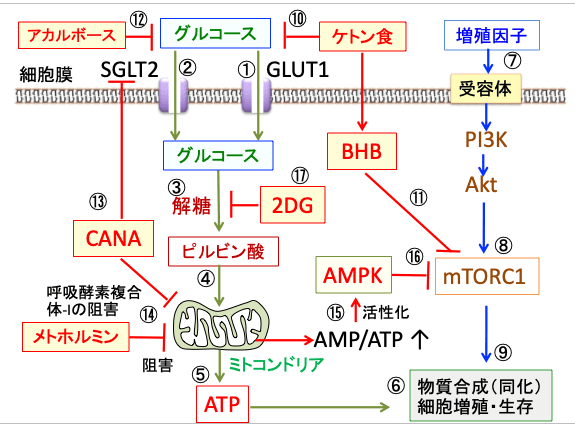
図: 血液中のグルコースは受動的グルコーストランスポーターのGLUT1(①)と能動的な輸送体(②)のナトリウム-グルコース共輸送体 2 (SGLT2)によって細部内に取り込まれる。グルコースは解糖(③)でピルビン酸(④)に変換され、ミトコンドリアでATP産生に使われる(⑤)。ATPは物質合成(同化)と細胞増殖・生存を促進する(⑥)。増殖刺激が受容体を介して細胞に作用すると(⑦)、PI3キナーゼ(PI3K)というリン酸化酵素が活性化され、これがAktというセリン・スレオニンリン酸化酵素をリン酸化して活性化し、活性化したAktはmTORC1を活性化する(⑧)。活性化したmTORC1は物質合成(同化)と細胞増殖・生存を促進する(⑨)。ケトン食はグルコース取り込みを阻害し(⑩)、ケトン体のβ-ヒドロキシ酪酸(BHB)はmTORC1を阻害する(⑪)。アカルボースは消化管での糖質の分解を阻害してグルコースの吸収を阻害する(⑫)。SGLT2阻害剤のカナグリフロジン(CANA)はSGLT2を阻害してグルコースの取り込みを阻害する(⑬)。カナグリフロジン(CANA)とメトホルミンはミトコンドリアの呼吸酵素複合体1を阻害し(⑭)、AMP/ATP比を高めてAMP活性化プロテインキナーゼ(AMPK)を活性化する(⑮)。活性化したAMPKはmTORC1を阻害する(⑯)。2-デオキシ-D-グルコース(2DG)は解糖系を阻害する(⑰)。これらを併用すると、がん細胞のエネルギー(ATP)産生と物質合成を阻害して、がん細胞の増殖を抑制し、死滅できる。
857)SGLT2阻害剤カナグリフロジンの抗がん作用
【SGLT2阻害剤はがん患者の生存率を高める】
SGLT2(ナトリウム-グルコース共輸送体2)及びその阻害剤(SGLT2阻害剤)については856話で解説しています。
腎臓の糸球体で血液中の物質(水、塩類、有機物などの小さな分子)が一旦濾過された後、体に有用な物質を再び血液中に戻すための尿細管で再吸収が行われます。尿細管でグルコース(ブドウ糖)を再吸収するタンパク質がナトリウム-グルコース共輸送体2 (Sodium-Glucose Cotransporter 2:SGLT2)です。(下図)

図:腎臓の糸球体で濾過された原尿中のグルコースは尿細管でほとんどが再吸収されている。グルコースの再吸収は主に近位尿細管のナトリウム-グルコース共輸送体2 (Sodium-Glucose Cotransporter 2:SGLT2)で行われる。
SGLT2の働きを阻害するSGLT2阻害薬は、2型糖尿病の治療に使用されています。SGLT2を阻害することで、腎臓が尿中にグルコースを排出するよう促す効果があり、これにより血糖値を下げる効果があります。さらにインスリン分泌も低下するので、老化を抑制し、寿命を延ばすことになります。そして、この効果はがん細胞の増殖抑制にも効果があります。(下図)

図:SGLT2(ナトリウム-グルコース共輸送体2)阻害剤(①)は、腎臓で濾過されたグルコースの再吸収を阻害し(②)、尿中にグルコースを排出(③)ことによって血糖を低下する(④)。その結果、インスリン分泌が低下する(⑤)。血糖とインスリンの低下は抗老化と寿命延長と抗がん作用につながる。
実際に、SGLT2 阻害剤には、血糖降下効果に加えて、腎臓と心臓に対して広範囲の有益な作用(腎臓保護作用、心不全の発症予防など)が報告されています。(856話参照)
さらに、がん死亡を減らす効果も報告されています。
【SGLT2阻害剤使用はがん患者の生存率を高める】
以下のような報告があります。
Sodium-glucose cotransporter 2 (SGLT2) inhibitor initiation and hepatocellular carcinoma prognosis.(ナトリウム-グルコース共輸送体 2 (SGLT2) 阻害剤の開始と肝細胞癌の予後)PLoS One. 2022 Sep 12;17(9):e0274519.
【要旨の抜粋】
はじめに: 実験的研究は、ナトリウム-グルコース共輸送体 2 (SGLT2) 阻害剤が肝機能を改善し、肝細胞がん細胞の増殖を抑制できることを示している。この研究の目的は、SGLT2 阻害剤の使用によりヒト集団における 肝細胞がん患者の予後が改善されるという仮説を検証することである。
方法: 米国における国家監視・疫学・最終結果 (National Surveillance, Epidemiology and End Results :SEER) とメディケアにリンクされたデータを使用して、肝細胞がん患者の生存に対するSGLT2阻害剤の使用の効果を評価した。66歳以上の2型糖尿病を有する患者で2014年から2017年の間に新たに肝細胞がんと診断された3,185人が対象となり、2019年末まで追跡調査された。SGLT2阻害剤の投与開始に関する情報は、メディケアパートDファイル(Medicare Part D file)から抽出された。
結果: SGLT2阻害剤の使用は、潜在的な交絡因子を調整した後の死亡リスクの有意な低下と関連し(ハザード比 = 0.68、95% 信頼区間 = 0.54-0.86)、使用期間が長いほどより死亡リスクの低下と関連していた(ハザード比 = 0.60、95%信頼区間 = 0.41-0.88)。さらに、SGLT2阻害剤の使用は、患者の状況(年齢・性別・職業・地域など)、腫瘍の特徴、がん治療に関係なく、死亡リスクの14%から60%の低下と関連していることも判明した。
結論: SEER-Medicareの大規模データを使用した研究は、SGLT2 阻害剤の使用開始が、SGLT2 阻害剤を使用しなかった場合と比較して、既存の 2 型糖尿病を有する肝細胞がん患者の全生存期間の改善と関連していることを示している。
メディケア(Medicare)は米国の高齢者および障害者向け公的医療保険制度で、連邦政府が管轄している社会保険プログラムです。アメリカ合衆国に合法的に5年以上居住している65歳以上のすべての人が給付の対象となっています。
National Surveillance Epidemiology and End Results(SEER)は米国で1971年に制定されたNational Cancer Act(国家がん法)のもとに、1972年にNCI(National Cancer Institute:米国がん研究所)がスタートさせた地域がん登録制度です。がんの種類毎の罹患率や死亡率などのがんに関するデータを集めています。
この米国の地域がん登録(SEER)は米国人口の8~26%に相当する人口のがん発生率や死亡率のデータを集めており、極めて正確な情報です。
この論文では、メディケアの患者を対象にしたがん登録データ(SEER-Medicare)のデータを解析しています。
その結果、SGLT2阻害剤の使用は肝細胞がん患者の生存率を高めることが明らかになったということです。
この報告は米国のインディナ大学(Indiana University)の研究グループの研究です。
以下の論文も同じ研究グループからの報告です。
Sodium-glucose cotransporter 2 (SGLT2) inhibitors and non-small cell lung cancer survival.(ナトリウム-グルコース共輸送体 2 (SGLT2) 阻害剤と非小細胞肺がんの生存率)Br J Cancer. 2023 Apr;128(8):1541-1547.
【要旨の抜粋】
背景: ナトリウム-グルコース共輸送体 2 (SGLT2) 阻害剤は、腎臓および心血管疾患に対する効果が実証されている抗糖尿病薬である。この研究では、非小細胞肺がん患者の生存に対する SGLT2 阻害剤の役割を評価する。
方法: 全国監視・疫学・最終結果 (National Surveillance, Epidemiology and End Results :SEER) とメディケアのリンクされたデータを使用した。2014年から2017年の間に新たに非小細胞性肺がんと診断された66歳以上の糖尿病患者2万4915人が対象となり、2019年末まで追跡調査された。SGLT2阻害剤の使用に関する情報は、メディケアパートDファイルから抽出された。
結果: SGLT2阻害剤の使用は、潜在的な交絡因子を調整した後の死亡リスクの有意な低下と関連し(ハザード比 = 0.68、95% 信頼= 0.60-0.77)、使用期間が長いほどより強い関連性があった(ハザード比 = 0.54、95% 信頼区間 = 0.44-0.68)。さらに、SGLT2阻害剤の使用は、患者の状況(年齢・性別・職業・地域など)、腫瘍の特徴、がん治療に関係なく、死亡リスクの大幅な低下と関連していた。
結論: SEER-Medicareの大規模データ研究は、SGLT2 阻害剤の使用が、既存の糖尿病を有する非小細胞性肺がん患者の全生存期間の改善と関連していることを示している。
SEER-Medicareの大規模データを解析した結果、SGLT2阻害剤を使用している糖尿病患者は非小細胞肺がんによる死亡リスクが低下するという結果です。
糖尿病患者ではメトホルミンの使用ががんの発生率と死亡率を低下することは確立しています。メトホルミンと同様に、SGLT2阻害剤の使用は糖尿病患者のがん死亡を減らすという複数の疫学研究の結果が報告されています。
【がん細胞はSGLT2が発現している】
がん細胞はグルコース(ブドウ糖)の取り込みが亢進しています。この性質を使ったがんの診断法がPET検査(Positron Emission Tomography)です。PET検査ではグルコーストランスポーター1(GLUT1)からのグルコース取り込みを検出しています。
がん細胞ではSGLT2の発現が亢進していることも明らかになっています。以下のような報告があります。
Functional expression of sodium-glucose transporters in cancer(がんにおけるナトリウム-グルコーストランスポーターの機能発現)Proc Natl Acad Sci U S A. 2015 Jul 28;112(30):E4111-9.
【要旨】
がん細胞は増殖し生存するために大量のグルコースを必要とし、その取り込みは受動的グルコーストランスポーター (GLUT) によって促進されるというのが定説である。 我々は、膵臓がん細胞および前立腺がん細胞にグルコースを取り込む新しい機構、すなわちナトリウム・グルコーストランスポーター(SGLT)を介した能動的なグルコース輸送を特定した。
これは、SGLT に特異的な放射性イメージング プローブである α-メチル-4-デオキシ-4-[18F]フルオロ-D-グルコピラノシド(α-methyl-4-deoxy-4-[18F]fluoro-d-glucopyranoside)が、膵臓がんや前立腺がんなど、腫瘍の診断および病期分類に陽電子放出断層撮影法(PET検査)と併用できることを意味する。
GLUT プローブの [18F]フルオロデオキシグルコースの有用性には疑問がある。 さらに、マウスモデルでの結果に基づいて、食品医薬品局が承認したSGLT2阻害剤が患者の膵臓がん細胞および前立腺がん細胞の生存率を低下させるために使用できる可能性があることを示唆している。
この論文では3 つの実験的アプローチが使用されました。
まず、免疫組織化学染色による腫瘍組織における SGLT1 および SGLT2 の発現を検討し、がん細胞におけるSGLT1 および SGLT2の発現を認めました。
グルコース輸送体のGLUTによって輸送されないSGLT特異的放射性グルコース類似体であるα-メチル-4-デオキシ-4-[18F]フルオロ-d-グルコピラノシド(Me4FDG)を使用して、新鮮な単離腫瘍におけるグルコース取り込みを測定しています。
さらに、 Me4FDG-PET イメージングを使用して、膵臓がんおよび前立腺癌のマウスモデルにおける in vivo でのSGLT 活性を測定しています。
哺乳動物細胞には 2 つの主要なタイプのグルコーストランスポーターがあります。最初のグループは立体特異性グルコース輸送タンパク質 (GLUT) で、グルコース輸送は細胞膜を横切るグルコース濃度勾配によって駆動されます。
2 番目のグループには、グルコース輸送に膜貫通ナトリウム イオン濃度勾配を使用する SGLT が含まれます。この GLUT ファミリーは、グルコース濃度勾配に対しても、細胞内へのグルコースのより効率的な輸送を提供します。
がん細胞は、正常細胞と比較して、グルコースの取り込みと利用に対する需要が増加しています。これまでの研究では、多くの種類のがんにおける GLUT1 の過剰発現が実証されています。GLUT1 を介して腫瘍細胞をイメージングするための現在の標準的な陽電子放射断層撮影 (PET) のトレーサーは 18F-FDG(フルオロデオキシグルコース)です。この18F-FDGはSGLT2からは取り込まれません。SGLT2から取り込まれるグルコース類縁体として、α-メチル-4-デオキシ-4-[18F]フルオロ-d-グルコピラノシド(Me4FDG)が開発されました。このSGLT2トレーサーのMe4FDGを使った研究で、膵臓がん、前立腺がん、脳腫瘍など多くのがん細胞でSGLT2の昨日発現が実証されています。
SGLT2は正常細胞での発現は弱いので、SGLT-2を選択的に阻害することでがん細胞によるグルコース取り込みをブロックする方法は、魅力的ながん治療法であると思われます。
【SGLT2阻害剤のカナグリフロジンはミトコンドリアの呼吸酵素を阻害する】
SGLT2阻害剤のカナグリフロジンはミトコンドリアの呼吸酵素複合体を阻害する作用があります。以下のような報告があります。
The diabetes medication Canagliflozin reduces cancer cell proliferation by inhibiting mitochondrial complex-I supported respiration.(糖尿病治療薬カナグリフロジンは、呼吸をサポートするミトコンドリア複合体を阻害することでがん細胞の増殖を抑制する)Mol Metab. 2016 Aug 26;5(10):1048-1056.
【要旨】
目的: ナトリウム・グルコース・トランスポーター 2 (SGLT2) 阻害剤であるカナグリフロジン(Canagliflozin)とダパグリフロジン(Dapagliflozin)は、最近 2 型糖尿病の治療薬として承認された。最近の研究では、SGLT2 阻害剤が一部のがん細胞の増殖を阻害する可能性があることが示されているが、そのメカニズムは不明である。
方法: 前立腺がん細胞および肺がん細胞の増殖に対するSGLT2 阻害剤の効果を検討した。酸素消費量、細胞外酸性化率、細胞ATP、グルコース取り込み、脂質生成、AMP活性化プロテインキナーゼ(AMPK)のリン酸化、アセチルCoAカルボキシラーゼのリン酸化、およびp70S6キナーゼのリン酸化を評価した。
結果: 臨床的に達成可能な濃度のカナグリフロジンは、単独または放射線および化学療法剤ドセタキセルと併用した場合、前立腺がん細胞および肺がん細胞の細胞増殖およびクローン原性生存を阻害したが、ダパグリフロジンは阻害しなかった。カナグリフロジンはAMPKを活性化するリン酸化を亢進し、グルコースの取り込みを減少させ、ミトコンドリア複合体-I活性を阻害し、ATP産生と脂質合成を阻害した。ミトコンドリア呼吸の減少がカナグリフロジンの抗増殖作用にとって重要であることが示された。
結論: これらの実験結果は、ビグアナイド系メトホルミンと同様に、カナグリフロジンが血糖値を下げるだけでなく、前立腺がん細胞および肺がん細胞における呼吸酵素複合体Iと細胞増殖も阻害することを示している。これらの結果は、動物モデルにおける腫瘍形成に対するカナグリフロジンの抑制作用や、がんの発生率を低下させる疫学研究の結果を支持している。
ミトコンドリアのTCA回路によりNADHやFADH2の形で捕捉された水素は,ミトコンドリアのクリステにおいて,一連の酵素系(呼吸鎖複合体 I~IV)とATP合成酵素(呼吸鎖複合体Vとも言う)の連鎖を経て,最終受容体である酸素(O2)に渡されて水 H2Oになります。 複合体 I~IVの段階は,ミトコンドリア内膜のタンパク質や補酵素間で電子のやり取りが起こる過程であるため電子伝達系(呼吸鎖)と呼ばれます。
電子伝達系によってミトコンドリアマトリックスから膜間空間にプロトン(水素イオン)がくみ出され、輸送されたプロトンによってミトコンドリア内膜の内外にΔΨと呼ばれる電気化学的ポテンシャル(プロトンによって生じるpH差および電荷の差)が作り出されます。マトリックス側に戻るプロトンの駆動力を利用してATP合成酵素がADPと無機リン酸からATPを合成します。これを酸化的リン酸化と言います。
ミトコンドリアの呼吸鎖や酸化的リン酸化の過程が阻害されると、プロトン(水素イオン)がうっ滞して、ミトコンドリアからの活性酸素種の産生が増加することが知られています。メトホルミンやレスベラトロールは呼吸酵素複合体Iを阻害して、ミトコンドリアからの活性酸素の発生を増やす作用があります。SGLT2阻害剤のカナグリフロジンも同様の作用があるという報告です。

図:ミトコンドリアのTCA回路によりNADHやFADH2の形で捕捉された水素は,電子伝達系(呼吸鎖複合体 I~IV)によって、ミトコンドリア・マトリックスから膜間空間にプロトン(水素イオン)がくみ出され、ミトコンドリア内膜の内外に電気化学的ポテンシャル(プロトンによって生じる電荷の差)が作り出される。マトリックス側に戻るプロトンの駆動力を利用してATP合成酵素がADPと無機リン酸からATPを合成する。これを酸化的リン酸化と言う。
メトホルミンは、ミトコンドリアの呼吸鎖の最初のステップである呼吸酵素複合体I を阻害することが明らかになっています。その結果、ミトコンドリアでのATP産生が減少し、AMP:ATPの比が上昇し、AMP活性化プロテインキナーゼ(AMPK)が活性化されます。
活性化したAMPKは、肝臓の糖新生を抑制し、解糖を亢進し、骨格筋でのグルコース利用を促進して血糖を低下させます。
すなわち、メトホルミンの血糖降下作用はミトコンドリアにおけるATP産生の阻害によって体内のATP量が減少するためです。メトホルミンはミトコンドリア毒なのです。
体はATPを増やすために、グルコースの分解(異化)を促進し、糖新生(同化)を抑制するので、血糖が低下します。
最近の研究では、メトホルミンはミトコンドリアのグリセロールリン酸脱水素酵素(mitochondrial glycerol-phosphate dehydrogenase: mGDP)を阻害することも報告されています。(下図)

図:メトホルミンは有機カチオン輸送体1(organic cation transporter 1 :OCT1)によって細胞内に入り、ミトコンドリアに集積する。ミトコンドリアでは呼吸酵素複合体IとmGDP(ミトコンドリア・グリセロールリン酸脱水素酵素)を阻害してNADH酸化を阻害する。その結果、ミトコンドリアでのATP産生は低下する。これらの作用はAMP活性化プロテインキナーゼ(AMP)シグナル伝達系を亢進し、cAMP/PKAシグナル伝達系を抑制し、糖新生を抑制し、解糖を亢進する。(参考:BMC Biol. 2014; 12: 82.)
メトホルミンはミトコンドリアでのグルコースとグルタミンの利用を阻害して物質合成を阻害し、がん細胞の増殖を抑制する効果が報告されています。
メトホルミンの抗腫瘍効果のメカニズムは間接作用と直接作用に分けられます。
1)メトホルミンは肝臓での糖新生を阻害することによってインスリンとインスリン様成長因子-1(IGF-1)の分泌を低下させ、インスリン/IGF-1依存性のがん細胞増殖促進作用を抑制することによって間接的にがん細胞の増殖を抑制します。
2)ミトコンドリアの呼吸酵素複合体Iの活性を直接的に阻害することによって酸化的リン酸化と物質合成を抑制することによってがん細胞の増殖を抑制します。ATP産生減少によってAMP活性化プロテインキナーゼ(AMPK)が活性化するとmTORC1シグナル伝達系が抑制されます。mTORC1の抑制は低酸素誘導因子-1(HIF-1)活性を抑制します。このような多彩なメカニズムで直接的な抗腫瘍効果を示します。さらに、がん細胞のミトコンドリアでのグルコースとグルタミンの利用を阻害し、物質合成を阻害す効果も報告されています。(下図)

図:メトホルミンは直接的および間接的なメカニズムで抗腫瘍作用を示す。肝臓における糖新生を阻害し(1)、全身のグルコースとインスリンの量を低下し、がん細胞の増殖を抑制する(2)。さらに、ミトコンドリアの呼吸酵素複合体Iの阻害によるATP産生抑制、AMP活性化プロテインキナーゼ(AMPK)活性化、mTORシグナル伝達系の抑制、低酸素誘導因子-1(HIF-1)活性の抑制などのメカニズムで直接的な抗腫瘍効果を示す(3)。がん細胞のミトコンドリアでのグルコースとグルタミンの利用を阻害し、物質合成を阻害す効果も報告されている(4)。(参考:BMC Biol. 2014; 12: 82.)
【SGLT2阻害剤のカナグリフロジンはAMP活性化プロテインキナーゼを活性化して抗腫瘍効果を発揮する】
SGLT2阻害剤のカナグリフロジンは、尿中へのグルコースの排泄のみでなく、メトホルミンと同様にミトコンドリアの呼吸酵素複合体1を阻害してAMPKを活性化する効果もあります。以下のような報告があります。
The Na+/glucose co-transporter inhibitor canagliflozin activates AMP-activated protein kinase by inhibiting mitochondrial function and increasing cellular AMP levels.(Na + /グルコース共輸送体阻害剤カナグリフロジンは、ミトコンドリア機能を阻害し、細胞の AMP レベルを増加させることにより、AMP 活性化プロテインキナーゼを活性化する)Diabetes. 2016 Sep; 65(9): 2784–2794.
【要旨】
カナグリフロジン(Canagliflozin)、ダパグリフロジン(dapagliflozin)、 エンパグリフロジン(empagliflozin)は全て、最近 2 型糖尿病の治療薬として承認されたが、天然物であるフロリジン(phlorizin)に由来している。これらは、SGLT1 による腸でのグルコース取り込みに影響を与えることなく、腎臓での SGLT2 によるグルコース再取り込みを阻害することで高血糖を軽減する。
今回我々は、カナグリフロジンがAMP活性化プロテインキナーゼ(AMPK)も活性化することを報告する。この効果はフロレチン(フロリジンのアグリコン分解産物)でも見られるが、ダパグリフロジン、エンパグリフロジン、フロリジンでは有意な効果は認められない。
AMPK の活性化は、臨床試験でヒト血漿中で測定されたカナグリフロジン濃度で発生し、呼吸鎖複合体Iの阻害によって引き起こされる細胞内のAMPまたはADPの増加によって引き起こされた。
カナグリフロジンも SGLT2 とは独立して細胞のグルコース取り込みを阻害したが、これは AMPK の活性化とは関連していない。
カナグリフロジンは脂質合成も阻害したが、この効果はAMPK遺伝子を欠損した細胞では認められず、AMPKによるアセチルCoAカルボキシラーゼ1(ACC1)および/またはACC2のリン酸化を必要とした。
カナグリフロジンの経口投与は、マウス肝臓のAMPKを活性化したが、筋肉、脂肪組織、脾臓では活性化されなかった。
AMPK によるアセチル CoA カルボキシラーゼのリン酸化は肝臓の脂質含量を低下させることが知られているため、これらのデータは、他の SGLT2 阻害剤と比較して、カナグリフロジン療法の潜在的なさらなる利点を示唆している。
AMPKはアセチル CoA カルボキシラーゼをリン酸化して活性を阻害し、脂肪酸合成を阻害します。カナグリフロジンはメトホルミンと同様にAMPKを活性化して脂肪酸合成を阻害するということです。脂肪酸合成の阻害はがん細胞の増殖を抑制します。(下図)

図: ミトコンドリアのTCA回路で生成されたクエン酸は、細胞質でATPクエン酸リアーゼによってアセチルCoAに変換され(①)、アセチルCoAカルボキシラーゼによってマロニルCoAに変換され(②)、脂肪酸合成酵素によって脂肪酸が合成される(③)。メトホルミンとカナグリフロジンはミトコンドリアの呼吸酵素複合体を阻害する機序でATP産生を阻害してAMP/ATP比を上昇させ(④)、AMP活性化プロテインキナーゼ(AMPK)を活性化する(⑤)。活性化したAMPKはアセチルCoAカルボキシラーゼ(⑥)と脂肪酸合成酵素をリン酸化して阻害する(⑦)。その結果、がん細胞の増殖を抑制する。
カナグリフロジンはAMPKを活性化して膠芽腫の増殖を阻害することが報告されています。以下の報告は岐阜薬科大学と岐阜大学医学部(脳神経外科)のグループの研究です。
Canagliflozin Inhibits Glioblastoma Growth and Proliferation by Activating AMPK(カナグリフロジンはAMPKを活性化することにより膠芽腫の成長と増殖を阻害する)Cell Mol Neurobiol. 2023 Mar;43(2):879-892.
【要旨の抜粋】
ナトリウム グルコース トランスポーター 2 (SGLT2) 阻害剤は、SGLT2 を阻害することによって効果を発揮する抗糖尿病薬である。最近の研究では、様々ながん細胞がSGLT2 を発現しており、SGLT2 阻害剤が腫瘍の増殖を減弱させることが示されている。
3 種類の 膠芽腫細胞株、U251MG (ヒト)、U87MG (ヒト)、および GL261 (マウス) を使用し、膠芽腫細胞に対するSGLT2 の抗腫瘍効果を評価した。
膠芽腫細胞および マウスに移植したで膠芽腫細胞においてSGLT2の発現を認めた。
培養細胞の実験で、40μMのカナグリフロジン投与は、細胞増殖および細胞へのグルコース取り込みを有意に阻害した。
さらに、40 μM のカナグリフロジンは、AMP活性化プロテインキナーゼ(AMPK)のリン酸化を有意に増加させ、p70 S6 キナーゼおよび S6 リボソームタンパク質のリン酸化を抑制した。
siRNA SGLT2 を使用してSGLT発現を阻害した場合も、同様の結果が得られた。
移植腫瘍の実験では、膠芽腫細胞を移植して3日目後からカナグリフロジン100mg/kgを10日間経口投与した。カナグリフロジ投与は膠芽腫細胞移植マウスの腫瘍増殖を有意に抑制した。
これらの結果は、カナグリフロジが膠芽腫の治療に使用できる可能性を示唆している。
AMPKの活性化はmTORを抑制します。つまり、SGLT2阻害剤はグルコースの取り込みを阻害し、さらにAMPK/mTOR 経路を介してがん細胞の増殖を抑制します。以下のような報告があります。
Sodium-glucose co-transporter-2 (SGLT-2) inhibition reduces glucose uptake to induce breast cancer cell growth arrest through AMPK/mTOR pathway(ナトリウム-グルコース共輸送体-2 (SGLT-2) 阻害は乳がん細胞のグルコースの取り込みを減少し、AMPK/mTOR 経路を介して増殖停止を誘導する)Biomed Pharmacother. 2020 Dec;132:110821.
【要旨の抜粋】
目的: ナトリウム グルコース トランスポーター 2 (SGLT2) 阻害剤であるカナグリフロジン(Canagliflozin)とダパグリフロジン(Dapagliflozin)は、2 型糖尿病の治療薬として承認されている。 SGLT2 を発現しているがん細胞に対してSGLT2 阻害剤が増殖を抑制する潜在的な能力を示しているが、乳がんに対する SGLT2 阻害剤の効果についてはほとんど知られていない。 この研究の目的は、乳がんにおける SGLT2 阻害剤の抗がん活性を in vitro および in vivo で評価することである。
方法: 免疫組織化学およびイムノブロットアッセイを使用して、乳がんにおける SGLT2 発現を検査した。がん細胞の増殖と成長に対する SGLT2 阻害剤の効果を解析するために、MTT 細胞毒性アッセイ、コロニー形成アッセイ、およびヒト乳がん細胞ヌードマウス異種移植モデルを実施した。 フローサイトメトリーアッセイを実施して、SGLT2阻害剤による細胞周期停止およびアポトーシス誘導の効果を評価した。
結果:乳がん細胞株およびヒト乳がん組織サンプルでSGLT2 が発現していることを証明した。 SGLT2 阻害剤のダパグリフロジンとカナグリフロジンは、インビトロでのMTTアッセイ、クローン原性生存アッセイ、およびインビボでの異種移植片増殖モデルにおいて、乳がん細胞に対して強力な抗増殖効果を示した。
さらに、SGLT2阻害剤ががん細胞の細胞周期をG1/G0期で停止させ、細胞のアポトーシスを誘導することを認めた。 ウェスタンブロット分析により、SGLT2 阻害剤による処理により、乳がん細胞における Amp 活性化プロテインキナーゼ (AMPK) のリン酸化が増加し、70 kDa リボソームプロテイン S6 キナーゼ 1 (p70S6K1) のリン酸化が減少することが実証された。
結論: これらの所見は、SGLT2 阻害剤療法が AMPK を介した細胞周期停止とアポトーシスを誘導し、これが乳がん治療の新規戦略となる可能性があることを示している。
この研究では、MCF-7 および ZR-75-1 乳がん細胞における細胞内グルコース流入の減少が確認され、乳がんに対するカナグリフロジンおよびダパグリフロジンの抗がん効果における SGLT-2 阻害の関与が示されました。この研究で示されているように、乳がん細胞における SGLT-2 の発現がかなり高いため、これは重要であると考えられます。
【SGLT2阻害剤は多彩な機序で抗腫瘍効果を発揮する】
以下のような報告があります。
SGLT-2 Inhibitors in Cancer Treatment—Mechanisms of Action and Emerging New Perspectives.(がん治療における SGLT-2 阻害剤—作用機序と新たな視点の出現)Cancers (Basel). 2022 Dec; 14(23): 5811.
【要旨】
抗糖尿病薬であるナトリウム-グルコース共輸送体 2 阻害剤 (SGLT-2 阻害剤) には抗がん作用があることが最近示され、多くのがん細胞株でその発現が確認されている。
がん細胞はグルコースの取り込みが亢進している特徴があり、がん細胞によるグルコース取り込みをブロックする SGLT-2 阻害剤の能力は、魅力的な治療アプローチであると思われる。
SGLT2は腎臓の尿細管に存在し、さらにがん細胞にも発現が認められている。
さらに、多数の臨床試験が示しているように、SGLT-2 阻害剤の使用は糖尿病および/または心不全患者において忍容性が高く、安全である。
インビトロ細胞培養研究および前臨床インビボ研究により、SGLT-2阻害剤が特定の種類の癌に対して抗増殖効果を示すことが確認されているが、この作用のメカニズムはまだ不明である。
SGLT-2 が発現しているがん細胞であっても、SGLT2阻害剤の抗がん作用には SGLT-2 非依存性の機構が存在する可能性がある。この論文では、SGLT-2 阻害剤の抗がん作用の潜在的なメカニズムに関する現在の知識と、臨床腫瘍学における将来の応用の可能性について考察する。
以下のような報告もあります。
Canagliflozin, characterized as a HDAC6 inhibitor, inhibits gastric cancer metastasis.(HDAC6阻害剤として特徴付けられるカナグリフロジンは胃がんの転移を阻害する)Front Oncol. 2022 Nov 15;12:1057455.
【要旨の抜粋】
非ヒストンタンパク質のアセチル化修飾のメカニズムは、さまざまな生物学的プロセスに関与する重要なエピジェネティックな制御である。
ヒストン脱アセチル化酵素6(HDAC6) は主に細胞質に存在し、非ヒストンタンパク質を脱アセチル化する。
HDAC6 は、胃がんを含むがんにおける多くの発がん経路の重要なプロモーターとして特定されている。
この研究では、酵素アッセイにより、FDA 承認の薬物ライブラリーからカナグリフロジンを有効な HDAC6阻害剤として同定した。
HDAC6 に対する化合物の強い親和性は、表面プラズモン共鳴 (surface plasmon resonance) および細胞熱シフト アッセイ (cellular thermal shift assay) によってさらに検証された。
さらに、分子ドッキングにより、カナグリフロジンが HDAC6 の活性ポケットに結合し、重要な残基と相互作用を形成できることが示された。さらなる実験により、カナグリフロジンが胃がん細胞の遊走と上皮間葉移行を効果的に阻害できることがin vitroとin vivoの実験で明らかになった。
これらの結果は、カナグリフロジンが胃がんの転移抑制に有効な薬剤となる可能性があるという新たな発見を明らかにしている。
【カナグリフロジンはPD-L1の分解を促進する】
カナグリフロジンは免疫チェックポイント阻害剤の効き目を高める効果が報告されています。以下のような報告があります。
Canagliflozin primes antitumor immunity by triggering PD-L1 degradation in endocytic recycling.(カナグリフロジンは、エンドサイトーシスのリサイクリングにおけるPD-L1分解を誘発することにより、抗腫瘍免疫を刺激する)J Clin Invest. 2023 Jan 3;133(1):e154754.
【要旨の抜粋】
今回我々は、FDA(米国食品医薬品局) 承認のナトリウム-グルコース共輸送体 2 (SGLT2) 阻害剤のカナグリフロジンが PD-L1 発現を劇的に抑制し、T 細胞媒介細胞毒性を増強することを示した。 作用メカニズムの研究により、SGLT2 が原形質膜およびリサイクルエンドソームで PD-L1 と一緒に局在し、それによってプロテアソームを介したPD-L1の分解が阻害されることが明らかになった。
カナグリフロジンは、SGLT2 と PD-L1 の間の物理的相互作用を妨害し、その後 Cullin3SPOP E3 リガーゼによる PD-L1 の認識を可能にし、これにより PD-L1 のユビキチン化とプロテアソーム媒介分解が引き起こされた。
マウスの実験系において、カナグリフロジン投与またはSGLT2遺伝子のサイレンシングのいずれかにより、PD-L1発現が大幅に減少し、腫瘍の進行がPD-1 モノクローナル抗体の投与と同等のレベルに制限され、これは抗腫瘍細胞傷害性T細胞の活性の増加と相関していた。
注目すべきことに、PD-1 モノクローナル抗体治療を受けた非小細胞肺がん患者のグループでは、SGLT2の発現が多いほど、カナグリフロジンによる無増悪生存期間と全生存期間の延長が大きかった。
したがって、我々の研究は、細胞表面PD-L1の分解を促進するすぐに使用できる小分子薬としてカナグリフロジンを同定し、腫瘍細胞による免疫回避を克服する潜在的な治療法を提供する、
以下のような報告もあります。
Inhibitory effects of canagliflozin on pancreatic cancer are mediated via the downregulation of glucose transporter‑1 and lactate dehydrogenase A.(膵臓がんに対するカナグリフロジンの阻害効果は、グルコーストランスポーター 1 と乳酸脱水素酵素A の発現抑制を介して媒介される)Int J Oncol. 2020 Nov;57(5):1223-1233.
【要旨の抜粋】
膵臓がんは、予後が悪く、死亡率が高い、最も致死的な固形悪性腫瘍の 1 つである。 膵臓がん細胞は、急速な増殖を維持するために解糖の亢進を示す。 カナグリフロジンは、糖尿病の臨床治療に使用されるナトリウム・グルコース共輸送体 2 阻害剤である。
最近の研究では、肝細胞がんを抑制するカナグリフロジンの潜在的な能力が実証されているが、膵臓がんに対する カナグリフロジンの治療効果やメカニズムはほとんど報告されていなし。
本研究では、膵臓癌に対する カナグリフロジンの抗腫瘍効果を調査した。 得られたデータは、膵臓がんの増殖が カナグリフロジンによって用量依存的に効果的に抑制され、培養 Capan-1 細胞および PANC-1 細胞におけるピーク阻害率はそれぞれ 54.3% および 57.6% であった。 PANC-1 由来腫瘍を有するヌードマウスにおける腫瘍阻害率は 45.2% に達し、インビトロおよびインビボでの膵臓がんに対する有効な抗腫瘍活性が示唆された。
さらに、Capan-1 細胞と PANC-1 細胞をゲムシタビンとカナグリフロジンで併用治療すると、ゲムシタビン単独での治療と比較して、より大きな有効性が示された。
さらに、ゲムシタビンとカナグリフロジンの併用療法では、グルコース取り込みと乳酸生成が減少し、グルコーストランスポーター 1(GLUT1) や乳酸脱水素酵素 A などの解糖系関連遺伝子の mRNA レベルが減少したことから、膵臓がん細胞におけるグルコース代謝に対する阻害効果が示された。
さらに、カナグリフロジンはアポトーシス、特に初期アポトーシスを誘導し、PI3K、リン酸化AKT(p-AKT)、リン酸化TOR(p-mTOR)、低酸素誘導因子-1α(HIF-1α)のタンパク質レベルを低下させた。これは、PI3K/AKT/mTOR シグナル伝達経路が解糖プロセスに関与していることを示している。
これらの結果は、カナグリフロジンは解糖の阻害によって膵臓がん細胞の増殖を効果的に阻害することを実証している。
これは主にPI3K/AKT/mTORシグナル伝達経路によって媒介されており、膵臓がんの臨床治療におけるこの経路の重要性が明らかになった。 既存の薬剤であるカナグリフロジンの新たな用途を探索することは、創薬分野での薬剤開発に必要なコストと時間を削減できる可能性がある
カナグリフロジンは多彩なメカニズムで抗がん作用を発揮するようです。抗がん剤治療やケトン食に併用する価値はありそうです。
【AMP活性化プロテインキナーゼは細胞内のエネルギー状態を知るメカニズム】
飢餓に対応するためには、細胞内のエネルギーや栄養素の量を検知するメカニズムが必要です。このメカニズムは単細胞生物のレベルから必要です。
たとえば、食糧が不足しており、物質合成やエネルギー産生の材料が十分でない状況で細胞増殖のスイッチを入れると、細胞分裂の途中で材料がなくなって、細胞分裂を完結できなくなり、自滅します。
建築材料を確保できる目処がないのに建物の建築を開始し、材料不足のために途中で工事を中止せざるを得ない状況に陥るのと同じです。
つまり、細胞レベルで、細胞分裂を完結できるレベルのエネルギーと材料があるかを検知する仕組みが必要です。
エネルギーの不足を検知して、細胞増殖を停止するメカニズムの代表がAMP活性化プロテインキナーゼ(AMPK)です。
細胞増殖に必要な材料が十分に存在していることを検知して細胞増殖のスイッチを入れるのがmTORC1(哺乳類ラパマイシン標的蛋白質複合体-1)です。
AMPKとmTORC1のシグナル伝達系はクロストーク(シグナル伝達系が相互に影響しあうこと)して、細胞増殖を制御しています。
AMP活性化プロテインキナーゼ(AMP-activated protein kinase:AMPK)は人から酵母まで真核細胞に高度に保存されているセリン・スレオニンキナーゼ(セリン・スレオニンリン酸化酵素)の一種で、代謝物感知タンパク質キナーゼファミリー(metabolite-sensing protein kinase family)のメンバーとして細胞内のエネルギーのセンサーとして重要な役割を担っています。
全ての真核生物は、細胞が活動するエネルギーとしてアデノシン三リン酸(Adenosine Triphosphate :ATP)というヌクレオチドを利用しています。ATPは「生体のエネルギー通貨」と言われ、エネルギーを要する生物体の反応過程には必ず使用されています。ATPがエネルギーとして使用されるとADP(Adenosine Diphosphate:アデノシン-2-リン酸)とAMP(Adenosine Monophosphate:アデノシン-1-リン酸)が増えます。
すなわち、ATP → ADP + リン酸 → AMP+2リン酸というふうに分解され、リン酸を放出する過程でエネルギーが産生されます。
AMPKはこのAMPで活性化されるタンパクリン酸化酵素で、低グルコース、低酸素、虚血のような細胞内 ATP 供給が枯渇する状況において、AMPの増加に反応して活性化されます。
AMPKは細胞内エネルギー(ATP)減少を感知して活性化し、異化の亢進(ATP産生の促進)と同化の抑制(ATP消費の抑制)を誘導し、ATPのレベルを回復させる効果があります。
すなわち、AMPKが活性化すると、糖や脂肪や蛋白質の合成は抑制され、一方、糖や脂肪や蛋白質の分解(異化)が亢進してATPが産生されます。したがって、この効果は運動と同じ効果になり、肥満や2型糖尿病の治療にも有効です。
AMPK は、α,β,γの3つのサブユニットからなるヘテロ三量体として存在し、AMP がγサブユニットに結合することでその複合体が活性化されます。つまり、細胞内のAMP/ATP比の増加がAMPKを活性化します。
AMPKは同化(物質合成)を抑制するので、がん細胞の増殖を抑制する効果があり、抗がん剤治療の効果を高める効果があります。
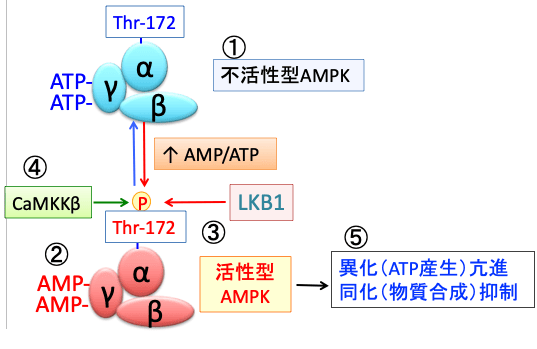
図:AMPK(AMP活性化プロテインキナーゼ)はα、β、γの3つサブユニットからなり(①)、細胞内のATPが減少するとγサブユニットに結合していたATPがAMPに置換する(②)。これによってAMPKの構造変化が起こると、LKB1というリン酸化酵素の親和性が高まり、αサブユニットのスレオニン172がリン酸化されると、さらにAMPKの活性が高まる(③)。カルモジュリンキナーゼキナーゼβ (CaMKKβ)もスレオニン172をリン酸化してAMPK活性を亢進する(④)。活性化したAMPKは異化を亢進してエネルギー産生を亢進し、物質合成を抑制するように代謝をシフトする(⑤)。
【ラパマイシンは哺乳類ラパマイシン標的タンパク質複合体1(mTORC1)を阻害する】
ラパマイシン(Rapamycin)は1970年代にイースター島(モアイ像で有名な南太平洋の島)の土壌から発見されたStreptomyces hygroscopicsという放線菌の一種が産生する有機化合物です。シロリムス(Sirolimus)という別名で呼ばれることもあります。
ラパマイシンは免疫抑制作用があり、米国では臓器移植の際の拒絶反応を防ぐために使用されています。さらに、平滑筋細胞増殖抑制作用や抗がん作用や寿命延長効果が知られています。
平滑筋細胞増殖抑制作用に関しては、狭心症や心筋梗塞の治療に使われる血管内ステントに冠動脈再狭窄予防効果を目的としてラパマイシンを配合したステントが製品化され、心臓カテーテル治療において使用されています。また、リンパ脈管筋腫症の治療薬としても使用されています。
ラパマイシンの生体内のターゲット分子が、哺乳類ラパマイシン標的タンパク質(mammalian target of rapamycin)、略してmTOR(エムトール)というタンパク質です。
mTORはラパマイシンの標的分子として同定されたセリン・スレオニンキナーゼ(タンパク質のセリンやスレオニンをリン酸化する酵素)で、細胞の分裂や生存などの調節に中心的な役割を果たすと考えられています。
酵母におけるラパマイシンの標的タンパク質が見出されてTOR(target of rapamycin)と命名され、後に哺乳類のホモログ(相同体)が見出されてmTOR(哺乳類ラパマイシン標的タンパク質)と命名されました。
mTORにはmTOR複合体1(mTORC1)とmTOR複合体2(mTORC2)の2種類があります。mTORに幾つかの他のタンパク質が結合して複合体を形成しますが、結合しているタンパク質の違いで2種類の複合体ができ、異なる機能を担っています。
mTORC1は成長因子や、糖やアミノ酸などを含む栄養素のセンサーとして機能し、mTORC2は細胞骨格やシグナル伝達の制御をしています。インスリンやインスリン様成長因子(IGF-1)によって活性化されるのはmTORC1の方です。ラパマイシンで阻害されるのもmTORC1の方です。
ラパマイシンは単独でTOR 活性を阻害するのではなく、細胞内でFKBP12(12kDa FK506 binding protein)と結合し,このFKBP12-ラパマイシン複合体がTOR に結合してTOR 活性を阻害します。
図:哺乳類ラパマイシン標的タンパク質複合体1(mTORC1)は複数のタンパク質から構成されるセリン・スレオニン・リン酸化酵素で、インスリンやインスリン様成長因子-1(IGF-1)や上皮成長因子(EGF)や血小板由来増殖因子(PDGF)などの増殖因子によって活性化される。mTORC1はタンパク質翻訳の開始因子であるelF4Eを抑制する4E結合タンパク質(4E-BP1)をリン酸化してその機能を抑制する。また、リボソームの生合成を促進するS6K1をリン酸化して活性化する。これらの作用によってmTORC1はタンパク質合成を促進する。その他、多くの標的タンパク質をリン酸化することによって脂質や核酸の合成を亢進し、細胞内小器官の消化・再利用に重要なオートファジーを抑制する。ラパマイシンはFKBP12と結合し、mTORとraptorの相互作用を阻害することによってmTORC1の活性を阻害する
【mTORC1とAMPKは栄養と増殖シグナルとエネルギー量を感知して増殖を制御する】
細胞の増殖というのは、栄養とエネルギーが利用できる状態にあるときに、新たな細胞構成成分(タンパク質、核酸、脂質など)を合成して、細胞の数を増やす生化学的プロセスのことです。
したがって、増殖するためには、細胞を新たに作る材料(栄養素)とエネルギー(糖質や脂質を酸化して得られるATP)が必要です。増殖因子や成長因子やホルモンなどによって細胞増殖の指令(シグナル)が来たときに、栄養素とエネルギーの供給が十分にある条件で、タンパク質や脂質の合成を促進して細胞増殖を実行するのが哺乳類ラパマイシン標的タンパク質(mTORC1)です。
インスリン、インスリン様成長因子-1(IGF-1)、成長ホルモンなどの増殖刺激が細胞に作用すると、それらの受容体を介してPI3キナーゼ(PI3K)というリン酸化酵素が活性化され、これがAktというセリン・スレオニンリン酸化酵素をリン酸化して活性化します。
活性化したAktは、細胞内のシグナル伝達に関与する様々な蛋白質の活性を調節することによって細胞の増殖や生存(あるいは死)の調節を行います。このAktのターゲットの一つがmTORC1です。
Aktは結節性硬化症(Tuberous Sclerosis:TSC)の原因遺伝子産物であるTSC1/TSC2複合体のTSC2をリン酸化して活性を低下させ、低分子 GTPaseの一種である Rheb (Ras Homolog enriched in Brain)の活性を高めます。活性化したRhebは mTOR のキナーゼ触媒ドメインに直接結合してmTORC1のキナーゼ活性を高めます。
アミノ酸は別の経路でmTORC1の活性を高めます。mTORC1の活性化においてアミノ酸(哺乳類では特にロイシン)が必須であり、これはアミノ酸が十分である場合に限り細胞がタンパク合成を開始できる仕組みと言えます。
このようにして、栄養源と増殖シグナルを感知して細胞の成長や分裂を促進するのがmTORC1です。
一方、細胞内のエネルギー低下を感知するのがAMP依存性プロテインキナーゼ (AMPK)です。グルコース欠乏や低酸素などにより細胞内ATP 量が減少すると、AMP/ATP 比の増加に伴いAMPKが活性化されます。AMPKはmTORC1活性を抑制して、異化作用の亢進や細胞成長の停止をもたらし、エネルギー消費の抑制(同化抑制)とエネルギー産生の亢進(異化促進)へと細胞の代謝をシフトさせます。
AMPKはTSC2のリン酸化(活性化)によるmTORC1の間接的な抑制と、mTORC1構成ユニットのRaptorのリン酸化による直接的な阻害のメカニズムでmTORC1活性を低下させ、細胞の増殖を抑制します。

図:インスリンやインスリン様成長因子-1や成長ホルモンなどの増殖刺激が受容体を介して細胞に作用すると(①)、それらの受容体を介してPI3キナーゼ(PI3K)というリン酸化酵素が活性化され、これがAktというセリン・スレオニンリン酸化酵素をリン酸化して活性化する(②)。活性化したAktはTSC1/TSC2を阻害してRheb(Ras homolog enriched in brain)を活性し(③)、mTORC1を活性化する(④)。低栄養の場合は、ATPの産生が低下してAMP/ATP比が上昇し、AMP依存性プロテインキナーゼ(AMPK)が活性化される(⑤)。AMPKは、TSC1/TSC2の活性化やmTORC1の直接的な作用によってmTORC1活性を抑制する(⑥)。このようにmTORC1とAMPKは栄養状態と増殖シグナルを感知して細胞の増殖や生存を制御している(⑦)。ラパマイシンはFKBP12と結合し、mTORC1の活性を阻害する(⑧)。
がん治療ではAMPKを活性化し、mTORC1活性を阻害することが重要です。この目的ではメトホルミン、カナグリフロジン、2-デオキシ-D-グルコース、アカルボース、ケトン食の組み合わせを試してみる価値はあると思います(トップの図参照)。
| « 856)ケトン体... | 858)アブラナ... » |



