がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
438) フェノフィブラートの抗がん作用(その2):腫瘍抑制性マイクロRNAの発現誘導作用
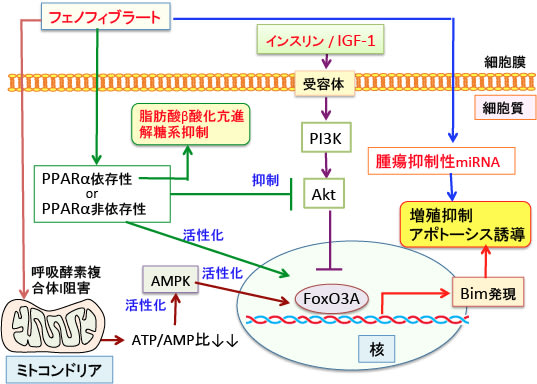
図:高脂血症治療薬のフェノフィブラートはPPARα(ペルオキシソーム増殖因子活性化受容体α)に依存するメカニズムで、がん細胞の解糖系を阻害し、脂肪酸β酸化を亢進してワールブルグ効果を抑制する。さらに、インスリンやインスリン様成長因子-1(IGF-1)で活性化されるAkt活性を阻害する。このAkt 活性化阻害と、PPARα非依存性のメカニズムで転写因子FoxO3aを活性化する。FoxO3aはBimの転写を誘導してアポトーシスを引き起こす。フェノフィブラートは腫瘍抑制性のマイクロRNA(miRNA)の発現を亢進して増殖抑制とアポトーシス誘導を引き起こすメカニズムも報告されている。さらに、フェノフィブラートはミトコンドリアの呼吸酵素複合体Iを阻害してATP産生を阻害し、ATP:AMP比を低下させてAMP活性化プロテインキナーゼ(AMPK)を活性化する。AMPKの活性化はFox3aの活性化など様々な抗腫瘍効果を示す。以上のようにフェノフィブラートは様々なメカニズムで抗腫瘍活性を示す。
438) フェノフィブラートの抗がん作用(その2):腫瘍抑制性マイクロRNAの発現誘導作用
【フェノフィブラートは様々な機序でグリオブラストーマの細胞死を誘導する】
グリオブラストーマ(神経膠芽腫)は非常に悪性度が高く、増殖や浸潤性が強く、ヒトの悪性腫瘍の中で最も予後不良の腫瘍の一つです。成人の脳腫瘍の約50%を占め、手術や放射線治療や抗がん剤治療などが行われますが、このような集学的治療を受けても平均生存期間は12~14カ月程度であり,治療成績はここ30年以上ほとんど改善していないと言われています。
グリオブラストーマに対してフィブラート系の高脂血症治療薬のフェノフィブラートが抗腫瘍効果を示すという実験結果が多数報告されています。その作用機序は多彩です。
フェノフィブラートなどのフィブラート系薬剤はペルオキシソーム増殖因子活性化受容体α(Peroxisome Proliferator-activated Receptor α:PPARα)という核内受容体の一種に結合して、脂質代謝を改善します。
PPARは細胞内のペルオキシソームの増生を誘導する受容体として発見され、糖質や脂質やタンパク質などの物質代謝や細胞分化に密接に関連している転写因子群です。
PPARにはアルファ型(PPARα)とガンマ型(PPARγ)とデルタ型(PPARδ)の3種類のサブタイプがあります。(437話参照)
フィブラート系薬剤は、PPARαに作動してペルオキシソームを増やして脂肪酸のβ酸化を亢進し、グルコースの解糖系を抑制する働きがあるので、がん細胞のワールブルグ効果(酸素がある条件でも、がん細胞はグルコースの嫌気性解糖系でエネルギーを産生していること)を阻害して、がん細胞の増殖を抑える効果があります。
この作用以外にも、インスリン様成長因子-1のシグナル伝達系(PI3K/Akt)を抑制する作用や、抗炎症作用や血管新生阻害作用などの抗腫瘍効果が報告されています。
フェノフィブラートの抗腫瘍効果には、本来のペルオキシソーム増殖因子活性化受容体(PPARα)を介した機序と、それとは関係ない機序(PPARα非依存性)が知られています。
フェノフィブラートがグリオブラストーマ細胞のFoxO3Aを活性化し、アポトーシスを誘導するBimの発現を亢進し、グリオブラストーマを死滅させる作用が報告されています。この作用に関しては326話で解説しています。
フェノフブラートのグリオブラストーマに対する抗腫瘍効果に関する最近の報告を紹介します。
【フェノフィブラートは腫瘍抑制性のマイクロRNAを誘導する】
以下のような論文が最近発表されています。
Anti-tumoral Effects of miR-3189-3p in Glioblastoma.(神経膠芽腫におけるmiR-3189-3pの抗腫瘍効果)J Biol Chem. 2015 Mar 27;290(13):8067-80.
【要旨の抜粋】
グリオブラストーマ(神経膠芽腫)は最も悪性度の強い脳腫瘍の一つである。我々は以前の研究で、グリオブラストーマ細胞をフェノフィブラートで処理すると増殖分化因子15(growth differentiation factor 15: GDF15)の発現量が増加することを発見している。
GDF15の遺伝子解析の結果、GDF15のイントロンにマイクロRNAのmiR-3189の存在を確認した。
そこで、グリオブラストーマの臨床例でmiR-3189が発現しているかどうか、miR-3189がグリオブラストーマ細胞の中で機能しているかどうかを検討した。
臨床サンプルの検討でアストロサイトーマ(星細胞腫)とグリオブラストーマに腫瘍組織では、正常の脳組織に比較して、miR-3189-3pの発現は抑制されていることを明らかにした。
miR-3189-3pを過剰発現させると腫瘍細胞の増殖と浸潤が顕著に阻害された。
グリオブラストーマ細胞をフェノフィブラートで処理するとmiR-3189-3pの細胞内量は増加した。
マイクロRNA(miRNA)は細胞内に存在する20~25塩基ほどのRNAで、タンパク質に翻訳されないイントロン部分からRNAに転写され、他の遺伝子の発現を調節する機能を持っています。
miRNAは細胞の発生、分化、増殖、がん化およびアポトーシスなどの細胞機能の根幹に関わっていることが知られています。このmiRNAは約1,000種類以上存在しており、様々な細胞機能の制御に関わっていると考えられています。
細胞のがん化に関わるmiRNAには、がん化を促進するはoncogenic miRNA (onco miRNA) と、がん化を抑制するTumor Suppressor miRNAがあります。
増殖分化因子15(growth differentiation factor 15: GDF15)はTGF-βスーパーファミリーに属するタンパク質の一つで、組織の損傷における炎症やアポトーシスの過程を制御する役割を担っています。
この論文の研究グループは、フェノフィブラートがグリオブラストーマ細胞のGDF15の発現を亢進することを以前の論文で報告しています。このGDF15自体に抗腫瘍効果があります。
さらに、この論文では、このGDF15の遺伝子のイントロン(タンパク質をコードしない部分)に腫瘍抑制性のマイクロRNAのmiR-3189の塩基配列が存在していることを発見しています。
そして、臨床サンプルのグリオブラストーマではmiR-3189の発現量が少なく、これを過剰に発現させるとグリオブラストーマ細胞の増殖と浸潤が抑制されることを示し、さらにフェノフィブラートがmiR-3189の発現量を増やすことを示しています。(フェノフィブラートは増殖分化因子15の発現も亢進)
つまり、フェノフィブラートはグリオブラストーマの細胞内でmiR-3189の発現を亢進して抗腫瘍効果を示すことを報告しています。
GDF15は非ステロイド性抗炎症剤活性化遺伝子-1(Nonsteroidal Anti- inflammatory drug-activated Gene-1:NAG-1)やマクロファージ抑制サイトカイン-1(Macrophage Inhibitory Cytokine-1 :MIC-1)とも呼ばれるトランスフォーミング増殖因子β(Transforming Growth Factor-β :TGF-β) スーパーファミリーに属するタンパク質です。
GDF15遺伝子は2つのエキソンと1つのイントロンからなり、前駆タンパク質が作られてから切断されて112個のアミノ酸からなるGDF15ペプチドになります。
miR-3189はこの唯一のイントロンの部分から産生されます。
GDF15はPPARαアゴニストのフェノフィブラート以外にも、抗炎症剤や抗がん剤でも発現が誘導されます。
フェノフィブラートとNSAIDs(非ステロイド性抗炎症剤)の併用、あるいは抗がん剤治療中にフェノフィブラートとNSAIDsを併用すると抗腫瘍効果を高めることができると言えます。
【フェノフィブラートはPPARαとp53に非依存性のメカニズムで抗腫瘍効果を示す】
以下のような報告があります。
Characterization of fenofibrate-mediated anti-proliferative pro-apoptotic effects on high-grade gliomas and anti-invasive effects on glioma stem cells.(高悪性度グリオーマに対するフェノフィブラートの増殖抑制とアポトーシス誘導作用と、グリオーマ幹細胞に対する浸潤抑制作用の検討)J Neurooncol. 117(2):225-34, 2014年
【要旨】
グリオブラストーマは高悪性度グリオーマ(High Grade Glioma:HGG)の中で最も浸潤性の高い悪性腫瘍である。手術や放射線治療やテモゾロマイドを使った治療が行われているが、その治療成績は非常に悪く、患者の予後は不良である。
ペルオキシソーム増殖因子活性化受容体α(Peroxisome Proliferator-activated Receptor-α:PPARα)のアゴニストは高脂血症の治療薬として広く使用されている。さらに、最近の研究でグリオブラストーマを含めて様々な種類のがん細胞に対して抗腫瘍作用を示すことが示されている。
本研究では、HGG細胞(高悪性度グリオーマ細胞)とグリオーマ幹細胞(Glioma Stem Cells:GSC)に対するPPARαアゴニストのフェノフィブラートの抗腫瘍作用のメカニズムを検討した。
フェノフィブラートは用量依存的およびp53非依存性のメカニズムでHGG細胞に対して25μM以上の濃度で増殖抑制作用を示し、50μM以上の濃度ではアポトーシス誘導作用を示した。
全てのHGG細胞株でPPARαの発現を認めた。しかし、PPARαの選択的阻害剤のGW6471でPPARαを阻害しても、フェノフィブラートによる増殖抑制作用とアポトーシス誘導作用は影響を受けなかった。これはフェノフィブラートの増殖抑制とアポトーシス誘導がPPARαに非依存性のメカニズムで発現することを意味している。
HGG細胞をフェノフィブラートで処理するとNF-κBやサイクリンD1を含む、主要なシグナル伝達系が抑制された。
Aktの発現量は変化せずにAktのリン酸化は減弱した。アポトーシスを制御しているBax(アポトーシス抑制性)とBcl-xL(アポトーシス促進性)への作用は、アポトーシスを促進する方向の効果を示した(Baxを抑制してBcl-xLを促進した)。
グリオーマ幹細胞(GSC)に対しては、フェノフィブラートは25μMの濃度でCD133とOct4の発現量を減少させ、浸潤性を減弱させた。
以上の結果から、フェノフィブラートはグリオーマに対して抗腫瘍作用を有し、高悪性度グリオーマの治療手段として有用性が示唆された。この薬は既に臨床で使用され、毒性の少ない安全性の高い薬であるため、早期の臨床試験での検討が必要である。
CD133とOct4は幹細胞(Stem cell)のマーカーです。フェノフィブラートがグリオーマ幹細胞のCD133とOct4の発現量を減らすということは、がん幹細胞の性質を抑制して、その結果浸潤活性を減弱させていることを示唆しています。
フェノフィブラートはAktの活性化(リン酸化)を抑制し、炎症促進性のNF-κBや細胞周期を進行させるサイクリンD1の発現抑制や、アポトーシス関連分子(BaxやBcl-xLなど)に作用し、抗腫瘍効果とアポトーシス誘導作用を示すという結果です。
これらの作用がp53に依存しないので、p53が変異しているがん細胞でも抗腫瘍効果が期待できることになります。さらにこの抗腫瘍効果がPPARαを介しないメカニズムによることを示唆しています。
フェノフィブラートにPPARαに非依存性の抗腫瘍効果があることは、他にも多くの論文があります。
【フェノフィブラートはミトコンドリアの呼吸を阻害する】
以下のような論文があります。
Molecular mechanisms of fenofibrate-induced metabolic catastrophe and glioblastoma cell death.(フェノフィブラート誘導性の代謝変動とグリオブラストーマ細胞死の分子メカニズム)Mol Cell Biol. 35(1):182-98, 2015年
【要旨】
フェノフィブラートはペルオキシソーム増殖因子活性化受容体α(PPARα)のアゴニスト(受容体に結合して作動させる物質)で、高脂血症治療薬として広く使用されている。
フェノフィブラートを含めてその他のPPARαアゴニストには抗がん作用が報告されている。我々は最近の研究で、フェノフィブラートが神経内分泌系の腫瘍細胞に対して非常に有効な抗腫瘍効果を示すことを報告している。このような有効な抗腫瘍活性を有するのに、フェノフィブラートによる腫瘍細胞死の誘導の分子メカニズムは明らかになっていない。
この報告では、培養細胞を使ったin vitroとの実験系と、マウスの頭蓋内にグリオブラストーマ細胞を移植したin vivoの実験モデルを用いて、フェノフィブラートによる腫瘍細胞の細胞死誘導作用のメカニズムを検討し、PPARαに依存しない新規の作用メカニズムを明らかにした。
フェノフィブラートは腫瘍細胞のミトコンドリアに集積し、ミトコンドリアの電子伝達鎖の複合体I(complex I)のレベルでミトコンドリア呼吸を阻害した。
フェノフィブラートはPPARα依存性の機序でグリオブラソトーマ細胞において亢進している解糖系代謝を抑制し、脂肪酸のβ酸化を亢進した。
これらの作用により、フェノフィブラートで長時間処理すると、細胞内ATPが枯渇し、AMP活性化プロテインキナーゼ(AMPK)が活性化され、哺乳類ラパマイシン標的タンパク質(mTOR)-オートファジー経路が阻害されて、広範な細胞死が誘導された。
興味深いことに、オートファジー活性剤はフェノフィブラートの抗腫瘍効果を減弱させ、オートファジー阻害剤はフェノフィブラートの抗腫瘍効果を促進した。
これらの結果はフェノフィブラートはグリオブラストーマに対して代謝の変動を引き起こして細胞死を誘導し、グリオブラストーマの治療に役立つ可能性があることを示している。
ミトコンドリアの呼吸酵素の複合体Iを阻害する作用はメトホルミンと同じです。メトホルミンもミトコンドリアの電子伝達系の呼吸酵素複合体Iを阻害してATP産生を阻害してAMPKを活性化することが明らかになっています。(384話)
つまり、フェノフィブラートの抗腫瘍作用にはメトホルミンと同様の機序の関与もあるようです。
グリオブラストーマの幹細胞のFoxO3aという転写因子を活性化すると、グリオブラストーマ幹細胞の分化が誘導され、成熟がん細胞と同じように抗がん剤や放射線で死滅しやすくなり、腫瘍形成能を失うので、腫瘍を消滅できるという報告があります。
メトホルミンもフェノフィブラートもFoxO3aを活性化することが報告されています。(339話参照)
したがって、フェノフィブラートとメトホルミンの併用はグリオブラストーマに対する抗腫瘍効果を高めることができると思います。
【PPARαリガンドはミトコンドリアをターゲットにする】
前述の論文と同様にPPARαリガンドがミトコンドリアに作用して抗腫瘍活性を示すことは他にも報告されています。以下のような論文があります。
Peroxisome Proliferator Activated Receptor A Ligands as Anticancer Drugs Targeting Mitochondrial Metabolism(ミトコンドリアの代謝をターゲットにする抗がん剤としてのペルオキシソーム増殖因子活性化受容体αリガンド)Curr Pharm Biotechnol. 2013 March 1; 14(3): 342–356.
【要旨】
正常細胞に比べて、がん細胞では解糖系(glycolysis)とグルタミン分解(glutaminolysis)と脂質合成(lipid synthesis)が亢進している。
ペルオキシソーム増殖因子活性化受容体α(PPARα)は栄養素(脂肪酸やその代謝産物)によって活性化され、活性化されたPPARαはがん促進性に働くAktやc-Mycの作用を阻害する作用がある。したがって、PPARαは、食事や医薬品による抗がん作用のターゲット分子の候補として注目されている。
PPARαはミトコンドリアでの脂肪酸の酸化(分解)とケトン体産生を刺激し、同時にグルコースとグルタミンの消費を減少させることによって、がん細胞の代謝上の弱点を攻めることができる。
PPARαの活性は絶食(fasting)によって亢進し、この作用はカロリー制限したケトン食の効果とも共通する。
カロリー制限したケトン食はNAD+/NADH比を上昇させ、ATP/AMP比を低下させる。
NAD+/NADH比の上昇は脱アセチル化酵素のSIRT1活性を高め、ATP/AMP比の低下はAMP依存性プロテインキナーゼ(AMPK)活性を亢進する。
SIRT1とAMPKは2つとも、PGC-1α(peroxisome proliferator activated receptor gamma 1 α coactivator)を介するメカニズムで、脂肪酸酸化を促進し、解糖系を阻害し、タンパク質と核酸と脂肪酸の合成を抑制する。
PGC-1αはPPARαと共同して作用し、様々な脳腫瘍で治療効果が報告されているカロリー制限とケトン食の抗がん作用に関与している。
以上のことから、PPARαの活性化はSIRT1とAMPKとPGC-1αの相互作用によって新規で低毒性のがん治療法となり、通常のがん治療の補完となる可能性がある。
PPARαのアゴニストは、がん細胞のミトコンドリアの代謝に作用して、がん細胞の増殖を抑えることができるという論文です。
カロリー制限したケトン食にPPARαアゴニストの併用で抗腫瘍効果が高まることが示されています。
PPARαは飢餓時の脂肪動員に働き、ミトコンドリアとペルオキシソームでの脂肪酸のβ酸化とω酸化とケトン体産生を活性化します。同時に解糖系と脂肪酸合成を阻害します。つまり、このような作用に関係する遺伝子の発現を制御しています。
したがって、ケトン食を実施するときPPARαのアゴニストの併用は抗腫瘍効果を高めることになります。(中鎖脂肪酸や長鎖脂肪酸やDHAやEPAはPPARαのアゴニストになります)
ある疫学研究でフィブラート服用でがん死亡率が低下することが示されています。
フェノフィブラートはカンナビノイド受容体にも作用して薬効を示す作用が報告され、カンナビノイドによる神経細胞保護作用の一部はPPARαによる核内転写活性を介することが報告されています。(437話参照)
がん治療の効果増強あるいは再発予防の目的でPPARαアゴニストやメトホルミンの服用を併用することは有用性のエビデンスがあると言えます。
【複数の核内受容体を活性化すると相乗効果が得られる】
PPARの標的遺伝子の発現の亢進するためには、レチノイドX受容体(RXR)の活性化も必要です。PPARのリガンドとRXRのリガンドのレチノイドの併用が相乗効果を示すことは、その作用メカニズムから理論的には当たり前ですが、PPARのリガンド(αもγも)とレチノイドの相乗効果を示す実験結果は多数報告されています。
RXRの活性化には、にきびの治療薬のイソトレチノイン(13cis-レチノイン酸)が利用できます。イソトレチノインは体内でオールトランスレチノイン酸(ATRA)に変換され、ATRAは9cis-レチノイン酸に変化してRXRを活性化します。
さらに、ビタミンD受容体がRXRとヘテロダイマーを形成して細胞の分化や増殖の制御に作用することが明らかになっています。ビタミンDの抗腫瘍効果については、最近多くの論文で報告されています。
がん研究の分野では、レチノイドやビタミンAを使ったがん細胞の分化誘導の研究は30年以上前から注目されています。しかし、培養がん細胞や動物実験では分化誘導作用が認められても、人間の腫瘍では有効性は証明できませんでした。
その当時は遺伝子のエピジェネティクス(ヒストンアセチル化による転写活性化など)や核内受容体の存在など知られていませんでした。
近年の研究によって核内受容体のリガンドによる活性化のメカニズムが明らかになり、その知識を十分に理解すれば、がん細胞の分化誘導療法も有効性と実用性を高めることができます。
つまり、ヒストンのアセチル化に、レチノイド、ビタミンD、PPARのリガンド(フィブラート製剤など)の併用は効果が期待できるかもしれません。
PPARαを活性化するフィブラートも、RXRを活性化するレチノイドも、ビタミンDも安価で、副作用も少ないので、このような分化誘導療法は試してみる価値はあると思います。
メトロノミック・ケモテラピーにレチノイド、ビタミンD、フェノフィブラートなどを併用した研究が報告されています。
Metronomic chemotherapy with the COMBAT regimen in advanced pediatric malignancies: a multicenter experience.(進行した小児がんにおけるCOMBAT療法によるメトロノミック化学療法:多施設研究)Oncology. 82(5): 249-260, 2012年
【要旨】
研究の背景:再発を繰り返す治療抵抗性の悪性腫瘍の小児患者の予後は極めて不良であり、新規で有効な治療法の開発が望まれている。有望な治療法の一つがメトロノミック化学療法(metronomic chemotherapy)である。欧州の小児疾患センターの3施設において進行した固形がんの小児患者74例を対象に行ったメトロノミック化学療法の結果を報告する。
方法:COMBAT療法はCombined Oral Metronomic Biodifferentiating Antiangiogenic Treatment(がん細胞の分化誘導作用と血管新生阻害作用のある薬剤を組み合わせた低用量頻回投与療法)の略で、テモゾロマイド(temozolomide)、エトポシド(エトポシド)、セレコキシブ(celecoxib)、ビタミンD、フェノフィブラート(fenofibrate)、レチノイン酸(retinoic acid)を組み合わせた治療法で、それぞれ低用量で毎日投与を行う治療法である。患者は2004年から2010年の間に募集した。
結果:2年生存率は43.1%であり、生存期間の中央値は15.4ヶ月(1.3~69.9ヶ月)であった。74例のうち50例(68%)は死亡し、24例は生存している。この24例のうち6例(8%)は病状が進行しており(progressive disease)、7例(9%)は病状安定か部分奏功(stable disease/partial response)であり、11例(15%)は完全奏功(complete response)であった。奏功するまでの平均期間は6ヶ月であった。 治療開始前にX線検査で腫瘍の大きさを測定できた62例のうち25例(40%)で、腫瘍縮小や病状安定の所見を認めた。この25例中14例では6ヶ月以内に臨床的な改善を認めた。 副作用は軽度で外来通院にて治療が可能であった。グレード2以上の非血液的毒性の発症に関しては、グレード3の肝障害を8例に認め、グレード3の口唇炎が16例に認められた。
結論:COMBAT療法は再発性/治療抵抗性の悪性腫瘍の小児患者に対して、毒性が低く、十分に実施可能で有効な治療法である。
この研究では、メトロノミック・ケモテラピー(低用量のテモゾロマイド、エトポシド)にシクロオキシゲナーゼ-2阻害剤のセレコキシブ、分化誘導剤のビタミンD、レチノイン酸、フェノフィブラートを併用しています。 ビタミンDとレチノイン酸とフェノフィブラートは核内受容体を介して細胞分化を誘導する組合せです。セレコキシブ(商品目:セレコックス)はCOX-2阻害作用によってがん細胞の増殖を抑え、抗腫瘍免疫を活性化する作用があります。
メトロノミック・ケモテラピーは抗がん剤の1回の投与量を少なくして、頻回に投与する抗がん剤治療です。経口の抗がん剤を通常より少ない量で毎日服用するような治療法です。 副作用は少なく、腫瘍血管の増生阻害や抗腫瘍免疫の活性化などによってがん組織の増大を阻止し、長期的ながん縮小あるいはがんとの共存を目指す治療法です。
低用量抗がん剤投与によるメトロノミック・ケモテラピーと、ビタミンDとレチノイン酸とフェノフィブラートによる細胞分化を誘導する組合せは試してみる価値はあると思います。
| « 437) フェノフ... | 439)ニューロ... » |



