図:真核細胞には様々な細胞内小器官が存在し、細胞内機能が分担されている。ペルオキシソームは、物質を酸化する様々な酸化酵素と、酸化反応によって生じる過酸化水素を消去するカタラーゼが多く存在する。
【糖や脂質の代謝に関与するペルオキシソーム増殖因子活性化受容体】
ペルオキシソーム増殖因子あるいはペルオキシソーム増殖剤と呼ばれるペルオキシソームを増やす作用がある物質が古くから多数見つかっています。この中には、食事中の脂肪酸や、プラスチック可塑剤のフタル酸エステル類、除草剤のようなものも含まれています。
これらの物質がどのようにしてペルオキシソームを増やすのかという研究の結果、ペルオキシソーム増殖因子が結合する核内受容体が見つかり、「ペルオキシソーム増殖因子で活性化される受容体」という意味で「ペルオキシソーム増殖因子活性化受容体(Peroxisome proliferator-activated receptor:PPAR)」という長い名前になっています。
このようにPPARは細胞内のペルオキシソームの増生を誘導する受容体として発見されましたが、その後の研究で、糖質や脂質やタンパク質などの物質代謝や細胞分化に密接に関連している転写因子群であることが明らかになりました。脂質や糖質の代謝を促進するので、PPARを活性化する物質は高脂血症や糖尿病の治療薬として臨床で使用されています。
歴史的には、フィブラートのような抗高脂血症薬やインスリン抵抗性を改善するチアゾリジンジオン系の抗糖尿病薬は作用機序が不明なまま臨床的有効性が認められて使用されていましたが、これらの薬が細胞のペルオキシソームの数を増やすことが見つかり、その後にPPARを活性化することによって薬効を示すことが明らかになりました。現在でもPPARをターゲットにして新薬の開発を進められています。
さらに、PPARの活性化はがん細胞の増殖抑制やアポトーシスや分化の誘導作用などの抗がん作用を示すことが明らかになっています。PPARの活性化剤は糖尿病や高脂血症の治療薬として多くの種類が販売されているので、これらをがんの治療に応用する研究が行われています。
【ペルオキシソーム増殖因子活性化受容体は核内受容体スーパーファミリーの一種】
ペルオキシソーム増殖因子活性化受容体(PPAR)はレチノイン酸受容体(RAR)やレチノイドX受容体(RXR)などと同じ核内受容体スーパーファミリーに属する核内受容体の一種です。
グルココルチコイドやエストロゲンやアンドロゲンのようなホルモンや、ビタミンAやビタミンDのような脂溶性ビタミンは、遺伝子発現を制御することによって生体機能を調節しています。
このような機能は、それぞれに特異的に反応する核内受容体と、標的遺伝子のDNAにそれらの受容体が結合する部位が存在するという仕組みで達成されます。
48種類の核内受容体の存在が知られていますが、その中にはリガンド(受容体に特異的に結合して活性化する物質)がまだ明らかになっていないものも多数あります。食事から摂取する様々な成分や代謝産物や胆汁酸などがリガンドになる場合もあります。
栄養素として食事から摂取された脂質は、エネルギー産生や細胞膜の材料になるのが主な役割ですが、脂肪酸が代謝されてできる様々な物質が、遺伝子発現にも作用することが明らかになっています。
このような脂質代謝産物による遺伝子発現の調節に関わっている核内受容体としてペルオキシソーム増殖因子活性化受容体(Peroxisome proliferator-activated receptors:PPARs)が知られています。
下図にPPAR の活性化と遺伝子転写調節機構を示しています。
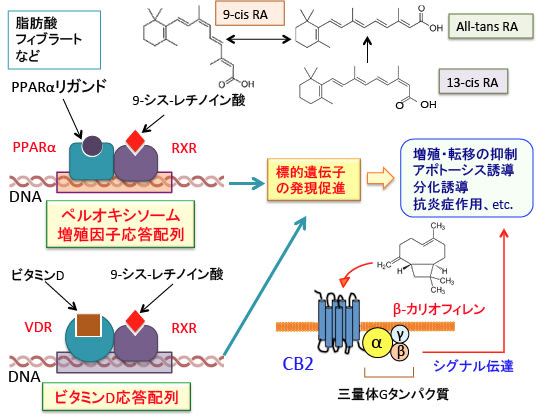
PPARはレチノイドX受容体(RXR)とヘテロダイマー(ヘテロ二量体)を形成して遺伝子のペルオキシソーム増殖因子応答配列に結合します。リガンドが結合していない状態ではPPAR-RXRヘテロダイマーに核内受容体コリプレッサーが結合して転写活性が抑制されています。コリプレッサー(co-repressor)というのは、核内受容体に結合してその転写活性を抑制する因子です。
PPARとRXRにそれぞれのリガンドが結合するとPPAR-RXRヘテロダイマーからコリプレッサーが分離し、転写活性を促進するコアクチベーター(co-activator)が結合します。コアクチベーターはヒストンアセチル化を促進する作用があり、DNAとヒストンの結合を緩めて、他の転写因子やRNAポリメラーゼが標的遺伝子のプロモーター領域に結合しやすくなり、転写が開始されます。このようにPPAR の活性化から遺伝子発現まで様々な因子が複雑に関与しています。
図:ペルオキシソーム増殖因子活性化受容体(PPARP)とレチノイドX受容体(RXR)はヘテロダイマー(PPAR-RXR)を形成して、コリプレッサーが結合してDNA結合は阻止されている。それぞれの受容体にリガンドが結合すると受容体の構造に変化が生じてコリプレッサーが離れ、コアクチベーターが結合して、標的遺伝子のDNAのペルオキシソーム増殖因子応答配列(AGGTCAの塩基配列が1塩基をはさんで同方向に並んだAGGTCA-n-AGGTCA のダイレクトリピート構造)に結合して転写を亢進する。
【PPARには3つのサブタイプがある】
このPPARには3種類のサブタイプがあります。主に肝臓や心臓や腎臓や消化管の細胞にあるアルファ型(PPARα)と、脂肪細胞に主にみられるガンマ型(PPARγ)、多くの組織で発現し脂肪酸燃焼とインスリン感受性を高めるデルタ型(PPARδ)です。
PPARαは大量のATPを必要とし脂肪酸酸化の盛んな臓器(肝臓・心臓・腎臓・消化管など)に多く存在します。PPARαは脂肪酸のβ酸化や細胞内外での脂質輸送に関与する多くの遺伝子の発現を誘導するので、高脂血症改善薬のターゲットになっており、フェノフィブラート(Fenofibrate)、ベザフィブラート(Bezafibrate)、クロフィブラート(Clofibrate)などのいわゆるフィブラート系の薬剤が高脂血症治療薬として使用されています。ベザフィブラートはPPARαだけでなくPPARγやPPARδの活性化作用もありPPAPの汎アゴニスト(pan-agonist)と呼ばれています。
また、PPARαは炎症を促進するNF-κB(nuclear factor-kappa B)の活性を抑制し、TNF-α(tumor necrosis factor-α )などの炎症性サイトカインの発現を抑制する作用も報告されています。
PPARγは脂肪組織でインスリン感受性を高めるアディポネクチン遺伝子の発現を促進し、インスリン抵抗性を高める炎症性サイトカインのTNF-αの産生を抑制する作用があります。これらのインスリン抵抗性を改善する作用によって糖尿病を治療する効果を発揮します。薬としてはピオグリタゾンが使用されています。
PPARδは多くの組織で発現し、リノール酸やリノレン酸やアラキドン酸などの多価不飽和脂肪酸やアラキドン酸由来物質などが内因性のリガンドとなっています。インスリン抵抗性の改善や脂肪酸のβ酸化の亢進などの作用があります。PPARのpan-agonist(一連の受容体を活性化する特異性の低い刺激剤)であるベザフィブラートはPPARδの活性作用があります。
以上のようにPPARは物質代謝やエネルギー産生に関与しており、摂食後はPPAR-γが作用して効率的に体内に脂肪を蓄え、空腹時はPPAR-αの作用により脂肪がエネルギーに変換され消費されます。これらのPPARの作用に異常が起こると糖尿病や高脂血症や肥満を引き起こします。一般的に、糖尿病はPPARγ、高脂血症はPPARα、肥満はPPARδが深く関与しています。
また、糖尿病や高脂血症や動脈硬化を予防する効果が指摘されている大豆(イソフラボン)や赤ワイン(レスベラトロール)や青魚(ドコサヘキサエン酸やエイコサペンタエン酸)の作用の一部はPPARへの効果が関与している可能性も指摘されています。
大麻に含まれるカンナビノイドの作用もPPARが関与する場合があります。
【フィブラート系薬剤は様々なメカニズムで抗がん作用を発揮する】
フィブラート(fibrate)系薬剤は、肝細胞内のペルオキシソーム増殖因子活性化受容体α(Peroxisome Proliferator Activated Receptor α:略してPPARα)という核内受容体に結合してPPARαを活性化することによって、アポA-、A-の産生増加、アポC-の産生低下、脂肪酸のβ酸化亢進、中性脂肪産生減少などの作用が発現して、コレステロールや中性脂肪を低下させる薬です。フェノフィブラート(Fenofibrate)、ベザフィブラート(Bezafibrate)、クロフィブラート(Clofibrate)などのいわゆるフィブラート系の薬剤が高脂血症治療薬として使用されています。
さらに、PPARαの活性化はがん細胞の増殖を抑制したりアポトーシスを誘導するタンパク質の発現を亢進する作用などの抗がん作用が報告されています。
例えば、PPARαの活性化はペルオキシソームを増やして脂肪酸のβ酸化を亢進し、グルコースの解糖系を抑制する働きがあるので、がん細胞のワールブルグ効果(酸素がある条件でも、がん細胞はグルコースの嫌気性解糖系でエネルギーを産生していること)を阻害して、がん細胞の増殖を抑える可能性が指摘されています。
さらに、インスリン様成長因子-1のシグナル伝達系(PI3K/Akt)を抑制する作用や、抗炎症作用や血管新生阻害作用などの抗腫瘍効果が報告されています。
フィブラート系薬剤の抗腫瘍効果には、本来のペルオキシソーム増殖因子活性化受容体(PPARα)を介した機序と、それとは関係ない機序(PPARα非依存性)が知られています。
例えば、フェノフィブラートは転写因子のFoxO3Aを活性化してBimの発現を誘導してグリオブラストーマ細胞の増殖抑制とアポトーシス誘導を引き起こすことが、報告されています。
Bimはがん細胞のミトコンドリアに作用してアポトーシスを誘導するタンパク質で、転写因子のFoxO3Aによって発現が誘導されます。(
326話参照)
PPARαとPPARγとPPARδを活性化する汎アゴニスト(pan-agonist)のベザフィブラートが肺がん治療に有効であるという論文があります。
【PPARαアゴニストは肺がんの予防や治療に役立つ】
PPARα activation can help prevent and treat non-small cell lung cancer.(PPARαの活性化は非小細胞性肺がんの予防と治療に役立つ)Cancer Res. 74(2):621-31. 2014年
【要旨】
肺がんに対する抗がん剤治療は有効性が低くかつ副作用も強いので、外科的切除の対象にならない非小細胞性肺がんの予後は極めて悪い。したがって、肺がんに対する有効性と安全性の高い治療法の開発が求められている。
この研究では、シトクロム P-450依存性アラキドン酸エポキシゲナーゼ(cytochrome P450 arachidonic acid epoxygenases)によって産生される血管新生促進作用のあるエポキシエイコサトリエン酸(epoxyeicosatrienoic acids)が、非小細胞性肺がんの増殖や進展を抑制する新規で安全な治療法のターゲットになることを示した。
ペルオキシソーム増殖因子活性化受容体α(PPARα)のリガンドであるベザフィブラート(Bezafibrate)とWyeth-14,643によってPPARαを活性化すると、シトクロム P-450依存性アラキドン酸エポキシゲナーゼ(Cyp2c44)の発現量は減少し、原発性と転移性の両方の非小細胞性肺がんの増殖や血管新生、血管内皮細胞のCyp2c44の発現、エポキシエイコサトリエン酸の血中濃度が減少することを、KRasLA2マウス肺がんモデルとヒト非小細胞性肺がんの同所移植腫瘍の実験モデルで示した。
PPARαのリガンドの抗腫瘍効果は投与が原発腫瘍の発生の前からスタートした場合と発生後に投与をスタートした場合のどちらでも認められ、PPARαリガンドの投与を中止したあとも継続した。つまり、PPARαリガンドの効果は長く続くことが示唆された。
これらの結果は、シトクロム P-450依存性アラキドン酸エポキシゲナーゼの発現や活性を抑制する治療法が、非小細胞性肺がんの治療に有効で安全性の高い新規の治療法となる可能性を示唆している。
さらに、ベザフィブラートは高脂血症の治療薬として臨床的に使用され比較的安全性の高いことが知られているので、我々の研究結果は、ヒトの肺がん治療におけるPPARリガンドの有効性を検討する臨床試験を実施する必要性を示している。
アラキドン酸は代謝されて様々な生理活性物質を産生し、生理機能の調節に重要な働きを担っています。
アラキドン酸の代謝にはシクロオキシゲナーゼ(cyclooxygenase)とリポキシゲナーゼ(lipoxygenase)とチトクローム450依存性エポキシゲナーゼ(cytochrome P-450 dependent epoxygenase)の3系統が主な代謝経路になっています。それぞれの代謝産物ががん細胞の増殖や血管新生や転移などに関与しています。
例えば、シクロオキシゲナーゼで産生されるプロスタグランジンE2ががん細胞の増殖や転移や血管新生を促進するので、シクロオキシゲナーゼの阻害剤である非ステロイド性抗炎症剤(アスピリンやセレコックスなど)には抗腫瘍作用があります。
この論文では、シトクロームP-450依存性エポキシゲナーゼによって産生されるエポキシエイコサトリエン酸の産生を抑制すると、非小細胞性肺がんの増殖や転移や血管新生の抑制に有効であることを報告しています。そして、シトクロームP-450依存性エポキシゲナーゼの発現が、PPARαの活性化によって抑制されることを示しています。したがって、PPARαを活性化するベザフィブラートが肺がんの治療に有効である可能性を示唆しています。
エポキシエイコサトリエン酸は、血管拡張、血管新生、動脈硬化抑制、血圧低下、抗炎症などの作用や、心臓の虚血再還流障害を抑制する効果などが報告され、循環器領域では有益なアラキドン酸代謝産物として認識されています。
しかし、がん治療の領域では、エポキシエイコサトリエン酸はがんの進行を促進する作用が明らかになっており、エポキシエイコサトリエン酸の産生を抑制することががん治療に役立つと考えられています。
アラキドン酸からエポキシゲナーゼによって産生されるエポキシエイコサトリエン酸ががんを促進するのに対して、ドコサヘキサエン酸(DHA)からエポキシゲナーゼによって産生されるエポキシドコサペンタエン酸(epoxydocosapentaenoic acids)はがん細胞の増殖を抑制する作用があることが報告されています。
Epoxy metabolites of docosahexaenoic acid (DHA) inhibit angiogenesis, tumor growth, and metastasis.(ドコサヘキサエン酸のエポキシ代謝産物は血管新生と腫瘍増大と転移を阻害する)Proc Natl Acad Sci U S A. 2013 Apr 16;110(16):6530-5.
したがって、魚の脂に多く含まれるDHAの抗腫瘍効果はエポキシゲナーゼの代謝産物でも証明されており、ω3系不飽和脂肪酸を多く摂取することががん治療に有用であることを支持しています。(
351話参照)
【PPARとカンナビノイド受容体の相互作用】
カンナビノイド受容体は大麻草に含まれる精神変容作用の原因成分である
Δ9-テトラヒドロカンナビノールなどのカンナビノイドが結合する細胞膜受容体として発見され、その後、内因性カンアビノイドとしてアナンダミドなどが見つかり、この内因性カンナビノイド・システムが多彩な生理機能の調節に関わっていることが明らかになっています(
434話参照)。
最近の研究で、核内受容体のペルオキシソーム増殖因子活性化受容体(PPAR)と細胞膜受容体(Gタンパク質共役型受容体)であるカンナビノイド受容体の相互作用が明らかになっています。以下のような論文が最近報告されています。
A potential role for cannabinoid receptors in the therapeutic action of fenofibrate. (フェノフィブラートの薬効メカニズムにおけるカンナビノイド受容体の関与)FASEB J. 2015 Apr;29(4):1446-55.
【要旨】
カンナビノイドはペルオキシソーム増殖因子活性化受容体(Peroxisome proliferator-activated receptors:PPARs)を介する作用機序が報告されている。そこで、カンナビノイド受容体に対するPPARアゴニストの作用を検討した。
遺伝子組換えによって作成してヒトのカンナビノイド受容体のタイプ1(CB1)とタイプ2(CB2)、さらにモルモットの小腸を用い、CB1とCB2の完全アゴニストであるCP55940を陽性対照(ポジティブ・コントロール)にして、アイソトープで標識したリガンドを用いた結合活性の検討やアゴニスト機能の検討を行った。
PPAR-αのアゴニストであるフェノフィブラート(fenofibrate)はμM以下のレベルでCB1とCB2の両方に結合活性を示した(pKi CB1, 6.3 ± 0.1; CB2, 7.7 ± 0.1)。
機能的にはフェノフィブラートはCB2受容体にアゴニストとして作用した(pEC50, 7.7 ± 0.1)。CB1に対しては部分アゴニストとして作用したが、高濃度ではアゴニストとしての作用は減弱し、ベル型の濃度-作用曲線を示した。
高濃度のフェノフィブラートはCB1受容体に対するCP55940の結合を阻害した。
分離したモルモット小腸を用いた実験で、電気刺激で誘導した筋収縮をCB1受容体を介するメカニズムで減弱した。
以上のようにフェノフィブラートは新しいクラスのカンナビノイド受容体のリガンドであり、アロステリック修飾薬(Allosteric modulator)であることが明らかになった。
したがって、フェノフィブラートはPPARへの作用に加えて、カンナビノイド受容体にも作用して薬効を示す可能性が示唆された。
この論文の要約にも記述されているように、カンナビノイドがカンナビノイド受容体だけでなくペルオキシソーム増殖因子活性化受容体(PPAR)を介する作用機序を有することは多くの報告があります。以下のような論文があります。
Cannabinoid activation of PPAR alpha; a novel neuroprotective mechanism.(カンナビノイドによるPPARαの活性化:神経保護作用の新たなメカニズム)Br J Pharmacol. 152(5):734-43. 2007年
【要旨】
研究の背景と目的:カンナビノイドによるカンナビノイド受容体CB1の活性化は神経傷害に対して保護作用を示すが、ある種のカンナビノイドはペルオキシソーム増殖因子活性化受容体(Peroxisome proliferator-activated receptors:PPAR)のリガンド(受容体に結合して活性化する物質)であることが報告されており、神経保護作用の別の作用機序となる可能性が指摘されている。
そこで、一連のカンナビノイドとN-oleoylethanolamine(内因性カンナビノイド様物質)についてPPARαの活性化作用と神経保護作用について検討した。
実験方法:PPARα受容体への結合活性は細胞フリーの実験系で、PPARαによる遺伝子転写の活性化作用はPPARα遺伝子を導入したHeLa細胞を用いて行った。
生体内におけるPPARαの活性化は、マウスを用いた脂肪動員(fat mobilization)と遺伝子転写活性によって検討した。
生体における神経保護作用は、通常のマウスとPPARα遺伝子欠損マウスを用いて検討した。
主な結果:内因性カンナビノイド様物質のN-oleoylethanolamine、アナンダミド(anandamide)、noladin エステル(2-Arachidonyl glyceryl ether)、Virodhamine (O-arachidonoyl ethanolamine)はいずれも、PPARαのリガンド結合ドメインに結合し、PPARαによる遺伝子転写を亢進した。
CB1とCB2の高親和性アゴニストの合成カンナビノイドのWIN55212-2は、PPARαアゴニストのフェノフィブラートと同じレベルの親和性でPPARαに結合し、PPARα依存性の遺伝子転写を活性化した。
植物カンナビノイドのデルタ9-テトラヒドロカンナビノールはPPARαのリガンド活性は認めなかった。
N-oleoylethanolamineとWIN55212-2はin vivoで脂肪分解を誘導した。
マウスを使って中脳動脈を閉塞して脳梗塞を起こす実験モデルで、N-oleoylethanolamineを前投与すると梗塞の範囲を減少させたが、PPARα遺伝子を欠損させたマウスでは脳梗塞の抑制は認めなかった。
N-oleoylethanolamineの投与はマウスの大脳皮質におけるNF-κB阻害タンパク質のIκBの発現量を増やし、NF-κBで転写が誘導されるシクロオキシゲナーゼ-2(COX-2)の発現は阻害された。
結論:以上の結果から、様々な構造の一連のカンナビノイド物質はPPARαを活性化する作用を有することが示された。そして、これらのカンナビノイドによる神経細胞保護作用の一部はPPARαによる核内転写活性を介することが示唆された。
カンナビノイド受容体タイプ2(CB2)の選択的アゴニストである
β-カリオフィレン(トランス-カリオフィレン)がPPARαのアゴニスト作用を有することが明らかになっています。(β-カリオフィレンのCB2アゴニスト作用については
434話参照)
trans-Caryophyllene is a natural agonistic ligand for peroxisome proliferator-activated receptor-α.(トランス-カリオフィレンはペルオキシソーム増殖因子活性化受容体αの天然リガンドである)Bioorg Med Chem Lett. 2014 Jul 15;24(14):3168-74.
トランス・カリオフィレンはβ-カリオフィレンと同じです。トランス・カリオフィレン(β-カリオフィレン)は多くの植物性精油に含まれるセスキテルペンでカンナビノイド受容体タイプ2(CB2)の選択的アゴニストですが、この論文では、さらにPPARαにも結合して活性化し、細胞の脂質代謝を亢進することを報告しています。
以上のような実験結果から、カンナビノイド受容体とPPARαを活性化する目的でフェノフィブラートとβ-カリオフィレンの併用は効果が期待できるかもしれません。
また、 フェノフィブラートにCB1とCB2受容体のアゴニスト活性があるということは、カンナビノイド受容体と相互作用する他の物質(例えばヘンプオイルに含まれるカンナビジオールやβカリオフィレンなど)と併用すると、大麻と同じような作用がでるのかもしれません。
CB1は抗ストレス作用や抗不安作用や抗うつ作用がありますが、大麻を吸えば処罰されるので、Hemp oilにCB1アゴニストを併用すれば、大麻と同じような精神作用が期待できるかもしれません。
つまり、グタグタと解説してきましたが、要は、大麻取締法で禁止されている大麻(マリファナ)を使わなくても、合法的な薬や食品成分の組合せで「ハイ」になれる可能性があるということです。