がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
481)認知症とケトン体(その1):ケトン体サプリメント
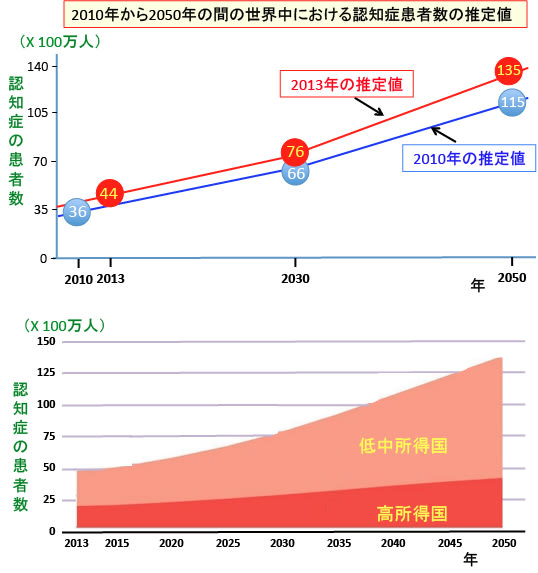
図:(上)2013年の世界中の認知症患者の人数は推定4400万人(2010年の推計は3600万人)であり、2030年には7600万人(同推計6600万人)、2050年には1億3500万人(同推計1億1500万人)に達する見込みだと報告されている。3年前(2010年)の予想より17%も増える可能性が指摘されている。
(下)今後は低中所得国での急速な増加が予測され、2050年には低中所得国の認知症患者が全体の70%以上を占めるようになる。
出典:国際アルツハイマー病協会(Alzheimer's Disease International)
481)認知症とケトン体(その1):ケトン体サプリメント
【認知症が予測以上のペースで増えている】
認知症の主な原因となっているアルツハイマー病が急激に増加し、家族や社会への負担が大きいため、社会問題化しています。
問題を深刻にしている理由の一つは、有効な治療法が無いことです。
したがって、発症を予防することが、公衆衛生における最大の優先事項として認識されています。
しかし、現実的には、アルツハイマー型認知症は急速に増えています。有効な予防法が見つかっていないことを示唆しています。
認知症の60から70%がアルツハイマー型認知症です。
国際アルツハイマー病協会(Alzheimer’s Disease International)は2013年12月に公表したポリシーブリーフ(政策提言)で、2013年の世界中の認知症患者の人数は推定4400万人(2010年の推計は3600万人)であり、2030年には7600万人(同推計6600万人)、2050年には1億3500万人(同推計1億1500万人)に達する見込みだと報告しています(トップの図参照)。
2010年に認知症による社会の費用負担は世界中で6040億ドル(現在のレートで約70兆円)で、これはがんと循環器疾患を合わせた額より大きいと言われています。
【認知症が予防できる根拠】
「認知」というのは、理解や判断や論理といった知的活動を総称する用語です。
「認知症」というのは単一の病気ではなく、共通の症状(進行性の認知機能の低下と、それによる日常生活の混乱)を呈する疾患群をまとめた呼称です。
認知症では物忘れにみられるような記憶の障害のほか、判断・計算・理解・学習・思考・言語などを含む脳の高次の機能に障害がみられます。
認知症は様々な疾患で発症します。
認知症を引き起こす原因として最も多いのがアルツハイマー病(アルツハイマー型認知症)で、その次が脳梗塞や脳出血などの脳血管障害の後遺症(血管性認知症)です。
アルツハイマー型認知症と脳血管性認知症はしばしば混在しています。つまり、共通のリスク要因と保護要因が存在することを示唆しています。
アルツハイマー病と血管性認知症には、遺伝性要因や血管病変や代謝異常や生活習慣など様々な要因が絡んでいます。長い前臨床期間(無症状期間)があることから、それらの要因をターゲットにして早い時期から予防に取り組むことができます。
物忘れに気づく前から、日頃から、認知症にならないように気をつけることが最も重要と言えます。
アルツハイマー病のリスク要因として、糖尿病、中年期の高血圧、中年期の肥満、運動不足、抑うつ、喫煙、低学歴が知られています。
これは、生活習慣と食生活の改善でリスクをかなり低減できることを示しています。
保護的に作用するものとして、オメガ3系不飽和脂肪酸、抗酸化剤、ビタミン、地中海式料理などが知られています。
精神・心理的要因としては、孤独、抑うつ、社会的孤立、精神的ストレスは認知症のリスクを高めます。
一方、高学歴、運動、社交的活動は認知症を防ぐ効果があります。
【認知症は様々な原因で発症する】
老化に伴って物覚えが悪くなるということは多くの高齢者が経験しています。これは脳の神経細胞が加齢とともに死滅し、減少するからです。老眼や難聴(聴力低下)と同じような老化に伴う生理的な機能低下です。
病的な原因によって記憶力や知能の低下する病気を「認知症」と言います。いったん正常に発達した知能が、脳の後天的な障害によって脳の働きが低下して、記憶や知能に障害をきたす病気です。
認知症は2004年までは「痴呆症」と呼ばれていましたが、この用語には差別的な意味あいがあるということで、2004年12月に認知症と改められています。
認知症は単一の病気ではなく、共通の症状を呈する疾患群をまとめた呼称です。
認知症を引き起こす原因として最も多いのがアルツハイマー病(アルツハイマー型認知症)です。その他、脳梗塞や脳出血などの脳血管障害の後遺症(血管性認知症)、転落事故や交通事故などによる脳挫傷の後遺症(頭部外傷後認知症)、パーキンソン病やハンチントン病など原因不明で徐々に神経細胞が死滅していく脳変性疾患、長期の大量飲酒(アルコール性認知症)、ヘルベス脳炎やインフルエンザ脳症など脳炎後認知症など、様々な原因によって認知症は発症します。
認知症の中心を占めるアルツハイマー型認知症は、原因は不明で、徐々に神経細胞が死滅していく病気です。20〜30歳代で発病する「遺伝性(家族性)アルツハイマー病」、40〜60歳代前半で発病する「若年性アルツハイマー型認知症」、それ以降に発病する高齢期のアルツハイマー型認知症があります。遺伝子異常については、遺伝性アルツハイマー病の原因遺伝子が明確になっていますが、他のリスク遺伝子も研究されています。
人口の高齢化とともに認知症の患者は年々増え続けており、社会的な問題にもなっています。
日本における最近の調査では、65歳以上の15%が認知症と推計されています。2015年の段階で国内の認知症高齢者は520万人で、10年後の2025年には700万人を超えると推定されています。
【認知症は生活上の混乱を引き起こす】
認知症は脳の働きが低下することによって様々な症状を呈します。
初期に現れるのは記銘力や記憶力の障害です。記銘力とは新しく体験したことを覚える能力で、記憶力は過去に体験したことを保持する能力です。
記銘力や記憶力が障害されると、約束を忘れる、買い物に行って店についたときに何を買うつもりだったか忘れている、財布などをどこにしまったかを忘れていつも探している、という症状として気づかれます。
さらに、今日は何月何日か、自分が住んでいる住所がわからないなど、自分が置かれた状態がわからない症状がみられます。これを「見当識障害」と言います。「見当識」とは自分の置かれた状況を認識する力です。
さらに病状が進むと、目でみたものを正しく理解できない(失認)、手順通りに物事を実行できない(失行)、言葉を理解できない、話せない(失語)という症状が出てきます。
失認と失行は頭頂葉が障害された場合に顕著になります。失認は「左右が判らない」、「日常用いている物品をみても、それが何かわからない」と言った症状です。
失行は運動障害がないにもかかわらず、行うべき動作や行為ができない状態です。「服を着ることができない」、「ネクタイが結べない」、「電話や自動販売機を使用できない」、「はさみやナイフや箸などの道具を使えなくなる」といった症状です。
左側頭葉は言語の意味を理解する役割を担うので、この部位の機能が低下すると、言葉を理解できなくなる「感覚性失語症」が起こります。
前頭葉は思考や理性的判断など高次の脳機能を担っているので、この部位の機能が低下すると性格(人柄)が変わり、身勝手な振る舞いが増え、社会的ルールを無視するようになり、無精になって家事や仕事をしなくなります。
これらの症状は脳の障害に起因するのので、認知症の基本症状(中核症状)と言います。
さらに、行動や心理状態に関連した症状もみられます。これらを認知症の周辺症状や問題行動と言います。
徘徊(あちこち歩き回る)、多動(一カ所にじっとしていられない)、妄想(お金や物を盗まれたと思いこむ)、幻覚(無い物が見える「幻視」、存在しない音や声が聞こえる「幻聴」)、睡眠障害、抑うつなどの症状です。そして末期には寝たきりになります。
このような認知機能の低下による症状と、それに伴う行動異常は、生活上の様々な混乱を引き起こし、この疾患特有の社会的問題を生み出します。たとえば、警察署では、徘徊高齢者の捜索や保護の仕事が増えているそうです。徘徊による事故も増えています。
認知症は進行すると仕事や日常生活に支障をきたすだけでなく、人格が崩壊し、人間としての尊厳が失われる点で非常に悲惨な病気です。認知症と診断されることは、本人だけでなく家族にとっても大きな精神的かつ経済的な負担になります。
アルツハイマー病やハンチントン病など認知症を引き起こす原因の多くで、まだ有効な治療法は確立していません。いくつかの薬は使用されていますが、症状の緩和や進行を遅らせる程度で、その効果には限界があります。開発中の薬は多くありますが、特効薬ができるのはかなり先のようです。
【認知症の増加が社会問題になっている】
超高齢社会を迎え、アルツハイマー病などの認知症が増加しています。認知症の治療や介護にかかる費用は、がんや心臓病や脳卒中よりも高いことが指摘されています。
認知症の場合、治療費や介護サービスの利用などによる直接費用の他に、家族などが無償で実施する介護にかかる費用(インフォーマルケアコスト)が大きいことも問題になっています。
医療費や介護費に加えて本人や家族の労働生産性損失などの費用も含んだ社会全体の費用を社会的費用と言います。この社会的費用は認知症がもっとも大きいと試算されています。
米国からの報告では、米国では認知症1人当たり年間,少なくとも4万1,689ドルの費用がかかっていると報告されています。(N Engl J Med. 368(14):1326-34.2013年)
この報告では、家族による無償介護が人件費として計算されており、家族による無償介護の費用が約半分を占めています。つまり、認知症は家族の労力負担が極めて大きい疾患と言えます。
2010年の米国では70歳以上の高齢者の14.7%が認知症で、認知症にかかる治療・介護の直接経費は1年間に1,090億ドルと試算されています。これは同年の心疾患の1020億ドルやがんの770億ドルよりも多い費用です。さらに認知症の場合、無償介護の人件費を含むと総額1,570億~2,150億ドルにのぼると試算されています。
日本でも、認知症にかかる社会的費用が慶應義塾大学医学部精神・神経科学教室と厚生労働科学研究の共同研究グループから試算されています。その報告によると2014年の日本における認知症の社会的費用は年間約14.5兆円と推定しています。
その内訳は、医療費が1.9兆円、介護費が6.4兆円、インフォーマルケアコスト(家族などが無償で実施する介護による費用)が6.2兆円となっています。
認知症患者一人あたりの家族が介護に費やす時間(インフォーマルケア時間)が週に24.97 時間、人件費などの費用(インフォーマルケアコスト)は1年間に382 万円と試算されています。
この社会的費用に加えて、介護に携わる家族の精神的負担を考慮すると、認知症は社会負担が極めて大きい疾患と言えます。
認知症の発症を予防することは、高齢化社会における医療において最優先の課題であり、医療費を抑制する最も重要なターゲットと言えます。また、認知症を予防することは家族のためであることを理解し、予防するための正しい知識を持って実践することが大切です。
【高血糖とインスリンは認知症の発生を増やす】
近年の認知症患者の増加は人口の高齢化だけによるものではないようです。人口構成の影響を排除した年齢調整した統計でも認知症の有病率は増加しています。
年齢調整というのは、基準となる集団の年齢構成(基準人口)に合わせて補正した値で、年齢調整した(同じ年齢構成と仮定して計算した)数値を比較することによって、高齢化などの年齢構成の変化の影響を取り除くことができます。
脳梗塞などの脳血管性の認知症は微増ですが、アルツハイマ−病が急増していることが指摘されています。例えば、1985年から2005年の間にアルツハイマー病の年齢調整有病率が3倍以上に増えているというデータがあります。
その理由として糖尿病の増加が最も関連していると言われています。糖尿病がアルツハイマー病の強い危険因子であることが明らかになっています。
糖尿病は1960年代くらいまでは極めて稀な病気でしたが、現在では5人に一人が糖尿病あるいは糖尿病予備軍と言われるくらいに増えています。つまり、糖質の多い食事自体がアルツハイマー病を増やしている可能性があるのです。
高血糖や糖尿病は様々なメカニズムで認知症の発症を促進します。高血糖/糖尿病は脳動脈硬化を進展させ、脳梗塞や潜在的脳虚血を引き起こして血管性認知症の原因になります。
グルコース(ブドウ糖)はタンパク質を糖化し、終末糖化産物(AGE)を増やし、酸化ストレスを高めて神経細胞にダメージを与えます。
さらに、高インスリン血症がアルツハイマー病発症に関わることが指摘されています。
アルツハイマー病は脳にアミロイドβといタンパク質が沈着して神経細胞を死滅させることで発症します。インスリンを分解する酵素がアミロイドβも分解する作用があるのですが、高インスリン血症になるとアミロイドβの分解が十分に行われなくなり、その結果、脳内のアミロイドβの沈着が促進され、神経細胞の傷害が進行すると考えられています。
インスリン分泌は糖尿病になる前の糖代謝異常の段階(糖尿病予備軍)で最も高くなります。つまり、糖尿病を含む糖代謝異常の状態は、脳にアミロイドβが沈着しやすい状態だと言えます。
したがって、食事からの糖質摂取を減らしてインスリン分泌を減らすだけでも、認知症の予防に役立つのです。
【認知症は食事や生活習慣で予防や治療できる】
身内に認知症がいる場合は、認知症を予防することを早めから積極的に実践することが大切です。
たとえば、魚の油に含まれるドコサヘキサエン酸(DHA)やエイコサペンタエン酸(EPA)、野菜や果物などビタミン・ミネラルやポリフェノールの多い食品の摂取は認知症の発症率を低下させることが知られています。逆に白米など糖質の多い食事は認知症の発症リスクを高めます。
地中海食はアルツハイマー型認知症の発症率を減らすことが報告されています。野菜や魚の多い食事がアルツハイマー型認知症の発症を減らすのです。
肥満や糖尿病やメタボリック症候群は動脈硬化を促進して脳血管障害の発症リスクを高めます。糖尿病やメタボリック症候群がアルツハイマー型認知症の発症率を高めることも報告されています。
肥満や糖尿病やメタボリック症候群はカロリー制限や糖質制限など適切な食事で改善できます。ケトン食はこれらの疾患を短期間に改善することが多くの臨床試験で確認されています。
福岡県久山町の住民を対象に行われている疫学調査の「久山町研究」でも、糖尿病が脳血管性とアルツハイマー型の両方の認知症の危険因子であることが示され、最近の認知症の急増は糖尿病患者が増えていることが要因になっていると指摘しています。
久山町の追跡調査では、牛乳・乳製品や大豆製品・豆腐、野菜などを多く食べ、ご飯や酒類が少ない食事パターンが脳血管性とアルツハイマー型の両方の認知症の発症リスクを半分程度に低下させることが明らかになっています。また、運動も認知症の発症リスクを低下させます。
外国では、ケトン体を増やすケトン食が、アルツハイマー病や脳血管障害やパーキンソン病やハンチントン病など神経変性疾患の改善に有効であることを示す研究結果が多数報告されています。ケトン食は糖尿病やメタボリック症候群の病状を顕著に改善する効果がありますが、ケトン体自体に神経細胞の働きを高めることが報告されています。
【ケトン食はアルツハイマー病の治療に有効】
ケトン体は脳神経のエネルギー代謝を良くし、活性酸素や炎症から神経細胞を保護する作用があるので、ケトン食にアルツハイマー病やパーキンソン病や脳卒中等を原因とする脳神経細胞障害の進行抑制に利用されています。ケトン食が認知障害の改善に有効であることが多くの臨床試験で示されています。
例えば、軽度の認知障害のある23人(男性10人、女性13人:平均年齢70.1±6.2)を対象に、高糖質食と低糖質食の2群に分けて6週間の食事療法を行った研究があります。(Neurobiol Aging 33(2):425.e19 – 425.e27, 2012年)
実験の結果、低糖質食のグループでは、言語記憶能力の統計的有意な改善を認め、さらに、体重、腹囲、空腹時血糖、空腹時インスリン値の統計的有意な減少が認められました。
記憶力の変化は、摂取カロリーやインスリン値や体重とは相関を認めませんでしたが、血中ケトン体値は記憶力の改善と正の相関が認められました。
つまり、ケトン体の濃度が高いほど記憶力が良くなったということで、食事性のケトーシスが認知障害を改善するという結果です。ケトーシス(ケトン症)は血液中にケトン体が増えた状態のことです。
この研究の結果は、アルツハイマー病の発症リスクの高い軽度認知障害をもつ高齢者に対して、6週間という短期間の食事(低糖質食)の介入だけで記憶力の改善ができることを示しています。
認知障害の改善の作用機序として、ケトン体による抗炎症作用や神経細胞のエネルギー代謝の改善作用などが示唆されています。神経細胞の主なエネルギー源はブドウ糖ですが、アルツハイマー病などの認知症では神経細胞のブドウ糖の取込みや代謝に異常が起こっているためにエネルギー産生の低下が認められます。ケトン体はブドウ糖に代わってエネルギー源となるため、神経細胞の働きを良くすると考えられています。
高齢ラットを使った実験でもケトン体が認知機能を高めることが報告されています。(Adv Exp Med Biol 662: 71-75, 2010年)
この報告では、高齢ラットを2群に分けて、標準的な餌とケトン食の餌で3週間飼育し、T-迷路法や物体認識テストなどで認知機能を測定しています。ケトン食で飼育した群の方が認知機能が良かったという結果が得られています。食事によるケトン症が神経変性疾患の改善に効果があることを示しています。
米国では中鎖脂肪酸トリグリセリド(中鎖脂肪酸中性脂肪)のカプリル酸トリグリセリドがアルツハイマー病の治療に有効な医療食として認可されています。カプリル酸(caprylic acid)は炭素数8個の中鎖脂肪酸(分子式はC8H16O2)です。中鎖脂肪酸は肝臓で代謝されてケトン体(アセト酢酸とβヒドロキシ酪酸)の産生を増やすので、神経細胞の働きを良くするのです。
アルツハイマー病あるいは軽度の認知障害をもった20人の成人を対象にして、日を改めて中鎖脂肪酸を摂取した場合とプラセボを摂取した場合で、認知力を比較した研究が報告されています。中鎖脂肪酸を投与すると90分後には血液中のβヒドロキシ酪酸のレベルが著明に上昇し、この時点で認知機能を測定しています。その結果、ケトン体の量が多いほど、認知機能の改善が認められました。
つまり、「アルツハイマー病の患者に中鎖脂肪酸を投与すると記憶力の改善が認められ、その改善の程度は血液中のβヒドロキシ酪酸のレベルと相関する」という結論です。(Neurobiol Aging. 25(3):311-4. 2004年)
神経細胞はブドウ糖とケトン体しかエネルギー源として利用できないのですが、アルツハイマー病ではブドウ糖の取り込みや利用に障害があり、そのため中鎖脂肪酸を摂取してケトン体の産生を増やすと神経組織のエネルギー産生が改善して症状が良くなると考えられています。その他にも、遺伝子発現調節作用の関与や、抗炎症・抗酸化・抗アポトーシスの機序による神経細胞保護作用も関与していると思われます(468話参照)。
【ケトン体をサプリメントとして補充する治療法が検討されている】
血中のケトン体濃度を高めるケトン食は食事中の糖質摂取を極端に減らし、脂肪の摂取を増やす必要があります。このような食事制限を行わずにケトン体をサプリメントとして補充して病気の治療に役立てようとする研究が行われています。
すなわち、がん治療や、アルツハーマー病やパーキンソン病などの神経変性疾患の治療にケトン体の補充が有効であることが多数報告されるようになっています。たとえば最近、以下のような報告があります。
Effects of exogenous ketone supplementation on blood ketone, glucose, triglyceride, and lipoprotein levels in Sprague–Dawley rats(Sprague-Dawleyラットにおけるケトン体とグルコースと中性脂肪とリポタンパク質の血液中濃度に対する外来性ケトン体補給の作用)Nutr Metab (Lond). 2016; 13: 9.
Published online 2016 Feb 4. doi: 10.1186/s12986-016-0069-y
【要旨】
研究の背景:ケトン食によって引き起こされる食事性ケトン症が多くの疾患に対して治療効果を示すことが明らかになっている。外来性にケトン体を経口摂取で補給することによって糖質制限をすることなく食事性ケトーシス(>0.5 mM)が維持できるかどうかを検討した。
方法:5種類のケトン体サプリメントをオスのSprague–Dawleyラットに経口的に28日間投与し、血液中のグルコースとケトン体と脂質の濃度に対する効果を検討した。
ケトン体サプリメントは次の5種類である。1,3-ブタンジオール(1,3-butanediol: BD)、β-ヒドロキシ酪酸のナトリウム/カリウム塩(sodium/potassium β-hydroxybutyrate mineral salt: BMS)、中鎖脂肪酸中性脂肪(medium chain triglyceride oil :MCT)、BMS+MCTの1:1混合物、1,3ブタンジオール・アセト酢酸ジエステル(KE)。
ラットにそれぞれのケトン体サプリメントを胃内投与にて1日に5–10 g/kgの用量で投与した。
週に1回血液を採取し、胃内投与前と投与後(0.5, 1, 4, 8, 12時間後)の血液中のグルコースとβ-ヒドロキシ酪酸の濃度を測定した。ケトン・サプリメントの投与開始後28日目には、中性脂肪とコレステロールの高比重リポタンパク(HDL)の血中濃度を測定した。
結果:コントロールのラットに比べて、外来性のケトン体の補充は、β-ヒドロキシ酪酸の血中濃度を上昇して維持し、グルコース濃度を低下させ、脂質に関してはほとんど影響しなかった。
結論:この研究によって、外来性のケトン体の経口による補充は、糖質制限を行わなくても食事性のケトン症を誘導でき、十分に実行できる(認容性がある)ことが示された。
様々な疾患に対してケトン食が治療効果を示すエビデンスが集まっており、研究者は食事制限を行わずに食事性ケトン症の有効性を活用する方法を検討しています。
ケトン食は1920年代から小児の薬剤抵抗性のてんかんの治療法としてその有効性が確立して治療に使用されています。
てんかん治療に加えて、ケトン食は体重減少(ダイエット)や2型糖尿病の治療にも顕著な治療効果を示すことが明らかになっています。
複数の研究によって、高脂肪+低糖質食が血清コレステロール値を上昇させることなく、体重を顕著に減少させることが示されています。
2型糖尿病患者の治療において、長期間のケトン食の安全性と有効性が示されています。この臨床試験において、56週間の適切に調整されたケトン食の摂取によって顕著な体重減少と血糖値の低下と脂質の値の改善が認められています。
最近になって研究者は、ニキビ、多嚢胞性卵巣症候群(Polycystic ovary syndrome)、がん、筋萎縮性側索硬化症(ALS)、外傷性脳傷害、アルツハイマー病など多くの疾患におけるケトン食の効果を検討し始めており、すでに有望な結果が多く報告されています。
古典的なケトン食では、食事中の脂肪:たんぱく質+糖質の重量比は4:1で、摂取総カロリーの80〜90%を脂肪から摂取ます。このケトン食によってエネルギー代謝は脂肪酸酸化と肝臓におけるケトン体産生にシフトし、ケトン体のアセト酢酸とβ-ヒドロキシ酪酸の血中濃度が増えます。アセト酢酸の脱炭酸によって生成されるアセトンは抗けいれん作用があることが報告されています。
飢餓や絶食や強度の運動やカロリー制限やケトン食など、グルコースの供給が減少し、インスリン分泌が抑制され、肝臓のグリコーゲンが枯渇する状況において、肝臓以外の組織にグルコースの代わりの代替エネルギー源を供給するためにケトン体は産生され、血中濃度が上昇します。
ケトン食は明らかな治療効果を有しますが、この食事療法を広く臨床応用するには幾つかの障壁があります。
まず第一に、厳しい食事制限は多くの人にとって受け入れがたく、十分に実行する事が困難であり、さらに高脂肪食に耐えられない人もいます。
少量の糖質摂取や過剰なたんぱく質の摂取は肝臓におけるケトン体産生を阻害するので、ケトン症を維持することが困難になります。
さらに、肝臓におけるケトン体の産生と組織におけるケトン体の利用が高まるまでに数週間を要するので(ケトン体適応:keto-adaptation)、ケトン食を開始してしばらくの間は軽度の低血糖症状を経験します。
最近の研究結果は、ケトン食の臨床効果の多くはケトン体代謝の効果によることが示されています。
βヒドロキシ酪酸とアセト酢酸は、両者ともミトコンドリアにおける活性酸素産生を減少させることが示されています。
外来性にケトン体を補給すると、ミトコンドリアにおけるエネルギー産生が良好になることが報告されています。
ケトン体は心臓の拍出量を28%増加させ、同時に酸素消費を減らしてATP産生は増やすことが示されています。
このように、ケトン体の増加は代謝効率を高め、その結果、活性酸素の産生を減らし、還元型グルタチオンの量を増やします。
Sullivanらは、ケトン食を10〜12日間投与されたマウスは、脳の海馬領域の神経細胞のミトコンドリアの脱共役たんぱく質(Uncoupling protein)の量が増えていることを示しています。脱共役タンパク質は酸化的リン酸化のエネルギーを生成する前に、膜間のプロトン勾配を浪費することができるミトコンドリアの内膜のタンパク質です。これはミトコンドリアにおける活性酸素の産生が減少していることを示唆しています。
Booughらは、ケトン食で4〜6週間飼育したラットではミトコンドリアの新生が増加することを示しています。
β-ヒドロキシ酪酸はクラスIのヒストン脱アセチル化酵素の内因性の選択的阻害剤であり、酸化ストレスに対して保護作用を示すことが報告されています。
さらに、ケトン体はTNF-αやIL-6、IL-8、MCP-1、E-selectin、I-CAM、PAI-1などの炎症性因子を減少させることによって炎症反応を抑制することが示されています。
このようにケトン食による健康作用は、ケトン体自体の作用によると考えられています。
このようなケトン食の有用性と実施上の制限を考慮したとき、外来性のケトン体を経口でサプリメントとして補うことは、食事制限をすることなく、治療的なケトン症を維持し、ケトン食の代替療法となる可能性があります。
栄養学的ケトン症を誘導できる天然あるいは合成のケトン体サプリメントが、幾つか見つかっています。
Desrochersらは、(R, S)-1,3 butanediol と (R, S)-1,3 butanediol-acetoacetate monoestersと diesterを外来性のケトン体サプリメントとして豚に投与し、血液中のケトン体濃度を0.5mM以上に上昇させています。
2012年にClarkeらは、ラットと人間において、R体β-ヒドロキシ酪酸のモノエステルの長期間の安全性と有効性を報告しています。
被験者は食事制限を行うことなく血中のケトン体の上昇を維持でき、副作用もほとんど経験しませんでした。これは、食事制限を行わずに、治療効果を示すために必要なレベルのケトン症を引き起こすことができる可能性を示しています。
以上のような背景から、この論文では、天然のケトン体として中鎖脂肪酸中性脂肪(MCTオイル)、β-ヒドロキシ酪酸のナトリウム/カリウム塩(BMS)、BMSとMCTオイルの1:1混合物(BMS+MCT)、合成のケトン体サプリメントとして、1,3-ブタンジオール(1,3-butanediol: BD)、1,3ブタンジオール・アセト酢酸ジエステル(ケトンエステル:KE)を用いて検討しています。
その結果、ケトン体サプリメントの長期間の補充が、糖質制限の必要なく、さらに脂質マーカーに影響を及ぼすことなく、ケトン症の状態を引き起こすことを示しています。
この論文の著者らは以前の論文で、ケトンエステルの補充が、糖質制限を必要とせずに中枢神経系の酸化傷害によるけいれんを遅らせる作用を示しており、今回の結果を支持しています。
つまり、ケトン体サプリメントの補充は、治療効果を示すケトン症の状態を維持する方法として有用であり、さらにケトン食の治療効果をさらに高める手段となることが示されています。
MCTオイルが栄養的ケトン症を誘導するのに利用されていますが、MCTオイルは用量依存的に消化器症状(下痢や腹痛)の副作用を引き起こすので、その使用に制限があります。
MCTオイル単独だと胃腸障害が多くでますが、MCTオイル+BMS(β-ヒドロキシ酪酸のナトリウム/カリウム塩)だと胃腸症状を軽減してケトン体を多く出せることがこの論文で示されています。
つまり、MCT単独だと胃腸症状が出やすいため、その使用量に制限がありますが、MCTオイルにβ-ヒドロキシ酪酸を併用することは有用な治療法となる可能性が指摘されています。
厳しい食事制限によるケトン食を行わなくても、マイルドな糖質制限に、MCTオイルとβ-ヒドロキシ酪酸の混合物をサプリメントとして補充する方法が、アルツハイマー病などの神経変性疾患やがんの治療に役立つ可能性が示唆されています。
実際に米国では中鎖脂肪酸トリグリセリド(中鎖脂肪酸中性脂肪)のカプリル酸トリグリセリドがアルツハイマー病の治療に有効な医療食として認可されています。カプリル酸(caprylic acid)は炭素数8個の中鎖脂肪酸(分子式はC8H16O2)です。中鎖脂肪酸は肝臓で代謝されてケトン体(アセト酢酸とβヒドロキシ酪酸)の産生を増やすので、神経細胞の働きを良くするのです。
神経細胞はブドウ糖とケトン体しかエネルギー源として利用できないのですが、アルツハイマー病ではブドウ糖の取り込みや利用に障害があり、そのため中鎖脂肪酸を摂取してケトン体の産生を増やすと神経組織のエネルギー産生が改善して症状が良くなると考えられています。その他にも、遺伝子発現調節作用の関与や、抗炎症・抗酸化・抗アポトーシスの機序による神経細胞保護作用も関与していると思われます。
MCTオイルにβヒドロキシ酪酸やそのエステルを組み合わせたサプリメントは認知症の治療に期待されています。
最近のケトン食関連の論文を読むと、ケトン体そのものをサプリメントにする動きや、それを商品化するビジネスもあるようです。ケトン体自体は体が産生する物質であるため特許は取れませんが、高品質で安価に製造できる方法を開発した企業は今後大儲けすると思います。
高脂肪食やケトン体を産生させるケトン食に対しては、ケトン体に対する間違った認識がまだ医学界にも残っているので、「ケトン体が体に良い」と言っても非難されることの方が多いのですが、最新の医学研究は「ケトン体をサプリメントとして補充する有用性」について検討していることを理解する必要があります。
新刊紹介:

| « 480)ケトン体... | 482)認知症と... » |



