がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
480)ケトン体:Metabolism’s Ugly Duckling(代謝の醜いアヒルの子)?
図:かつてケトン体は、糖や脂質の代謝異常に伴って産生される「体に有害で不必要な成分」と認識されてきた。代謝における「Ugly Duckling(醜いアヒルの子)」と長い間思われていたが、最近の研究でケトン体は「有益な生理作用を示す代謝産物」であることが明らかになっている。ケトン体の寿命延長作用や抗老化作用、抗がん作用、認知症改善作用などの多彩な健康作用を示すことが示され、糖尿病やメタボリック症候群の治療にも有効であることが示されている。ケトン食はダイエット(減量)にも著効を示すことが臨床試験で証明されている。食事からの糖質摂取を減らし、健康に良い脂肪の摂取を増やして脂肪代謝を促進し、ケトン体の産生を増やすことは、健康を高め病気を予防する方法として注目されている。
480)ケトン体:Metabolism’s Ugly Duckling(代謝の醜いアヒルの子)?
【空腹にならない生活が病気を増やしている?】
肥満や糖尿病やアルツハイマー病の急増が地球規模で起こっています。最近の疫学研究の論文では、肥満や糖尿病やアルツハイマー病に関して「Epidemics(流行)」という言葉を使っています。感染症がどんどん広がるように、肥満や糖尿病やアルツハイマー病が流行しているという現状を表しています。
これらの3つの疾患は相互に関連しています。糖質の多い食事は肥満を引き起こします。肥満はインスリン抵抗性を高めて糖尿病の発症を促進します。肥満と糖尿病はアルツハイマー病の主要な危険因子になっています。
このような疾患の急増には、近代における食生活が関係していることが指摘されています。すなわち、精製度の高い糖質の摂取とそれに伴う高インスリン血症、その結果として生じる体脂肪の蓄積です。
最近の多くの人は空腹感を感じることのない生活を送っています。空腹を感じる前に1日3度の食事とおやつを規則的に食べています。その結果、体の中では脂肪が燃えない状況が続き、それが体の不調やある種の病気の原因になっていることが指摘されています。
食事が入ってこなければ体脂肪が燃焼し始めますが、食料が豊富な現代においては、体脂肪に蓄えられたエネルギーを使う前に、手近なエネルギー源である糖質の摂取を体は要求し、ご飯やお菓子を食べてしまいます。このような食生活が多くの病気を増やしているのです。
人類が農耕を初める前、すなわち1万年以上前の旧石器時代においては、食べ物は狩猟や採集によって得ていました。狩猟採集民にとっては食事が毎日できるという保証はありません。しかし、何日も食べなくても体を維持し動かせることができます。
私たちの体には、食事で余ったエネルギーを脂肪として貯蔵し、食事が取れないときに貯蔵した脂肪を燃焼させて体が必要とするエネルギーを産生するという仕組みを持っているからです。
ブドウ糖が枯渇した状態で脂肪酸が燃焼するとき、肝臓ではケトン体(アセト酢酸とβ-ヒドロキシ酪酸)という物質ができます。このケトン体は脳にエネルギー源を供給するために肝臓で作られる物質です。ブドウ糖が無くても細胞は脂肪を分解してエネルギーを産生できます。しかし、脳の神経細胞は例外です。
脂肪は血液脳関門(血液と脳脊髄液との間の物質交換を制限する機構)を通過できないため、脳は脂肪をエネルギー源として利用できないからです。
狩猟採集を行っていた時代には、飢餓状態において貯蔵脂肪が盛んに燃焼し日常的にケトン体が多く産生されていました。
現代人はケトン体が出ないような食生活になっています。これが多くの病気を引き起こしている可能性が指摘されています。
絶食で産生されるケトン体はブドウ糖以上に安全で、エネルギー源として有用な正常な代謝産物であることが明らかになっています。さらに最近の研究によって、細胞のシグナル伝達や遺伝子発現の調節や抗炎症作用や抗酸化作用などの様々な有用な働きが明らかになり、顕著な減量効果、老化予防や寿命延長効果、がんやアルツハイマー病などの難病の治療にも有効であることが報告されるようになりました。
断食療法が多くの病気の治療や健康増進に有効であることは経験的に知られていますが、その作用機序の一つが脂肪の燃焼とケトン体の産生にあります。
絶食やケトン食によって正常な人間に起こるケトン血症(血中にケトン体が増える状態)は安全で生理的な現象ですが、世の中にはケトン体に対する誤解がまだ多く残っています。
【「みにくいアヒルの子」から「美しい白鳥」に変身したケトン体】
アンデルセン童話に「みにくいアヒルの子」という話があります。
容姿が異なるために兄弟からいじめられていた「みにくいアヒルの子」は、本当は白鳥の子供で、大人になって美しい白鳥になったという童話です。
ケトン体を「Metabolism’s Ugly Duckling(代謝の醜いアヒルの子)」と表現した論文もあります。「実際は美しい白鳥だった」という意味が込められています。
ケトン体は19世紀中頃に糖尿病性ケトアシドーシスの患者の尿に大量に含まれることから最初に見つかったので、「ケトン体は脂質の不完全な酸化によって生成される毒性のある不必要な代謝産物である」とこの時代の医師の多くが認識していました。
しかし、20世紀のはじめになると、「ケトン体は、飢餓時や食事からの糖質や糖原性アミノ酸の供給が不足したときに、肝臓で脂肪酸から産生される正常な代謝産物で、肝臓以外の組織で容易にエネルギー源として利用される」ことが明らかになりました。
さらに、1920年代にはケトン体の産生を増やす高ケトン食が、小児の薬剤抵抗性てんかんの治療に極めて有効であることが明らかになりました。
1967年には、長期間の絶食や飢餓時に脳のエネルギー源としてグルコースに代わってケトン体が使用されることが明らかになりました。それまでは、脳のエネルギー源はグルコースのみと考えられていたのです。
1990年代に入ると、食事によってケトン体の産生を高めるケトン食が、グルコースの利用障害のある神経疾患の治療に有効であることが明らかになります。
さらに、パーキンソン病やアルツハイマー病などの脳では、ミトコンドリアの機能異常によって、エネルギー産生が低下していることが多くの研究で明らかになっています。
ケトン体はミトコンドリアでATP産生に効率よく利用され、さらに、神経細胞をフリーラジカルの害から守る作用があるので、ケトン食が、パーキンソン病やアルツハイマー病やその他の神経変性疾患の治療に有効であることが報告されるようになりました(468話)。
近年では、ケトン体のβヒドロキシ酪酸がヒストン脱アセチル化酵素の阻害作用によって遺伝子発現に作用してストレス抵抗性の増強や抗老化や寿命延長の効果を発揮することや(322話)、炎症を引き起こすNLRP3インフラマソームの活性を阻害することによって抗炎症作用を示す作用(471話)、細胞膜の受容体を介して細胞機能に影響する作用(472話)などが明らかになっています。ケトン食が寿命を延ばす可能性も報告されています(467話)。そして、サプリメントとしてケトン体を補充する治療法も検討されるようになってきました。
つまり、発見された当時は「代謝における醜いアヒルの子」と思われていたケトン体が、実際は、極めて多彩で有用な働きを発揮する代謝産物であることが判明したのです。最近ではβヒドロキシ酪酸は「an anti-aging ketone body(抗老化ケトン体)」と表現され、様々な老化性疾患を予防し、寿命を延ばす効果も指摘されるようになってきました。
1型糖尿病で発生する糖尿病性ケトアシドーシスではケトン体は25mmol/L以上に上昇し、血糖も300mg/dL以上に増加して酸性血症(アシドーシス)になります。
しかし、飢餓や絶食や低糖質高脂肪食で起こるケトン症ではケトン体は6〜8mmol/Lを上限にしてそれ以上は増えません。肝臓におけるケトン体の産生能に限界があるのと、他の組織でエネルギー源として盛んに利用されるので、ある一定以上は増えないのです。
もし現在でも、絶食で上昇するケトン体が体に悪いという医師がいれば、それは勉強不足です。この事は10年以上前から、医学の常識になっています。
絶食で体内に増えるケトン体が有毒であるのであれば、日常的に飢餓を体験している野生の動物や、狩猟採取で食糧を得ていた氷河時代の人類が生き延びることはできなかったはずです。
ケトン体が有毒な代謝産物であれば、このような不都合な代謝は進化の過程で淘汰されてきたはずです。むしろ、飢餓を生き延びるために進化の過程で獲得した代謝系と考えるのが妥当です。
【脳はブドウ糖とケトン体しかエネルギー源として利用できない】
多くの人の食事は摂取カロリーの50〜70%を糖質から摂取しています。体重や労働や運動の状況によって消費カロリーは異なりますが、一般的に1日に250〜400gの糖質を摂取しています。このような状況では、エネルギー産生には主に糖質が分解してできるブドウ糖が利用されます。
一方、飢餓状態で体脂肪が燃焼するとき、あるいは糖質摂取を少なくして脂肪の摂取を増やしたときには脂肪酸が主なエネルギー源になります。多くの組織は脂肪酸を細胞内に取り込んで、脂肪酸を分解してエネルギーを産生できます。しかし、脳の細胞は脂肪酸を利用できません。
脳の毛細血管には、薬物などを血中から脳内への移行を制限する血液脳関門という仕組みが存在します。ブドウ糖やアミノ酸は特殊なトランスポーター(輸送担体)を使って脳内に入ることができますが、脂肪酸は分子量が大きいので血液脳関門を通過できません。
そこで、肝臓で脂肪酸を分解して分子量の小さい炭素数4個のケトン体(アセト酢酸とβヒドロキシ酪酸)に変換して、血液中に放出します。このケトン体は、血液脳関門を通過して神経組織の細胞(ニューロンやグリア細胞)に取り込まれて、ミトコンドリアで代謝されてエネルギー源として利用されます。
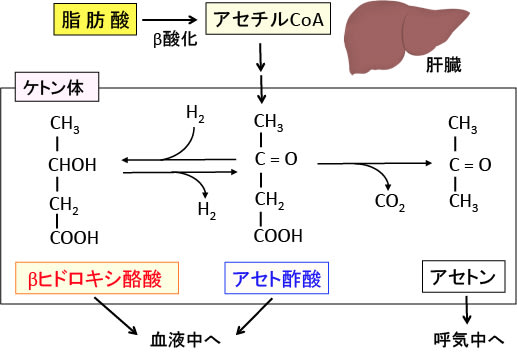
図:肝臓では、脂肪酸が分解されてできたアセチルCoAからアセト酢酸が生成され、これは脱炭酸によってアセトンへ、還元されてβヒドロキシ酪酸へと変換される。この3つをケトン体と言う。
脂肪酸と違ってケトン体は水溶性であるため、特別な運搬蛋白質の助けがなくても肝臓からその他の臓器(心臓や筋肉や腎臓や脳など)に効率よく運ばれ、細胞内でケトン体は再びアセチル-CoAに戻され、TCA回路で代謝されてエネルギー源となる。この際、エネルギー産生に使われるのはアセト酢酸のみで、βヒドロキシ酪酸はアセト酢酸に変換されてエネルギー代謝に使用される。アセトンはエネルギー源にはならず、呼気から排出される。
つまり、ケトン体はブドウ糖が枯渇した時に、脳にエネルギー源を供給するために、肝臓で脂肪酸を分解して作られる物質なのです。脳以外の組織は脂肪酸をそのままエネルギー源にできますが、脳組織には脂肪酸が入れないために、肝臓で脂肪酸を分解して分子量を小さくして血液脳関門を通れるようにしたのがケトン体です。
ケトン体は脂肪酸と違って水溶性であるため、特別な運搬蛋白質の助けがなくても肝臓から筋肉や心臓や腎臓や脳など多くの臓器に効率よく運ばれ、モノカルボン酸トランスポーターを使って細胞膜や血液脳関門を容易に通過し、細胞内のミトコンドリアで代謝されてグルコースに代わるエネルギー源として利用されます。特に脳にとってはブドウ糖が枯渇したときの唯一のエネルギー源となります。
ケトン体は急速に血液中から細胞内に取り込まれてエネルギー源として利用されます。血液循環におけるケトン体の回転時間(turnover time)は約2分と言われています。
健康な成人は肝臓で1日に185gのケトン体を産生できるという報告があります。
体のエネルギー供給源におけるケトン体の割合は、1晩の絶食で2〜6%、3日間の絶食で30〜40%になると報告されています。
糖質摂取がゼロでも血糖は正常範囲の低値(65-80 mg/dl程度)で維持されます。これは、肝臓でアミノ酸やグリセロールからブドウ糖が合成されるからです。これを糖新生といいますが、これによって糖質を全く摂取しなくても血糖値が正常に保たれます。糖質を摂取しなくても低血糖にはなりません。
糖質を摂取しないと肝臓で1日に60〜65gのグルコースが作られます。しかし、この量では脳が必要とするブドウ糖の量を賄いきれません。
脳は通常1日に100グラム以上のブドウ糖を消費しています。(脳は体のエネルギーの20%を消費しています。1日に400〜500キロカロリーになります。ブドウ糖で100〜125gになります)
そこで、ケトン体が代替エネルギー源として利用されるのです。
長期におよぶ絶食のときにはケトン体が脳のエネルギーの60%以上を供給しています。
240キロカロリーをケトン体が賄っていると計算すると、ブドウ糖を1日80グラム分に相当します。
もしケトン体が供給されなければ体のタンパク質を分解してエネルギー源を産生することになります。
もし、脳が必要とする100から150gのグルコースをたんぱく質を分解して糖新生で作ろうとすると1日に172から259gのたんぱく質を分解する必要があるという計算があります。
この率で、体のたんぱく質が消耗されると2週間で死に至る計算になります。
しかし実際は、平均的な体格の人が飢餓(水分以外は何も食べない)で死亡するのに57〜73日(平均61日)かかります。これは、体脂肪が燃焼してケトン体がエネルギー源となってたんぱく質の分解を減少させているからです。
1966年に、飢餓時の脳へのエネルギー供給にケトン体が使用されていることが証明されました。このとき、肥満患者を5〜6週間に渡って、治療的絶食を行って実験しています。
血糖が3.8mMであったのに対してケトン体は7mMのレベルに達していました。つまり、長期の絶食では、ケトン体が血糖値(グルコース濃度)の2倍近くになって、エネルギー供給源となり、脳へのエネルギー供給はグルコースからケトン体にスイッチするのです。
この発見によって、代謝系における「みにくいアヒルの子」と言われ、有毒で役に立たない代謝産物と思われたケトン体が、実は飢餓時において体の生存に必須な代謝産物であることが明らかになったのです。
【βヒドロキシ酪酸は抗老化作用がある】
以下のような論文があります。
D-beta-hydroxybutyrate extends lifespan in C. elegans(D-β-ヒドロキシ酪酸は線虫の寿命を延ばす)Aging (Albany NY). 2014 Aug; 6(8): 621–644.(PMCID: PMC4169858)
【要旨】
ケトン体のβヒドロキシ酪酸はヒストン脱アセチル化酵素阻害作用があり、多くの疾患モデルにおいて治療効果が示されているが、老化(aging)に対する効果についてはまだ十分に研究されていない。
そこで、線虫(C. elegans)の寿命に対するβヒドロキシ酪酸の作用を検討した。
βヒドロキシ酪酸は線虫の寿命を約20%延長した。
RNA干渉(RNAi)によってヒストン脱アセチル化酵素(HDACs)のhda-2またはhda-3遺伝子の発現を阻止しても寿命を延長し、この状態ではβヒドロキシ酪酸による寿命延長作用は認められなかった。
βヒドロキシ酪酸による寿命延長作用には、DAF-16/FOXOとSKN-1/Nrfの寿命延長のシグナル伝達系、サーチュインのSIR-2.1、AMPキナーゼのサブユニットのAAK-2が必要であった。
カロリー制限の状態と同じにした遺伝子改変モデルではβヒドロキシ酪酸は寿命を延長できなかった。これはβヒドロキシ酪酸がカロリー制限と同様のメカニズムで寿命延長効果を果たしている可能性を示唆している。
βヒドロキシ酪酸の添加はβヒドロキシ酪酸脱水素酵素の活性を高め、線虫における酸素消費量を増やした。
SKN-1のターゲット遺伝子で短鎖脱水素酵素(short chain dehydrogenase)のF55E10.6の発現をRNA干渉で阻止すると、寿命延長効果とβヒドロキシ酪酸の添加によって誘導されるβヒドロキシ酪酸脱水素酵素の活性亢進作用が抑制された。これは、F55E10.6は誘導性のβヒドロキシ酪酸脱水素酵素として作用することを示している。
さらに、βヒドロキシ酪酸の投与は、線虫の熱耐性(thermotolerance)を高め、グルコース毒性を抑制した。
βヒドロキシ酪酸はアルツハイマー病のアミロイドβの毒性を遅延させ、パーキンソン病のαシヌクレイン(alpha-synuclein)の凝集を減少させた。
これらの結果は、βヒドロキシ酪酸がヒストン脱アセチル化酵素の阻害と、ストレス応答経路の活性化によって寿命を延長させることを示している。
βヒドロキシ酪酸には、エネルギー源としてだけでなく、アルツハイマー病やパーキンゾン病のような神経変性疾患の予防や治療に効果があることが、動物実験や臨床試験で示されています。
さらに、老化速度を遅くして、老化関連疾患の発症を防いだり、寿命を延ばす作用も報告されています。
このような作用のメカニズムの一つとして、βヒドロキシ酪酸によるクラスIとクラスIIaのヒストン脱アセチル化酵素の阻害作用があります。
この作用はヒストンのアセチル化を亢進することによってある種の遺伝子発現を誘導します。βヒドロキシ酪酸によるヒストンアセチル化で誘導される遺伝子としてFoxO3AとMT2((metallothionein 2)があり、これらの遺伝子の発現は細胞の活性酸素に対する抵抗性を高めることができ、その結果、寿命を延ばす効果が示されています。
βヒドロキシ酪酸の血中濃度は数日の絶食で1〜2 mMのレベルに達し、カロリー制限(カロリー摂取を20から40%減らす)では0.6mM程度に達します。
クラスIヒストン脱アセチル化酵素のβヒドロキシ酪酸の50%阻害濃度(IC50)は2〜5mMであるので、数日の絶食やカロリー制限やケトン食で達しうるβヒドロキシ酪酸の濃度で、体内でクラスIヒストン脱アセチル化酵素の阻害による効果が期待できると言えます。
線虫を使った実験でβヒドロキシ酪酸を投与すると寿命が延長し、たんぱく質やグルコースの毒作用に抵抗性になることが報告されています。
カロリー制限下でβヒドロキシ酪酸を投与しても寿命延長効果は認められませんでした。つまり、βヒドロキシ酪酸はカロリー制限と類似のメカニズムで寿命を延ばしていることを示唆しています。
また、ヒストン脱アセチル化酵素(had-2またはhad-3)の遺伝子を欠損させた線虫では、βヒドロキシ酪酸の寿命延長効果は認められませんでした。
また、ヒストン脱アセチル化酵素の遺伝子を欠損させえた線虫では、βヒドロキシ酪酸を加えなくても寿命延長を認めました。
以上のことから、βヒドロキシ酪酸による寿命延長効果はヒストンアセチル化の関与があることが示唆されました。
β-ヒドロキシ酪酸による線虫(C. elegans)の寿命延長の作用機序を以下にまとめています。

図:β-ヒドロキシ酪酸による線虫(C. elegans)の寿命延長の作用機序
β-ヒドロキシ酪酸はヒストン脱アセチル化酵素を直接阻害する作用があり(1)、その結果、DAF-16/FOXO遺伝子の転写を促進し、活性化する(2)。β-ヒドロキシ酪酸はミトコンドリアで代謝され、クエン酸回路(TCA回路)の代謝が亢進し(3)、電子伝達系の活性が亢進して活性酸素の産生が増える(4)。酸化ストレスが亢進すると抗酸化応答経路のSKN-1/Nrf2の活性が亢進する(5)。
訳者注:
FOXOは「Forkhead box O」の略で、DNA結合ドメインFOX(Forkhead box)をもつForkheadファミリーのサブグループ“O”に属する転写因子です。哺乳類ではFOXO1,3,4,6の4種類が存在、線虫ではDaf-16、ショウジョウバエではdFOXOとそれぞれ1種類のみ存在し、栄養飢餓時に活性化される転写因子です。
転写因子というのは特定の遺伝子の発現(DNAの情報を蛋白質に変換すること)を調節している蛋白質で、FOXOはストレス応答、代謝制御、細胞周期、アポトーシス、DNA修復などに関連する多くの遺伝子の発現誘導を促します。がん抑制遺伝子としての性格ももっており、FOXOの活性化は抗がん作用があります。
FOXOはインスリン-PI3K-AKTシグナルによって抑制されます。つまり、PI3K-AKTシグナルが活性化されるとAKTによって直接的にリン酸化され、FOXOの核外移行を促進することでその転写活性は抑制されます。
一方、栄養飢餓状態ではPI3K-AKTの不活性化に伴いFOXOの活性化が誘導されることになります。つまり、FOXOは絶食やカロリー制限や糖質制限などによる寿命延長や抗がん作用に関与する転写因子として重要な役割を担っています。
炎症などによって活性酸素の発生量が増えると、細胞は活性酸素を消去する酵素(スーパーオキシド・ディスムターゼ、カタラーゼ、グルタチオン・ペルオキシダーゼなど)の発現や活性を高めたり、フリーラジカルを消去するグルタチオンなどの抗酸化物質の合成を高めたりして、活性酸素の害(酸化ストレス)を軽減しようとします。
また、グルタチオンSトランスフェラーゼ(GST)などのフェースII(第2相) 解毒酵素と言われる代謝酵素は、様々な発がん物質や有害物質を無毒化する作用があります。
細胞が活性酸素や発がん物質や有害な成分(抗がん剤や放射線も含む)によって攻撃を受けると、これらの活性酸素消去酵素やグルタチオンやフェースII解毒酵素が細胞内に誘導され(遺伝子発現が増えたり産生量が増える)、細胞を守るシステムが働きます。
このような細胞内の防御システムの活性化に中心的な働きを行っているのがNrf2(Nuclear Respiratory Factor 2)という転写因子です。
抗酸化酵素やグルタチオンの産生に関する酵素やフェース2解毒酵素の遺伝子の発現調節領域には、抗酸化反応エレメント(antioxidant response element:ARE)という領域があって、この部分にNrf2が結合するとこれらの遺伝子の転写が促進されるのです。
ホルミシス(hormisis)効果というものがあります。体に有害と思われている放射線や活性酸素やある種の発がん物質も、微量であれば体を刺激する方向で働いて、これらの害に対する抵抗力が高まるという効果です。刺激やストレスがくり返されると、生体はそれらに対して適応するように体が反応するため、その刺激やストレスに対して抵抗性になると考えられるのですが、抗酸化力や解毒力の増強のメカニズムに関しては転写因子のNrf2の活性化が関与しています。
体内で活性酸素を発生させて発がん作用を示すような物質を、少量だけ投与すると、かえって発がんが抑えられることがあります。これは、軽度の酸化ストレスに対して、適応反応として体の中の抗酸化酵素が増加するためであると考えられています。この場合も、Nrf2の活性化が重要な役割を担っています.
つまり、上記の論文は、βヒドロキシ酪酸を投与すると、ストレス抵抗性を高めるFOXO(線虫ではDAF-16)と抗酸化力を高めるNrf2(線虫ではSKN-1)が活性化されることによって抗老化と寿命延長の効果が得られるということです。
日頃から血中のケトン体レベルを高めることは、老化予防と寿命延長に役立つということです。
飢餓状態のときに生物は生殖を先延ばしにせざるを得ないのですが、食物が豊富になったときに生殖を再開できるように、飢餓状態のときに体の老化を停止させるメカニズムが作動します。その因子がβヒドロキシ酪酸である可能性が示唆されています。
画像をクリックするとサイトに移行します。
| « 479)膠芽腫と... | 481)認知症と... » |





