がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
637)クエン酸とアセチルCoAを増やすがん治療:メトホルミン+シンバスタチン+ケトン食

図:TCA回路で生成されたクエン酸の一部はミトコンドリから細胞質に出てATPクエン酸リアーゼによってアセチルCoAに変換される(①)。アセチルCoAはアセチルCoAカルボキシラーゼによってマロニルCoAに変換されて脂肪酸が合成される(②)。アセチルCoAはヒドロキシメチルグルタリル-CoA(HMG-CoA)合成酵素によってHMG-CoA(ヒドロキシメチルグルタリル-CoA)に変換され(③)、HMG-CoA還元酵素によってメバロン酸に変換されコレステロールが合成される(④)。脂肪酸とコレステロールの合成は細胞増殖を促進する(⑤)。メトホルミンはAMP活性化プロテイン・キナーゼ(AMPK)を活性化し、AMPKはアセチルCoAカルボキシラーゼを阻害して脂肪酸合成を阻害する(⑥)。AMPKはHMG-CoA還元酵素も阻害する(⑦)。シンバスタチンはHMG-CoA還元酵素を阻害する(⑧)。HMG-CoAはHMG-CoAリアーゼによってアセト酢酸に変換され、アセト酢酸はβヒドロキシ酪酸になる(⑨)。βヒドロキシ酪酸は脱アセチル化酵素阻害作用によってタンパク質のアセチル化を亢進する(⑩)。アセチルCoAはタンパク質のアセチル化のアセチル基のドナーになってタンパク質のアセチル化を亢進する(⑪)。タンパク質のアセチル化はタンパク質機能を変化して、がん細胞の増殖を抑える効果を示す(⑫)。βヒドロキシ酪酸はタンパク質メチル化以外の機序でもがん細胞の増殖抑制効果を示す(⑬)。メトホルミンやシンバスタチンによってHMG-CoA還元酵素や脂肪酸合成を阻害することは、直接的な抗腫瘍作用の他に、ケトン食を行っているときは、HMG-CoAからケトン体の合成へ向う経路を亢進することによって抗腫瘍効果を増強する(⑭)。
637)クエン酸とアセチルCoAを増やすがん治療:メトホルミン+シンバスタチン+ケトン食
【メトホルミンはタンパク質のアセチル化を亢進する】
ケトン食を行うときに糖尿病治療薬のメトホルミンと高脂血症治療薬のシンバスタチンを併用すると、抗がん作用を強めることができます。その理由はトップの図にまとめています。そのメカニズムを理解するためには代謝に関する生化学の知識が必要です。この理解を助けるために、部分部分に分けて解説します。
まず、「メトホルミンが細胞内のアセチルCoAを増やして、タンパク質のアセチル化を亢進する」という現象です。
タンパク質は様々な翻訳後修飾を受けて機能が変化します。このようなタンパク質の翻訳後修飾の一つに「アセチル化」があります。
アセチル化というのはアセチル基(CH3CO)が結合することです。
例えば、DNAとヒストンの結合を緩くする機序として、「ヒストンのアセチル化」という現象があります。ヒストンのN末端領域のリシン残基のアミノ基(-NH2)がアセチル化という修飾を受けるとアミド(-NHCOCH3)に変換し、リシン残基の塩基性が低下して酸性のDNAとの親和性が無くなり、DNAからヒストンが離れ、DNAが露出して遺伝子転写が亢進することになります。
このヒストンのアセチル化は様々な遺伝子の発現に影響して、一般的にがん細胞の増殖を抑える方向で作用します。
タンパク質のアセチル化は、ヒストンだけでなく、非ヒストンタンパク質にも起こります。アセチル化を受けるタンパク質には多数が知られており、これらの非ヒストンタンパク質のアセチル化は、タンパク質の安定性や局在や他のタンパク質やDNAとの相互作用などに影響して、がん細胞の発生や増殖や転移などに関与しています。
通常、ヒストンや非ヒストンタンパク質のアセチル化はがん細胞の増殖を抑制する方向で働くため、このような作用をもった物質はがんの治療に役立つと考えられています。
ケトン体のβヒドロキシ酪酸はヒストン脱アセチル化酵素阻害作用があり、タンパク質のアセチル化を促進する機序がケトン食の抗がん作用のメカニズムの一つになっています。(322話参照)
このようなヒストンや非ヒストンタンパク質のアセチル化の反応で、アセチル基を提供しているのがアセチルCoAです。したがって、細胞内でクエン酸を増やし、脂肪酸合成を阻害すれば、細胞内でアセチルCoAが増えて、タンパク質のアセチル化が亢進し、がん細胞の増殖が抑制されることになります。
糖尿病治療薬のメトホルミンはAMP活性化プロテインキナーゼ(AMPK)を活性化します。AMPKは異化を亢進し、同化を抑制します。その結果、細胞内でアセチルCoAが増えます。
以下のような研究報告があります。
Activation of AMP-activated Protein Kinase by Metformin Induces Protein Acetylation in Prostate and Ovarian Cancer Cells(メトホルミンによるAMP活性化プロテインキナーゼの活性化は前立腺がん細胞と卵巣がん細胞においてタンパク質のアセチル化を誘導する)J Biol Chem. 2016 Nov 25; 291(48): 25154–25166.
【要旨】
AMP活性化プロテインキナーゼ(AMPK)はエネルギーセンサーおよび代謝の主な調節因子である。 AMPKは、全身および細胞のエネルギー状態を監視する燃料計として機能する。
AMPKの活性化は、細胞内のAMP/ATP比が増加したときに起こり、そして同化作用から異化作用への代謝的転換をもたらす。
AMPKは、アセチル−CoAからマロニル−CoAへの変換を触媒するアセチル−CoAカルボキシラーゼ(ACC)をリン酸化して阻害する。このACCによるアセチル−CoAからマロニル−CoAへの変換は脂肪酸の新規合成における最初の律速反応である。
したがって、AMPKは、代謝とシグナル伝達とクロマチン構造および転写の交差点に位置する重要な代謝産物であるアセチルCoAの恒常性を調節している。
細胞質と核におけるアセチルCoAの濃度は、ヒストンのアセチル化に影響を及ぼし、代謝とクロマチン構造を結び付けている。
この研究では、広く使用されている抗糖尿病薬のメトホルミンまたはAMP模倣物5-アミノイミダゾール-4-カルボキサミドリボヌクレオチド(5-aminoimidazole-4-carboxamide ribonucleotide)によるAMPKの活性化が、ACC(アセチル−CoAカルボキシラーゼ)の活性を阻害するリン酸化を増加させ、アセチルCoAからマロニルCoAへの変換を減少させ、その結果、前立腺がん細胞と卵巣がん細胞に置けるタンパク質のアセチル化を増やし、遺伝子発現を変化させることを示す。
ACCのアロステリック阻害剤の5−(テトラデシルオキシ)−2−フロ酸(5-(tetradecyloxy)-2-furoic acid)によるACCの直接阻害もまた、ヒストンおよび非ヒストンタンパク質のアセチル化を増加させる。
AMPK活性化は肝臓キナーゼB1(liver kinase B1)を必要とするので、メトホルミンは肝臓キナーゼB1欠損細胞においてタンパク質アセチル化を誘導しない。
以上をまとめると、我々のデータは、AMPKがタンパク質アセチル化のための核および細胞質におけるアセチル-CoAの利用可能性を調節し、メトホルミンなどのAMPK活性化剤は、タンパク質のアセチル化を高め、遺伝子発現のパターンを変える能力を持ち、さらにメトホルミンの生理学的効果の多様性を広げる。
メトホルミンは様々な機序で抗腫瘍効果を発揮しますが、そのメカニズムの一つとしてメトホルミンがタンパク質のアセチル化を亢進する作用を提示しています。
【アセチルCoAはエネルギー産生(異化)と物質合成(同化)とシグナル伝達のハブとなっている】
コエンザイムA(CoA)は補酵素Aとも呼ばれ、生物にとって極めて重要な補酵素で、様々な化合物を結合することによって糖質や脂質やアミノ酸などの代謝反応に関わります。
補酵素Aはパントテン酸とアデノシン二リン酸、および 2-メルカプトエチルアミンから構成されており、末端にあるチオール基に様々な化合物のアシル基がチオエステル結合することによってクエン酸回路やβ酸化などの代謝反応に関わります。例えばアセチル基が結合したものがアセチルCoAです。

図:コエンザイムA(Coenzyme A; CoA)は補酵素Aとも言う。CoAにアセチル基が結合したものがアセチルCoAになる。
コエンザイムAは1945年にフリッツ・アルベルト・リップマンによって発見されています。リップマンはTCA回路を発見したハンス・クレブスと一緒に1953年にノーベル賞(生理学・医学賞)を受賞しています。
グルコース代謝の場合は、グルコース(ブドウ糖)が解糖系で作られたピルビン酸がミトコンドリア内に取り込まれてピルビン酸脱水素酵素複合体の作用で二酸化炭素(CO2)が除去されてアセチル基になり、このアセチル基にコエンザイムA(CoA)が結合してアセチルCoAに変換され、アセチルCoAはクエン酸に変換されてTCA回路と電子伝達系によってさらにATPの産生が行われます。
脂肪酸はミトコンドリアにおけるβ酸化によってアセチルCoAを産生し、同様にTCA回路と電子伝達系によってさらにATPの産生が行われます。
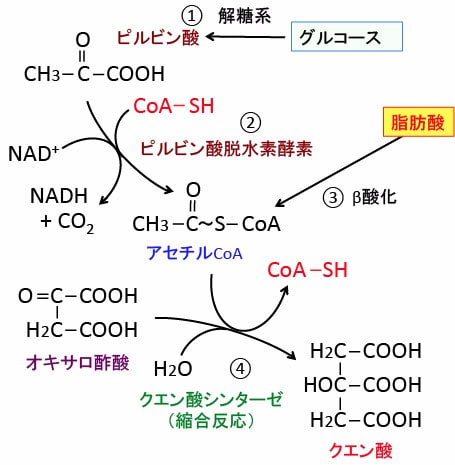
図:グルコースは解糖系でピルビン酸に変換され(①)、ピルビン酸はミトコンドリアに入ってピルビン酸脱水素酵素によって二酸化炭素(CO2)が除去されてアセチル基になり、このアセチル基にコエンザイムA(CoA)が結合してアセチルCoAに変換される(②)。脂肪酸はβ酸化によってアセチルCoAを産生する(③)。アセチルCoAとオキサロ酢酸からクエン酸が生成される反応がTCA回路の最初のステップになる(④)。TCA(Tricarboxylic acid)というのは3つのカルボキシル酸基(COOH)を持つクエン酸のことで、TCA回路はクエン酸回路とも言う。
脂肪酸合成が必要なときは、TCA回路で産生されたクエン酸の一部が細胞質に移行して、ATPクエン酸リアーゼによってアセチルCoAに変換され、脂肪酸合成に使われます。アセチルCoAは細胞膜を通過できないので、ミトコンドリアでできたクエン酸が細胞質に移行してアセチルCoAの合成に使われます。

図:TCA回路で産生されたクエン酸の一部は細胞質でATPクエン酸リアーゼによってアセチルCoAに変換され、さらにマロニルCoAから脂肪酸が合成される。がん細胞は細胞の数を増やすために脂肪合成が亢進しており、これら脂肪酸合成に関与する酵素の活性が亢進している。
がん細胞では脂肪酸合成が亢進していますが、グルコースは乳酸の方に代謝されミトコンドリアでのTCA回路でのピルビン酸→アセチルCoA→クエン酸という経路は抑制されています。そこで、がん細胞ではグルタミンがTCA回路を逆向きに進む逆向きTCA回路(reverse TCA cycle)による脂肪酸合成が亢進しています。
正常細胞では、TCA回路(クエン酸回路、クレブス回路)は下図に示す時計回りで反応が進行します。
TCA回路で産生されるクエン酸は細胞質に出てATPクエン酸リアーゼでアセチルCoAに変換されて脂肪酸合成に使用されます。
急速に増殖する腫瘍のミトコンドリアでは、通常の「時計回り」のTCA回路に加えて、逆の向きの「反時計回り」の還元的カルボキシル化(reductive carboxylation)という経路が生じています。
グルタミン由来のαケトグルタル酸の酸化的代謝はコハク酸を産生しTCA回路を順行性に回します。αケトグルタル酸のイソクエン酸脱水素酵素(isocitrate dehydrogenase)による還元的代謝はTCA回路のクエン酸を増やします。低酸素で増殖するがん細胞は、ミトコンドリア依存性の脂肪酸合成をバイパスするために還元的グルタミン代謝を使うことが報告されています。
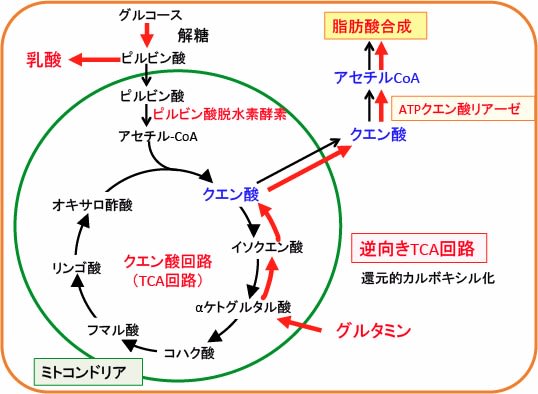
図:TCA回路で産生されるクエン酸は細胞質に出てATPクエン酸リアーゼでアセチルCoAに変換されて脂肪酸合成に使用される。急激に増殖する腫瘍のミトコンドリアでは、TCA回路の順行性の代謝に加えて、グルタミン由来のαケトグルタル酸がイソクエン酸脱水素酵素(isocitrate dehydrogenase)による還元的代謝によってTCA回路を逆行してクエン酸を増やしている。
細胞内ではエネルギー産生と物質合成とシグナル伝達系は密接にリンクしています。その中心となっているのがアセチルCoAです。
すなわち、糖や脂肪やタンパク質が分解(異化)されてアセチルCoAになり、アセチルCoAはとミトコンドリアでTCA回路と電子伝達系でエネルギー(ATP)を産生します。
このATPのエネルギーを使って、アセチルCoAは3-ヒドロキシ-3-メチルグルタリルCoA (HMG-CoA)からメバロン酸を経由してコレステロールを合成します。また、アセチルCoAはアセチルCoAカルボキシラーゼ(ACC)によってマロニルCoAとなり、脂肪酸合成酵素によって脂肪酸が合成されます。
さらに、アセチルCoAはタンパク質アセチル化のアセチル基のドナーとなり、タンパク質機能の制御に関わっています。
このように、アセチルCoAはエネルギー産生(異化)と物質合成(同化)とシグナル伝達のハブとなっているのです。従って、最初に紹介した論文で、「メトホルミンによるAMP活性化プロテインキナーゼ(AMPK)の活性化がタンパク質のアセチル化を誘導する」というメカニズムが理解できます。
AMPKは異化を促進し、同化を阻害して、細胞内のアセチル基を増やして、タンパク質のアセチル化を誘導して、シグナル伝達系に作用するというメカニズムです。
AMPKを活性化すると、物質合成(同化)が抑制され、タンパク質のアセチル化はがん細胞の増殖を抑制する方向で作用するので、AMPKの活性化ががん治療に役立つことが理解できます。

図:食事から摂取した糖と脂肪とタンパク質は、それぞれグルコース、脂肪酸、アミノ酸に分解されて体内に吸収され、細胞内で分解(異化)されてアセチルCoAになる(①)。アセチルCoAから、3-ヒドロキシ-3-メチルグルタリルCoA (HMG-CoA)とメバロン酸を経由してコレステロールが合成される(②)。アセチルCoAはマロニルCoAを経由して脂肪酸が合成される(③)。アセチルCoAはミトコンドリアでTCA回路と電子伝達系でエネルギー(ATP)を産生する(④)。さらに、アセチルCoAはタンパク質のアセチル化のアセチル基のドナーとなり、タンパク質機能の変化によってシグナル伝達系の制御にも関わっている(⑤)。このように、アセチルCoAはエネルギー産生(異化)と物質合成(同化)とシグナル伝達系のリンクの中心となっている。
【細胞内のエネルギー量を感知して代謝を制御するAMP活性化プロテインキナーゼ】
細胞内にはエネルギー(ATP)の量を感知してATP産生と消費を制御する仕組みがあります。その中心的役割を担っているのがAMP活性化プロテインキナーゼ (AMPK)というタンパク質です。
ブドウ糖欠乏や低酸素などにより細胞内ATP 量が減少すると、AMP/ATP 比の増加に伴いAMPKが活性化されます。AMPKはエネルギー消費の抑制(同化抑制)とエネルギー産生の亢進(異化促進)へと細胞の代謝をシフトさせる働きがあります。
AMPKは触媒作用を持つαサブユニットと、調節作用を持つβサブユットとγサブユニットから構成されるヘテロ三量体として存在します。運動やカロリー制限や虚血や低酸素などによってATPが減少してAMP/ATP比が上昇すると、γサブユニットに結合していたATPがAMPに置換します。これによってAMPKの構造変化が起こると、LKB1というリン酸化酵素の親和性が高まり、αサブユニットのスレオニン172がリン酸化されると、さらにAMPKの活性が高まります。カルモジュリンキナーゼキナーゼβ (CaMKKβ)もスレオニン172をリン酸化してAMPK活性を亢進します。活性化したAMPKは異化を亢進してエネルギー産生を亢進し、物質合成を抑制するように代謝をシフトします。
糖尿病治療薬のメトホルミンはミトコンドリアの呼吸鎖を阻害してATP産生を低下させる機序とLKB1を活性化する両方の機序でAMPKを活性化します。ビタミンD3は細胞内のフリーのカルシウムを増加させ、カルモジュリンキナーゼキナーゼβ (CaMKKβ)を活性化させてAMPK活性を亢進します。

図:AMPKは触媒作用を持つαサブユニットと、調節作用を持つβサブユットとγサブユニットから構成されるヘテロ三量体として存在する。細胞内のATPが減少してAMP/ATP比が上昇すると、γサブユニットに結合していたATPがAMPに置換する。これによってAMPKの構造変化が起こると、LKB1というリン酸化酵素の親和性が高まり、αサブユニットのスレオニン172がリン酸化されると、さらにAMPKの活性が高まる。カルモジュリンキナーゼキナーゼβ (CaMKKβ)もスレオニン172をリン酸化してAMPK活性を亢進する。活性化したAMPKは異化を亢進してエネルギー産生を亢進し、物質合成を抑制するように代謝をシフトする。
【メトホルミンはAMPKを活性化して脂肪酸合成を抑制する】
メトホルミン(metformin)は、世界中で1億人以上の2型糖尿病患者に使われているビグアナイド系経口血糖降下剤です。
メトホルミンは、ミトコンドリアの呼吸鎖の最初のステップである呼吸酵素複合体I を阻害することが明らかになっています。さらに、メトホルミンはミトコンドリアのグリセロールリン酸脱水素酵素(mitochondrial glycerol-phosphate dehydrogenase: mGDP)を阻害することも報告されています。その結果、ミトコンドリアでのATP産生が減少し、AMP:ATPの比が上昇し、AMP活性化プロテインキナーゼ(AMPK)が活性化されます。
活性化したAMPKは、肝臓の糖新生を抑制し、解糖を亢進し、骨格筋でのグルコース利用を促進して血糖を低下させます。
すなわち、メトホルミンの血糖降下作用はミトコンドリアにおけるATP産生の阻害によって体内のATP量が減少するためです。ATPを増やすために、グルコースの分解(異化)を促進し、糖新生(同化)を抑制するので血糖が低下します。
基本的には、運動と同じことです。運動も体内のATP量が減るので、グルコースの分解が促進されるように代謝が変わります。AMPK活性化において、メトホルミンは運動しないで運動と同じ効果を発揮します。
活性化したAMPKは、細胞内のATP量を増やすために異化を亢進し、同化を抑制します。
「異化」と言うのは高分子の物質を分解してエネルギー(ATP)を産生することで、「同化」はより低分子の化合物から高分子の生体成分を作り出すことです。つまり、メトホルミンはAMPKを活性化してタンパク質やグリコーゲンや糖質や脂肪酸やコレステロールの合成を阻害します。AMPKは脂肪酸合成を促進するアセチルCoAカルボキシラーゼと脂肪酸合成酵素の活性を阻害します(下図)。
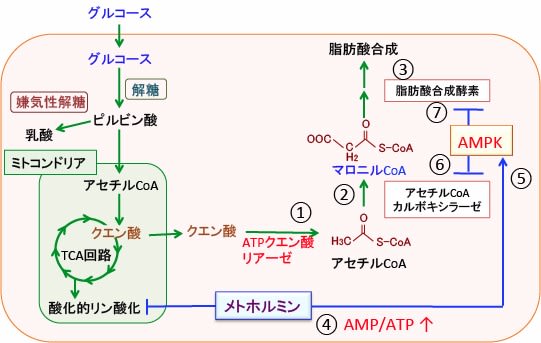
図: ミトコンドリアのTCA回路で生成されたクエン酸は、細胞質でATPクエン酸リアーゼによってアセチルCoAに変換され(①)、アセチルCoAカルボキシラーゼによってマロニルCoAに変換され(②)、脂肪酸合成酵素によって脂肪酸が合成される(③)。メトホルミンはミトコンドリアの呼吸酵素を阻害する機序でATP産生を阻害してAMP/ATP比を上昇させ(④)、AMP活性化プロテインキナーゼ(AMPK)を活性化する(⑤)。活性化したAMPKはアセチルCoAカルボキシラーゼ(⑥)と脂肪酸合成酵素を阻害する(⑦)。その結果、がん細胞の増殖を抑制する。
AMPKはスタチンと同様にHMG-CoA還元酵素(3-hydroxy-3-methylglutaryl-CoA reductase)の活性を阻害します。HMG-CoA還元酵素は、コレステロールやイソプレノイドを合成するメバロン酸経路の律速酵素の一つで、この酵素の阻害剤はスタチン (Statin)として知られ、コレステロール降下剤として広く用いられています。
メバロン酸はコレステロールの合成に必要なだけでなく、糖たんぱくの合成や、GTP結合タンパク質(Gタンパク質)のイソプレニル化に必要な物質(geranylpyrophophateやfarnesylpyrophosphate)を作ります。したがって、メバロン酸経路が阻害されると、がん細胞の増殖は抑えられことになります。
さらに、HMG-CoAはHMG-CoAリアーゼによってアセト酢酸に変換され、アセト酢酸はβヒドロキシ酪酸になります。
βヒドロキシ酪酸は脱アセチル化酵素阻害作用によってタンパク質のアセチル化を亢進します。
アセチルCoAはタンパク質のアセチル化のアセチル基のドナーになってタンパク質のアセチル化を亢進します。タンパク質のアセチル化はタンパク質機能を変化して、がん細胞の増殖を抑える効果を示します。メトホルミンやシンバスタチンによってHMG-CoA還元酵素や脂肪酸合成を阻害することは、直接的な抗腫瘍作用の他に、ケトン食を行っているときは、HMG-CoAからケトン体の合成へ向う経路を亢進することによって抗腫瘍効果を増強するのです。
したがって、ケトン食とメトホルミンとシンバスタチンの併用は相乗効果によって抗腫瘍効果を増強します。
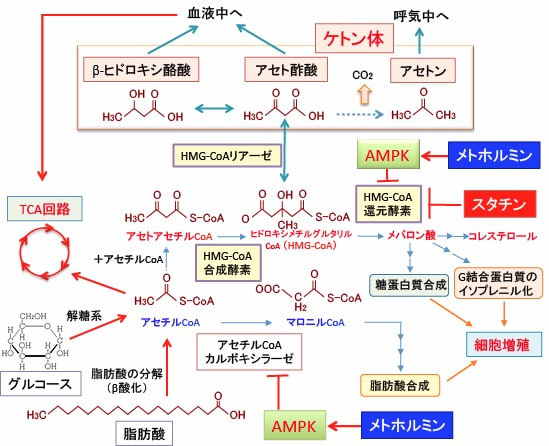
図:ヒドロキシメチルグルタリル-CoA(HMG-CoA)からメバロン酸に変換するHMG-CoA還元酵素を阻害すると、コレステロール合成の抑制だけでなく、がん細胞の増殖を抑える効果も得られる。一方、HMG-CoAはHMG-CoAリアーゼによってアセト酢酸に変換される。AMP活性化プロテインキナーゼ(AMPK)はHMG-CoAの活性を阻害するので、AMPKを活性化するメトホルミンもHMG-CoA還元酵素の作用を阻害する。スタチンやメトホルミンによってHMG-CoA還元酵素を阻害することは、直接的な抗腫瘍作用の他に、糖質制限やケトン食を行っているときは、HMG-CoAからケトン体の合成へ向う経路を亢進することによって抗腫瘍効果を示す可能性が示唆される。メトホルミンによって活性化されるAMPKは脂肪酸合成を阻害してがん細胞の増殖を阻害する効果もある。
【がん細胞はLKB1の異常が起こっている】
AMPKは細胞のエネルギー代謝を調節する因子として重要な役割を担っています。
AMPKは低グルコースや低酸素や虚血など細胞のATP供給が枯渇させるようなストレスに応答して活性化されます。
AMPKのγサブユニットにはATPが結合していますが、ATPが枯渇してAMP/ATP比が上昇すると、γサブユニットに結合していたATPがAMPに置き換わります。その結果、アロステリック効果(酵素の立体構造が変化すること)によってこの複合体は中等度(2~10倍程度)に活性化され、上流に位置する主要なAMPKキナーゼであるLKB1に対して親和性が高くなり、LKB1によってαサブユニットのスレオニン-172(Thr-172)がリン酸化されると、酵素活性は最大に活性化されます。LKB1はセリン・スレオニンキナーゼで、AMP活性化プロテインキナーゼ(AMPK)をリン酸化して活性化します。
この機序だと、LKB1に異常があると、AMPKの活性化が十分に起こらないことになります。
肺がんや子宮内膜がんなど多くのがんでLKB1遺伝子の変異が認められ、機能が失活しています。つまり、LKB1遺伝子に変異がある場合は、メトホルミンの抗腫瘍効果は期待できないことになります。
そこで、LKB1以外のルートでのAMPKの活性化ががん治療において重要になってきます。
アスピリンの体内代謝産物で活性本体であるサリチル酸がAMPKを直接活性化する作用があることが報告されています。(Science 336(6083):918-922, 2012)
LKB1以外では、カルモジュリンキナーゼキナーゼβ (CaMKKβ)もスレオニン-172(Thr-172)をリン酸化してAMPKを活性化することが示されています。
カルモジュリンキナーゼキナーゼβ(CaMKKβ)を活性化する方法として生薬の黄芩(おうごん)に含まれるバイカリンやビタミンD3が報告されています。
【バイカリンのAMPK活性化作用】
生薬の黄芩(おうごん)に含まれるバイカリンがLKB1を介さない機序でAMPKを活性化することが報告されています。以下のような報告があります。
CaMKKβ Is Involved in AMP-Activated Protein Kinase Activation by Baicalin in LKB1 Deficient Cell Lines(LKB1欠損細胞におけるバイカリンによるAMP活性化プロテインキナーゼの活性化にCaMKKβが関与している)
PLoS One. 2012; 7(10): e47900.
【要旨】
AMP活性化プロテインキナーゼ(AMPK)はエネルギー代謝において重要な役割を果たしており、その活性はシグナル伝達の上流に位置する2つのキナーゼ(リン酸化酵素)、すなわちLKB1とCa2+/カルモジュリン依存性プロテインキナーゼ・キナーゼ(CaMKKβ)によって制御されている。
以前の研究で我々は、中国伝統医学で使用される黄芩(おうごん:Scutellaria baicalensis)に含まれる主要なフラボノイドであるバイカリン(baicalin)が、高脂肪食で誘導される脂肪肝の発生を、AMPKの活性化を介する機序で阻止することを明らかにしている。しかし、AMPK活性化の機序については不明である。
この研究では、LKB1遺伝子が欠損したHeLa細胞 とA549細胞の2種類の細胞株において、バイカリンがAMPKのスレオニン172(Thr-172)のリン酸化を引き起こしてANPKを活性化し、その下流に位置するターゲットであるアセチル-CoAカルボキシラーゼのセリン-79(Ser-79)のリン酸化を起こすことを示した。
LKB1遺伝子が欠損したHeLa細胞 とA549細胞におけるバイカリンによるAMPKとアセチル-CoAカルボキシラーゼのリン酸化は、LKB1を発現しているHepG2細胞と同じレベルであった。
Ca2+/カルモジュリン依存性プロテインキナーゼ・キナーゼ(CaMKKβ)の選択的阻害剤のST0-609によってCaMKKβの活性を阻害すると、HeLa細胞とHepG2細胞の両方において、バイカリンによって誘導されるAMPKの活性化が阻害された。これは、バイカリンによるAMPKの活性化がCaMKKβによって起こっていることを示唆している。
バイカリンの添加によって、細胞内のカルシウムイオン(Ca2+)濃度が著明に上昇することが示された。この場合、HeLa細胞に比べてHepG2細胞では細胞内カルシウムの最高濃度は低かった。
細胞内のカルシウムイオン(Ca2+)をキレート剤のEDTAやEGTAを添加してキレート(結合)させたり、小胞体のCa2+-ATPaseの阻害剤であるthapsigarginによって細胞内の貯蔵カルシウムイオンを枯渇させると、HeLa細胞におけるバイカリンによるAMPKの活性化は阻止された。
バイカリンによって細胞内ATPの量や活性酸素の産生には変化は起こらなかった。最後に、HeLa細胞において、オレイン酸添加によって引き起こされる細胞内脂肪蓄積を、ST0-609でCaMKKβを阻害したあとではもはやバイカリンは減少できなかった。
これらの結果は、バイカリンによるAMPKの活性化はCa2+/CaMKKβ依存性の経路の関与していることを示しており、CaMKKβがAMPKの上流に位置するキナーゼ(リン酸化酵素)として作用している。
黄芩(オウゴン)はシソ科のコガネバナ(Scutellaria baicalensis)の根で、抗菌作用や抗炎症作用や抗がん作用があります。肥満や高脂血症にも効果が認められています。
フラボノイドのバイカリンやバイカレインやオウゴニンなどが含まれ、その抗炎症作用や抗がん作用に関する研究は数多くあります。がんの漢方治療でも使用頻度の高い生薬です。肥満や高脂血症にも効果が認められています。
この論文では、黄芩の主要なフラボノイドであるバイカリンがCaMKKβを活性化してAMPKを活性化するという効果を報告しています。したがって、LKB1に変異があるがん細胞にもAMPKを活性化できることになります。
【ビタミンD3はAMPKの活性化を亢進する】
ビタミンD3は細胞内のフリーのカルシウム濃度を上昇させてCa2+/カルモジュリン依存性プロテインキナーゼ・キナーゼ(CaMKKβ)を活性化します。
すなわち、AMPKを活性化するシグナル伝達の上流に位置する2つのキナーゼ(リン酸化酵素)、すなわちLKB1とCa2+/カルモジュリン依存性プロテインキナーゼ・キナーゼ(CaMKKβ)によって制御されています。したがって、メトホルミンとビタミンD3の併用はAMPKの活性を相乗的に高めることが示唆されます。
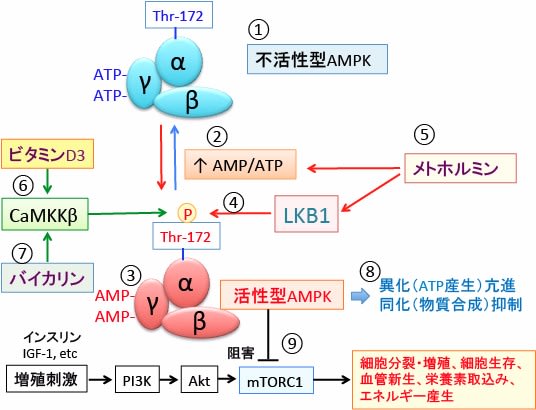
図:AMP活性化プロテインキナーゼ(AMPK)はα, β, γの3つのサブユニットからなるヘテロ三量体として存在する(①)。ATPが減少してAMP/ATP比が上昇すると(②)、γサブユニットに結合していたATPがAMPに置換する(③)。これによってAMPKの構造変化が起こると、LKB1というリン酸化酵素の親和性が高まり、αサブユニットのスレオニン172がリン酸化されると、さらにAMPKの活性が高まる(④)。メトホルミンはミトコンドリアの呼吸鎖を阻害してATP産生を低下させる機序とLKB1を活性化する両方の機序でAMPKを活性化する(⑤)。ビタミンD3は細胞内のフリーのカルシウムを増加させ、カルモジュリンキナーゼキナーゼβ (CaMKKβ)を活性化させてAMPK活性を亢進する(⑥)。生薬の黄芩(おうごん)に含まれるバイカリンもCaMKKβを活性化してAMPKを活性化する(⑦)。活性化したAMPKは異化を亢進してエネルギー産生を増やし、物質合成(同化)を抑制する(⑧)。活性化AMPKは哺乳類ラパマイシン標的タンパク質(mTORC1)を阻害して増殖を抑制する(⑨)。ビタミンD3や黄芩を使うとLKB1遺伝子に変異のあるがん細胞にもAMPKを効率的に活性化して抗がん作用を増強できる。AMPK活性化(スレオニン172がリン酸化)においてメトホルミンとビタミンD3と黄芩は相乗効果が期待できる。
ビタミンD3とメトホルミンの相乗効果に関しては多くの研究があります。 以下のような論文があります。
Synergistic antitumor activity of vitamin D3 combined with metformin in human breast carcinoma MDA-MB-231 cells involves m-TOR related signaling pathways. (ヒト乳がん細胞MDA-MB-231細胞におけるビタミンD3とメトホルミンの併用による相乗的な抗腫瘍効果はmTOR関連のシグナル伝達系が関与する)Pharmazie. 2015 Feb;70(2):117-22.
この研究では、ヒト乳がん細胞株MDA-MB-231を用いて、ビタミンD3とメトホルミンの併用はアポトーシス誘導において相乗効果があることを報告しています。
その抗腫瘍効果の発現にはmTOR関連のシグナル伝達系が関与することを報告しています。
つまり、ビタミンD3とメトホルミンはmTOR(哺乳類ラパマイシン標的蛋白質)の活性を阻害することによってアポトーシスを誘導することを示しています。
前立腺がんや大腸がんでも同様の効果が報告されています。
Vitamin D3 potentiates the growth inhibitory effects of metformin in DU145 human prostate cancer cells mediated by AMPK/mTOR signalling pathway.(ビタミンD3はAMPK/mTORシグナル伝達系を介して、DU145ヒト前立腺がん細胞に対するメトホルミンの増殖阻害作用を増強する)Clin Exp Pharmacol Physiol. 2015 Jun;42(6):711-7.
ヒト前立腺がん細胞を含めた多くの種類のがん細胞株に対して、メトホルミンとビタミンD3はともに強力な増殖抑制作用を示します。
この論文では、DU145ヒト前立腺がん細胞の増殖を、メトホルミンとビタミンD3を単独で投与した場合に比べて、この2つの薬の併用はより強力な増殖抑制効果を示すことを示しています。
培養したDU145細胞において、ビタミンD3とメトホルミンは細胞増殖阻害とアポトーシス誘導において相乗効果を示しました。
この抗腫瘍効果のメカニズムとして細胞周期でのG1/S期での停止、AMP依存性プロテインキナーゼ(AMPK)の活性化とそれによるmTORシグナル伝達系の阻害、がん遺伝子のc-Mycの発現抑制、アポトーシス抵抗性のBcl-2たんぱく質の発現低下の関与が示唆されました。
この2つの薬の併用がホルモン非依存性の前立腺がんの治療に使える可能性を示唆しています。
前述のようにメトホルミンはAMPKを活性化してAkt/mTORシグナル伝達系を抑制し、抗腫瘍効果を発揮します。
ビタミンD3はメトホルミンのAkt/mTORシグナル伝達系の抑制効果を増強して、アポトーシス誘導を亢進するという作用機序です。
Combined use of vitamin D3 and metformin exhibits synergistic chemopreventive effects on colorectal neoplasia in rats and mice. (ビタミンD3とメトホルミンの併用はラットとマウスの結腸直腸がんの発生に対して相乗的な化学予防効果を示す)Cancer Prev Res (Phila). 2015 Feb;8(2):139-48.
この研究はラットとマウスを用いた大腸発がん実験での検討です。
メトホルミンは化学発がんモデルで大腸がんの発生を抑制する作用があります。ビタミンD3はメトホルミンの発がん抑制作用を増強するという結果です。
そのメカニズムとして、mTOR活性の抑制を認めています。
さらに、ビタミンD3にはビタミンD受容体/β-カテニンのシグナル伝達系に作用してβ-カテニンの働きを抑制することによってc-MycやサイクリンD1の発現を抑制する作用も指摘しています。
ビタミンD3とメトホルミンの併用は、相乗効果によって発がん抑制や抗腫瘍効果を高めることができるという結論です。
以上のような研究から、がん細胞のAMPKを活性化して増殖や生存を阻害する方法として、ケトン食、メトホルミン、シンバスタチン、ビタミンD3、黄芩の入った漢方薬の組み合わせは効く可能性があります。さらに解糖系を阻害する2-デオキシ-D-グルコースや、ビルビン酸脱水素酵素を活性化してミトコンドリアでの酸化的リン酸化を促進するジクロロ酢酸の併用は、さらに抗腫瘍効果を高めます。
このようながん細胞の代謝の特徴をターゲットにした治療法を多数のがん患者さんに試してもらっていますが、副作用はほとんど経験しません。がんの種類や進行状況によってケースバイケースですが、抗腫瘍効果と副作用を総合的に評価すると、通常の抗がん剤治療より有効性は高い実感はあります。副作用がほとんど無く、がん細胞の増殖を有意に抑えることができれば、それはがん治療として有用性は高いと思います。
新刊紹介

(ご購入はこちらへ)
銀座東京クリニックでも販売しています(詳細はこちらへ)
| « 636)シンバス... | 638) 植物に含... » |



