がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
638) 植物に含まれるイソプレノイドはスタチンの抗腫瘍効果を増強する
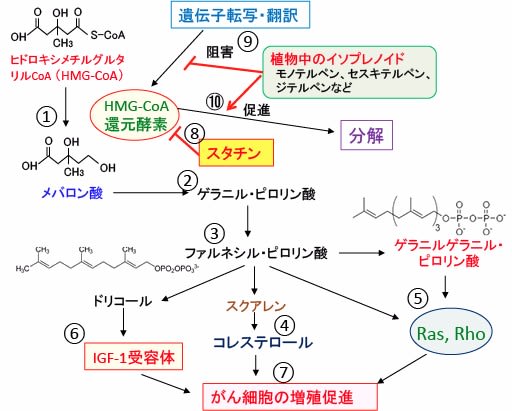
図:アセチルCoAからコレステロールを合成するメバロン酸経路においては、3-ヒドロキシ-3-メチルグルタリル補酵素A(HMG-CoA)がHMG-CoA還元酵素によってメバロン酸に変換される反応からスタートし、このHMG-CoA還元酵素がメバロン酸経路の律速酵素になっている(①)。メバロン酸からゲラニル・ピロリン酸(②)、ファルネシル・ピロリン酸(③)が合成され、さらにコレステロールが合成される(④)。ファルネシル・ピロリン酸からゲラニルゲラニル・ピロリン酸が合成され、このゲラニルゲラニル・ピロリン酸とファルネシル・ピロリン酸は低分子量Gタンパク質のRasやRhoの活性化に必要(⑤)。さらにメバロン酸経路の中間代謝産物はインスリン様成長因子-1(IGF-1)受容体の活性化にも関与する(⑥)。これらはがん細胞の増殖を促進する(⑦)。高脂血症治療薬のスタチンはHMG-CoA還元酵素とHMG-CoAとの結合を競合阻害することによって活性を阻害する(⑧)。植物中に多く含まれるイソプレノイド(モノテルペン、セスキテルペン、ジテルペンなど)もメバロン酸経路で合成される中間代謝産物で、これらのイソプレノイドはHMG-CoAの遺伝子転写や翻訳を阻害し(⑨)、HMG-CoAの分解を促進する(⑩)。したがって、植物に含まれるイソプレノイドはスタチンの抗がん作用を相乗的に高める。
638) 植物に含まれるイソプレノイドはスタチンの抗腫瘍効果を増強する
【コレステロールはアセチルCoAを材料にして体内で合成される】
コレステロールは、動物細胞にとっては生体膜の構成物質の一つであり、細胞膜の流動性や機能の調節に重要な働きを行っています。さらにシグナル伝達など様々な生命現象に関わる重要な化合物で、生体内に広く分布します。
コレステロールは食物にも含まれていますが、体内のコレステロールのうち、食事由来は3割程度で、7割くらいは糖質や脂肪酸を材料にして体内(肝臓や皮膚、腸粘膜、副腎、卵巣、精巣など)で合成されています。
コレステロールはアセチルCoA(グルコースや脂肪酸などの分解によって生成される)からメバロン酸を経由して合成されます。この生合成経路をメバロン酸経路と言います。
メバロン酸経路の律速酵素は3-ヒドロキシ-3-メチルグルタリルCoAレダクターゼ(3-hydroxy-3-methylglutaryl-CoA reductase ;HMG-CoA還元酵素)です。
一連の化学反応系において、全体の反応速度を決定する反応を律速段階と言い、その反応に関わる酵素を律速酵素と言います。律速(りっそく)というのは「速さ」を「律する(制御する)」という意味で、「全体の反応速度を決める」という意味の用語です。
例えば、ボトル(瓶)に水を入れて、逆さまにして水を出すとき、水が出る速さを決めるのは、ボトルの首(ネック)の部分の大きさになります。化学反応においてボトルネックと同じ役割を担うのが律速酵素です。
HMG-CoA還元酵素を阻害すると肝臓でのコレステロール生合成を抑制することができるため、多くのHMG-CoA還元酵素阻害剤が開発され高脂血症治療薬として臨床で使われています。
このようなHMG-CoA還元酵素の働きを阻害することによって血液中のコレステロ-ル値を低下させる薬(HMG-CoA還元酵素阻害剤)の総称をスタチン(Statin)といいます。
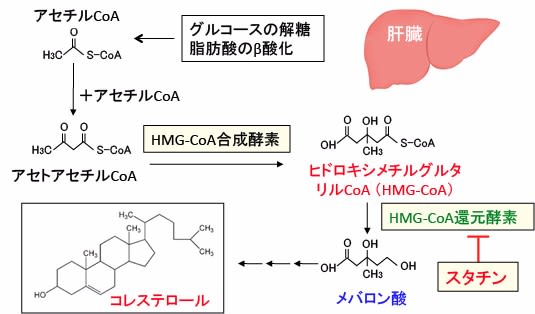
図:スタチンは肝臓においてヒドロキシメチルグルタリル-CoA(HMG-CoA)からメバロン酸に変換するHMG-CoA還元酵素を阻害することによってコレステロール合成を抑制する。
最初のスタチンであるメバスタチンは1973年に青カビの一種から発見され、それ以降、様々な種類のスタチンが開発され、高コレステロール血症の治療薬として世界各国で使用されています。近年の大規模臨床試験により、スタチンは高脂血症患者での心筋梗塞や脳血管障害の発症リスクを低下させる効果があることが明らかにされています。
【メバロン酸経路の中間代謝産物ががん細胞の増殖を亢進する】
がん細胞が細胞分裂で細胞の数を増やすためには、細胞膜を構成ずる脂肪酸やコレステロールの合成を増やす必要があります。さらに、メバロン酸経路で産生される中間代謝産物が、がん細胞の増殖の維持と促進に重要な働きを担っています。そのために、がん細胞ではメバロン酸経路での代謝が亢進しています。
例えば、細胞内シグナル伝達系のスイッチとして働くGTP結合タンパク質の機能にメバロン酸経路の中間代謝産物のファルネシル・ピロリン酸とゲラニルゲラニル・ピロリン酸が必要です。
GTP結合タンパク質(Gタンパク質)は内在性のGTP加水分解(GTPase)活性をもつタンパク質の総称で、この内、低分子量Gタンパク質群(Ras, Rho,など)は分子量が2万~3万のタンパク質で、これまで100種類以上報告されています。RasやRhoはがん遺伝子として知られています。
Gタンパク質はGTP結合型(on)/GDP結合型(off)として細胞内シグナル伝達に関与しています。
すなわち、Gタンパク質はGDP結合不活性型とGTP結合活性型の間をサイクル(GTPaseサイクル)することにより、細胞外からの情報を細胞内に伝達します。
Rasは21kDaの分子量の単量体GTPaseです。
Rasは細胞外のさまざまな刺激、例えばチロシンキナーゼ受容体やサイトカイン受容体やカルシウムチャネルなどの刺激を受けてGDPが結合した不活性の状態からGTPに結合した活性化の状態に移行します。このGDP/GTP交換反応を促進するのがGEF(guanine-nucleotide exchange factors)です。
またGTPに結合したRasは内在性のGTPaseによりGDP結合型に戻りますが、この反応を促進するのがGTPase-activating proteins(GAP)です。
活性化したGTP結合型のRasは幅広い下流のターゲット(effectors)と相互作用をし、下流のシグナルを活性化します。そのeffectorとして細胞増殖や生存を促進するRafキナーゼやPI-3 キナーゼなど多数のシグナル伝達系が知られています。がん細胞ではRasタンパク質の変異によって、GTPが結合した状態の活性型が持続して、細胞の増殖や運動や生存が促進されています。

図:(左)正常細胞では、低分子量GTP結合タンパク質のRasは、細胞外のさまざまな刺激を受けてGDP/GTP交換反応を促進するGEF(guanine-nucleotide exchange factors)の作用によって(①)、GDPが結合した不活性の状態からGTPに結合した活性化の状態に移行し(②)、シグナル伝達の下流に位置するエフェクターを活性化し、細胞増殖やアポトーシスや遺伝子発現を制御する(③)。GTPに結合したRasは内在性のGTPaseによりGDP結合型に戻るが、この反応はGTPase-activating proteins(GAP)で促進される(④)。
(右)がん細胞では、Rasタンパク質は変異し、スイッチが常時オンの状態になっている(⑤)。GAPによるGTPの分解もできない(⑥)。活性化したGTP結合型のRASは下流のターゲット(エフェクター)と相互作用をし、下流のシグナル伝達系を活性化する(⑦)。そのエフェクターとして細胞増殖や生存を促進するRAFキナーゼ(RAF/MEK/ERK経路)やPI-3 キナーゼ(PI3K/AKT/mTORC1経路)など多数のシグナル伝達系が知られている。その結果、がん細胞ではRasタンパク質の変異によって、GTPが結合した状態の活性型が持続して、細胞の増殖と生存が促進されている。
さて、RasやRhoといったGTP結合タンパク質(Gタンパク質)が機能を発揮するためにはGタンパク質がプレニル化をいう修飾を受ける必要があります。
プレニル化反応(Prenylation)とは、疎水性のプレニル基を付加する反応のことです。
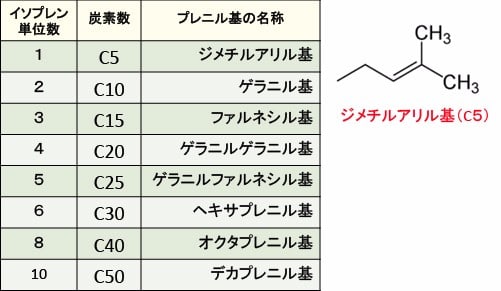
プレニル基とは、炭素数5のイソプレン単位で構成される構造単位の総称で、各プレニル基にはイソプレン単位数によって下の表のような呼び名がついています。
RasやRhoなどの低分子量Gタンパク質は、そのほとんどでC末端から4番目のアミノ酸残基がシステインであり、ファルネシル基やゲラニルゲラニル基などの脂肪酸が結合しており、この脂質修飾により、細胞膜に直接結合できると考えられています。
すなわち、低分子量Gタンパク質はイソプレニル化(ファルネシル基やゲラニルゲラニル基の結合)を受けた後に細胞膜に移行し、GTP結合型(on)/GDP結合型(off)としてGDP結合不活性型とGTP結合活性型の間をサイクル(GTPaseサイクル)することにより、細胞外からの情報を細胞内に伝達します。

図:タンパク質にファルネシル基やゲラニルゲラニル基が結合すると細胞膜と結合できるようになる。
KRasは、上皮成長因子受容体(EGFR)のシグナル伝達経路において重要な役割を担うタンパク質です。そのシグナル伝達経路は複雑なカスケードを構成し、がんの発生と進行に関与しています。特に、膵臓がんのほとんどでKRas遺伝子の変異による異常活性化が認められています。
KRasは、ファルネシル化を受けて細胞膜に結合することによって機能を果たすことができます。
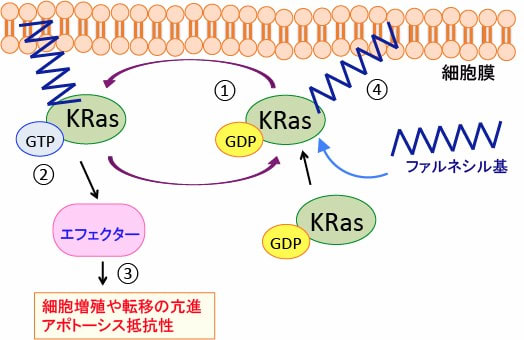
図:低分子量Gタンパク質の一種のKRasは、GDP結合型が不活性型で(①)、上皮成長因子受容体などからの刺激を受けてGTP結合型となって活性化され(②)、エフェクタータンパク質に作用して情報を伝達し、細胞の増殖や転移を亢進し、アポトーシス(細胞死)に抵抗性になる(③)。KRasが細胞膜の脂質に接着するときにファルネシル基と結合する必要があり、これができないとKRasは活性化できない(④)。
また、がん細胞の増殖を促進するインスリン様成長因子-1(IGF-1)の受容体の働きにも、メバロン酸経路の代謝産物が必要で、メバロン酸経路の阻害がIGF-1受容体の働きを阻害して、がん細胞の増殖を抑制することが知られています。
このように、がん細胞のメバロン酸経路を阻害することは、がん細胞の増殖を抑制することになります。
【脂肪酸やコレステロールの産生はフィードバック阻害によって調節されている】
HMG-CoA還元酵素を阻害するスタチンには水溶性のものと脂溶性のものがあり、がん細胞に対する効果を期待するには脂溶性のものを使う必要があります。
水溶性スタチンは肝臓細胞膜に存在する有機アニオン輸送担体によって細胞内に取り込まれるので、肝細胞に選択的に取り込まれます。
脂溶性スタチンは細胞膜透過性が良いので、あらゆる臓器・組織の細胞内へ移行し得えます。
つまり、肝臓におけるコレステロール産生を抑制する目的では、他の細胞に影響が少ない点で水溶性スタチンの方が良いのですが、がん細胞に取り込まれて、メバロン酸経路を阻害して増殖抑制効果を期待するには脂溶性のものである必要です。
スタチンの中で最も脂溶性の高いのがシンバスタチン(simvastatin)で、がんの患者さんがシンバスタチンを服用すると再発率が顕著に低下することが報告されています(636話参照)。

図:3-ヒドロキシ-3-メチルグルタリル補酵素A(HMG-CoA)がHMG-CoA還元酵素によってメバロン酸に変換され(①)、メバロン酸からゲラニル・ピロリン酸(②)、ファルネシル・ピロリン酸(③)が合成され、さらにコレステロールが合成される(④)。ファルネシル・ピロリン酸からゲラニルゲラニル・ピロリン酸が合成され、このゲラニルゲラニル・ピロリン酸とファルネシル・ピロリン酸は低分子量Gタンパク質のRasやRhoの活性化に必要(⑤)。さらにメバロン酸経路の中間代謝産物はインスリン様成長因子-1(IGF-1)受容体の活性化にも関与する(⑥)。これらはがん細胞の増殖を促進する(⑦)。高脂血症治療薬のスタチンはHMG-CoA還元酵素とHMG-CoAとの結合を競合阻害することによって活性を阻害する(⑧)。
さて、コレステロール合成やメバロン酸経路の阻害の目的であれば、スタチンの使用だけで目的を達成できるようにも思います。
しかし、これには問題もあります。スタチンでHMG-CoA還元酵素の活性を阻害すると、細胞はHMG-CoA還元酵素の発現を増やしたり、分解を阻止して、HMG-CoA還元酵素の量を増やすメカニズムが作動するからです。
多くの酵素反応はフィードバック機序で制御されており、HMG-CoAの活性が阻害されると、その産生産物(コレステロールなど)の低下を感知して、細胞はHMG-CoAの量を増やすのです。
代謝系のある段階の反応が、その系の下流の産物によって阻害されることをネガティブフィードバック調節と言います。代謝経路でその後に続く産物が高濃度に存在すると、その代謝系での反応がそれ以上必要ないので、酵素活性を阻害して反応を止める制御です。
一方、ある経路の産物が過剰に存在すると、それが他の経路の反応をスピードアップして、過剰に存在する物質を他の経路での代謝に振り替える調節をポジティブフィードバック調節と言います。

図:ある産物が過剰に蓄積した場合に、その産物によって上流の酵素反応が阻害されることによってその産物の合成が止められる(ネガティブフィードバック)。場合によっては、同じ材料(図のC)を使う他の反応系を促進することによって合成が調節される(ポジティブフィードバック)。
このようなフィードバック調節は生成物による酵素のアロステリック制御により行われます。
アロステリック制御というのは、酵素にある物質が結合すると構造変化が起こって機能が変化する現象です。「アロステリック」とは 「別の形」 を意味する用語です。
酵素の構造の変化によって、活性が阻害される場合(アロステリック阻害)と促進される場合(アロステリック促進)があります。

図:酵素のアロステリック部位に制御物質が結合して酵素活性が促進する場合を「アロステリック促進」と言う。一方、酵素のアロステリック部位に制御物質が結合して酵素活性が阻害される場合を「アロステリック阻害」という。
コレステロールは多くの生物学的過程で必須な働きを担っているので細胞内のコレステロール量が不足すると細胞機能に支障をきたします。しかし、コレステロールが過剰に合成されると細胞に毒性を示します。従って、細胞内のコレステロールのレベルを感知してコレステロール合成を調節する仕組みが必要になります。
コレステロール合成の律速段階を制御するのは小胞体膜上に局在するHMG-CoA還元酵素です。
AMP活性化プロテインキナーゼ(AMPK)はこの酵素をリン酸化して活性を阻害します。
細胞内のATP量が低下すると、AMPKが活性化して、異化(脂肪酸やグルコースの酸化)が促進され、同化(脂肪酸やコレステロールの合成)が抑制されます。AMPKを活性化するメトホルミンはHMG-CoAを阻害したコレステロールの合成を低下させます。(636話参照)
コレステロール合成の調節は、細胞内のコレステロールと他のステロールの濃度の変動を感知することによって達成されます。
コレステロールは膜に埋め込まれており、ステロールセンシングドメインを含む小胞体に埋め込まれたHMG-CoA還元酵素とSCAP(SREBP cleavage-activating protein)によって膜でステロール濃度の変化が感知されます。
HMG-CoA還元酵素は自身のステロールセンシングドメインによってステロールの増加を検出することによってINSIG(insulin-induced gene:インスリン誘導遺伝子)-1およびINSIG-2と呼ばれる2つの他の小胞体タンパク質と結合し、ユビキチン・リガーゼに結合します。これはHMG-CoA還元酵素のプロテアソームでの分解を引き起こします。つまり、コレステロールが多くなるとHMG-CoA還元酵素の分解が促進されるという制御機構が存在します。
SCAPは転写因子SREBP(sterol regulatory element-binding protein:ステロール調節エレメント結合タンパク質)ファミリーの活性化に必須です。
SREBPはコレステロールと脂肪酸合成に関与する遺伝子を調節しています。
SREBPは転写因子の塩基性ヘリックス・ループ・ヘリックス・ロイシンジッパー(bHLH-Zip)ファミリーに属しています。
SREBPは小胞体に付着する不活性前駆体として合成され、転写活性を持つためには核に到達する必要があります。
コレステロール値が低くなると、SCAPがSREBPに結合し、それを小胞体からゴルジ体に誘導されます。
ついで、SREBPはSite-1とSite-2プロテアーゼによって連続したタンパク質プロセシングをうけて、ゴルジ体膜からN末端のbHLH-Zip領域が遊離します。
このbHLH-Zip領域は核に入り、標的遺伝子のエンハンサー/プロモーター領域の中のステロール調節配列(Sterol Regulatory Element: SRE)に結合して転写を活性化します。
コレステロールが増加すると、SCAPはINSIGに結合し、小胞体膜にあるSREBP複合体を捕捉します。するとSREBPはゴルジ体に到達することができず、bHLH-Zip領域が放出されないため、遺伝子の転写も活性化されません。したがって、脂肪酸やコレステロールの合成はストップします。
SREBP は転写因子にもかかわらず、小胞体に膜結合型の蛋白として合成されるユニークな蛋白で、この小胞体にある SREBP が、コレステロールが低下すると、転写活性のある部分が切り離されて、核にある遺伝子に結合して機能を発揮するのです。(実際はもっと複雑なメカニズムですが、難解すぎるので簡略化してまとめています)

図:転写因子のSREBP(sterol regulatory element-binding protein:ステロール調節エレメント結合タンパク質)は小胞体に付着する不活性前駆体として存在する。膜のコレステロールが少ないときはInsig(insulin-induced gene:インスリン誘導遺伝子)と結合して小胞体に留まっている(①)。コレステロール値が低くなると、SCAP(SREBP cleavage-activating protein)とSREBPは小胞体からゴルジ体に誘導される(②)。SREBPはSite-1とSite-2プロテアーゼによって連続したタンパク質プロセシングをうけて、ゴルジ体膜からN末端の塩基性ヘリックス・ループ・ヘリックス・ロイシンジッパー(bHLH-Zip)領域が遊離する(③)。遊離したbHLH-Zip領域は核に移動し(④)、標的遺伝子のエンハンサー/プロモーター領域の中のステロール調節配列(sterol regulatory element: SRE)に結合して転写を活性化する(⑤)。その結果、脂肪酸合成やコレステロール合成やコレステロール取込みに関与するタンパク質が作られる(⑥)。インスリンは脂肪酸合成を促進する遺伝子発現に関与するSREBP-1を活性化する(⑦)。ステロールはコレステロール合成を促進するSREBP-2の活性化を阻害する(⑧)。(Semin Liver Dis. 2013 Nov; 33(4): 301–311.のFig1を日本語に改変)
【イソプレノイドはメバロン酸経路で産生される】
動物や植物には膨大な数の代謝産物が存在します。その中に「イソプレノイド」というグループがあります。
イソプレノイド(isoprenoid)というのは、C5単位の「イソプレン」が複数個結合してできた天然有機化合物群です。
「イソプレン」と呼ばれる構造は炭素5個と水素8個(C5H8)でできています。このイソプレン構造が鎖状や環状に結合して、低分子の精油成分(炭素10個のモノテルペン類、炭素15個のセスキテルペン類など)や、高分子のコレステロールやカロテノイドやユビキノンなどが作られます。

基本単位のイソプレンは、メバロン酸経路のイソペンテニル二リン酸(IPP)が生合成前駆体です(下図)。つまり、植物に含まれるテルペノイドやステロイドはほとんどメバロン酸経路由来です。

【植物に含まれるイソプレノイドはスタチンの抗腫瘍効果を増強する】
メバロン酸経路の阻害はがん細胞の増殖抑制や細胞死を誘導します。HMG-CoA還元酵素の活性をスタチンで阻害することは一つの方法です。
メバロン酸経路のフィードバック制御の仕組みを利用すると、HMG-CoA還元酵素の発現を抑制し、分解を促進することができます。つまり、細胞内のイソプレノイドを増やすとメバロン酸経路を抑制できます。以下のような報告があります。
Plant-derived monoterpenes suppress hamster kidney cell 3-hydroxy-3-methylglutaryl coenzyme a reductase synthesis at the post-transcriptional level.(植物由来モノテルペンはハムスター腎臓細胞の3‐ヒドロキシ‐3‐メチルグルタリル補酵素A還元酵素の合成を転写後レベルで抑制する)J Nutr. 2003 Jan;133(1):38-44.
【要旨】
哺乳動物細胞におけるメバロン酸およびコレステロール合成の律速酵素は、3-ヒドロキシ-3-メチルグルタリル-CoA(HMG-CoA)還元酵素である。HMG-CoA還元酵素の制御は、最終産物であるコレステロールや中間代謝産物のイソプレノイド中間体によって転写および転写後作用の両方を通して起こる。
植物メバロン酸代謝の生成物、すなわち植物由来イソプレノイドもまた哺乳動物HMG-CoA還元酵素を抑制する。
以前の研究で、イソプレノイドが転写後レベルでHMG-CoA還元酵素の合成を抑制することを報告した。我々は、ロバスタチンで処理したC100細胞をメバロン酸または植物由来イソプレノイド(モノテルペン、リモネン、ペリリルアルコールまたはゲラニオール)を単独、あるいはオキシステロールや25-ヒドロキシコレステロール(25-OH C)と併用で培養することによって、植物由来イソプレノイドが転写後レベルで哺乳動物HMG-CoA還元酵素の合成も調節するという仮説を検証した。
メバロン酸はHMG ‐ CoA還元酵素のタンパク質レベルとmRNAレベルをそれぞれ65と66%減少させた(P <0.05)。
環状モノテルペンのリモネンおよびペリリルアルコールは、HMG-CoA還元酵素の合成をそれぞれ70および89%低下させた(P 非環式モノテルペンのゲラニオールはHMG-CoA還元酵素の合成を98%抑制し、mRNAレベルを66%低下させた(P <0.05)。
25-OH Cとメバロン酸または任意の3つのモノテルペンの組み合わせは、ロバスタチンのみで処理した細胞と比較して、HMG-CoA還元酵素のmRNAレベルを低下させた(P HMG-CoA還元酵素の合成とmRNAレベルの変化の違いは、翻訳レベルでのHMG-Co還元酵素の合成に対するイソプレノイドの特異的な影響を反映しています。
メバロン酸はHMG-CoA還元酵素の分解を促進したが、そのような効果はモノテルペンについては観察されなかった。
これらの結果は、3つの植物由来イソプレノイドが主にHMG-CoA還元酵素のmRNAの翻訳効率を減弱させることによって転写後レベルでHMG-CoA還元酵素の合成を抑制することを示している。
植物に多く含まれるテルペノイドがHMG-CoA還元酵素の転写後のmRNAの翻訳を抑制して、HMG-CoA還元酵素の合成を抑制するという結果です。以下のような論文もあります。
Studies of the isoprenoid-mediated inhibition of mevalonate synthesis applied to cancer chemotherapy and chemoprevention. (がんの化学療法および化学予防への応用のためのメバロン酸合成のイソプレノイド媒介性阻害の研究)Exp Biol Med (Maywood). 2004 Jul;229(7):567-85.
【要旨】
ファルネシル・ピロリン酸およびメバロン酸経路の他のリン酸化生成物は、低分子量Gタンパク質や核のラミンや増殖因子受容体のたんぱく質の翻訳後修飾ならびに生理学的機能にとって不可欠である。
これらの化合物を合成する酵素活性、すなわちHMG-CoA還元酵素およびメバロン酸 - ピロリン酸デカルボキシラーゼの阻害剤、ならびにこれらの化合物を利用する酵素のプレニルタンパク質トランスフェラーゼの阻害剤は、新規の抗がん剤として開発できる可能性を有する。
HMG-CoA還元酵素の阻害剤(スタチン)、メバロン酸 - ピロリン酸デカルボキシラーゼの阻害剤(フェニル酢酸ナトリウムおよびフェニル酪酸ナトリウム)、ファルネシルタンパク質トランスフェラーゼの阻害剤(R115777, SCH66336, BMS-214662, Tipifarnib, L-778,123, and, prematurely, perillyl alcohol)の第I相および第II相試験の結果から、その臨床的効果は示唆されている。しかし、これらの薬物の臨床的有効性は用量制限性の毒性によって弱められている。
これらの非特異的な成長抑制剤は、細胞周期のG1停止を誘導し、アポトーシスおよび分化を誘導する。このような作用は、遺伝子発現の制御、シグナル伝達系のタンパク質および増殖因子受容体の翻訳後プロセシングの阻害、またはジアシルグリセロール(diacylglycerol)シグナル系の変化による細胞シグナル経路の制御に起因する。
多様なイソプレノイド、およびHMG-CoA還元酵素の阻害剤のロバスタチンは、細胞増殖を調節し、細胞周期停止を誘導し、アポトーシスを開始し、そして細胞シグナル伝達活性を抑制する。
臨床上最も重要なイソプレノイドであるペリリルアルコール(Perillyl alcohol)は、当初はファルネシルタンパク質トランスフェラーゼを阻害すると考えられていたが、その後の研究で、ペリリルアルコールが低分子量Gタンパク質およびHMG CoA還元酵素の合成を抑制することを明らかにした。
ステロイド産生組織では、ステロール調節エレメント結合タンパク質(sterol regulatory element binding proteins:SREBP)1aおよび2によって媒介されるステロールによるフィードバック制御が、転写レベルでのHMG-CoA還元酵素活性の一次的調節となっている。二次的な調節、すなわちHMG-CoA還元酵素活性の非ステロール性イソプレノイドによる微調整は、酵素タンパク質の翻訳および分解のレベルで起こる。
がん組織におけるHMG-CoA還元酵素活性は亢進しており、ステロールによるフィードバック制御に抵抗性を示す。これは、ステロール調節エレメント結合タンパク質(SREBP)の異常によると思われる。しかしながら、がん組織のHMG-CoA還元酵素はイソプレノイドを介した転写後制御による抑制には良く反応する。
非環式セスキテルペン(acyclic sesquiterpene)であるファルネソール(Farnesol)、ならびにファルネシル類縁体(farnesyl homologs)、ガンマ - トコトリエノール(gamma-tocotrienol)および様々なファルネシル誘導体は、HMG-CoA還元酵素の合成を阻害し、分解を促進する。
環状モノテルペン(Cyclic monoterpenes)であるd-リモネン(d-limonene)、メントール(menthol)、ペリリルアルコール(perillyl alcohol)、ならびにカロテノイド・フラグメントのベータ - イオノン(beta-ionone)はHMG-CoA還元酵素の量を減少させる。
ペリリルアルコールおよびd-リモネンは翻訳効率を調節することによりHMG-CoA還元酵素の量を低下させる。
がん細胞の増殖を維持するためには、HMG-CoA還元酵素の発現の上昇および非ステロール生成物の需要が増大する。これは、がん組織におけるHMG-CoA還元酵素のイソプレノイドに対する感受性を増幅し、その結果、がん細胞はイソプレノイド媒介性増殖抑制に対して正常細胞よりも応答性が高くなる。
HMG CoA還元酵素の強力な非選択的阻害剤であるロバスタチンと、腫瘍に特異的に転写後にHMG-CoA還元酵素活性を減弱させることが示されているγ-トコトリエノールの併用は、ヒトDU145およびLNCaP前立腺がん細胞の増殖を相乗的にする。
メバロン酸合成のイソプレノイド媒介性阻害は、ロバスタチンや他の非選択的メバロン酸経路阻害剤の高用量投与で問題になる用量制限毒性の無い、新規の化学療法戦略となる可能性がある。
がん細胞はステロール調節エレメント結合タンパク質(SREBP)の異常があるので、ステロールによるHMG-CoA還元酵素のフィードバック制御に抵抗性を示します。しかし、がん細胞のHMG-CoA還元酵素はイソプレノイドを介した転写後制御による抑制には良く反応するという事です。したがって、植物由来のイソプレノイドの摂取がメバロン酸経路の阻害によって抗腫瘍活性を示すという内容です。
ペリリルアルコールは、ラベンダー、レモングラス、セージ、ペパーミントなどの様々な植物の精油に含まれます。ペリリルアルコールはリモネンから作られます。リモネンは柑橘類などの植物の精油に含まれます。リモネンやペリリルアルコールはメバロン酸経路のゲラニルピロリン酸から形成される単環式テルペンです。
ファルネソール (farnesol) は、直鎖セスキテルペンの一種のテルペノイド系有機化合物です。バラやレモングラス、シトロネラの精油に含まれそれらの芳香をもたらす成分の一つです。最も単純なセスキテルペンで、多くのセスキテルペンの前駆体になります。
サプリメントとして市販されているトコトリエノールもメバロン酸経路を阻害することが報告されています。
Tocotrienols potentiate lovastatin-mediated growth suppression in vitro and in vivo.(in vitroおよびin vivoの実験系において、トコトリエノールはロバスタチンによる増殖抑制を増強する)Exp Biol Med (Maywood). 2007 Apr;232(4):523-31.
【要旨】
3-ヒドロキシ-3-メチルグルタリル補酵素A(HMG-CoA)還元酵素は、メバロン酸経路における律速酵素であり、メバロン酸経路は増殖関連タンパク質の膜固定および生物学的機能のために必須の中間体を提供する。
HMG-CoA還元酵素の競合阻害剤であるスタチンは、前臨床試験のレベルではがん細胞の増殖抑制活性を示すが、ヒトにおける臨床応用では、心血管疾患の予防に使用される用量では抗がん作用が認められず、その用量制限毒性によってがん治療への応用が妨げられている。
がん細胞ではHMG-CoA還元酵素の活性は亢進し制御異常な状態にあるが、イソプレノイドによる転写後の発現抑制に対する感受性は保持されている。したがって、このイソプレノイド媒介性の転写後発現抑制は、スタチンによるHMG-CoA還元酵素の阻害作用を増強する。したがって、イソプレノイドとロバスタチンの併用は、がん細胞のHMG-CoA還元酵素の活性を相乗的に抑制し、その結果、がん細胞の増殖も相乗的に抑制する。
イソプレノイドを含むビタミンEの異性体のd-ガンマ-トコトリエノール(d-gamma-tocotrienol)とd-デルタ-トコトリエノール(d-delta-tocotrienol)、およびロバスタチンはマウスの悪性黒色腫細胞B16の増殖を用量依存性に抑制し、その48時間培養の50%増殖阻害濃度は、それぞれ、20±3μM、14±3μM、1.5±0.4μMであった。
ロバスタチン(1μM)とd- ガンマ-トコトリエノール(5μM)の併用投与は細胞増殖を完全に阻止し、その増殖抑制作用はロバスタチン単独(12%)およびd-ガンマ-トコトリエノール単独(8%)によって個別に誘発された阻害の合計をはるかに超えた。
これら2つの薬剤の相乗効果は、ヒトDU145前立腺がん細胞およびヒトA549肺がん細胞においても示された。
C57BL6マウスに、ロバスタチン12.5mg/kg体重、d-デルタ-トコトリエノール62.5 mg/kg体重、または両方の薬剤の混合物を補足した食餌をB16細胞移植後22日間与えた。併用投与群のみが、コントロール群(薬物非投与群)に比べて有意に腫瘍縮小を認めた。
がん細胞のHMG-CoA還元酵素を転写後に抑制するイソプレノイドとの併用は、スタチンの有効投与量を低下させ、がんの化学予防や治療における新規のアプローチを提供し得る。
トコトリエノールはサプリメントとして市販されています。
ビタミンEは、トコフェロールとトコトリエノールの二種類に大きく分けられます。メバロン酸経路を阻害するのはトコトリエノールの方で、トコフェロールにはそのような作用はありません。むしろトコトリエノールのメバロン酸経路阻害作用をトコフェロールは阻害するという報告があります。
したがって、メバロン酸経路阻害作用を目的にトコトリエノールを使用するときはトコフェロールの入っていないものを摂取することが大切です。(市販されているトコトリエノールのサプリメンにはトコフェロールが入っているものが多くあります)
シンバスタチンなどのスタチンを使ったらがん治療を試すとき、トコトリエノール、精油成分の多い野菜や生薬の摂取は試してみる価値はあると思います。
| « 637)クエン酸... | 639)トコトリ... » |



