がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
314)ω3系多価不飽和脂肪酸(EPAとDHA)と乳がん
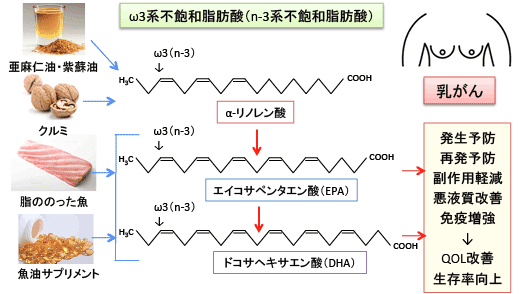
図:亜麻仁油(フラックスシードオイル)や紫蘇油(エゴマ油)やクルミに多く含まれるα-リノレン酸や、魚の油に多く含まれるエイコサペンタン酸(EPA)とドコサヘキサエン酸(DHA)はオメガ3系不飽和脂肪酸(あるいはn-3系不飽和脂肪酸)に分類される。α-リノレン酸は体内で合成されないので必須脂肪酸になる。体内でα-リノレン酸はEPAとDHAに変換されるが、その量は少ないので、EPAとDHAも最近は必須脂肪酸に入れることもある。EPAとDHAは乳がんの発生や再発を予防する効果、抗がん剤治療の副作用を軽減し抗腫瘍効果を高める効果、悪液質を改善する効果などがあることが報告されている。EPAやDHAの摂取量が多いと乳がん治療後の再発や死亡のリスクが低下することが報告されている。
314)ω3系多価不飽和脂肪酸(EPAとDHA)と乳がん
【オメガ3系不飽和脂肪酸は乳がん治療後の生存率を高める】
魚の油に多く含まれるω3系多価不飽和脂肪酸のエイコサペンタエン酸(EPA)とドコサヘキサエン酸(DHA)が乳がんや前立腺がんや大腸がんなど多くのがんの発生を予防したり、治療効果を高めることが報告されています。
EPAやDHAを多く摂取すると乳がんの治療後の生存率を高めるという研究結果が報告されています。その論文の要旨を以下に紹介します。
Marine fatty acid intake is associated with breast cancer prognosis.(魚油の摂取は乳がんの予後と関連する)J Nutr. 141(2):201-6.2011
米国のカリフォルニア大学サンディエゴ校のMooresがんセンターからの報告
【要旨の抜粋】
主に魚油に含まれているオメガ3系多価不飽和脂肪酸のエイコサペンタエン酸(EPA)とドコサヘキサンエン酸(DHA)は、培養細胞を使ったin vitro(試験管内)の実験で乳がん細胞の増殖を抑制し、動物を使った発がん実験では乳がんの発がん過程を抑制する結果が報告されている。
この研究では、早期の乳がんと診断され治療を受けた3081人を対象にしたコホート研究にて、EPAとDHAの摂取が乳がん治療後の予後にどのような影響を及ぼすかを検討した。
平均追跡期間は7.3年であった。食事内容は24-hr recalls(追跡期間中に何回かインタビューして、質問した時点から24時間前までの全ての食事や飲み物を聞き取る方法)で行った。食事やサプリメントからのEPAとDHAの摂取量と、無再発生存期間と全生存率との関連を検討した。
食事からのEPA/DHAの摂取が多い女性は、がんの再発および新たな乳がんの発生のリスクが約25%減少した。EPA/DHAの摂取の少ない下位3分の1のグループに対して、中位3分の1のグループにおける乳がんの再発および新たな乳がんの発生リスクのハザード比は0.74(95% CI = 0.58-0.94)、上位3分の1のグループのハザード比は0.72(95% CI = 0.57-0.90)であった。
食事からのEPA/DHAの摂取の多い女性は、用量依存的に全死因死亡率が低下した。
EPA/DHAの摂取の少ない下位3分の1のグループに対して、中位3分の1のグループの全死因死亡率のハザード比は0.75(95% CI = 0.55-1.04)、上位3分の1のグループのハザード比は0.59(95% CI = 0.43-0.82)であった。魚油サプリメントからのEPAとDHAの摂取は乳がんの予後との関連は認めなかった。
この研究の結果は、食事からの魚油の摂取は、早期の乳がんにおいて再発リスクや全死因死亡率の低下と関連していることを示している。
このコホート研究は米国で行われたthe Women’s Healthy Eating and Living (WHEL) studyという研究で、この本来の目的は、早期の乳がんの治療後に野菜・果物・食物繊維が豊富で脂肪が少ない食事が、乳がんの予後(再発率や生存率)にどのような影響を与えるかを検討する目的で行われました。その結果は2007 年に報告されていますが、結論は「野菜と果物と食物繊維が極めて豊富で脂肪の少ない食事は、7.3年間の追跡調査で、早期の乳がんの治療後の再発や新たな乳がんの発生や死亡率を減らす効果は認めなかった」(Among survivors of early stage breast cancer, adoption of a diet that was very high in vegetables, fruit, and fiber and low in fat did not reduce additional breast cancer events or mortality during a 7.3-year follow-up period.)というものでした。(JAMA 298:289-98, 2007)
この時に集めたデータで、食事中からの魚油の摂取量で検討すると、魚油(つまりDHAとEPA)の摂取量が多いと、再発率や新たな乳がんの発生率や全死因死亡率が低下するという結果が得られたということです。
ただしこの場合、DHAとEPAだけの効果がどうかは断定できません。魚の摂取の多い人は、相対的に肉の摂取が少ないはずですので、肉が少ないためだけかもしれません。あるいは、魚が豊富で肉が少ない食事が相乗的に効果を発揮している可能性もあります。
DHA/EPAをサプリメントから多く摂取したグループでは再発率や死亡率を下げる効果が認められていませんが、これは、DHA/EPAのサプリメントを摂取していたのは3000人中130人くらいしかいないため、人数が少なくて統計的に差が出ないという理由の他、サプリメントを摂取している人の中には肉を多く摂取している人も混じっている可能性もあります。食品からDHAやEPAの摂取が多い人は魚が多いので肉は少ないという関係がありますが、サプリメントからのDHAやEPAの摂取が多い人はそのような差が無いので、効果が出にくい可能性があります。
いずれにしても、早期の乳がん患者さんは、日頃から魚油(DHAとEPA)を多く摂取するような食事は、がんの再発予防と死亡率を低下させる効果が期待できるといえます。このような食事(魚が多く肉眼少ない)を行っておれば、DHA/EPAのサプリメントでの摂取はさらに抗腫瘍効果を高めるはずです。
なお、DHAやEPAの摂取が乳がんの発生を減らすかどうかは、多数の疫学研究が行われていますが、効果を認めないという結果もかなりあります。この理由に一つは、米国など魚の摂取が全体的に少ない国で比較しても、魚油のがん予防効果が出にくい可能性があります。魚油の摂取が多い国での検討では、多く摂取しているグループと摂取量の少ないグループで統計的な差が出やすいようです。
例えば、米国より魚摂取が多いシンガポールの前向きコホート研究では、DHA/EPAの摂取量と乳がんの発がんリスクが逆相関する結果が得られています。
また、食事の内容を調査するのではなく、血中のDHAやEPAの濃度を測定する調査法でも、血中のオメガ3系不飽和脂肪酸の多いほど乳がんの発生率が低いことが報告されています。(Int J Cancer 111: 584-91, 2004)
また、最近報告された、約35000人を追跡したthe Vitamins and Lifestyle(VITAL)Cohort研究では、魚油サプリメントを摂取している人は乳がんの発生が減少する結果が得られています(HR=0.68; 95% CI=0.50-0.92)。(Cancer Epidemiol Biomarkers Prev. 19: 1696-708, 2010)
したがって、日頃から食事やサプリメントからの魚油(DHA, EPA)の摂取は、乳がんの発生や再発の予防に効果が期待できると言えます。
【オメガ3系不飽和脂肪酸はパクリタキセルの末梢神経障害を軽減する】
DHAやEPAが乳がんの抗がん剤治療の副作用を軽減し、抗腫瘍効果を高める効果があることは多くの研究によって示されています。
例えば、転移した乳がん患者の抗がん剤治療の効果をDHAは高めることが、フランスで行われた第2相試験で確かめられています。転移のある進行乳がんで抗がん剤治療(FEC)を受けている25例に1日1.8gのDHAを投与した、対象なしのオープン試験ですが、 奏功率は44%で平均生存期間は22ヶ月で、血中DHA量が多いほど生存期間が長かったという結果です。Br J Cancer. 2009 Dec 15;101(12):1978-85.
培養細胞を使った実験などで、がん細胞の細胞膜の脂肪の組成においてDHAが増えると、イオンチャンネルや受容体やシグナル伝達系に変化が起こって、がん細胞の抗がん剤感受性が高まることが報告されています。そのような作用機序で、DHAを多く摂取すると乳がん細胞の抗がん剤感受性が高まると考えられています。
米国オハイオ州立大学の外科からの報告で、乳がんのハイリスク患者を対象に、DHA/EPAを1日0.84, 2.52, 5.04, 7.56 gの4つの用量で投与し、血中と乳腺脂肪組織内のEPA/DHAの量が増加することが確かめられています。1日7.56gまでのDHA/EPA投与は副作用が無く安全に投与できると報告されています。(Am J Clin Nutr. 2010 May;91(5):1185-94
)
最近の報告で、EPAとDHAがパクリタキセルによる末梢神経障害を軽減することが報告されています。以下のような論文があります。
Omega-3 fatty acids are protective against paclitaxel-induced peripheral neuropathy: a randomized double-blind placebo controlled trial.(オメガ-3脂肪酸はパクリタキセルによる末梢神経障害を軽減する:ランダム化二重盲検プラセボ対照試験)BMC Cancer 2012 Aug 15:12:355
【要旨】
背景:知覚性末梢神経の軸索障害(axonal sensory peripheral neuropathy)はパクリタキセルの主な用量制限性の副作用である。オメガ3系不飽和脂肪酸は神経細胞に対する保護作用と、末梢神経障害の発生に関与している炎症性サイトカインの産生を阻害する作用によって、様々な神経系疾患に対して治療効果を有している。
方法:パクリタキセルによって引き起こされる末梢神経障害に対して、オメガ3系不飽和脂肪酸に末梢神経障害の発生頻度や重症度を減らす効果があるかどうかを検討する目的で、ランダム化二重盲検プラセボ対照試験を行った。
本研究の目的に合致した乳がん患者を無作為に2群に分け、パクリタキセルによる治療中および治療終了後1ヶ月間の間、1群にはオメガ3系不飽和脂肪酸(1回640mg,1日3回)を摂取させ、もう1群(コントロール群)にはプラセボを摂取させた。
抗がん剤開始前と終了後1ヶ月経過後に、患者の臨床症状と電気生理学的検査を行い、末梢神経障害の程度を簡易総合神経障害スコア(reduced Total Neuropathy Score)に基づいて評価した。
結果:オメガ3不飽和脂肪酸を摂取した30人のうち21例(70%)は神経障害の発生を認めなかった。一方、コントロール群では神経障害の発生を認めなかったのは27人中11例(40.7%)であった。この発生頻度の差は統計的に有意であった(OR = 0.3, .95% CI = (0.10-0.88), p = 0.029)。
末梢神経障害の程度には統計的有意差は認めなかったが、コントロール群(プラセボ群)の方が末梢神経障害の重症度は高い傾向にあった。
結論:オメガ3系不飽和脂肪酸は、パクリタキセルによる末梢神経障害の発生を防ぐための有効な神経保護剤である可能性が示唆された。乳がんの患者は抗がん剤の助けによって無再発生存期間がより長くなっている。パクリタキセルによる神経障害を軽減する方法は、患者の生活の質(QOL)を顕著に改善する効果が期待できる。
神経細胞や筋肉細胞は細胞分裂を行わないため、抗がん剤や放射線治療を受けても、ダメージを受けにくいと思われています。しかし、パクリタキセル(商品名タキソール)やドセタキセル(商品名タキソテール)などのタキサン製剤、ビンクリスチン(商品名オンコビン)やビノレルビン(商品名ナベルビン)などのビンカアルカロイド製剤、シスプラチン(商品名ランダなど)やカルボプラチン(商品名パラプラチン)やオキサリプラチン(商品名エルプラット)などの白金錯体製剤、プロテアソーム阻害剤のボルテゾミブ(商品名ベルケイド)では、高頻度に末梢神経障害による副作用(しびれや感覚障害や痛み)が発現します。この末梢神経障害の原因として、神経軸索の微小管の傷害や神経細胞の直接傷害などが関連しています。
微小管は細胞骨格を形成する蛋白質であり、チューブリンというタンパク質が集まった長い直径約25nmの管状構造をもっています。微小管は細胞内の蛋白質の輸送や細胞内小器官輸送のレールとして機能しており、細胞分裂の時の染色体の移動に必要です。つまり、細胞分裂する際に、複製されたDNAは染色体と呼ばれる構造に凝集し、細胞の両極へと引き寄せられ、等分されますが、このとく染色体を分裂した2つの細胞に分離する働きをするのが微小管です。
近年、抗がん剤の標的の一つとして微小管が注目されています。がん細胞が分裂する時に、チューブリンから微小管が形成される過程を阻害すれば、細胞分裂を防ぐことができるからです。
しかし、微小管の形成を阻害することは、細胞分裂の阻害だけでなく、神経障害の原因にもなります。神経の軸索(神経線維)は、神経細胞の細胞体から発する1本の長い突起で、他の神経細胞や筋肉に信号を伝達するケーブルのようなものです。軸索の中にある微小管は軸索の発育や物質の輸送に関連しています。神経軸索の中では、微小管は細胞体から神経軸索の先端に向かって伸びていて、微小管の上で、モータータンパク質の助けを借りて、神経軸索内でのタンパク質の輸送が行われます。
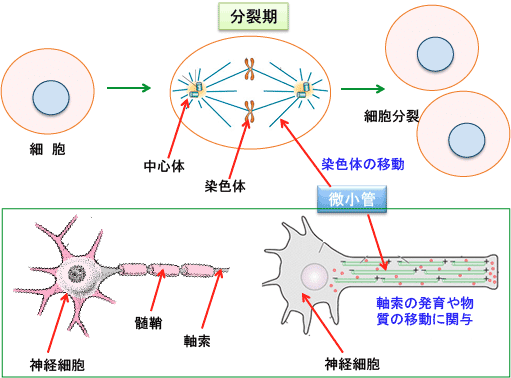
図:微小管は細胞が分裂する時に染色体の移動に必要なため、微小管の形成を妨げると細胞分裂が阻害される(上)。また、神経細胞の信号を伝達する軸索の中にも微小管があり、軸索の発育や物質の輸送に関連している(下)。したがって、微小管をターゲットにする抗がん剤は、その副作用としてしびれや感覚低下や痛みなどの末梢神経障害の副作用が問題になる。
したがって、微小管をターゲットにする抗がん剤は、その副作用として神経細胞の軸索の働きを傷害し、神経の信号が正しく伝達出来なくなって、しびれや感覚障害や痛みなどの末梢神経障害の副作用を引き起こします。
タキサン系抗がん剤やビンカアルカロイド系抗がん剤は微小管を標的として作用することによりがん細胞の抑えるため、神経細胞の微小管も傷害され、神経障害を引き起こします。多くの場合、指先のしびれ感にはじまり、しだいに上の方に広がっていきます。進行すると筋力低下や歩行困難なども生じます。自律神経が障害されると便秘や排尿障害が起こることもあります。
またプラチナ製剤は、神経細胞に直接ダメージを与える結果、二次的に軸索障害をきたしていると考えられています。下肢やつま先のしびれに代表される感覚性の末梢神経障害が主に起こります。
末梢神経障害を起こると、日常生活において、服のボタンがとめにくくなる、つまづきやすくなる、手や足の先がしびれる、温度感覚が無くなる、味覚が変わるなど様々な症状が発生してきます。強い痛みを感じる場合もあります。聴力障害や耳鳴りが起こることもあります。
抗がん剤による神経障害はいったん発現すると有効な対策が少なく、不可逆的になる場合もあります。したがって、症状が強い場合には、抗がん剤治療の中断や薬剤の変更を余儀なくされます。がん患者が治療を早期に中止する最も多い理由の一つです。
パクリタキセルは乳がん、胃がん、卵巣がん、子宮体がん、非小細胞性肺がんに使われる抗がん剤で、末梢神経障害によって投与が困難になることが多い抗がん剤です。
パクリタキセルによる末梢神経障害を軽減するサプリメントとしてアセチル-L-カルニチンやαリポ酸、メラトニンなどがあります。これらにDHAやEPAを加えると効果を高めることができるかもしれません。
DHA/EPAが神経障害を緩和するメカニズムとして、炎症性サイトカインやプロスタグランジンの産生を抑える抗炎症作用や、神経細胞の膜に取込まれることによって神経細胞の機能や修復を促進する作用などが指摘されています。DHAやEPAが神経細胞の細胞膜に取込まれると、イオンチャンネルや受容体やシグナル伝達に作用して、神経細胞の働きや修復が促進されるようです。
【新たな乳がんの発生や子宮内膜がんの発生予防にも有効】
乳がんの治療後は、もとのがんの再発(局所再発と転移)だけでなく、反対側など残った乳腺組織に新たながんが発生するリスクもあります。DHA/EPAの摂取はこのような新たな乳がんの発生を予防する効果も期待できます。
また、ホルモン療法剤のタモキシフェンを長期に服用すると子宮体がん(子宮内膜がん)の発生リスクが高くなることが報告されています。DHA/EPAが子宮体がんの発生を予防する効果が報告されています。以下のような論文があります。
Omega-3 and omega-6 fatty acid intakes and endometrial cancer risk in a population-based case-control study.(地域住民を対象にしたケース・コントロール研究におけるオメガ3とオメガ6の脂肪酸摂取と子宮内膜がんのリスク)Eur J Nutr. 2012 Aug 23. [Epub ahead of print]
【要旨】
目的:魚の油に多く含まれるオメガ3(あるいはn-3)系の多価不飽和脂肪酸に発がん予防効果があることは、動物や培養細胞を使った多くの実験で示されている。しかし、人間において、多価不飽和脂肪酸や魚の摂取と子宮体がん(子宮内膜がん)の発生リスクに関しては、様々な結果が得られており、コンセンサスが得られていない。
方法:子宮内膜がんの発生率と脂肪および魚の摂取との関連を、地域住民をベースにした、556例の子宮内膜がん患者と、これに年齢を一致させた553人(対照群)を対象にして、多変量非条件ロジスティック回帰法(multivariate unconditional logistic regression methods)を用いて検討した。
結果:n-3系不飽和脂肪酸のトータルの摂取量は子宮内膜がんの発生率を関連を認めなかったが、エイコサペンタエン酸(EPA)とドコサヘキサエン酸(DHA)の摂取は子宮内膜がんの発生率を著明に低下させた。n-3:n-6の比率は、子宮内膜がんの発生率と逆相関の関係にあったが、魚の摂取量とは相関しなかった。魚油のサプリメントの摂取は子宮内膜がんの発生率低下と関連していた(OR = 0.63 (95 % CI: 0.45-0.88).)
結論:我々の研究結果は、食事およびサプリメントからのEPAおよびDHAの摂取は子宮内膜がんの発生率を低下させる効果が期待できることを示している。
したがって、タモキシフェンを服用中の場合、EPAやDHAを多めに摂取することは子宮体がんの予防になる可能性はあります。
以上のように、乳がんの抗がん剤治療中やホルモン療法治療中や治療後の再発予防の目的で、魚油のEPAやDHAを食事やサプリメントから多く摂取することは有用だと言えます。
DHA/EPAのサプリメントの1日2~3グラム程度の摂取は、抗がん剤や放射線治療の治療中や、手術の前後に摂取して問題なく、栄養状態を改善し、治療効果を高める効果が十分に期待できるエビデンスがあるサプリメントと言えます。ただし、食事から動物性脂肪(ω6系不飽和脂肪酸)を取り過ぎると、ω3系不飽和脂肪酸をサプリメントで補う効果が低下するので、日常の食事でも、ω6を減らし、ω3の多い食品を摂取することが大切です。ω3系不飽和脂肪酸のサプリメントを摂取するだけでは効果は弱く、食事を含めてω6:ω3の比を低くすることが重要です。
以下は脂質に関する参考資料:
【オメガ3とオメガ6の脂肪酸とは】
私たちは食物から様々な種類の「あぶら」を摂取しています。一般に、常温で液体のあぶらを油(oil)、個体のあぶらを脂(fat)と表記し、両方を総称して油脂と言います。油という字に「さんずい」がついているのは液体であることを意味し、ほとんどの植物性油や魚油は常温で液体であり、油になります。一方、多くの陸上動物(牛脂、豚脂、人間の脂肪など)と熱帯植物(ヤシ油、パーム油、ココアバターなど)のあぶらは常温で個体の脂です。
油脂は3価のアルコールであるグリセロール(グリセリンとも言う)1分子に3分子の脂肪酸 が結合した構造をしています(下図)。グリセロールには手(-OH)が3本あり、それに脂肪酸が結合して脂肪(油脂)になります。一般的には脂肪酸が3個ずつ結合してトリグリセリド(中性脂肪)と呼ばれます。脂肪の種類による違いは、グリセリンは全て共通するため、脂肪酸の形態で説明されます。

脂肪酸は1 個ないし複数個の炭化水素(CH2)の連結した鎖(炭化水素鎖)からなり、その鎖の両末端はメチル基(CH3)とカルボキシル基(COOH)で、基本的な化学構造はCH3CH2CH2・・・CH2COOHと表わされます。
脂肪酸には、飽和脂肪酸と不飽和脂肪酸があり、飽和脂肪酸では、炭化水素鎖の全ての炭素が水素で飽和しています。一方、不飽和脂肪酸では炭化水素鎖中に1個ないし数個の二重結合(CH=CH)が含まれます。不飽和脂肪酸中で二重結合の数が2個以上のものを多価不飽和脂肪酸と云い、5 個以上の二重結合を持つ脂肪酸を高度不飽和脂肪酸と呼びます。
脂肪は、それを構成している脂肪酸の構造の違いによって融点などの化学的性状が異なってきます。二重結合をもつ不飽和脂肪酸の多い脂肪は常温で液状になりますが、飽和脂肪酸になると固まりやすくなります。固まりやすい脂肪を多く摂取すると血液がドロドロになって動脈硬化が起こりやすくなります。
リノール酸 CH3(CH2)3 CH2CH=CHCH2CH=CH(CH2)7COOH では、CH3 に最も近い二重結合は、CH3から6番目のCにあります。この位置に二重結合を持つ全ての脂肪酸をω6系不飽和脂肪酸に分類します。
α-リノレン酸CH3CH2CH=CHCH2CH=CHCH2CH=CH(CH2)7COOH では、CH3に最も近い二重結合はCH3から3番目のC にあります。この位置に二重結合を持つ全ての脂肪酸をω3系不飽和脂肪酸に分類します。最近ではω6の代わりにn-6 を用いてn-6系不飽和脂肪酸、そしてω3の代わりにn-3を用いてn-3系不飽和脂肪酸と呼ぶことが多くなっています(下図)。

動物(人を含む)は、多くの不飽和脂肪酸中で、リノール酸とα-リノレン酸を合成できません。これら2種類の不飽和脂肪酸は動物にとって不可欠であり、動物はこれらを食物として摂取する必要がありますのでこれらを必須脂肪酸と言います。ω6 系不飽和脂肪酸はリノール酸 → γ-リノレン酸 → アラキドン酸のように代謝されていき、アラキドン酸からプロスタグランジン、ロイコトリエン、トロンボキサンなどの重要な生理活性物質が合成されます。プロスタグランジンなどのアラキドン酸代謝産物は炎症や細胞のがん化を促進したり、がん細胞の増殖を速める作用があるのですが、体のいろんな生理作用に必要ですから、動物は食物(植物および肉類)としてリノール酸を摂取しなければ生存できません。アラキドン酸はリノール酸から体内で合成されますが、体内で十分な量が生成されないためアラキドン酸も必須脂肪酸になっています。
ω3系不飽和脂肪酸はα-リノレン酸 → エイコサペンタエン酸(EPA) → ドコサヘキサエン酸(DHA)と代謝されていきます。ω3 系不飽和脂肪酸は炎症やアレルギーを抑え、血栓の形成や動脈硬化やがん細胞の発育を抑える作用があります。したがって、食物中のα-リノレン酸/リノール酸の比を上げると、血栓性疾患、脳梗塞および心筋梗塞、炎症、アレルギー、発がん、がんの転移、高血圧などの発症率が低下するという報告があります。α-リノレン酸から体内でEPAとDHAが産生されますが、その量は少ないので、食事やサプリメントでEPAとDHAを積極的に摂取する意味はあります。
【ω3系不飽和脂肪酸/ω6系不飽和脂肪酸の比を上げるとがん細胞はおとなしくなる】
細胞膜は蛋白質や脂肪酸や糖質から作られます。細胞膜の脂肪酸は食物から摂取された脂肪酸がそのまま取り込まれるため、食事中の脂肪酸の違いによって細胞の性質を変えることができます。その理由は、細胞膜の脂肪酸から作られるプロスタグランジンやロイコトリエンなどの化学伝達物質の種類が違ってくるからです。
リノール酸やγ-リノレン酸やアラキドン酸のようなω6系不飽和脂肪酸を多く取り込んだがん細胞は増殖が早く転移しやすくなります。一方、魚油に多く含まれるドコサヘキサエン酸(DHA)やエイコサペンタエン酸(EPA)やα-リノレン酸のようなω3不飽和脂肪酸を多く取り込んだがん細胞は増殖が抑えられ、抗がん剤で死にやすくなります。ω6系不飽和脂肪酸は、がん細胞の増殖や血管新生を促進するプロスタグランジンE2の原料になり、ω3系不飽和脂肪酸はプロスタグランジンE2の産生を抑えることが関連しています。
プロスタグランジンE2(PGE2)は細胞の増殖や運動を活発にしたり、細胞死が起こりにくくする生理作用があるため、がん細胞の増殖や転移を促進します。PGE2はω6 系不飽和脂肪酸のリノール酸から合成され、DHAなどのω3 系不飽和脂肪酸はPGE2が体内で増えるのを抑える働きがあります。このように、脂肪酸の代謝産物は細胞内のシグナル伝達系に作用してがん遺伝子やがん抑制遺伝子の働きに影響を及ぼします。
DHAががんの予防や治療の効果を高めることは多くの臨床的研究や実験的研究で明らかになっています。毎日魚を食べている人は、そうでない人に比べ大腸がんや乳がんや前立腺がんなど欧米型のがんになりにくいという研究結果もあります。
DHAががん細胞の増殖速度を遅くしたり転移を抑制し、腫瘍血管新生を阻害し、がん細胞に細胞死(アポトーシス)を引き起こすことなどが多くのがん細胞で示されています。プロスタグランジンE2は血管新生を促進するので、プロスタグランジンE2産生を阻害するDHAには腫瘍血管の新生を阻害するようです。その他にも、抗がん剤の効果を増強し副作用を軽減する効果も報告されています。
がん性悪液質を改善する効果も報告されています。がん性悪液質とは、がん細胞や炎症細胞から産生される炎症性サイトカイン(TNF-αやIL-6など)によって体重減少や食欲不振などの症状が出る状態です。DHAやEPAには、TNF-αやIL-6などの炎症性サイトカインの産生を抑える抗炎症作用があります。
免疫状態を改善し、感染症の予防効果も指摘されています。手術前や手術後にEPAやDHAを1日2~3グラム補充した食事は、手術後の炎症を軽減し、体重減少や栄養状態の悪化を防ぐ効果があるという臨床試験の結果が多数報告されています。手術侵襲によって挫滅した組織で炎症反応がおこり、炎症性サイトカインの産生などが原因となって筋肉や体重の減少が起こりますが、EPAやDHAは炎症性サイトカインの産生を抑えるなどの作用によって筋肉の異化を抑制し、体重減少を予防し術後の経過を良くします。
このようにDHAやEPAやαリノレン酸のようなω3系脂肪酸はがんの発育を抑制し、アラキドン酸のようなω6系脂肪酸はがんの発育を促進するので、摂取するω3系脂肪酸とω6系脂肪酸の比が腫瘍の発育に影響することになります。ω6系不飽和脂肪酸は肉や多くの植物油に多く含まれ、ω3系不飽和脂肪酸は魚や亜麻仁油や紫蘇油(エゴマ油)に多く含まれます。したがって、肉を控え、魚を多く食べることはがん細胞の増殖や転移を遅くする効果が期待できます(下図)。

図:肉はアラキドン酸などω6不飽和脂肪酸が多く、プロスタグランジンE2の産生を増やして、がん細胞の増殖・転移や血管新生を促進し、がん細胞のアポトーシス(細胞死)を抑制して再発促進に働く。魚に含まれるDHAやEPAなどのω3不飽和脂肪酸は逆の作用でがんの再発を抑制する。植物性油(コーン油、大豆油、ベニバナ油など)に含まれるリノール酸はω6不飽和脂肪酸で、亜麻仁油(フラックシードオイル)と紫蘇油(エゴマ油)に含まれるαリノレン酸はω3不飽和脂肪酸になる。
【培養した微細藻類由来DHAが注目されている】
がんや認知症や循環器疾患の予防や治療にDHAやEPAが有効であることは確立しています。従って、DHAやEPAの多い脂の乗った魚を多く食べることが推奨されています。しかし、魚のメチル水銀やマイクロプラスチックなど海洋汚染に由来する有害物質の魚への蓄積の問題が、魚食を安易に推奨できない事態になっています。
メチル水銀は毒性が強く、血液により脳に運ばれ、やがて人体に著しい障害を与えます。母親が妊娠中にメチル水銀を体内に取り込んだことにより、胎児の脳に障害を与えることもあります。
魚は自然界に存在する水銀を食物連鎖の過程で体内に蓄積するため、日本人の水銀摂取の80%以上が魚介類由来となっています。魚摂取が増えるとメチル水銀の体内摂取が増え、胎児の脳の発育に悪影響を及ぼすことが明らかになり、厚生労働省は平成15年(2003年)に妊婦の魚摂取に関する注意事項を公表しています。つまり、妊婦や小児は魚を多く食べてはいけないと言っています。
海洋でDHAとEPAを作っている微細藻類を培養して、培養した微細藻類からDHAとEPAを取り出せば、汚染物質がフリーのDHA/EPAを製造できます。閉鎖環境での培養のため、汚染の心配がありません。植物由来なので菜食主義者も抵抗なく摂取できます。(下図)

図:オメガ3系多価不飽和脂肪酸のエイコサペンタエン酸(EPA)やドコサヘキサエン酸(DHA)は微細藻類が合成している(①)。プランクトン(②)が微細藻類を食べ、小型魚(③)がプランクトンを食べ、大型魚(④)が小型魚を食べるという食物連鎖によって、魚油にEPAやDHAが蓄積している。人間は魚油からDHAとEPAを摂取している(⑤)。環境中の水銀(⑥)が魚に取り込まれてメチル水銀になって魚に蓄積する(⑦)。DHAとEPAを産生している微細藻類をタンク培養して油を抽出すると(⑧)、汚染物質がフリーで、植物由来のDHA/EPAが製造できる(⑨)。
がん治療には1日3から5グラムのDHAの摂取が有効であることが多くの研究で示されています。通常の魚油の場合、DHA含有量は10%から20%程度です。1日5グラムのDHAを摂取するには25gから50gの魚油の摂取が必要になります。
そこで、微細藻類の中でもDHA含有量が極めて多いシゾキトリウム(Schizochytrium sp.)をタンク培養して製造したDHA(フランス製)を原料にした「微細藻類由来オイル(DHA含有量51%)」を製造してがん治療に使用しています。
詳細は以下のサイトで紹介しています。
| « 313)L-カルニ... | 315)超高齢者... » |




