がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
472)β-ヒドロキシ酪酸とGPR109A受容体
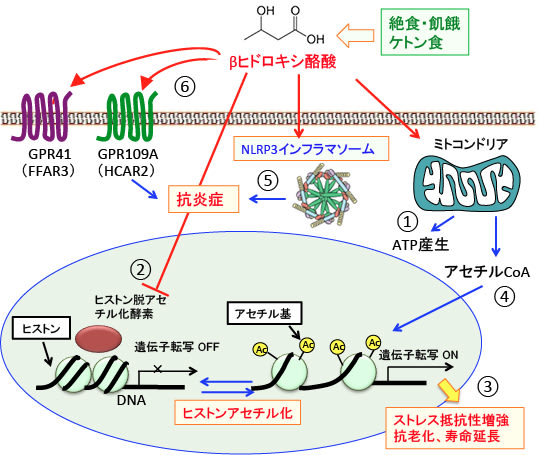
図:①ケトン体のβ-ヒドロキシ酪酸はミトコンドリアで代謝されてATPを産生する。②β-ヒドロキシ酪酸はヒストン脱アセチル化酵素を阻害してヒストンのアセチル化を亢進する。③その結果、ストレス抵抗性を高める遺伝子や抗老化・寿命延長に関連する遺伝子の発現を亢進する。④β-ヒドロキシ酪酸の代謝で増加したアセチルCoAはヒストン・アセチル化のアセチル基の供給源となっている。⑤β-ヒドロキシ酪酸はNLRP3インフラマソームの活性を阻害することによって抗炎症作用を発揮する。⑥β-ヒドロキシ酪酸は少なくとも2つの受容体(GPR109AとGPR41)のリガンドになる。GPR41の作用はまだ十分に解明されていないが、GPR109Aの活性化は抗炎症作用と関連している。このようにβ-ヒドロキシ酪酸はエネルギー源としての働き以外に様々なメカニズムの生理活性作用を有する体内物質と言える。
472)β-ヒドロキシ酪酸とGPR109A受容体
【β-ヒドロキシ酪酸がリガンドになる受容体がある】
絶食や超低糖質のケトン食を行うと肝臓でケトン体の産生が増えます。ケトン体にはアセト酢酸とβ-ヒドロキシ酪酸とアセトンがありますが、アセトンは呼気に排出されるので、エネルギー源になるのはアセト酢酸とβ-ヒドロキシ酪酸です。アセト酢酸とβ-ヒドロキシ酪酸は血液で他の組織に運ばれ、β-ヒドロキシ酪酸はアセト酢酸に変換されてTCA回路で代謝されてエネルギー源になります(下図)。

図:肝臓で生成されたケトン体(アセト酢酸とβヒドロキシ酪酸)は肝臓以外の組織の細胞に運ばれミトコンドリアのTCA回路と電子伝達系でATP産生に使われる。βヒドロキシ酪酸からアセト酢酸への変換時とTCA回路での反応でNADHやFADH2に捕捉された電子は電子伝達鎖で受け渡され、最終的にATP合成酵素によってATPが合成される。
このように、ケトン体はグルコース(ブドウ糖)が枯渇したときのグルコースに代わるエネルギー源としての働きが最も重要だと考えられています。
しかし、絶食という非常事態に体は合理的に対応する必要があります。エネルギー消費を減らすために自然免疫や炎症応答を抑制したり、抗酸化力などの抵抗性を高めて生き延びる必要があります。このような代謝や細胞機能の変化を起こすためにケトン体がなんらかの作用を持っているかもしれないという仮説があります。
実際に、絶食やケトン食で血糖値のレベル(数mM)に達するβ-ヒドロキシ酪酸が、ヒストン脱アセチル化酵素阻害作用(322話参照)やNLRP3インフラマソームの活性阻害作用(471話参照)があることは飢餓状態を生き延びるうえで合目的な作用と言えます。
さらに、ケトン体のβ-ヒドロキシ酪酸がリガンドとなる受容体が現時点で2種類見つかっています。リガンドというのは、受容体に結合して作用を発揮する物質のことです。
β-ヒドロキシ酪酸が作用する受容体は、GPR109A(HCAR2, PUMA-Gとも報告されている)とGPR41(FFAR3とも言う)で、共にGタンパク質共役型受容体です。GPR41は交感神経節に多く分布していますが、その働きに関してはまだ十分に解明されていません。
GPR109Aはナイアシン(ニコチン酸)の受容体として知られ、ニコチン酸誘導体のニセリトロール(商品名:ペリシット)は高脂血症治療薬として臨床で使用されています。GPR109Aは中性脂肪の分解を抑制して高脂血症を改善する作用をもっています。
GPR109Aの発現は最初は脂肪細胞だけだと思われていましたが、免疫細胞や肝細胞や小腸や大腸の粘膜上皮細胞や網膜色素上皮細胞などにも発現していることが明らかになっています。免疫調節作用に関わっていることも報告されています。
β-ヒドロキシ酪酸がGPR109Aに作用して脂肪の分解を抑制するのは、絶食や超低糖質で脂肪の分解が亢進していることの逆の作用ですが、脂肪分解の行き過ぎを調節するフィードバックとして作用しているのではないかという意見もあります。
しかし、最近の研究で、GPR109Aの活性化が神経障害を抑制したり、神経細胞を保護する作用があることが明らかになっています。
例えば、GPR109Aの活性化は糖尿病性網膜症やパーキンソン病の改善作用があることが報告されています。
【β-ヒドロキシ酪酸はGPR109Aを活性化して糖尿病性網膜症を改善する】
以下のような論文があります。
GPR109A as an anti-inflammatory receptor in retinal pigment epithelial cells and its relevance to diabetic retinopathy.(網膜色素上皮細胞における抗炎症受容体としてのGPR109Aと糖尿病性網膜症との関連)Invest Ophthalmol Vis Sci. 53(4):2208-17. 2012年
【要旨】
研究の目的:網膜色素上皮細胞はビタミンのナイアシンおよびケトン体のβ-ヒドロキシ酪酸の受容体であるGPR109Aを発現している。糖尿病ではβ-ヒドロキシ酪酸のレベルが上昇しているので、糖尿病の網膜におけるGPR109A受容体の発現を検討した。さらに、網膜色素上皮細胞の働きとの関連について検討した。
方法:糖尿病マウスと人間の剖検例における眼球の網膜におけるGPR109Aの発現を定量的PCR法で解析した。ヒト網膜色素上皮細胞株であるARPE-19細胞と、正常型(wild-type)とGPR109A遺伝子を欠損したGpr109a(-/-)マウスの網膜色素上皮細胞を、ナイアシンあるいはβ-ヒドロキシ酪酸の存在下あるいは非存在価でTNF-αで処理したのち、IL-6とCcl2(human chemokine (C-C motif) ligand 2)の発現を定量的PCRとELISA法で測定した。
結果:糖尿病のマウスとヒトの網膜においてGPR109Aの発現は亢進していた。ARPE-19細胞において、TNF-αで刺激するとIL-6とCcl-2の発現と分泌は増加した。ナイアシンとβ-ヒドロキシ酪酸はこの作用を抑制したので、TNF-α誘導性のIL-6とCcl-2の発現亢進はGPR109A受容体の関与が示唆された。正常のマウスから採取した網膜色素上皮細胞の初代培養でも同様の結果であった。しかし、GPR109A受容体を欠損するGpr109a(-/-)マウスから採取した網膜色素上皮細胞の初代培養を使った実験では、TNF-α誘導性のIL-6とCcl-2発現と分泌に対するナイアシンとβ-ヒドロキシ酪酸の抑制作用は認められなかった。これは、ナイアシンとβ-ヒドロキシ酪酸の網膜色素上皮細胞における抗炎症作用がGPR109A受容体を介するメカニズムで起こっていることを証明している。
結論:網膜色素上皮細胞においてGPR109A受容体は抗炎症作用を発揮する役割を担っており、糖尿病の網膜においてはGPR109Aの発現が亢進している。炎症は糖尿病性網膜症の重要な発症要因である。
糖尿病の網膜におけるGPR19Aの発現亢進と、そのリガンドであるβ-ヒドロキシ酪酸が糖尿病で上昇するのは、糖尿病による網膜組織の炎症に対処しようという応答かもしれないと我々は推測する。GPR109Aを活性化する医薬品は、糖尿病性網膜症の治療に有用である可能性がある。
つまり、糖尿病でケトン食を実践してβ-ヒドロキシ酪酸の濃度を高めれば、糖尿病性網膜症の治療になるということです。糖尿病の合併症の予防や治療にケトン体の産生を高めることの有効性を示唆しています。
GPR109AはGタンパク質共役型受容体(7回膜貫通型受容体)の一種です。Gタンパク質共役型受容体(G protein coupled receptor : GPCR)は細胞膜の受容体で、光・匂い・味などの外来の刺激や、神経伝達物質・ホルモン・イオンなどの内因性の刺激を感知し、細胞内に伝達するはたらきをしています。
GPCRに分類される細胞膜受容体を作る遺伝子は1000種類以上が見つかっており、細胞膜受容体の最大のグループを形成しています。
医薬品の半数くらいがGタンパク質共役型受容体をターゲットにしていると言われています。GPCRにはアドレナリン受容体やヒスタミン受容体、ドーパミン受容体、嗅覚受容体、アデノシン受容体、セロトニン受容体、オピオイド受容体、カンナビノイド受容体など多数あります。Gタンパク質共役型受容体については434話で解説しています。
GPR109AはビタミンB群のナイアシン(ニコチン酸)の高脂血症改善作用の受容体として知られています。ナイアシンの抗脂肪分解作用はGPR109A受容体を介する作用です。
ニコチン酸誘導体のニセリトロール(商品名:ペリシット)は高脂血症治療薬として臨床で使用されています。
ケトン体のβ-ヒドロキシ酪酸がリガンドとなる受容体が現時点で2種類見つかっています。GPR109A(HCAR2, PUMA-Gとも報告されている)とGPR41(FFAR3とも言う)で、共にGタンパク質共役型受容体です。GPR41に関してはその作用はまだ十分に解明されていません。交感神経節に多く発現しています。
GPR109Aは最初は脂肪細胞だけだと思われていましたが、免疫細胞や肝細胞や小腸や大腸の粘膜上皮細胞などでも発現していることが明らかになっています。さらに網膜色素上皮細胞にも発現しています。
IL-6とCcl2は網膜硝子体疾患の発症と進展に密接に関連している炎症性因子です。
IL-6は炎症性サイトカインで、Ccl2は単球走化性タンパク質-1(monocyte chemotactic protein-1)とも呼ばれ、白血球を集め、活性化し、炎症性サイトカインの分泌を誘導する殊によって炎症を引き起こします。
したがって、IL-6とCcl2の発現を抑制することは網膜の炎症を抑え、糖尿病性網膜症の進展を抑える作用があります。
この論文の著者らは、糖尿病では網膜のダメージが起こって網膜症や失明が起こりますが、それを防ぐために、体は合目的に、網膜色素上皮細胞にGPR109Aの発現が増え、β-ヒドロキシ酪酸がリガンドとなって、この傷害を防ごうとしていると考えています。このような都合の良い応答なのかは不明ですが、ケトン食は糖尿病合併症の網膜症や失明を防ぐ効果が期待できると言えます。
ケトン食が糖尿病性腎症を改善することは471話で紹介しています。糖尿病で、低糖質食と高脂肪食のケトン食で、β-ヒドロキシ酪酸を1〜2mMのレベルに高めることは合併症の予防や治療に有効かもしれません。
【β-ヒドロキシ酪酸はGPR109Aを活性化してパーキンソン病を改善する】
β-ヒドロキシ酪酸は様々な機序で神経障害を軽減する効果が知られています。
①ケトン体のβヒドロキシ酪酸はアセト酢酸に変換されてグルコースの代替エネルギー源となります。
②ケトン体は神経細胞のミトコンドリアを増やし、ミトコンドリア機能を正常化してミトコンドリアにおける活性酸素の産生を減らし、酸化ストレスを軽減します。
③βヒドロキシ酪酸はクラス1ヒストン脱アセチル化酵素阻害作用があり神経細胞の核のヒストンアセチル化を亢進して、学習機能や認知機能を高めます。
④非ヒストンタンパクのアセチル化も神経機能の働きを高め、細胞死を抑制する方向で働きます。
⑤βヒドロキシ酪酸は神経組織の炎症を引き起こすNLRP3インフラマソームの活性を阻害します。
⑥βヒドロキシ酪酸は脳血管を拡張し脳血流を良くする作用があります。
このような様々な機序が総合的に作用して、ケトン体の産生を高めるケトン食はアルツハイマー病やパーキンソン病やハンチントン病などの神経変性性疾患に対して治療効果を発揮し、さらに学習機能や認知機能を高める効果があります。(468話参照)
さらに、GPR109A依存性のメカニズムによるβ-ヒドロキシ酪酸の抗炎症作用が、神経変性疾患の治療効果に関与している可能性が指摘されています。以下のような論文があります。
Anti-inflammatory effects of BHBA in both in vivo and in vitro Parkinson's disease models are mediated by GPR109A-dependent mechanisms.(動物および培養細胞を使ったパーキンソン病の実験モデルにおけるβ-ヒドロキシ酪酸の抗炎症作用はGPR109A依存性のメカニズムを介する)J Neuroinflammation. 2015 Jan 17;12:9. doi: 10.1186/s12974-014-0230-3.
【要旨】
研究の背景:パーキンソン病の進展においては神経組織の炎症が重要な役割を果たしていることが示されている。過剰に活性化されたミクログリアが、炎症関連の酵素や炎症性サイトカインを産生し、周囲の神経細胞にダメージを与え、最終的には神経変性を引き起こす。したがって、ミクログリアの活性化を阻害することは、パーキンソン病の進展を抑制する有効な治療法となる可能性が示唆されている。
以前の研究において、β-ヒドロキシ酪酸がBV-2細胞におけるリポ多糖(LPS)誘導性の炎症を抑制し、ドーパミン作動性神経をダメージから保護することが示されている。しかし、その作用機序については解明されていない。そこで、本研究では、LPS誘導性の生体内(in vivo)および培養細胞を使った(in vitro)パーキンソン病実験モデルを用いて、その作用機序の検討を行った。
方法:培養細胞を使ったin vitroの実験では、中脳から採取した神経細胞とグリア細胞の初代培養の実験系を用い、β-ヒドロキシ酪酸で前処理してLPSで刺激した。中脳由来の神経細胞とグリア細胞の初代培養系において、ドーパミン取込みやチロシン・ヒドロキシラーゼ陽性の神経細胞や形態学的解析を行った。
生体内の実験モデルでは、中脳の黒質内にLPSを注入してミクログリアの活性化とドーパミン作動性ニューロンの傷害を誘導した。ミクログリアの活性とドーパミン作動性ニューロンの生存率と機能に対するβ-ヒドロキシ酪酸の作用を検討した。
培養細胞を用いた実験では、初代培養のミクログリアをβ-ヒドロキシ酪酸で前処理してLPSで刺激し、炎症関連の酵素や炎症性サイトカインやNF-κBシグナル伝達系の応答に関して解析した。
結果:中脳由来の神経細胞-ミクログリアの初代培養の実験モデルでは、LPSによって誘導されるドーパミン取込み低下とチロシン・ヒドロキシラーゼ陽性ニューロンの死滅に対して、β-ヒドロキシ酪酸は用量依存的に抑制した。
ラットの中脳黒質にLPSを注入して作成したパーキンソン病の動物モデルの運動機能をβ-ヒドロキシ酪酸は顕著に改善した。このβ-ヒドロキシ酪酸の効果は、ミクログリアの過剰活性化の阻害と、黒質におけるドーパミン作動性ニューロンの保護作用によることが示された。
さらに、培養細胞を用いたメカニズム研究では、ミクログリアに対するβ-ヒドロキシ酪酸の阻害作用はGタンパク質共役型受容体のGPR109Aを介し、NF-κBシグナル伝達系に作用し、炎症性の酵素(誘導性一酸化窒素合成酵素とシクロオキシゲナーゼ-2)と炎症性サイトカイン(TNF-α、IL-1β、IL-6)の産生を阻害することが明らかになった。
結論:本研究の結果は、炎症性機序によるドーパミン作動性ニューロンの傷害に対するβ-ヒドロキシ酪酸の保護作用を支持している。
ドーパミン作動性ニューロンは間脳視床下部や中脳黒質などに分布し、パーキンソン病は黒質のドーパミン作動性ニューロンが死滅して数が少なくなることによって発症します。
チロシン・ヒドロキシラーゼ(TH)は、カテコールアミン代謝の第一段階を触媒する酵素であり、ドーパミン作動性ニューロンやノルエピネフリン作動性ニューロンで発現しています。
脳や脊髄など神経組織には大きくわけて2種類の細胞が含まれています。神経細胞(ニューロン)とそれを支える神経膠細胞(グリア細胞)です。
グリア細胞は主に3種類あり、アストロサイト、オリゴデンドロサイト、ミクログリアと呼ばれています。
このうちアストロサイトとオリゴデンドロサイトの2つはニューロン(神経細胞)と同じ神経外胚葉に由来し、ニューロンを支持し栄養を与える機能を有します。
一方、ミクログリア(小膠細胞)は骨髄系の白血球のマクロファージに由来します。ミクログリアは脳内で何か異常が起これば直ちにそこに移動し、形を大きく変化させ、病原体など敵だと認識すれば排除しようと戦い、脳細胞が死んでしまえばそれを食べて組織をきれいに保とうとします。
ミクログリアは病原体などの敵と戦うときには相手を倒そうとして様々な毒性の物質(活性酸素や炎症性サイトカインなど)を出しますが、うまく制御できないとそれが味方の細胞(特に健康なニューロン)にも作用して、余計にニューロンを殺してしまうことなります。
つまり、ミクログリアはマクロファージと同様に、傷害を受けた神経組織を修復する目的で活性化されるのですが、このミクログリアの活性化が何らかの原因で慢性化すると神経細胞の死滅が促進されることになります。 様々な神経変性疾患で、ミクログリアの過剰な活性化が起こっていることが明らかになっています。
神経変性疾患とは、様々な原因により脳内の様々な部位で神経細胞が病的に死滅してしまうために生じる疾患の総称です。疾患ごとに障害を受けやすい神経細胞の種類がある程度決まっており、障害される神経細胞の働きにより疾患の症状が決まります。
アルツハイマー型認知症は記憶を担当する海馬などの神経細胞の障害であり、筋萎縮性側索硬化症は運動を担当する神経細胞(運動ニューロン)の障害です。パーキンソン病は運動を調節するドーパミン神経の障害で、脊髄小脳変性症は運動を調節する小脳などの障害です。
ハンチントン病(ハンチントン舞踏病)は、大脳中心部にある線条体尾状核の神経細胞が変性・脱落することにより進行性の不随意運動(舞踏様運動)、認識力低下、情動障害等の症状が現れる常染色体優性の遺伝病です。
パーキンソン病は50歳以降に発症することが多く、手足が震える(振戦)、筋肉がこわばる(固縮)、動作が遅くなる(寡動、無動)、転びやすくなる(姿勢反射障害)といった症状を呈し、徐々に症状が進行していきます。
神経伝達物質のドーパミンを作る中脳の黒質という部分の神経細胞が変性・脱落して発症すると考えられています。黒質の神経細胞は大脳基底核の神経細胞と接続していますが、神経細胞同士の連絡のやり取りにドーパミンが使われています。ドーパミンが十分に作られなくなると、神経細胞同士の連絡に不都合が生じて、運動がスムーズにいかなくなり、前述した特徴的な症状が現れます。
パーキンソン病の日本での有病率は、人口1,000人当たりに約一人と言われており、日本全体で10万人以上の患者さんがいると推定され、高齢化社会の進行に伴って今後ますます患者が増えると予想されています。
パーキンソン病患者の病理解剖の検査では、中脳の黒質に活性化したミクログリアが増えていることが示されています。
黒質に炎症を引き起こすとパーキンソン病と似た病気を作成できることが多くの動物実験モデルで示されています。
ミクログリアはマクロファージを同じような機能を持っています。したがって、ミクログリアの活性化は、TNF-αやIL-1βやIL-6のような炎症性サイトカインや、シクロオキシゲナーゼ-2(COX-2)や誘導性一酸化窒素合成酵素(iNOS)などの炎症関連の酵素の発現を亢進し、神経細胞にダメージを与えることが知られています。
したがって、ミクログリアの活性を抑制することが神経変性疾患の進行抑制に役立つと考えられています。
様々な実験系で、β-ヒドロキシ酪酸は抗炎症作用を示し、神経細胞のダメージを軽減することが報告されています。
培養細胞を使った実験系では、中脳から採取した初代培養の系で、ニューロンとグリア細胞を共存した状態で培養し、そこにLPS(リポ多糖)を添加すると、ミクログリアが活性化されて炎症性サイトカインやCOX-2やiNOSが産生されて、ニューロンがダメージを受けて死滅します。
この実験系でチロシン・ヒドロキシラーゼで免疫染色するとドーパミン作動性ニューロンを検出でき、アイソトープを使ったドーパミンの取込みを測定するとドーパミン作動性ニューロンの機能を解析できます。
10ng/mlの濃度のLPSを添加して7日間培養すると、ドーパミン作動性ニューロンの数やドーパミンの取込みは70%くらい減少しています。
この研究では、β-ヒドロキシ酪酸は1.5mMの濃度で顕著な改善効果を示しています。1.5mMは数日間の絶食やケトン食で容易に達し得る濃度です。
動物実験では、LPSを注入する3日前からβ-ヒドロキシ酪酸をポンプを使って皮下に持続注入しています。1日に1.6mmol/kgの量です。βヒドロキシ酪酸の分子量は104なので、1日量は体重1kg当たり166mgです。
ミクログリアをLPSで刺激するとGPR109Aの発現が誘導されてきます。
炎症性サイトカインやCOX-2やiNOSの発現に対するβ-ヒドロキシ酪酸の抑制作用は、GPR109AをsiRNAでノックダウンさせたミクログリアでは認められませんでした。この結果から、β-ヒドロキシ酪酸のミクログリアに対する抑制作用はGPR109Aを介することが明らかになっています。
iNOS(誘導性一酸化窒素合成酵素), COX-2(シクロオキシゲナーゼ-2), TNF-α, IL- 1β, ,IL-6 はいずれも転写因子の NF-κBによって発現が亢進されます。
ミクログリアをLPSで刺激するとNF-κBが活性化されることが示されています。β-ヒドロキシ酪酸はこのNF-κBの活性化を抑制します。
しかし、この抑制作用はGPR109AをsiRNAでノックダウンさせたミクログリアでは認められませんでした。
以上のことから、β-ヒドロキシ酪酸はGPR109Aを介して、NF-κBの活性化を抑制し、炎症性サイトカインやiNOSやCOX-2の発現を抑制して抗炎症作用を示すことが明らかになったという研究です。
パーキンソン病の治療にGPR109Aがターゲットになるということです。GPR109Aの内因性のリガンドであるβ-ヒドロキシ酪酸の濃度を1〜2mMのレベルに高めればGPR109Aを十分に活性化できます。
以下のような総説論文もあります。
Nutritional or pharmacological activation of HCA(2) ameliorates neuroinflammation.(栄養成分あるいは医薬品によるHCA2の活性化は神経組織の炎症を軽減する)Trends Mol Med. 2015 Apr;21(4):245-55. doi:
HCA2はGPR109Aの別名です。2つは同じものです。
【要旨】
神経組織の炎症は、多発性硬化症や脳卒中を含む多くの神経疾患に共通する病理所見である。しかしながら、神経系の炎症を制御する治療法の確立は困難である。
神経炎症における炎症細胞はHCA2受容体を発現している。HCA2は内因性の神経保護作用のあるケトン体のβ—ヒドロキシ酪酸の受容体であり、さらにフマル酸ジメチル(dimethyl fumarate)とニコチン酸の受容体でもある。
フマル酸ジメチルは多発性硬化症の治療に有効であり、ニコチン酸は実験的脳卒中に治療効果を示すことが報告されている。
この総説では、神経炎症を軽減するフマル酸ジメチルとニコチン酸とβ-ヒドロキシ酪酸の治療効果にHCA2が関与しているエビデンスをまとめた。
さらに、神経炎症性疾患におけるHCA2の治療効果の作用メカニズムと最近開発されたHCA2の合成リガンドの治療効果について考察した。
これは、総説論文ですが、β-ヒドロキシ酪酸の神経変性疾患に対する治療効果としてGPR109A(HCA2)の関与が重要ということです。
β-ヒドロキシ酪酸はグルコースが枯渇した時の代替エネルギーとしての役割だけでなく、遺伝子発現や受容体を介するシグナル伝達や、その他様々なメカニズムで抗炎症作用、ストレス抵抗性の増強、神経細胞保護作用、抗老化作用、寿命延長作用などの作用を発揮しています。
宗田哲男先生の著書のタイトル「ケトン体が人類を救う」は的を得ているようです。
| « 471)糖尿病と... | 473)循環器疾... » |



