がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
473)循環器疾患とケトン食
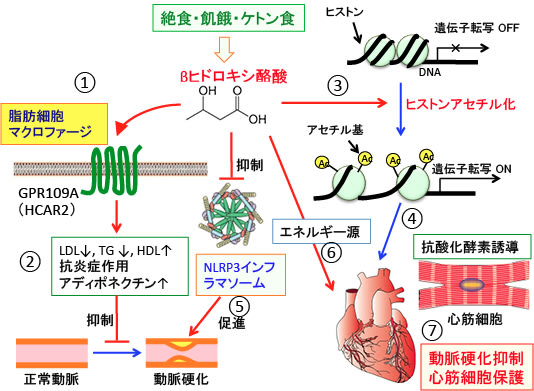
図:①絶食や飢餓やケトン食で産生されるケトン体のβ-ヒドロキシ酪酸は脂肪細胞やマクロファージに発現しているGPR109A(HCA2やHCAR2とも言う)に作用し、②LDLコレステロースや中性脂肪(TG)を低下させ、HDLコレステロールを増やし、炎症を抑制し、アディポネクチンの産生・分泌を促進して動脈硬化を抑制する。③β-ヒドロキシ酪酸はヒストン脱アセチル化酵素阻害作用によって心筋細胞のヒストンのアセチル化を亢進する。④この作用はSODやカタラーゼなどの抗酸化酵素の発現を増やし、心筋を酸化傷害から保護する。⑤高血糖や高脂血症や酸化ストレスなどで活性化されるNLRP3インフラマソームは血管炎症と動脈硬化を促進する。β-ヒドロキシ酪酸はNLRP3インフラマソームの活性を抑制することによって動脈硬化の進行を抑制する。⑥β-ヒドロキシ酪酸は心筋細胞のエネルギー源となる。⑦これらの作用が総合的に作用して、β-ヒドロキシ酪酸は動脈硬化性疾患を予防し、様々な傷害やストレスに対して心筋を保護する作用を示す。
473)循環器疾患とケトン食
【ケトン体を有害と考えるのは間違っている】
ケトン体を毒性物質だと思っている人はまだ多くいます。医学の領域でもそのように思われています。
公益社団法人日本薬学会のサイトの「薬学用語解説」では、「糖尿病患者の場合、尿ケトン体が陽性ならば管理状態は不良とされる。肥満者が絶食のような無理な食事制限をした場合や、健常人が激しい運動をした場合にも尿中ケトン体は陽性になる。」と記述されています。
また、臨床試験の某検査機関のサイトには、ケトン体が異常高値を示す病態として、「糖代謝異常(糖尿病、糖原病)、飢餓、悪液質、発熱、下痢、嘔吐、脱水、消化吸収障害、妊娠悪阻、小児自家中毒、甲状腺機能亢進症、グルカゴノーマ、褐色細胞腫、先端巨大症
」が記載されています。
このように、ケトン体が産生される状況は特殊な病的な状態であるようなニュアンスで記述されているため、「ケトン体が体内で増える状況は良くない」と多くの医師は考えています。
しかし、ケトン体が毒性物質であるなら、氷河期に獲物が獲れずに日常的に飢餓状態になっていた人類やその他の動物は絶滅していたはずです。
1ヶ月間水だけの絶食を行ってケトン体の濃度が上がってもアシドーシス(血液が酸性になる状態)にはなりませんし、体に毒作用を示すこともありません。
むしろ、最近の研究結果は、絶食や飢餓によるケトン体の上昇は、生理学的に有用な作用をもたらすことが明らかになってきました。つまり、「ケトン体=健康に悪い」というのは間違いで、「ケトン体=健康に良い」と言える根拠が増えています。
絶食で起こるケトーシスはむしろ様々な効能を示します。
抗てんかん薬に抵抗性のてんかん患者にケトン食が有効であることは医学的に確立されています。絶食がてんかん発作を抑制することは古代ギリシャの時代のヒポクラテスがすでに記載しています。
絶食時には脳のエネルギー源の75%近くがケトン体によって供給されます。
絶食しても、肝臓で糖新生によって1日に60〜65gのグルコースが産生されるので、糖質を完全に絶っても糖新生でできるグルコースを使って30%くらいはグルコースを使っています。
脳の重量(1200g程度)は体重の2%くらいですが、脳が消費するエネルギーは体の20%程度になります。1日2000キロカロリーの20%で400キロカロリーだとグルコース100g分になります。100gだと糖新生では間に合わないので、ケトン体を多く使うしかありません。
脂肪酸は血液脳関門を通過できないので、脳では利用できません。
血液脳関門というのは、薬物などを血中から脳内への移行を制限する仕組みで、多くの物質は脳内に自由に入ることができません。ブドウ糖やアミノ酸は特異的なトランスポーター(輸送担体)を使って脳内に入ることができますが、炭素数が12以上の長鎖脂肪酸は血液脳関門を通過できません。
ケトン体の利用は細菌でも認められています。多くの細菌はβ-ヒドロキシ酪酸が多数重合したポリ・β-ヒドロキシ酪酸(poly-β-hydroxybutyrate)をエネルギーの貯蔵に使用しています。20億から30億年前の古細菌でも、ポリ・β-ヒドロキシ酪酸をエネルギー貯蔵に使用してます。
グルコースが重合してグリコーゲンになるように、β-ヒドロキシ酪酸が重合してポリ・β-ヒドロキシ酪酸になります。動物が脂肪をエネルギー貯蔵に使うように細菌はβ-ヒドロキシ酪酸が重合した物質をエネルギー貯蔵に利用しています。
β-ヒドロキシ酪酸は生物界において古細菌のころから有用な生理物質だったのです。
【β-ヒドロキシ酪酸はGPR109A受容体の内因性リガンド】
GPR109A受容体については472話で解説しています。
GPR109AはGタンパク質共役型受容体(7回膜貫通型受容体)の一種です。Gタンパク質共役型受容体(G protein coupled receptor : GPCR)は細胞膜の受容体で、光・匂い・味などの外来の刺激や、神経伝達物質・ホルモン・イオンなどの内因性の刺激を感知し、細胞内に伝達するはたらきをしています。
GPCRに分類される細胞膜受容体を作る遺伝子は1000種類以上が見つかっており、細胞膜受容体の最大のグループを形成しています。
Gタンパク質共役型受容体(G protein coupled receptor : GPCR)には、まだ内因性リガンドが発見されていないものが多く残っています。このようなリガンドが見つかっていない受容体をオーファン受容体(Orphan Receptor)と言います。Orphan は「孤児」という意味です。リガンドは受容体に特異的結合してその受容体を活性化する物質です。
GPR109Aも長い間そのリガンドが判らないオーファン受容体でしたが、2003年に、ビタミンB3として知られるナイアシン(ニコチン酸)の受容体であることが判明し、さらにケトン体のβ-ヒドロキシ酪酸の受容体であることが明らかになりました。
ナイアシンの高脂血症の改善と動脈硬化の予防効果はこのGPR109Aを介することが明らかになっています。GPR109A遺伝子を欠損するマウスでは、ナイアシンの高脂血症の改善と動脈硬化の予防効果が見られないことが報告されています。
動脈硬化の抑制に関しては、高脂血症の改善(LDLコレステロール低下、HDLコレステロール増加、中性脂肪低下)による作用の他に、ナイアシンはマクロファージに発現しているGPR109Aに作用して動脈硬化の進行を抑えることが報告されています。これは、動脈硬化を起こしやすくしたマウスに、GPR109A遺伝子を欠損したマウスの骨髄を移植すると、ナイアシンの動脈硬化抑制作用は認められなくなることから証明されています。
ナイアシンはその血清脂質に対する有効性から、心血管疾患に50年以上前から使用されています。
つまり、ケトン体のβ-ヒドロキシ酪酸にはGPR109Aを介して、高脂質血症と動脈硬化を改善する効果があると考えられています。
GPR109A(HCA2とも呼ばれる)は脂肪組織とマクロファージに多く発現しています。
マクロファージあるいはその系統の細胞であるミクログリア細胞の活性化が原因となる様々な炎症性疾患にGPR109Aのリガンドが抑制的に作用します。
その結果、様々な神経炎症性疾患(パーキンソン病やアルツハイマー病など)や動脈硬化性疾患を抑制します。
マクロファージの細胞株を使った実験で、マクロファージをLPS(リポ多糖)で活性化するとGPR109Aの発現が増加します。β-ヒドロキシ酪酸はマクロファージのGPR109Aに作用してマクロファージの活性を抑え、抗炎症作用を発揮します。
GPR109A(HCA2)は炎症性疾患の治療薬の開発の重要なターゲットとして注目されています。
【GPR109Aはアディポネクチンの分泌を刺激する】
GPR109Aがアディポネクチンの分泌を刺激するという報告もあります。アディポネクチンは人間の脂肪(脂肪細胞)から分泌されるホルモンの一種で、寿命を延ばす作用と同時に、がんを抑制する作用があります。以下のような論文があります。
Niacin stimulates adiponectin secretion through the GPR109A receptor.(ナイアシンはGPR109A受容体を介するメカニズムでアディポネクチンの分泌を刺激する)Am J Physiol Endocrinol Metab. 2009 Mar;296(3):E549-58.
【要旨】
ナイアシン(ニコチン酸)はメタボリック症候群の男性において血清アディポネクチンの濃度を高めることが最近報告されている。しかしながら、ナイアシンがアディポネクチンの分泌を制御するメカニズムについてはまだ解明されていない。
ナイアシンはその受容体であるGPR109Aに依存するメカニズムと、GPR109Aを介さないメカニズムで脂肪分解に作用することが知られている。そこで、この研究はアディポネクチンの分泌におけるGPR109Aの役割を検討する目的で行った。
まず、ラットを使った動物実験では、ナイアシン(30 mg/kg)の経口投与は血清アディポネクチンを急速に高めたが、遊離脂肪酸の血清濃度は低下させた。
さらに、脂肪細胞の初代培養を使った実験では、ナイアシンあるいはβ-ヒドロキシ酪酸(GPR109A受容体の内因性リガンド)を脂肪細胞に投与すると、アディポネクチンの分泌が増え、脂肪分解が減少した。この作用は脂肪細胞を百日咳毒素で前処理すると阻止された。(補足:百日咳毒素はGタンパク質共役型受容体のシグナル伝達を阻止する)
細胞膜にGPA109A受容体の発現が無い3T3-L1脂肪細胞では、ナイアシンはアディポネクチン分泌や脂肪分解に作用しなかった。
これらの培養細胞を使った実験結果をさらに確かめるため、GPR109A受容体を正常に持ったマウスとGPR109A受容体遺伝子を欠損させた(ノックアウトした)マウスを用い、ナイアシンあるいはプラセボ(偽薬)を1回投与して血清を採取しアディポネクチンと遊離脂肪酸の濃度を測定した。
GPR109A受容体を正常に持ったマウスでは、ナイアシン投与後10分以内に血清中のアディポネクチンは増え、遊離脂肪酸は減少した。しかしながら、GPR109A受容体遺伝子を欠損させたノックアウトマウスでは、ナイアシン投与はアディポネクチン分泌と脂肪分解には作用しなかった。
これらの結果は、GPR109A受容体は、アディポネクチン分泌と脂肪分解の制御において重要な役割を担っていることを示している。
【ヒストン脱アセチル化酵素阻害剤の心筋保護作用】
病気の治療や創薬のターゲットとして、NLRP3インフラマソーム阻害剤やヒストン脱アセチル化酵素阻害剤が注目されています。この2つは、2型糖尿病や認知症や動脈硬化性疾患などの多くの疾患の共通のターゲットになっています。
そして、ケトン体のβ-ヒドロキシ酪酸がこの2つの活性を持つことが明らかになったことから、一気にケトン食の健康作用のメカニズムと臨床的有効性が注目されてきました。
心筋梗塞も脳梗塞も動脈硬化が基礎になっています。
血管内皮細胞に傷をつけて動脈硬化を起こす動物実験モデルでヒストン脱アセチル化酵素阻害剤が動脈硬化の発症を予防することが報告されています。
さらに、糖尿病性心筋症の動物モデルで、ヒストン脱アセチル化酵素阻害剤の心筋保護作用が報告されています。以下のような報告があります。
Histone deacetylase (HDAC) inhibition improves myocardial function and prevents cardiac remodeling in diabetic mice (ヒストン脱アセチル化酵素の阻害は糖尿病マウスにおける心筋機能を改善し、心臓リモデリングを予防した)Cardiovasc Diabetol. 2015; 14: 99. Published online 2015 Aug 7. doi: 10.1186/s12933-015-0262-8
「心臓リモデリング(Cardiac remodeling)」とは心臓に負荷がかかった時に心臓のポンプ機能を維持するために左心室を肥大化して適応しようとするマイナスの再構築のことです。心筋負荷が進行すると、心筋症から心不全の状態に移行します。
【要旨】
研究の背景:ヒストン脱アセチル化酵素の阻害が心筋細胞傷害から心臓を保護し、内在性の血管筋新生(angiomyogenesis)を刺激することが報告されている。しかしながら、糖尿病の心臓に対してヒストン脱アセチル化酵素の阻害が心筋保護作用を示すかどうかは明らかになっていない。本研究では、ヒストン脱アセチル化酵素の阻害が糖尿病性心筋症における心臓機能を維持し、心臓リモデリングを抑制できるかどうかを検討した。
方法:ICR系成熱マウスを用い、ストレプトゾトシン(streptozotocin)投与によって糖尿病を発症させる群と、ストレプトゾシンを投与しない対象群の2群を作成した。ストレプトゾシン投与群で高血糖が確認された糖尿病マウスは、ヒストン脱アセチル化酵素阻害作用のある酪酸ナトリウム(sodium butyrate)を1%の濃度で飲水に混入して投与した。対象群、対象+酪酸ナトリウム群、ストレプトゾシン投与(糖尿病)群、ストレプトゾトシン投与(糖尿病)+酪酸ナトリウム群の4つの群にわけて比較した。心機能は7、14、21週後に評価した。
結果:心エコー検査(超音波心臓検査)で糖尿病マウスは心臓機能の低下を認めたが、ヒストン脱アセチル化酵素阻害剤の酪酸ナトリウムの投与を受けた糖尿病マウスでは、心機能の顕著な改善を認めた。糖尿病性心筋症に対して、ヒストン脱アセチル化酵素阻害は心肥大(心臓:脛骨比で評価)の程度を減弱し、心筋間質の線維化を心筋細胞のアポトーシスを抑制し、血管筋新生を高めた。
特筆すべきは、ヒストン脱アセチル化酵素阻害によってグルコース・トランスポーター(GLUT)のGLUT1とGLUT4の発現が亢進し、GLUT1のアセチル化とp38リン酸化の亢進を伴っていた。さらに、糖尿病マウスの心筋細胞では、ヒストン脱アセチル化酵素阻害によって、重要は抗酸化酵素であるスーパーオキシド・ディスムターゼ(SOD)の量が増えていた。
結論:ヒストン脱アセチル化酵素阻害は、糖尿病マウスにおいて心臓機能を向上させ、心臓リモデリングを抑制する重要な作用を担っている。
酪酸の化学式はCH3(CH2)2COOHでβ-ヒドロキシ酪酸の化学式はCH3CHOHCH2COOHで、酪酸の一つの炭素に水酸基(OH)がついた構造です。酪酸のヒストン脱アセチル化酵素阻害作用は古くから知られています。酪酸はがん細胞の増殖を停止し、分化を誘導し、アポトーシスを引き起こすことは古くから知られており、そのメカニズムがヒストン脱アセチル化酵素阻害作用であることも良く知られています。
ケトン体のβ-ヒドロキシ酪酸も酪酸と類似のヒストン脱アセチル化酵素阻害作用を示します。
この実験では酪酸ナトリウムを飲水で投与して体内のヒストン脱アセチル化酵素を阻害すると糖尿病性心筋症を予防したという結果が得られています。
β-ヒドロキシ酪酸は内因性のヒストン脱アセチル化酵素阻害物質です。したがって、ケトン体を高めることは糖尿病による心筋傷害の抑制にも効果が期待できると思います。
糖尿病関連の心血管系の合併症は糖尿病関連死の主要な原因になっています。糖尿病が進行すると糖尿病性心筋症を発症し、心不全を引き起こします。
心臓では脂肪酸を主なエネルギー源として利用しています。正常な成人の心臓では、使用されるATPの95%以上がミトコンドリアでの酸化的リン酸化で産生されています。このうち70%くらい(60〜90%)が脂肪酸の酸化によって産生されています。脂肪酸以外の燃料としてグルコース(ブドウ糖)、乳酸、アミノ酸、ケトン体があります。
脂肪酸は心筋細胞のミトコンドリアに入って酸化されます。このミトコンドリアに入るとき、長鎖脂肪酸はL-カルニチンの助けが必要です。したがって、L-カルニチンは心臓の働きを高めます。ケトン体は脂肪酸より簡単にミトコンドリアでATP産生に利用できます。つまり、血中のケトン体濃度が高い状態は心筋のエネルギー産生にも有利になります。
【絶食やβ-ヒドロキシ酪酸が心筋虚血による再還流傷害を軽減する】
ヒストンアセチル化が心疾患や脳血管疾患の発症を防ぐことが多くの動物実験で報告されています。
動物実験でヒストン脱アセチル化酵素の阻害剤が心肥大や心筋細胞死や線維化や心不全を防ぐことが報告されています。
絶食やケトン体のβ-ヒドロキシ酪酸が心筋虚血による心筋傷害を抑制することが報告されています。
以下のような報告があります。
Short-Term Fasting Reduces the Extent of Myocardial Infarction and Incidence of Reperfusion Arrhythmias in Rats.(短期間の絶食はラットにおける心筋梗塞の程度と虚血再還流による不整脈の頻度を減少する)Physiol. Res. 61: 567-574, 2012
この実験では、ラットを使って冠動脈の左前下降枝を20分間遮断し、その後3時間再還流して心筋梗塞を起こす実験モデルで検討しています。
冠動脈を閉塞する前3日間の絶食(水だけ)を行うと、梗塞のサイズが普通に食事をしていたコントロール群が74.3%に対して3日間の絶食群が48.5%に減少しました。再還流直後に起こる心室性期外収縮の頻度がコントロール群が194.9回に対して絶食群が12.5回と顕著に減少しました。さらに、心筋におけるβ-ヒドロキシ酪酸の量が顕著に増加していました。
心筋のβ-ヒドロキシ酪酸の濃度はコントロール群が1.22±0.21 mM/g に対して絶食群では15.58±2.56 mM/g でした。しかし、アセト酢酸の濃度に差はありませんでした。
この実験では、3日間の絶食が、虚血再還流による心筋障害を軽減する効果を示しています。そのメカニズムとして、ケトン体の増加による細胞保護作用を言及しています。
これ以前には、長期間の絶食が心筋保護作用があることは複数の実験で報告されていました。そこでこの研究では3日間という短期間の絶食でも顕著な保護作用を認めたという論文です。
心筋梗塞では冠動脈の閉塞が起こり、その閉塞を早く解除することが、治療の基本になります。しかし、虚血後の血液の再還流によって心筋障害が増悪することがあり、これを虚血再還流障害といっています。
この原因として、活性酸素や一酸化窒素などのフリーラジカル産生による障害,炎症性サイトカインやエンドセリンやアラキドン酸など各種ケミカルメディエータ産生による障害,活性化好中球と血管内皮細胞の相互作用に基づく障害などの機序が考えられています。
心臓の虚血再還流障害による不整脈の発生が抗酸化物質の投与によって軽減できることが報告されています。
ラットの心臓の虚血再還流障害の実験で、普通に食事を与えた群に比べて、24時間のファスティング(絶食)の群の方が、ラットの心筋の還元型グルタチオン(GSH)と酸化型グルタチオン(GSSG)の比率(GSH/GSSG)が上昇し、過酸化脂質の量が減少することが報告されています。
多くの実験で、絶食やカロリー制限が活性酸素の産生を減らすことが明らかになっています。その理由はいろいろ考えられます。
絶食によって炎症細胞の活性が抑制されます。β-ヒドロキシ酪酸を投与すると虚血再還流障害による心筋梗塞のサイズを減らす効果が報告されています。以下のような報告があります。
dl-3-Hydroxybutyrate administration prevents myocardial damage after coronary occlusion in rat hearts (dl-3-ヒドロキシ酪酸の投与はラット心臓の冠動脈閉塞後の心筋障害を防ぐ)Am J Physiol Heart Circ Physiol 283: H1968–H1974, 2002;
3-ヒドロキシ酪酸はβ-ヒドロキシ酪酸と同じです。
ラットの左冠動脈を30分間閉塞して120分間再還流する実験モデルで、血管を閉塞する前に60分間、dl-3-ヒドロキシ酪酸を静脈注射で投与してその効果を検討しています。その結果、絶食+3-ヒドロキシ酪酸投与群で梗塞サイズの減少を認めています。この群の心筋のATP含量が増加していたので、3-ヒドロキシ酪酸がATPを産生して梗塞サイズを縮小したと考察しています。
絶食が酸化ストレスに対する抵抗性を高めることは多くの実験系で確かめられています。
栄養飢餓時にFOXO3という転写因子が活性化されます。FOXO3は酸化ストレスや飢餓ストレスに対する抵抗力を高める作用があります。
FOXOの転写因子活性は、成長ホルモン/インスリン/インスリン様成長因子-1(IGF-1)のシグナル伝達系によって抑制されます。絶食はこの成長ホルモン/インスリン/IGF-1シグナル伝達系を抑制し、FOXOの転写因子活性を高めることによって、ストレスに対する抵抗性を高めます。
また、β-ヒドロキシ酪酸がFoxo3遺伝子のプロモーター領域のヒストンのアセチル化を引き起こして、Foxo3の発現を誘導することが示されています。
酵母の実験では活性酸素や抗がん剤に対する抵抗性は、栄養飢餓(絶食)によって10倍以上に高まることが報告されています。
抗がん剤投与の前2日間の絶食が抗がん剤の副作用を軽減するという報告もあります(391話参照)。
β-ヒドロキシ酪酸はクラスIヒストン脱アセチル化酵素の阻害剤で、50%阻害濃度(IC50)はおよそ2~5 mMと報告されています。
心筋の虚血再還流傷害を抑制する効果はクラスIヒストン脱アセチル化酵素の阻害が関与しています。
Selective inhibition of class I but not class IIb histone deacetylases exerts cardiac protection from ischemia reperfusion.(虚血再還流における心臓保護作用はクラスIIbではなくクラスIのヒストン脱アセチル化酵素の選択的阻害で得られる)J Mol Cell Cardiol. 2014 Jul; 72: 138–145.
この論文では、ラットを用いた実験系で、クラスIヒストン脱アセチル化酵素の選択的阻害剤が虚血再還流傷害から心臓を保護し、そのメカニズムとして、心筋においてヒストンのアセチル化がFOXO3遺伝子の転写を亢進し、その結果、抗酸化酵素のスーパーオキシドディスムターゼ(SOD)やカタラーゼの産生を増やし、抗酸化作用を高めて、虚血再還流による酸化傷害を防ぐと言っています。この機序はβ-ヒドロキシ酪酸のヒストン脱アセチル化酵素阻害を最初に報告したサイエンスの論文(322話参照)と同じ結論です。
最近の報告では、クラスIヒストン脱アセチル化酵素阻害剤は心筋タンパク質のSUMO化を増やして心筋細胞の保護作用を示すことが報告されています。以下のような論文があります。
Class I HDAC Inhibition Stimulates Cardiac Protein SUMOylation Through a Post-Translational Mechanism.(クラスIヒストン脱アセチル化酵素阻害剤は翻訳後修飾のメカニズムで心筋タンパク質のSUMO化を亢進する)Cell Signal.26 (12): 2912-2920, 2014
SUMO(small ubiquitin-related modifier)は生物種間で高度に保存されたユビキチン様タンパク質で,翻訳後修飾に関与します。ユビキチンとは一次配列で10%の相同性を有し,ユビキチンに類似した三次構造をとります。ユビキチン修飾は基質タンパク質をタンパク質分解に誘導する働きをしますが、SUMO化はタンパク質の輸送や局在や相互作用や安定化などに関与します。
タンパク質のリジンはアセチル化やSUMO化の翻訳後修飾を受けます。この論文では、クラスIヒストン脱アセチル化酵素阻害剤は心筋タンパク質のSUMO化を亢進して細胞保護作用を示す結果が得られています。
このように次から次にβ-ヒドロキシ酪酸の薬効が明らかになると、ケトン食が様々な難病に効果を発揮するというのは、驚くことでは無くなったようです。
| « 472)β-ヒドロ... | 474)医療大麻... » |



