がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
551)カンナビジオールは活性酸素の産生を高めて抗腫瘍効果を発揮する
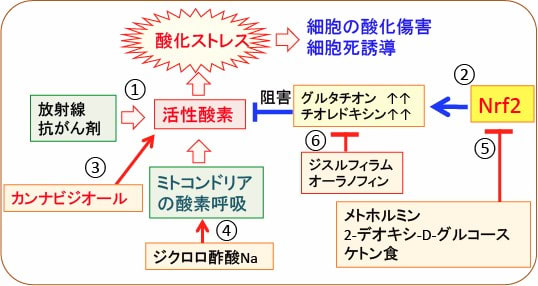
図:放射線や抗がん剤は、活性酸素の産生を高めて酸化ストレスを亢進し、細胞の酸化傷害を引き起こして細胞死を誘導する(①)。酸化ストレスを軽減するために転写因子のNrf2の活性を亢進し、グルタチオンやチオレドキシンシステムを亢進して活性酸素による酸化傷害に抵抗する(②)。カンナビジオールは細胞内の活性酸素の産生を高める(③)。ジクロロ酢酸ナトリウムはミトコンドリアの酸素呼吸を亢進して活性酸素の産生を高める(④)。メトホルミンや2-デオキシ-D-グルコースやケトン食はNrf2の活性化を阻害する(⑤)。ジスルフィラムやオーラノフィンはグルタチオンやチオレドキシンによる抗酸化システムを阻害することによって酸化ストレスを高める(⑥)。これらを組み合せると、がん細胞に効率的に酸化ストレスを増強して、がん細胞の増殖を抑制できる。
551)カンナビジオールは活性酸素の産生を高めて抗腫瘍効果を発揮する
【THC/CBD製剤は標準治療との併用で生存期間を延長する】
がんの緩和治療において大麻の有効性が報告されています。すなわち、食欲増進、体重増加、睡眠の改善、抗がん剤治療による吐き気や嘔吐の軽減などの症状の緩和や改善効果は多くの臨床試験で有効性が示されています。
さらに、がん細胞の増殖抑制やアポトーシス誘導などの抗がん作用が培養細胞や動物モデルを用いた研究で示されています。
そこで、大麻製剤(医療大麻や大麻抽出エキス製剤など)の抗がん作用を検討する臨床試験が始まっています。
2017年2月7日にGW PharmaceuticalsはTHCとCBDを含む大麻製剤が、脳腫瘍(膠芽腫)に対する臨床試験で有効性を認めたというプレスリリースを行っています。(原文のサイトはこちら)
このプレスリリースでは、再発した多形性膠芽腫(Glioblastoma Multiforme)の患者21人を対象にした探索的第2相プラセボ対照臨床試験によって、テトラヒドロカンナビノール(THC)とカンナビジオール(CBD)を含む大麻抽出エキスの有効性を検討し、有効性を示す結果を得たと発表しています。
再発性神経膠芽腫患者の1年生存率は、対照群が53%、THC:CBD製剤で治療を受けた群が83%で、統計的に有意な差を認めました(p=0.042)。
生存期間の中央値は対照群が369日で、THC:CBD群は550日でした(下表)。

表:膠芽腫の抗がん剤治療にTHCとCBDを含む大麻抽出エキスを併用すると生存期間を延長できることが報告されている。
これは少人数を対象にした探索的な臨床試験の結果です。
初めから大規模な臨床試験を行って結果が悪ければ、大きな経済的損失を被るので、初めに探索的な小規模な臨床試験を行います。これで有効性が示唆されれば、さらに有効性を確認するために大規模な臨床試験が行われることになります。この探索的な臨床試験で大麻製剤の有効性が確認されたというプレスリリースです。
小人数でも統計的に有意差が出ているので、医学的には有効性が認められたといえます。
ただし、プラセボ群9例、THC:CBD投与群11例で、有意差のp値が0.042なので、大規模な臨床試験で有意差が出ない可能性は無いわけではありません。しかし一応、「膠芽腫のテモゾロマイド治療と併用して、THC:CBD製剤が統計的有意に抗腫瘍効果を高めるという結果が得られた」ということです。
GW社は米国の食品医薬品局(the U.S. Food and Drug Administration :FDA)と欧州医薬品庁(the European Medicines Agency: EMA)から、THC:CBD製剤の神経膠腫に対する希少疾病用医薬品指定を受けています。今後、大規模な臨床試験でその有効性と安全性が検証され、有効性が認められれば、標準治療として使用できるようになります。
今まで、多くの基礎研究で、THCとCBDがグリオブラストーマ(膠芽腫)に効く可能性は示唆されていましたので、臨床試験で有効性が確認されたので、試してみる価値はあると言えます。(411話、455話参照)
ただし、日本ではまだ医療大麻は使えません。THC/CBD製剤も大麻抽出製剤なので、日本では使用できません。
成熟した茎から抽出したカンナビジオール(CBD)オイルであれば、食品扱いで販売されています。てんかんの治療にはCBDオイルで十分ですが、がん治療にはTHC+CBDの方が良いようです。
しかし、THC+CBD製剤が使用できないので、CBDのみの製剤でどの程度の抗腫瘍効果が期待できるかを検討する必要があります。
【カンナビノイドには直接的な抗がん作用が報告されている】
THCやCBDなどのカンナビノイドには直接的な抗がん作用が報告されています。その作用機序は極めて多彩です。一つの作用機序ではなく、複数の作用機序で総合的に抗腫瘍効果を示すと考えるのが妥当です。
抗腫瘍作用として、がん細胞の増殖抑制、アポトーシス誘導、転移や浸潤の抑制、血管新生阻害などが報告されています。
その作用メカニズムとして、がん細胞の増殖シグナル伝達を阻害する作用、細胞周期を停止させる作用、小胞体ストレスを誘導してオートファジーを亢進して細胞死を引き起こす作用、がん細胞の活性酸素の産生を高めて酸化ストレスによってがん細胞を死滅させる作用など多くの報告があります。
カンナビノイド受容体のCB1とCB2に作用する大麻成分としてΔ9-テトラヒドロカンナビノール(THC)があります。
医療大麻を使ったがん治療は、THCやカンナビジオール(CBD)の抗がん作用を利用しています。
カンナビジオール(CBD)にはCB1やCB2のアゴニスト作用はなく、むしろTHCのCB1への作用を阻害する作用があります(550話参照)。しかし、カンナビジオールはCB1やCB2以外の受容体やイオンチャネルやシグナル伝達系に作用するので、THCとカンナビジオールの併用は、それぞれ単独では起こし得ない新規なシグナル伝達系を制御して抗腫瘍効果を発揮する可能性が示唆されています。
内因性カンナビノイドのアナンダミドや2-アラキドノイルグリセロールの分解を阻害する薬も同様の目的で検討されています。
内因性カンナビノイドの分解を阻害すれば内因性カンナビノイドの濃度が高くなって、がん細胞の増殖を阻害できると考えられています。
CB1とCB2以外にも、TRPV1(Transient receptor potential cation channel subfamily V member 1)やGPR55(G protein-coupled receptor 55)やPPAR(peroxisome proliferator-activated receptor)も内因性カンナビノイドの受容体として働くことが報告されており、抗腫瘍的に作用しますが、まだそのメカニズムは十分に明らかになっていません。
【カンナビジオールの抗腫瘍活性は抗酸化剤で消去される】
カンナビジオールの抗がん作用のメカニズムとして、Id-1 (Inhibitor of DNA binding-1)の発現を阻害する作用(411話参照)や、がん細胞に活性酸素の産生を亢進して酸化ストレスを高めてがん細胞を死滅させるメカニズムが報告されています。
ここでは、活性酸素の産生を高める作用について解説します。以下のような報告があります。
Reactive oxygen species-mediated therapeutic response and resistance in glioblastoma(グリオブラストーマにおける活性酸素種による治療効果と治療抵抗性)Cell Death Dis. 2015 Jan; 6(1): e1601.
【要旨】
グリオブラストーマは治療に抵抗性で、再発が多く、診断後5年以内に90%の患者が死亡しており、極めて予後不良の腫瘍である。グリオブラストーマの腫瘍組織の中には幹細胞様の性質をもったがん幹細胞が存在し、このがん幹細胞が治療に抵抗性を示している。
幾つかの抗がん剤は、活性酸素種の細胞内濃度を高めることによって抗がん作用を発揮し、これらは酸化還元治療薬(redox therapeutics)と総称されている。
本研究においては、カンナビジオールに対するグリオーマ幹細胞の感受性と抵抗性の作用メカニズムを検討した。カンナビジオールは毒性や精神作用が無いカンナビノイドの一種で酸化還元制御作用を持っている。
グリオーマの原発組織から採取したグリオーマ幹細胞を用いた実験で、カンナビジオールは活性酸素種の産生を顕著に増加させ、細胞生存とリン酸化されたAKTと自己複製を阻害し、グリオーマ幹細胞を移植したマウスの生存率を向上させた。
グリオーマ幹細胞の自己複製の阻害は、リン酸化p38経路の活性化と、Sox2とID1とp-STAT3の抑制によって引き起こされていた。
カンナビジオールを投与すると、一部のグリオーマ幹細胞は適応して抵抗性を示し、再増殖を開始する。
解析の結果、カンナビジオールに対する抵抗性は、抗酸化応答システムのXc活性部位のサブユニットxCTの過剰発現や活性酸素種依存性の様々なマーカーの変化を伴っていた。
このようなグリオーマ幹細胞の再プログラム化は培養細胞とマウスの移植腫瘍で認められ、NRF2 (nuclear factor, erythroid 2-like)の活性化がその一部の作用メカニズムとなっていた。
さらに、カンナビジオール投与と抗酸化応答システムXc(シスチン・グルタミン酸トランスポーター系)の阻害を併用すると、相乗効果によって活性酸素種の産生が亢進し、抗腫瘍活性が増強し、グリオーマ幹細胞の生存と自己複製と浸潤が阻害される。
我々の研究結果は、酸化還元治療薬の抗腫瘍活性の新規なメカニズムを提供するものであり、グリオブラストーマの治療において活性酸素種の産生を高める治療法の併用の有用性を示唆している。
簡単にまとめると、カンナビジオールはグリオブラストーマ細胞に活性酸素の産生を高めて抗腫瘍作用を示しますが、グリオブラストーマ細胞はシスチン・グルタミン酸トランスポーター系(Xcシステム)やNRF2系などの抗酸化システムを活性化して酸化ストレスを軽減し、カンナビジオールの抗腫瘍活性に抵抗性を示すように適応します。そこで、このような抗酸化システムを阻害する治療を併用すると、カンナビジオールの抗腫瘍作用は元に戻るということです。
還元型グルタチオンの合成に必要なシステインを細胞内に取り込むシスチン・グルタミン酸トランスポーター系(Xcシステム)については346話で解説しています。

図:カンナビジオールはグリオブラストーマ(膠芽腫)細胞に活性酸素の産生を高めて酸化ストレスを亢進する(①)。酸化ストレスが高度に亢進すると細胞の酸化傷害が起こり細胞死が誘導される(②)。がん細胞は抗酸化システムを活性化して酸化傷害に抵抗性を示す(③)。したがって、がん細胞の抗酸化システムを阻害する方法を併用すると、カンナビジオールの抗腫瘍効果を高めることができる。
【がん細胞の抗酸化システムを阻害するとカンナビジオールの抗腫瘍効果は増強する】
多くの抗がん剤は、最終的には細胞内の活性酸素の産生を高めて、細胞死を誘導します。増殖の速いがん細胞ほど、酸化ストレスを高める治療に感受性が高いと言えます。
しかし、このような抗がん剤は正常細胞にも毒性が強いので、副作用を多く引き起こします。
したがって、がん細胞に選択的に活性酸素の産生を高める物質があれば、それは有効な抗がん剤になります。
その候補の一つとしてカンナビジオールが注目されています。
しかし、がん細胞に酸化ストレスを高めると、がん細胞は細胞内の抗酸化システムを活性化させて抵抗します。
前述の論文では、シスチン・トランスポーター(xCT)やNRF2 (nuclear factor, erythroid 2-like)の活性化がカンナビジオールの抗腫瘍効果を阻害することが報告されています。
がん細胞は還元型グルタチオン(GSH)の合成を促進することで、酸化ストレス抵抗性を高め、増殖や転移や治療抵抗性を高めていることが知られています。
シスチン・トランスポーター(xCT)はシスチン/グルタミン酸交換輸送体とも呼ばれ、哺乳類細胞形質膜上に発現するアミノ酸トランスポーターの一種で、細胞内のグルタミン酸との交換により細胞外のシスチンを細胞内に輸送する機能を有します。
シスチンはグルタチオンの構成成分であるシステインが2個結合したアミノ酸で、シスチンが細胞内に取り込まれると、システインに代わってグルタチオンを合成する材料になります。このトランスポーターの発現が亢進すると、細胞内グルタチオンレベルが上昇し、これによって、活性酸素などの酸化ストレスに対する防御能が高まると考えられます。
スルファサラジン(別名:サラゾスルファピリジン:商品名はサラゾピリンなど)という潰瘍性大腸炎の治療に使われている既存薬にシスチン・トランスポーターを特異的に阻害する作用があることが報告されています。
シスチントランスポーターの阻害剤であるスルファサラジンを投与すれば、がん細胞内のグルタチオンの濃度が低下し、酸化ストレスに対する抵抗性が低下するので、抗がん剤や放射線治療が効きやすくなると推測されます。(346話参照)
前述の論文でもシスチン・トランスポーター(xCT)の働きを阻害する目的でスルファサラジンが検討されていますが、体内利用率が低いので、あまり強い阻害活性は認めていないようです。特にマウスを使った生体内(in vivo)実験では、体内利用率が悪いので、スルファサラジンによる抗酸化システムの阻害作用は確認できなかったようです。
シスチン・トランスポーター(xCT)の発現を亢進するのがNrf2という転写因子です。Nrf2の発現や活性を抑制する治療法を併用するとカンナビジオールの抗がん作用が増強できます。
【細胞内の抗酸化システムを利用してがん細胞は抗がん剤抵抗性になる】
細胞には、活性酸素や有毒物質による害から細胞自身を守る手段や仕組みが備わっています。
例えば、細胞内で活性酸素の発生量が増えると、細胞は活性酸素を消去する酵素(スーパーオキシド・ディスムターゼ、カタラーゼ、グルタチオン・ペルオキシダーゼなど)の発現や活性を高めたり、フリーラジカルを消去するグルタチオンなどの抗酸化物質の合成を高めたりして、活性酸素の害(酸化ストレス)を軽減しようとします。
また、グルタチオンSトランスフェラーゼ(GST)などのフェースII(第2相) 解毒酵素と言われる代謝酵素は、様々な発がん物質や有害物質を無毒化する作用があります。
細胞が活性酸素や発がん物質や有害な成分(抗がん剤や放射線も含む)によって攻撃を受けると、これらの活性酸素消去酵素やグルタチオンやフェースII解毒酵素が細胞内に誘導され(遺伝子発現が増えたり産生量が増える)、細胞を守るシステムが働きます。
このような細胞内の防御システムの活性化に中心的な働きを行っているのがNrf2という転写因子です。
転写因子というのは特定の遺伝子の発現(DNAの情報を蛋白質に変換すること)を調節している蛋白質です。
抗酸化酵素やグルタチオンの産生に関する酵素やフェース2解毒酵素の遺伝子の発現調節領域には、抗酸化反応エレメント(antioxidant response element:ARE)という領域があって、この部分にNrf2が結合するとこれらの遺伝子の転写が促進されるのです。
ホルミシス(hormisis)効果というものがあります。体に有害と思われている放射線や活性酸素やある種の発がん物質も、微量であれば体を刺激する方向で働いて、これらの害に対する抵抗力が高まるという効果です。刺激やストレスがくり返されると、生体はそれらに対して適応するように体が反応するため、その刺激やストレスに対して抵抗性になると考えられるのですが、抗酸化力や解毒力の増強のメカニズムに関しては転写因子のNrf2の活性化が関与しています。
化学発がん物質の研究でもホルミシス効果が認められています。体内で活性酸素を発生させて発がん作用を示すような物質を、少量だけ投与すると、かえって発がんが抑えられることがあります。これは、軽度の酸化ストレスに対して、適応反応として体の中の抗酸化酵素が増加するためであると考えられています。この場合も、Nrf2の活性化が重要な役割を担っています.
このNrf2は様々なストレスや有害物質から細胞を守っているので、細胞にとっては重要な防御システムです。
しかし、最近の研究によると、がん細胞ではNrf2の活性が非常に高くなっており、しかもNrf2の活性が高いがん細胞ほど治療に抵抗性で予後が悪いという結果が得られています。
つまり、がん細胞は、抗がん剤や放射線治療から自分を守るためにNrf2を利用しているということです。
がん細胞におけるNrf2の働きを阻害することができれば、抗がん剤や放射線治療の効き目を高めることができます。まだ培養細胞や動物実験の段階ですが、抗がん剤治療や放射線治療にNrf2阻害剤を併用すると抗腫瘍効果が高まることが報告されています。
【Nrf2は細胞の抗酸化力を高める】
転写因子のNrf2は、抗酸化機能や解毒機能を持つ様々な遺伝子の転写を誘導します。
活性酸素種や食物に含まれる親電子性物質によりもたらされる酸化ストレスは,DNAやタンパク質や脂質などの生体高分子を酸化することで傷害を与え、がんや糖尿病や腎臓疾患や神経変性疾患など様々な疾患を引き起こす原因になります。
このような酸化ストレスに対する防御機構において重要な機能を担っているのが、Keap1-Nrf2システムです.
正常細胞において酸化ストレスの無い状況では、Nrf2はKeap1(Kelch-like ECH-associated protein 1)というタンパク質に結合することによりユビキチン化を受け、分解しています。
しかし、酸化ストレスにさらされるとKeap1のシステイン残基が修飾を受けて構造が変化し、Keap1からNrf2が離れて核へ移行し、遺伝子上流に存在する抗酸化剤応答配列ARE(antioxidant response element)に結合することによって、このARE配列をもつ様々な遺伝子(抗酸化酵素やグルタチオンの合成に関与する酵素やフェースII解毒酵素など)の発現を誘導し、抗酸化や解毒に関するタンパク質や因子の合成を高めます。
このような作用によって、正常細胞や前がん細胞においては、Nrf2の活性を亢進するNrf2活性剤は発がん過程を抑制するので、がん予防物質として認識されています。このようなNrf2の活性化を介したがん予防物質としてスルフォラファンやクルクミンやレスベラトロールなどが報告されています。
一方、がん細胞においては、Nrf2が恒常的に活性化しており、Nrf2活性を阻害するとがん細胞は死にやすくなることが報告されています。
ヒトの肺がんなど多くの固形腫瘍でNrf2機能の異常亢進が見つかっています。そして、Nrf2の活性が高いと治療に抵抗性で予後が不良であることが報告されています。
Nrf2は解毒酵素、抗酸化タンパク質、薬剤排出トランスポーターなどの遺伝子を統括的に活性化することにより、がん細胞の抗がん剤耐性と放射線耐性をもたらします。
さらに、Nfr2はグルコースやグルタミンの代謝を変化させて細胞増殖に有利な同化反応を促進します。
Nrf2はがん細胞のペントースリン酸経路を活性化して、核酸とNADPHの産生を増やすことで細胞増殖を亢進します。NADPHはグルタチオンの合成にも必要です。
多くのがん細胞では、酸化ストレスの有無とは関係なくNrf2の発現量と活性が亢進しています。その理由は、RASやMYCなどのがん遺伝子がNrf2を活性化しているからです。
Nrf2の活性を抑制するKeap1の遺伝子変異によってNrf2が活性化する場合も見つかっています。
恒常的に安定化したNrf2は酸化ストレスや抗がん剤/放射線治療に対する抵抗性を増強し、さらに積極的に細胞増殖を促進することになります。
抗がん剤治療や放射線治療によって活性酸素が増えると、がん細胞はさらにNrf2の量を増やして抵抗性を獲得してきます。
このようにNrf2の活性化はがん細胞が治療に対する抵抗性を獲得するメカニズムとして重要です。したがって、がん細胞のおけるNrf2の機能阻害は、抗がん剤治療の有効な戦略となります。

図:Keap1-Nrf2システムは酸化ストレスや有害物質に対する防御機構において重要な役割を担っている。転写因子のNrf2は細胞質でKeap1によって分解が促進されることによって活性が抑制されている。正常細胞では酸化ストレスが加わると、Keap1の構造が変化してNrf2から離れ、フリーになったNrf2が核内に移行して、抗酸化酵素や解毒酵素の遺伝子の上流に存在する抗酸化剤応答配列ARE(antioxidant response element)に結合して、これらの遺伝子の発現を亢進する。その結果、正常細胞では活性酸素や発がん物質を解毒することになるので、Nrf2の活性を促進するもの(=Nrf2活性剤)はがん予防効果がある。
一方、がん細胞においては、KRasやcMycなどのがん遺伝子の活性化やKeap1の遺伝子変異などによってNrf2は恒常的に活性化しており、抗酸化酵素や解毒酵素の産生や活性が亢進している。そのため、がん細胞は酸化ストレスや細胞傷害性物質に対する抵抗性が亢進しており、これが抗がん剤や放散線治療に対する抵抗性の原因になっている。したがって、がん細胞においては、Nrf2の活性を阻害するもの(=Nrf2阻害剤)ががん治療に役立つ。このように、正常細胞(前がん細胞も含む)とがん細胞とではNrf2に対する対応は全く異なる。
糖尿病性腎症や慢性閉塞性肺疾患など多くの酸化ストレスと関連する疾患の予防や治療のためにNrf2の活性化剤が臨床応用に向けて開発されています。
一方、がんの治療になるとNrf2の阻害剤が有益になる可能性が高いと考えられています。
がん細胞のNrf2を阻害すると、
①がん細胞内での活性酸素種の蓄積によってアポトーシス(細胞死)が誘導できる。
②抗がん剤治療や放射線治療の効き目を高めることができる。
③がん細胞での物質合成(同化反応)を阻害することによって増殖を阻害できる。
などの効果が期待できます。
ただし、全身投与の場合は、がん組織以外の正常組織での酸化ストレス応答を減弱させる欠点もあります。つまり、がん細胞特異的にNrf2を阻害できる方法があれば、がん治療に役立ちます。
【がん細胞特異的にNrf2活性を阻害する方法】
Nrf2の転写活性を介した抗酸化酵素や解毒酵素の発現にはグルコースの供給が必要であるという報告があります。
Glucose availability is a decisive factor for Nrf2-mediated gene expression.(グルコースの供給がNrf2を介した遺伝子発現のための決定的な要因である)Redox Biol. 2013 Jun 21;1(1):359-65.
この論文では、スルフォラファンでNrf2を活性化する方法や、Nrf2を阻害するKeap1遺伝子を機能欠損させる方法(遺伝子ノックアウト)でNrf2の活性を亢進する方法で実験しています。
Nrf2を活性化するとグルコースの取込みが増え、ペントースリン酸経路でのNADPHの産生が増えることが示されています。
そして、グルコースの供給や取込みを阻害するか、あるいはペントースリン酸経路を阻害してNADPHの産生を阻害すると、Nrf2を介した遺伝子発現が抑制され、抗酸化酵素や解毒酵素の発現が抑制されることが示されています。
つまり、糖質制限やケトン食や2−デオキシグルコースなどで、がん細胞におけるグルコースの取込みやペントースリン酸経路を抑制する方法は、グルコースの取込みが亢進しているがん細胞に選択的にNrf2の活性を阻害できる可能性があります。
ケトン食と2-デオキシグルコースと抗がん剤/放射線治療の相乗効果については337話、338話、341話、346話などで解説していますが、ケトン食と2-デオキシグルコース、およびその他のグルコース代謝を阻害する方法は、がん細胞におけるNrf2の活性抑制に有効だと言えます。(その他の方法については353話、355話参照)
メトホルミンがNrf2活性を抑制するという報告があります。
Metformin inhibits heme oxygenase-1 expression in cancer cells through inactivation of Raf-ERK-Nrf2 signaling and AMPK-independent pathways.(メトホルミンはRaf-ERK-Nrf2 シグナル伝達系とAMPK非依存的経路の阻害によってがん細胞のヘムオキシゲナーゼ-1を阻害する)Toxicol Appl Pharmacol. 2013 Sep 1;271(2):229-38.
ヘムオキシゲナーゼ-1は、ヘム(heme)をビリベルジン(biriverdin)と一酸化炭素(CO)と遊離鉄(Fe)に分解する酵素です。ビリベルジン(緑色の色素)は、ビリベルジン・リダクターゼ(biriverdin reductase)により、ビリルビン(bilirubin:黄疸の時の黄色の色素)に分解されます。このヘム分解により産生れるビリベルジンとビリルビンには強力な抗酸化作用があり、酸化ストレスによる細胞傷害を抑制します。
メトホルミンはRaf-ERKシグナル伝達系を抑制しNrf2の発現量を減らす効果があることを報告しています。
メトホルミンとケトン食と2-デオキシグルコースの組合せは抗腫瘍効果において相乗効果がありますが、Nrf2活性の抑制においても相乗効果が期待できそうです。(338話参照)
また、黄芩(おうごん)という生薬に含まれるクリシン(chrysin)というフラボノイドがNrf2活性を抑制するという報告があります。
Chrysin enhances sensitivity of BEL-7402/ADM cells to doxorubicin by suppressing PI3K/Akt/Nrf2 and ERK/Nrf2 pathway.(クリシンはPI3K/Akt/Nrf2 と ERK/Nrf2 経路を抑制することによってBEL-7402/ADM細胞のドキソルビシンに対する感受性を高める)Chem Biol Interact. 2013 Oct 25;206(1):100-8
この論文では、クリシンが増殖シグナル伝達系のPI3K-Aktと ERK経路を抑制することによってNrf2のmRNAとタンパク質の発現量を顕著に減少させ、抗がん剤に対する感受性(効き目)を高めることが報告されています。クリシンにはグルタチオン濃度を低下させて抗がん剤の効き目を高める効果も報告されています。
Chrysin enhances doxorubicin-induced cytotoxicity in human lung epithelial cancer cell lines: the role of glutathione.(Chrysinはヒト肺がん細胞株におけるドキソルビシンによる細胞毒性を増強する:グルタチオンの役割)Toxicol Appl Pharmacol. 258(1):1-9.2012年
Chrysinがグルタチオンの細胞内からの排出を誘導してグルタチオン濃度を低下させて抗がん剤感受性を高める機序が報告されています。この論文では、4種類のヒト肺がん細胞株を用いた実験で、chrysinがドキソルビシンの殺細胞効果を増強することが報告されています。
黄芩は抗炎症作用や様々な抗がん作用が報告され、がんの漢方治療においても使用頻度が高く、その抗腫瘍作用は経験的に知られています。その抗がん成分としてバイカリン、バイカレイン、オーゴニンなどが知られていますが、クリシンの効果もあるのかもしれません。
(クリシンは米国などではサプリメントとしても販売されていますが、ヒトに対する効果に関しては証明されているわけではありません)
以上のことから、ケトン食+2−デオキシグルコース+メトホルミンの組合せや、その他のグルコース代謝(解糖系やペントースリン酸経路)を阻害する治療法と、ジクロロ酢酸ナトリウムやアルテスネイトやスルファサラジンなどがん細胞に酸化ストレスを高める方法(352話参照)を併用すると相乗効果が期待できそうです。
そして、このような方法でがん治療を行うときは、スルフォラファンを多く含むブロッコリースプラウトや抗酸化剤(N-アセチルシステイン、ビタミンEやC)は避けた方が良いと言えます。
【活性酸素の産生を増やすがん治療】
がん細胞の酸化ストレスを高めてがん細胞を死滅させる治療法は「oxidation therapy(酸化治療)」と呼ばれています。
がん細胞ではミトコンドリアの機能異常などによって酸素呼吸を行うと活性酸素の産生が高まります。
がん細胞は酸化ストレスを高めたくないので、ミトコンドリアでの代謝を抑制し、酸素を使わない解糖系での代謝を亢進させています。
したがって、解糖系を抑制しミトコンドリアでの酸化的リン酸化(酸素を使ったエネルギー産生)を亢進すれば、がん細胞内の酸化ストレスを能動的に高め、がん細胞を死滅させることができます。
放射線治療と一部の抗がん剤(ビンブラスチン、シスプラチン、マイトマイシンC、ドキソルビシン、カンプトテシンなど)は、がん細胞に酸化傷害を引き起こして細胞にダメージを与えて死滅させます。その他の抗がん剤も、細胞死を引き起こすときに活性酸素が使われます。
したがって、放射線治療や抗がん剤治療の最中は、抗酸化作用のあるサプリメントの摂取は細胞死を阻害します。一方、酸化ストレスを増強すれば、放射線治療や抗がん剤治療の効き目を高めることができます。
ここ数年の動きとして、がん細胞の酸化ストレスを高める治療が注目されています。酸化治療については352話、417話、418話、419話などで紹介しています。
基本は、解糖系を阻害(2-DG)し、ミトコンドリアの活性化などによって活性酸素の産生を高め(ジクロロ酢酸、メトホルミン、カンビジオール)、がん細胞の抗酸化システムを阻害する方法(ジスルフィラム、オーラノフィン)の併用が有効です。
さらにがん細胞に酸化ストレスを高めるケトン食、アルテスネイト、高濃度ビタミンC点滴、半枝蓮の煎じ薬を併用すると、がん細胞に酸化傷害を与えて、増殖を抑制し、細胞死を誘導できます。
| « 550)カンナビ... | 552)抗がん剤... » |




