がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
586)抗がん剤治療による心臓毒性
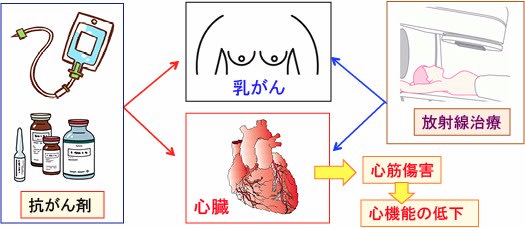
図:乳がんの治療で使用される抗がん剤には心臓に毒性のあるものが多い。左乳房の放射線照射では心臓が放射線によるダメージを受ける場合もある。米国心臓協会(American Heart Association)は「乳がん患者は治療に伴う心臓毒性を認識しなければならない」と注意喚起している。
586)抗がん剤治療による心臓毒性
【抗がん剤による心臓毒性】
抗がん剤の副作用としては、白血球や血小板が減少する骨髄抑制と、吐き気や下痢などの消化器毒性がよく知られていますが、その他に、心臓、肝臓、腎臓、肺、神経系などの主要臓器に障害をきたすこともあります。
心臓毒性を示す抗がん剤としては、ドキソルビシン(アドリアマイシン)などのアントラサイクリン系抗がん剤がよく知られています。
その他、シクロフォスファミド、5-フルオロウラシル、パクリタキセル、ハーセプチンなども心臓毒性の発現が報告されています。
ドキソルビシンによる心毒性は、1)投与後数時間以内に発現し、可逆性の不整脈などが主体の急性毒性、2)投与の数日後から数週間以内に発現する心筋炎や心外膜炎などの亜急性毒性、3)投与後数週間から数ヶ月以上して発現する慢性毒性の3種類に分類されます。
一般的には、ドキソルビシンの心臓毒性とは3)の慢性毒性を指し、心筋障害による致死的なうっ血性心不全を来すことが知られています。
この慢性毒性(心筋症)はドキソルビシンの総投与量が多くなるほど発症率が高まります。450mg/m2を超えると発現頻度が高くなり、1000mg/m2を超えると50%に達すると言われています。
うっ血性心不全を発現すると、利尿剤やジギタリス製剤などの治療に対する反応が悪く、死亡率が30~60%と極めて高いと言われています。
高齢者や心疾患を持っていたり、左乳房や縦隔へ放射線照射との併用や、心臓毒性を持つ他の抗がん剤との併用の場合は、特に心臓毒性に対する注意が必要です。
【乳がんの抗がん剤治療や放射線治療が心血管疾患のリスクを高めている】
乳がんの抗がん剤治療では、ドキソルビシン(アドリアマイシン)などのアントラサイクリン系抗がん剤や、シクロフォスファミド、パクリタキセル、フルオロウラシル、ハーセプチンなど心臓毒性を示す抗がん剤が多く使われます。
AC療法(ドキソルビシン+シクロホスファミド療法)は、乳がんの患者さんに対して行う標準的な抗がん剤治療です。術前化学療法と術後補助化学療法のいずれにも使用されています。
ドキソルビシン(アドリアシン)とシクロホスファミド(エンドキサン)は、1日目(Day 1)に投与し、2~21日目は休薬します。通常の1回の投与量はドキソルビシンは60mg/m2、シクロフォスファミドは600mg/m2です。60mg/m2は体表面積1m2当たり60mgという意味です。
3週間隔で通常4回投与します。4回の投与でドキソルビシンの総投与量は240mg/m2、シクロフォスファミドは2400mg/m2になります。
EC療法(エピルビシン / シクロホスファミド併用療法)やCEF療法(シクロホスファミド / エピルビシン / フルオロウラシル併用療法)も乳がんの抗がん剤治療として使用されます。
EC療法では1回にエピルビシン 100 mg/m2、シクロホスファミド 600 mg/m2を3週間隔投与、4~6コース反復します。したがって、エピルビシンの総投与量は400〜600 mg/m2になります。
CEF療法では、1回の投与量がシクロホスファミド 500 mg/m2、エピルビシン 100 mg/m2、フルオロウラシル 500 mg/m2で、3週間隔投与で4~6コース反復されます。したがって、エピルビシンの総投与量は400〜600 mg/m2になります。
さらに、術後の放射線治療(左側)では、心臓への照射も起こり、これが心筋傷害や血管傷害の原因になっています。通常、乳房温存手術後の放射線治療の総線量は50グレイ(Gy)程度です。
このように、乳がんの抗がん剤治療と放射線治療では、心臓への障害が起こりやすいと言えます。
米国心臓協会(American Heart Association)は乳がん治療と心血管疾患の関わりについて新たな科学的声明(Scientific Statement)をまとめ、Circulation(2018年2月1日オンライン版)に発表しています。
この声明では、米国では乳がん患者332万人に対して心血管疾患を有する女性は4,780万人と推定しています。また、乳がんの早期検出と治療法の改善により、心血管疾患を合併しながら長期生存を続ける乳がんサバイバーが増加したが、65歳以上の高齢サバイバーでは乳がんよりも心血管疾患で死亡する者が多いと言っています。このため、がんの治療中および治療後に心血管危険因子を適切に管理することが重要であると警告しています。
つまり、「乳がん患者は治療に伴う心臓毒性を認識しなければならない」と注意喚起しています。
アントラサイクリン系薬、アルキル化薬、ホルモン療法薬、HER2標的薬などは心不全を引き起こす可能性があります。その他にも、放射線療法による冠動脈疾患、代謝拮抗薬による冠動脈攣縮、タキサン系薬による徐脈、サイクリン依存性キナーゼ(CDK)4/6阻害薬によるQT延長などの副作用が指摘されています。このため、この声明では「乳がん治療中の心毒性の監視、予防、管理が極めて重要であり、治療後も長期にわたる遅発性心毒性のモニタリングが必須である」と指摘しています。
この声明では、心機能障害のリスクを上昇させる乳がん治療としては、以下を挙げています。
- 高用量のアントラサイクリン系薬剤による治療:250mg/m2以上のドキソルビシンまたは600mg/m2以上のエピルビシン
- 心臓が照射範囲内に入る高線量の放射線療法:30Gy以上の放射線療法
- 連続治療:低用量のアントラサイクリン系薬剤による治療(250mg/m2未満のドキソルビシンまたは600mg/m2未満のエピルビシン)およびその後のtrastuzumab(ハーセプチン)による治療
- 併用療法:低用量のアントラサイクリン系薬剤による治療(250mg/m2未満のドキソルビシンまたは600mg/m2未満のエピルビシン)と、照射範囲内に心臓が入る低線量の放射線療法(30Gy未満)の併用
つまり、標準的に広く行われているレベルの抗がん剤治療や放射線治療は、心臓に毒性があると言えます。アントラサイクリン系抗がん剤(ドキソルビシンやエピルビシン)だけでなく、ハーセプチンやシクロフォスファミドや放射線治療が加わると、さらに心血管傷害のリスクが上がります。
補助化学療法や放射線治療は乳がんの再発予防には有効ですが、長期的には心血管疾患のリスクを高めるのは確実です。心血管疾患のリスクを減らす方法を併用することも重要と言えます。
【ドキソルビシンの心臓毒性を軽減するサプリメントと生薬】
ドキソルビシン(アドリアマイシン)の心臓毒性を緩和するサプリメントとしてコエンザイムQ10(CoQ10)が知られています。
CoQ10は抗酸化作用があり、昔は心不全の治療薬として用いられており、ドキソルビシンの心臓障害から保護する作用が報告されています。
ヨーロッパで使用されているハーブのミルクシスルもドキソルビシンの心臓毒性を緩和する効果が報告されています。
生薬の中にも、抗酸化作用や細胞保護作用によって、抗がん剤による臓器ダメージから保護する効果をもったものが報告されています。
ドキソルビシンの心臓毒性に対する生薬の保護作用を、マウスやラットを使った動物実験で検討した研究がいくつか報告されています。
このような動物実験で、田七人参(でんしちにんじん)、当帰(とうき)、枸杞子(くこし)、甘草(かんぞう)が、動物実験などでドキソルビシンの心臓障害を緩和する効果があることが報告されています。
1)田七人参(でんしちにんじん):
田七人参(三七人参とも呼ばれる)はウコギ科のサンシチニンジン(Panax notoginseng)の根で、高麗人参の仲間です。
田七人参には、血管や心臓や肝臓に対する効果があります。
肝細胞の保護作用と、障害を受けた肝細胞の再生を促進する効果があるので、肝機能障害に使用されます。
また、止血作用があるので、喀血、吐血、血便など出血がある場合に使用されます。
伝統的かつ経験的に、田七人参が心臓機能を良くし、心筋のダメージに対して保護作用を示すことは良く知られています。心筋梗塞や狭心症の治療に田七人参が利用されています。
さらに、抗がん剤による心臓障害に対して田七人参サポニンが保護作用を示す動物実験の研究結果が報告されています。(Planta Med. 74:203-209, 2008)
この研究では、ドキソルビシンの抗がん作用を低下させず、ドキソルビシンによる心臓毒性に対して田七人参サポニンは心臓保護作用を示すことが報告されています。(論文の詳細は第67話で紹介しています)
2)当帰(とうき)
:
当帰はセリ科のトウキ又はその他近縁植物の根です。
血管拡張と血行促進により身体を温める効果があり、冷えを改善します。補血作用があり、体力の衰えや貧血や皮膚の乾燥を軽減する効果があります。
婦人科領域の主薬であり、貧血、冷え症、生理痛、月経不順などの治療に用いられます。さらに、心臓疾患や脳血管疾患の治療にも使用されています。マウスを使った実験でドキソルビシンの心臓障害を緩和する効果が報告されています。以下のような報告があります。
Angelica sinensis: a novel adjunct to prevent doxorubicin-induced chronic cardiotoxicity.(当帰:ドキソルビシンによる慢性心臓毒性を予防する新しい補助療法)Basic Clin Pharmacol Toxicol. 101:421-426, 2007
この論文では、当帰(Angelica sinensis)は中国医学で心臓血管疾患や脳血管疾患の治療に広く用いられているので、ドキソルビシンで誘発される慢性的な心筋毒性に対する当帰の効果を検討したと記述しています。
マウスに当帰の熱水抽出エキス(15g/kg)を4週間毎日経口投与しています。
その後にドキソルビシンは15mg/kgの静脈内投与を週に1回投与しています。
心筋毒性は、心電図、心筋細胞中の抗酸化活性、クレアチンキナーゼとAST(アスパラギン酸アミノトランスフェラーゼ)、心筋の組織変化で評価しています。
ドキソルビシンの累積投与量が60mg/kgになると、死亡、心電図におけるQT延長や心拍数減少、心筋細胞の抗酸化活性の低下、血清AST値の上昇が生じます。
ドキソルビシンを投与する前に当帰エキスを4週間前投与しておくと、死亡率を有意に減少さえ、心臓機能を良くし、血清中のASTを低下させ、心筋細胞の抗酸化活性を正常化し、不整脈を減らし、心臓の伝道系異常を正常化することを示しています。
しかし、当帰エキスの投与はドキソルビシンの抗腫瘍活性を妨げませんでした。
以上の結果から、当帰エキスはドキソルビシンによる心筋細胞の酸化傷害に対して心筋細胞保護作用を示し、ドキソルビシンによる抗がん剤治療の副作用軽減のために新規の治療法になると言っています。
3)枸杞子(くこし):
ナス科のクコの果実で、疲労回復や老化防止の効果があり、民間薬として昔から不老長寿の薬として利用されています。
欧米でも、クコの実は、非常に強い抗酸化作用と抗老化作用をもつ食品として人気があります。
Protective effect of Lycium barbarum on doxorubicin-induced cardiotoxicity.(ドキソルビシンの心臓毒性に対するクコの保護効果)Phytother Res. 21:1020-1024, 2007
この論文では、ラットを用いてドキソルビシンを5mg/kg静脈内注射で週1回、3週間投与する実験で、38%のラットが死にましたが、クコシを25mg/kg毎日摂取させることによって致死率は13%に低下し、心臓機能のダメージも顕著に低下しました。ドキソルビシンの抗腫瘍効果を妨げる作用は認められませんでした。
4)甘草(かんぞう):
甘草の心臓保護作用が報告されています。以下のような報告があります。
Cardioprotective effects of Glycyrrhiza uralensis extract against doxorubicin-induced toxicity.(ドキソルビシン誘導性毒性に対する甘草エキスの心筋保護作用)Int J Toxicol. 2011 Mar;30(2):181-9.
この報告では、マウスにドキソルビシン(20mg/kg)を1回腹腔内投与して心筋傷害を誘導しています。ドキソルビシンを投与すると心筋細胞の逸脱酵素の乳酸脱水素酵素(LDH)やクレアチン・キナーゼのアイソザイム(CK-MB)の血中の値が上昇します。
この実験で、甘草エキス(100mg/kg)を8日間、経口で投与するとLDHとCK-MBの上昇が顕著に抑制されました。つまり、甘草の抽出エキスがドキソルビシンによる心筋傷害を阻止したという結果です。
甘草エキスの投与によってドキソルビシンの抗腫瘍活性は妨げられませんでした。
その機序として、心筋細胞のグルタチオン・ペルオキシダーゼの活性とグルタチオンの量が増加していたという結果を報告しています。この論文の結論は、ドキソルビシンの心臓毒性の軽減に甘草の投与が有効であるとしています。
甘草(かんぞう)はウラル地方、シベリア、モンゴル、中国北部に分布するマメ科の多年草のウラルカンゾウ(Glycyrrhiza uralensis)や同属植物の根および根茎を用います。
甘草は漢方薬の中で最も多く配合され、他の薬物の効能を高めたり、毒性を緩和する作用があります。「百薬の毒を解す」と言われ、他の生薬の刺激性や毒性を緩和する目的でも配合されます。
甘草の主な薬効成分であるグリチルリチンは砂糖の30から50倍の甘味があり、漢方薬の苦味を軽減する効果もあります。グルチルリチンにはステロイド様作用、抗炎症作用、抗潰瘍作用、鎮咳作用などがあります。
肝機能を改善する作用もあり、強力ネオミノファーゲンCやグリチロンなどのグリチルリチン製剤もあります。
甘草を多量に服用すると浮腫、高血圧、低カリウム血症などの偽アルドステロン症やミオパチーの副作用が出ます。そのため、1日量は1〜3グラム程度を使用します。
生の甘草は抗炎症作用や解毒作用が強く、炒めて炙甘草にすると補気作用が強くなります。したがって、煎じ薬の場合は、炎症や化膿症には生甘草を用い、体力低下や胃腸機能の低下には炙甘草を用いるという使い分けをしています。
以上の研究は動物実験ですので、人間の場合にはどの程度の効果があるかは、まだ不明です。
しかし、抗酸化作用や細胞保護作用があり、心臓疾患に経験的に使用されてきた生薬が、動物実験でドキソルビシンの心臓傷害を緩和し死亡率を低下させているので、人間でも効果が期待できると思います。
ドキソルビシンだけでなく、心筋障害を引き起こしやすいシクロフォスファミド、5-フルオロウラシル、パクリタキセル、ハーセプチンなどの抗がん剤治療に田七人参、当帰、枸杞子、甘草を含む漢方薬を併用することは有用性があると思います。
【2−デオキシ-D-グルコースの心筋保護作用】
がん細胞は正常細胞に比べてグルコース(ブドウ糖)の取込みが多く、ATP産生や細胞分裂するための物質合成に大量のグルコースを必要としています。したがって、グルコースの取込みや利用を妨げれば、ATP産生や物質合成が低下し、抗がん剤や放射線治療の効き目が高くなります。
2-デオキシ-D-グルコース(2-DG)はグルコース(ブドウ糖)の2位のOHをHに変換したグルコース類縁体です(下図)。

がん細胞はグルコーストランスポーター(GLUT1)を多く発現しているので、2−デオキシ-D-グルコース(2-DG)も多く取り込みます。取込まれても解糖系で代謝されないので、2-DGを多く取り込んだがん細胞はグルコース代謝の阻害作用が著明に現れます(下図)。

図:2-デオキシ-D-グルコース(2-Deoxy-D-glucose:2-DG)は、グルコース(ブドウ糖)の2位の水酸基(OH)が水素原子(H)に置換された物質(グルコース誘導体)で、がん細胞はグルコースの取込みが多く、2-DGの取込みも多い。2-デオキシ-D-グルコース(2-DG)はグルコース・トランスポーター(GLUT1)によって細胞内に取り込まれる(①)。がん細胞はGLUT1の発現量が増え、グルコースと同時に2-DGも多く取り込む。2-DGはヘキソキナーゼで2-DG-6-リン酸(2-DG-6-PO4)に変換されるが、それ以上代謝されない(②)。がん細胞はフォスファターゼの活性が低いので、2-DG-6-リン酸ががん細胞内に蓄積する(③)。2-DG-6-リン酸はヘキソキナーゼをフィードバック阻害(アロステリック阻害)するので、 2-DG-6-リン酸を取り込んだがん細胞はグルコースの解糖系での代謝が阻害される(④)。その結果、がん細胞のエネルギー産生と物質合成は阻害されることになり、ATPが枯渇する(⑤)。2-DGは小胞体でのタンパク質のN-グリコシル化(糖鎖の結合による修飾)を阻害し、折り畳みの不完全な異常タンパク質(unfolded protein)を増やして小胞体ストレスを引き起こす(⑥)。その結果、がん細胞は死滅しやすくなり、抗がん剤感受性が亢進する(⑦)。
培養細胞を使った実験や動物にがん細胞を移植した動物実験で、2-DGを投与すると抗がん剤や放射線治療の治療効果が高まることが多くの実験系で確認されています。
さらに動物実験で、2-DGが脳や心臓に対する抗がん剤や放射線のダメージを軽減する作用が認められています。その作用機序についてはまだ十分に解明されていませんが、AMP活性化プロテインキナーゼ(AMPK)の活性化やオートファジーの阻害など複数のメカニズムが示唆されています。以下のような論文があります。
Caloric restriction mimetic 2-deoxyglucose antagonizes doxorubicin-induced cardiomyocyte death by multiple mechanisms.(カロリー制限と同様の作用がある2-デオキシグルコースはドキソルビシンによる心筋細胞死を複数のメカニズムで阻止する)J Biol Chem. 2011 Jun 24;286(25):21993-2006.
【要旨】
食事からのカロリー摂取を減らすカロリー制限が心血管系の健康状態を良くすることが知られている。グルコース類縁物質の2-デオキシ-D-グルコースはカロリー制限と同様の作用を示すことが複数の動物実験で報告されている。しかしながら、2-DGが心機能に有益な作用を示すかどうかはまだ不明である。
この研究では、抗がん剤で副作用として心筋障害を引き起こすドキソルビシンの投与で引き起こされる心筋細胞死に対して2-DGが抑制作用を示すかどうかを検討した。
新生児ラットの心筋細胞を0.5mMの2-DGで処理すると、ドキソルビシンで誘導される心筋細胞のダメージや細胞死を顕著に抑制した。
2-DGは細胞内ATP量を17.9%低下させたが、ドキソルビシンによって引き起こされる著明なATP枯渇は阻止し、これが2-DGによる心筋細胞死の抑制に寄与していると考えられた。
さらに、2-DGはAMP活性化プロテインキナーゼ(AMPK)の活性を高めた。
AMPKシグナルの阻害剤(compound Cまたは干渉RNA)を投与すると、2-DGの心筋細胞保護作用は阻止された。
逆に、薬や遺伝子的方法でAMPK活性を増強すると、ドキソルビシンの心筋細胞障害は抑制された。2-DGとAMPK活性化剤を併用すると相加効果は認めなかった(注:両方とも同じ機序でドキソルビシンによる心筋障害を抑制するので、併用しても相加や相乗効果は得られないということ)
さらに2-DGはオートファジー(自食作用)を誘導するが、このオートファジーは細胞内タンパク質の分解であり、その活性化は細胞の状況によって良い場合(細胞障害から保護する)と悪い場合(細胞障害を悪化する)がある。
2-DGはオートファジーを活性化するが、ドキソルビシンによって引き起こされる細胞障害性のオートファジーは阻止した。
以上のことから、カロリー制限と同様な作用を示す2-DGはドキソルビシンで誘導される心筋細胞のダメージや細胞死を阻止することが明らかになり、その作用機序としては、ATP量の維持、AMPKの活性化、ドキソルビシンによって誘導されるオートファジーの阻害など複数のメカニズムが関与していることが示唆された。
このように、2-DGはがん細胞の抗がん剤感受性や放射線感受性を高め、正常細胞に対しては抗がん剤や放射線のダメージから守る作用があります。2-DGを抗がん剤治療や放射線治療と併用するエビデンスは高いと言えます。
【CB1阻害はドキソルビシンによる心臓毒性を軽減する】
カンナビノイド受容体CB1はドキソルビシンの心臓毒性を亢進し、CB1の阻害はドキソルビシンの心臓毒性を軽減することが報告されています。以下のような報告があります。
Pharmacological Inhibition of CB1 Cannabinoid Receptor Protects Against Doxorubicin-Induced Cardiotoxicity.(カンナビノイド受容体CB1の薬理学的阻害はドキソルビシンによって誘導される心臓毒性を軽減する)J Am Coll Cardiol. 2007 August 7; 50(6): 528–536.
【要旨】
研究の目的;ドキソルビシンによって引き起こされる心臓毒性のin vivo(動物を使った生体内での実験)およびin vitro(細胞培養の系での実験)を用いて、カンナビノイド受容体1(CB1)の阻害剤の効果を検討した。
研究の背景:ドキソルビシンは非常に有効性の高い抗がん剤の一つであるが、強い心臓毒性の副作用があるため、臨床での使用には制限がある。様々な生理的および病的な状況において、内因性カンナビノイドはCB1受容体を介して心臓機能を低下させる作用があり、このような作用はCB1アンタゴニスト(拮抗薬)によって阻止できる。
方法:心臓左室機能、アポトーシスの指標、CB1/CB2受容体の発現量、内因性カンナビノイド濃度などを種々の方法で解析した。
結果:マウスを用い、体重1kg当たり20mgのドキソルビシンを腹腔内に1回投与してから5日後の検査で、左心室収縮期圧や左室駆出分画(ejection fraction)や心伯出量など様々な心機能の指標は顕著に低下した。内因性カンナビノイドのアナンダミドの心筋内濃度はコントロール群に比較して上昇を認めた。しかし、カンナビノイド受容体CB1とCB2の発現量には変化は認めなかった。
CB1のアンタゴニスト(受容体に結合してその働きを阻害する薬:拮抗薬)であるrimonobantやAM281を投与すると、ドキソルビシンによって引き起こされる心筋細胞のアポトーシスが阻止され、心機能低下が顕著に改善した。
培養心筋細胞株H9c2細胞を用いたin vitroの実験で、ドキソルビシンは培養心筋細胞の生存率を低下させ、アポトーシスを引き起こしたが、心筋細胞をCB1の拮抗薬で前処理すると、心筋細胞のアポトーシスは阻止された。
この阻害作用は、CB1とCB2のアゴニスト(受容体に働いて機能を示す作動薬)やCB2のアンタゴニスト(拮抗薬)では認められなかった。
結論:以上の結果は、ドキソルビシンによって引き起こされる心臓毒性に対して、カンナビノイド受容体CB1の拮抗薬や阻害剤が有効な治療薬となる可能性を示唆している。
CB1受容体の働きを阻害することはドキソルビシンの心臓毒性を軽減できるという報告です。
カンナビジオールにはCB1受容体の阻害作用があります。その他の機序でもカンナビジオールには心筋保護作用が知られています。以下のような報告もあります。
Cannabidiol Protects against Doxorubicin-Induced Cardiomyopathy by Modulating Mitochondrial Function and Biogenesis(カンナビジオールはミトコンドリアの機能と新生を制御することによってドキソルビシン誘発性心筋障害を防ぐ)Mol Med. 2015; 21(1): 38–45.
【要旨】
ドキソルビシンは広く使用されている抗腫瘍活性の高い抗がん剤であるが、その用量依存的な心臓毒性によって臨床使用に限界がある。
ドキソルビシンの心臓毒性には活性酸素や一酸化窒素による酸化ストレスの亢進や、心筋細胞や血管内皮細胞のミトコンドリア機能の障害や細胞死が関与している。
カンナビジオールは大麻に含まれる精神活性を持たない成分であり、有害作用は少なく、抗酸化作用や抗炎症作用を有し、さらに最近は抗腫瘍活性も報告されている。
ドキソルビシン誘発性の心筋障害のマウスの実験モデルを用いて、カンナビジオールの効果を検討した。
ドキソルビシン誘発性心筋障害は心筋細胞のダメージのレベル(血清中のクレアチニンキナーゼと乳酸脱水素酵素の値)、活性酸素や一酸化窒素による細胞傷害のレベル(細胞内のグルタチオン量、グルタチオンペルオキシダーゼ1活性、脂質過酸化、3-ニトロチロシン形成、誘導性一酸化窒素合成酵素mRNAレベル)、心筋細胞死(アポトーシス、ポリADPリボースポリメラーゼ1依存性)、心筋機能(心拍出機能と左室内径短縮率)で評価した。
ドキソルビシンはミトコンドリア新生を抑制し、ミトコンドリア機能を低下させ(呼吸酵素複合体IとIIの活性低下)、心筋細胞における脱共役たんぱく2と3(uncoupling protein 2 and 3)とmedium-chain acyl-CoA dehydrogenase mRNAの発現を低下させた。
カンナビジオールの投与は、これらのドキソルビシン誘発性の心筋機能の障害を改善し、活性酸素や一酸化窒素による細胞ストレスと細胞死を軽減した。
カンナビジオールは障害されたミトコンドリア機能をミトコンドリア新生を改善した。
これらの実験結果は、ドキソルビシンによる心筋障害に対する新たな治療法をしてカンナビジオールの有用性を示唆しており、ミトコンドリアの機能や新生に対するカンナビジオールの作用は、他の多くの組織障害の実験モデルでのカンナビジオールの作用機序を説明できるかもしれない。
CB1活性をアロステリック機序で抑制するカンナビジオールは、抗がん剤による心臓や肝臓のダメージによる副作用に対して抑制効果を発揮する可能性があります。
抗がん剤の副作用予防のサプリメントとしてカンナビジオール・オイルは多くの報告があります。
その他、ω3系不飽和脂肪酸のドコサヘキサンエン酸(DHA)やエイコサペンタエン酸(EPA)がアントラサイクリン系抗がん剤の心筋毒性を軽減する事が報告されています。

図:抗がん剤のドキソルビシンは心筋にダメージを与える。カンナビノイド受容体CB1はミトコンドリアの新生や機能を低下させることによってドキソルビシンによる心筋傷害を増悪させる。CB1は大麻成分のΔ9-テトラヒドロカンナビノールによって活性化される。カンナビジオールはCB1受容体をアロステリック機序で阻害する。したがって、カンナビジオールはCB1の活性を低下させ、ミトコンドリア新生を亢進し、ミトコンドリア機能を高めて、ドキソルビシン心筋傷害を軽減する。
【乳がん患者の半数以上は無駄な抗がん剤治療を受けている】
乳がんの予後は血行性転移の有無にかかっています。手術時にすでに転移していた場合、多くは3年以内に再発しますが、10年以上経過して再発が見つかることもあります。
転移による再発を防ぐ(あるいは遅らせる)目的で乳がん患者の80%程度が手術後に補助化学療法を受けているという報告があります。
診断時の年齢によりますが、術後補助化学療法によって15年生存率では3%から15%くらいの生存率上昇の臨床的有益性があると報告されています。
しかし、再発したり転移するのは、乳がん患者の40%もいないので、6割以上の患者は無駄に抗がん剤治療を受け、有害作用を受けていることになります。
つまり、乳がん患者の半数以上が、手術後に何もしなくても再発しないのに、無駄に抗がん剤治療を受けて寿命を短くしているということになります。
高齢者の乳がんサバイバーは乳がんの再発し死亡するより心臓疾患で死亡する確率の方が高いことを、米国心臓協会(American Heart Association)は明らかにしています。
問題は、既に転移している人と、転移していない人を判別する有効な方法が無いことです。
通常行われている腫瘍の大きさや核異型度(グレード)や細胞分裂(Ki-67)などで予後(再発の可能性)を推測していますが、これらは全身性の血行性転移の可能性とはあまり相関していないことが明らかになっています。
リンパ節転移と血行性転移はメカニズムが異なるため、リンパ節転移の程度では、血行性転移のリスクは評価できないと言われています。
血行性転移のリスクを正しく評価できれば、補助化学療法の必要な乳がん患者を絞ることができ、無駄な抗がん剤治療(補助化学療法)が減らせることになります。そのような信頼性の高い方法が見つかれば、経済的損失が大きく、寿命も短縮する、無駄で有害な術後補助化学療法を減らせることになります。
ただ、まだそのような方法は無いので、当分の間は、乳がん患者の半分くらいは、何のメリットも無い、無駄で有害な補助化学療法を受けざるを得ないようです。
抗がん剤や放射線の心臓毒性を減らす方法として、コエンザイムQ10、ミルクシスル、漢方薬、カンナビジオール、2-デオキシ-D-グルコース、ω3系多価不飽和脂肪酸(DHA/EPA)などは、多少の効果が期待できるかもしれません。(ただし、動物実験での研究しかなく、臨床試験での有効性はいずれも証明されていません。)
がんの標準治療はがん細胞を攻撃することが中心で、体を守ることを重視していません。
『乳がんの再発率を10%減らすために、乳がん患者の半数が、無駄で有害な抗がん剤治療を受けても仕方ない』という論理は、漢方的発想からは受け入れられません。食事や運動や漢方治療などで体の治癒力と抵抗力を高めて、寿命を延ばしながらがんの再発を予防するという方法論も、高齢化社会でもっと受け入れられて良いと思います。
今週(2018年3月19日)発売の『気と血のめぐり 本格漢方2018(朝日新聞出版)』で、丁宗鐵先生(日本薬科大学学長、百済診療所院長)と『漢方とがん』で対談しています。

本の紹介はこちらへ:
| « 585)がん細胞... | 587)乳がんの... » |



