がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
646) 免疫細胞の働きを阻害するがんの微小環境:がん組織の酸性化と栄養枯渇
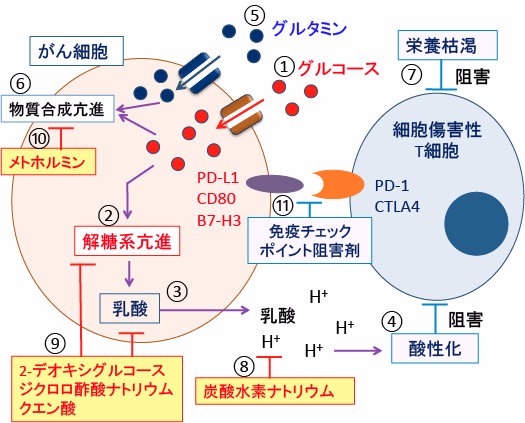
図:がん細胞はグルコースの取り込みが増え(①)、解糖系が亢進し(②)、乳酸産生が増えている(③)。乳酸は細胞外に排出され、がん組織は酸性化し、T細胞の働きを阻害する(④)。グルタミンなどのアミノ酸の取り込みも増え(⑤)、がん細胞内では物質合成が亢進している(⑥)。グルコースやグルタミンのがん細胞内への取り込みが亢進しているので、がん組織内のリンパ球は栄養枯渇の状態にあり、細胞機能は阻害される(⑦)。炭酸水素ナトリウム(重曹)はがん組織内の水素イオンを中和して酸性化を抑制する(⑧)。2-デオキシグルコース、ジクロロ酢酸ナトリウム、クエン酸は解糖系を抑制し、乳酸産生を軽減する(⑨)。メトホルミンは物質合成(同化)を抑制する(⑩)。がん細胞はPD-L1などのリガンドで、細胞傷害性T細胞のPD-1やCTLA4を刺激して抗腫瘍免疫を抑制しており、免疫チェックポイント阻害剤でT細胞によるがん細胞への攻撃を活性化する治療が行われている(⑪)。がん組織の酸性化や栄養枯渇や低酸素という免疫抑制性の微小環境を改善すると、免疫チェックポイント阻害剤などの免疫療法の効き目を高めることができる。
646) 免疫細胞の働きを阻害するがんの微小環境:がん組織の酸性化と栄養枯渇
【T細胞ががん細胞を攻撃する】
最近はオプジーボやヤーボイなどの免疫チョックポイント阻害剤を使った治療の有効性が多く報告されています。
免疫チェックポイント阻害剤はT細胞によるがん細胞への攻撃を活性化します。しかし、がん組織は酸性化や栄養枯渇などの要因で、T細胞が働きにくい環境にあります。このような免疫抑制性の微小環境を改善すると、免疫チョックポイント阻害剤などの免疫療法の効き目を高めることができます。
がん細胞に対する免疫細胞の攻撃の機序と、T細胞の働きを阻害するがん組織の微小環境とその改善の仕方を理解することはがん治療において重要です。
リンパ球にはB細胞・T細胞・ナチュラルキラー細胞などがあります。
B細胞は抗体を使って細菌やウイルスを攻撃するもので、これを「液性免疫」といいます。
一方、ウイルス感染細胞やがん細胞など自分の細胞に隠れている異常を発見して、Tリンパ球などが直接攻撃する免疫の仕組みを「細胞性免疫」といいます。
この液性免疫と細胞性免疫の制御は2種類のヘルパーT細胞 (Th) のバランスによって決まります。ヘルパーT細胞は、B細胞やT細胞の増殖や働きを調節するタンパク質(サイトカイン)を分泌して、液性免疫と細胞性免疫のバランスを調節しており、そのサイトカインの産生パターンから、Th1(1型ヘルパーT) 細胞とTh2(2型ヘルパーT) 細胞に分類されます。
Th1細胞はインターフェロン・ガンマ(IFN-γ)や インターロイキン-2(IL-2)を分泌して細胞性免疫に関与し、Th2細胞はIL-4, IL-5, IL-6, IL-10などを分泌して液性免疫に関与します。
ヘルパーT前駆細胞(Th0)がTh1細胞になるためにはマクロファージや樹状細胞から分泌されるIL-12が必要であり、一方、Th2細胞となるためにはT細胞から分泌されるIL-4が必要とされています。

図:ヘルパーT前駆細胞(Th0)は1型ヘルパーT細胞(Th1)と2型ヘルパーT細胞(Th2)に分化誘導される(①)。 Th1細胞はインターフェロン・ガンマ(IFN-γ)や インターロイキン-2(IL-2)を分泌して細胞性免疫に関与し(②)、Th2細胞はIL-4, IL-5, IL-6, IL-10などを分泌して液性免疫に関与する(③)。ヘルパーT前駆細胞(Th0)がTh1細胞になるためにはマクロファージや樹状細胞から分泌されるIL-12が必要であり(④)、一方、Th2細胞となるためにはT細胞から分泌されるIL-4が必要とされている(⑤)。Th1細胞はナチュラルキラー(NK)細胞(⑥)やキラーT細胞(⑦)を活性化してがん細胞を攻撃する。
【自然免疫と獲得免疫】
免疫システムは病原体やがん細胞から生体を守る働きを担っています。この免疫システムは自然免疫と獲得免疫に分けられます。
自然免疫は先天的に備わった免疫で、微生物などに特有の分子パターンを認識して異物を攻撃します。マクロファージや好中球には細菌などの病原体に共通した情報を認識できる受容体を細胞表面に持っていて、病原体を認識して貪食します。
さらにマクロファージはナチュラルキラー細胞を活性化します。
ナチュラルキラー(natural killer)細胞(略してNK細胞)は、ターゲットの細胞を殺すのにT細胞と異なり事前に感作させておく必要が無いことから、生まれつき(natural)の細胞傷害性細胞(killer cell)という意味で名付けられました。
「感作」というのは、前もって抗原に対する認識能を高めておくことで、感作させておく必要がないというのは、初めて出あった細胞でも、直ちにその異常細胞を認識して攻撃できるということです。
ナチュラルキラー細胞(NK細胞)は、MHCクラスI分子が喪失した細胞(自己性を喪失した異常な細胞)を認識して攻撃します。
NK細胞の細胞質にはパーフォリンやグランザイムといった細胞傷害性のタンパク質をもち、これらを放出してターゲットの細胞を死滅させます。
がん細胞を見つけると直ちに攻撃するため、がんに対する第一次防衛機構として、特に発がん過程の初期段階でのがん細胞の排除において重要な役割を果たしています。
一方、獲得免疫は,後天的に外来異物の刺激に応じて形成される免疫です。高度な抗原特異性と免疫記憶を特徴とします。
マクロファージや樹状細胞が、がん細胞からがん抗原ペプチドと呼ばれる小さな蛋白質を捕足し、その情報がヘルパーT細胞に伝えられ、その情報に従って特定のがん抗原に対する免疫応答が引き起こされるのが獲得免疫です。
T細胞は、がん抗原で活性化されて初めて細胞傷害活性を持つようになります。すなわち、細胞傷害活性を持たないT細胞が抗原提示細胞から抗原ペプチド(がん抗原)を提示されて活性化してはじめてがん細胞に対して特異的な細胞傷害活性を持つ細胞傷害性T細胞(キラーT細胞)となり、がん細胞を攻撃するようになります。
細胞傷害性T細胞(CTL)は細胞傷害物質であるパーフォリン、 グランザイム, TNF(tumor necrosis factor)などを放出したり、ターゲット細胞のFasを刺激してアポトーシスに陥らせることでがん細胞やウイルス感染細胞を死滅させます。
細胞傷害性T細胞の一部はメモリーT細胞となって、異物に対する細胞傷害活性を持ったまま宿主内に記憶され、次に同じ異物(抗原)に暴露された場合に対応できるよう備えます。

図:活性化したマクロファージはナチュラルキラー細胞(NK細胞)を活性化する(①)。活性化されたマクロファージやNK細胞などががん細胞を攻撃し(②)、がん細胞の破壊が起こるとがん抗原が放出される(③)。抗原による感作の必要のないがん細胞に対する第一次防衛機構が「自然免疫」となる(④)。がん抗原を貪食した樹状細胞(⑤)は、がん抗原の情報をT細胞やB細胞に渡して活性化し(⑥)、がん細胞を攻撃する(⑦)。がん抗原特異的な免疫応答によるがん細胞の攻撃が「獲得免疫」となる(⑧)。
【抗原提示とT細胞の活性化】
病原微生物が侵入したり、何らかの原因で炎症が起こると、血管から顆粒球や単球などが遊走して来ます。このように炎症反応によって集まってきたり、あるいは組織に常在していた樹状細胞やマクロファージは、侵入した細菌やウイルス粒子、あるいは死滅した細胞の死骸や断片などを取り込み、リンパ液の流れに沿って所属リンパ節に移動します。
樹状細胞やマクロファージは取り込んだタンパク質を分解し、その結果産生されたペプチド(アミノ酸が数個から数十個つながったもの)をMHC(major histocompatibility complex:主要組織適合抗原複合体)分子の上に提示します。
活性化した樹状細胞はリンパ節で手当たりしだいにナイーブT細胞(まだ一度も活性化されたことのないT細胞)とくっつきあって、何かを確かめます。ナイーブT細胞はその表面にT細胞抗原認識受容体(TCR)を持っています。樹状細胞の表面に提示されたMHC+抗原ペプチドとピタッとくっつく受容体(TCR)をもったナイーブT細胞と出会うと、そのT細胞を活性化します。
抗原を提示して活性化している樹状細胞にはCD80/86という補助刺激因子が発現しており、T細胞のCD28と結合し、刺激を送ります。
さらに、活性化した樹状細胞はサイトカインを放出しており、ナイーブT細胞はそれを浴びることになります。
このように、TCRを介するシグナルとCD28を介する補助刺激とサイトカインによる刺激を同時に受けたTリンパ球は初めて活性化し、TCRの特異性を保ったままで分裂・増殖して自らのクローンを増やします。
CD4陽性T細胞(ヘルパーT細胞)は、Th1またはTh2のパターンを示すサイトカイン産生細胞へと分化します。
CD8陽性T細胞(キラーT細胞)は成熟し、細胞質内にパーフォリンやグランザイムなどを含んだ細胞傷害顆粒を持つエフェクター細胞になります。
エフェクター細胞はリンパ節を離れ、胸管を経て循環血液中へと流れ込み、血流に従って全身を巡ります。炎症の起こっている組織から産生されるサイトカインやケモカインなどの作用でエフェクターT細胞は炎症部位に集まり、病原菌やがん細胞の攻撃に参加します。

図:がん細胞から放出されたがん抗原を未熟樹状細胞が取り込んで成熟して抗原を提示するとき、MHC(major histocompatibility complex:主要組織適合抗原複合体)分子にペプチド抗原を載せて細胞傷害性T細胞やヘルパーT細胞に提示する。このとき、MCH+ペプチド抗原にぴったり結合するTCR(T細胞受容体)を持つT細胞は、補助刺激因子(CD28とCD80/86など)や樹状細胞から放出されるサイトカインの働きで活性化され、がん抗原を認識するT細胞が増殖し、がん細胞を攻撃する。
【抗がん剤や放射線は抗腫瘍免疫を刺激する】
放射線治療が全身の抗腫瘍免疫の活性化の引き金になりうることが明らかになっています。
がん組織に放射線照射を行うと、がん細胞が死滅して細胞内成分が放出されるとこれらの成分が危険シグナルとなって自然免疫が活性化されます。同時に死滅したがん細胞からがん抗原が放出され、このがん抗原の情報を抗原提示細胞(樹状細胞やマクロファージ)が細胞傷害性T細胞(CTL)に提示してCTLは活性化され、獲得免疫が成立すると、生き残ったがん細胞を攻撃して排除しようとします。このような非照射のがん細胞にも免疫細胞の作用が働くことをアブスコパル効果(Abscopal efffect)と言います。(447話参照)
同様に、抗がん剤治療も、分裂しているがん細胞を死滅させるだけでなく、この死滅した細胞から放出された細胞成分が自然免疫を刺激し、がん抗原が樹状細胞などの抗原提示細胞に認識されて、がん抗原特異的な抗腫瘍免疫を引き起こします(下図)。
したがって、通常の抗がん剤治療と免疫チェックポイント阻害剤の併用が相乗効果を示す可能性があり、実際に、抗がん剤と免疫チェックポイント阻害剤の併用による奏功率の向上が報告されています。

図:放射線治療や抗がん剤治療でがん細胞が死滅するとがん抗原が放出される(①)。がん抗原は樹状細胞やマクロファージなどの抗原提示細胞に取込まれ、ペプチドに分解されて抗原ペプチドとして抗原提示細胞上のMHC(主要組織適合抗原複合体)に提示される(②)。MHCはがん抗原を介してCTL(細胞傷害性T細胞)上のTCR(T細胞受容体)と反応してCTLを活性化し、抗原提示を受けたがん抗原特異的なCTLは増殖し(③)、がん抗原を持っているがん細胞を攻撃する(④)。
シクロフォスファミドなどの抗がん剤は通常の壊死やアポトーシスに比べて免疫応答を惹起しやすい形でがん細胞を死滅させます。このような細胞死は「免疫原性細胞死」と呼ばれています。
シクロフォスファミドの他、アントラサイクリン系(doxorubicin, epirubicin, idarubicin)、オキサリプラチン(oxaliplatin)、ミトキサントロン(mitoxantrone)、ボルテゾミブ(bortezomib)などが免疫原性細胞死を起こしやすいことが報告されています。
2−デオキシ-D-グルコースをがん細胞に取り込ませておくと、抗がん剤による免疫原性細胞死を増強することが報告されています。(447話参照)
したがって、放射線治療や抗がん剤治療を受けるときは、その前に2-デオキシグルコースをがん細胞に取り込ませ、さらに治療後は免疫原性細胞死を起こした死滅したがん細胞を樹状細胞の認識させ、がん抗原特異的なCT4+T細胞(ヘルパーT細胞)とCD8+T細胞(キラーT細胞)を活性化して増殖させるという治療戦略は効果が期待できます。樹状細胞の活性化においてピドチモドを利用すると効果を高めることができます(450話参照)。
【細胞傷害性T細胞を抑制するPD-1とCTLA-4】
細胞傷害性T細胞(キラーT細胞)は抗原提示細胞(樹状細胞やマクロファージ)から抗原を提示されると活性化されて、敵(病原菌やがん細胞など)を攻撃します。
細胞傷害性T細胞にはPD-1やCTLA-4という受容体が存在します。PD-1はプログラム細胞死1(programmed death-1)、CTLA-4は細胞傷害性Tリンパ球抗原-4 (cytotoxic T-lymphocyte-associated protein 4)の略です。
これらの受容体のリガンド(受容体に結合して作用する物質)となるPD-L1やB7(B7-1, B7-2)を抗原提示細胞が持つことによって細胞傷害性T細胞の働きを抑制しています。
つまり、PD-1受容体やCTLA-4受容体がリガンドによって刺激されると、T細胞の増殖が停止し細胞死を来すことになります。このようにして細胞傷害性T細胞の過剰な応答を制御しています。
細胞傷害性T細胞の働きを阻害するPD-L1やB7はがん細胞にも発現しています。つまり、がん細胞は免疫系の制御システムを利用して、がん組織内の細胞傷害性T細胞の働きを阻止しています。
PD-1受容体やCTLA-4受容体は細胞傷害性T細胞を死滅させるスイッチなようなものなので、これらのスイッチが入らないようにすれば、細胞傷害性T細胞は生き残ってがん細胞の攻撃力を高めることができます。
CTLA-4に対する抗体(ヒト型抗ヒトCTLA-4モノクローナル抗体)のイピリブマブ(ipilimumab: YERVOY)やヒト型抗PD-1モノクローナル抗体のニボルマブ(nivolumab商品名「オプジーボ(Opdivo)」)などがあります。このような免疫チェックポイント阻害剤を使用すると、がん細胞を攻撃する細胞傷害性T細胞の働きを高めることが可能になります。
体に備わったがん細胞に対する攻撃力を高めてがんを治療しようというのが「がんの免疫療法」の理論です。「免疫細胞を活性化する」という従来の免疫療法では十分な効果が得られなかったのですが、その大きな理由は免疫応答にブレーキをかける仕組みの存在です。このブレーキを解除して免疫細胞に100%の力でがん細胞を攻撃させようというのが、CTLA-4やPD-1/PD-L1をターゲットにした治療法です。(下図)
ただ、この治療法は免疫細胞の暴走を許して、自己免疫疾患を引き起こすという副作用もあります。

図:抗原提示細胞上にはMHCクラスII(MHC-II)といわれる分子があり、抗原を介してT細胞上のTCR(T細胞受容体)と反応して細胞傷害性T細胞を活性化する(①)。T細胞上にはCD28とCTLA-4があり、CD28は恒常的に発現し、抗原提示細胞からのB7-1やB7-2というリガンドによってT細胞活性化に作用する(②)。一方、CTLA-4はT細胞活性化にともなって発現が誘導され、B7-1やB7-2によって刺激されるとT細胞を抑制する(③)。CTLA-4はCD28よりもB7に対する親和性が強いので、活性化したT細胞の過剰な応答を抑制する。同様に、PD-1(Programmed death-1)は抗原提示細胞のPD-L1(別名B7-H1)と結合することによって抑制型の免疫調節シグナルを活性化させる(④)。がん細胞もB7-1やB7-2やPD-L1が発現しており、細胞傷害性T細胞の働きを抑制している。T細胞のCTLA-4とPD-1の働きを特異抗体で阻害すると、がん細胞に対する細胞傷害性T細胞の働きを高めることができる(⑤)。
がん細胞を非自己と認識して、それを攻撃するためにT細胞は活性化しますが、PD-1リガンド(PD-L1)を持ったがん細胞と接触すると、CTL上のPD-1とリガンド(PD-L1)が結合することにより、免疫シグナルは抑制され、T細胞はがん細胞を攻撃できなくなってしまいます。これがT細胞を活性化するだけの従来の免疫療法に限界があった理由です。活性化したCTL(細胞傷害性T細胞)をがん組織に送っても、がん細胞を攻撃しようと近づくとPD-L1によって自身のPD-1のスイッチが入って死滅するからです。
がん細胞がPD-1リガンドを多く発現しているほど、予後が悪いというデータも報告されています。
T細胞やNK細胞を活性化すると同時に、T細胞上のPD-1やCTLA-4の働きを阻止すると、がん組織を免疫力だけで縮小できる可能性があります。
【がん組織は免疫細胞の働きを抑制する微小環境を作っている】
免疫チェックポイント阻害剤を用いた免疫療法はがん細胞に特異的なT細胞の働きを活性化してがん細胞を死滅させる効果を増強します。しかし、全ての症例に効くわけではありません。むしろ効くのは一部です。
その理由としてもっとも重要なのが、免疫抑制性の微小環境の存在です。がん組織の微小環境がT細胞の働きを弱めているのです。
まず、がん細胞はグルコース(ブドウ糖)やアミノ酸の取り込みが亢進し、エネルギー産生と細胞分裂の材料に使っています。これらの栄養素は、リンパ球が増殖し、がん細胞を排除する働きを実行する上でも必要です。従って、がん組織ではT細胞が働くために必要な栄養素が枯渇しているのです。
さらに、がん細胞では解糖系でのグルコース(ブドウ糖)代謝の亢進で、乳酸の産生が亢進しています。がん細胞内に乳酸が蓄積すると細胞毒になるので、がん細胞は乳酸を細胞外に排出しています。従って、がん組織には乳酸が増え、その結果、がん細胞の周囲は酸性になっています。
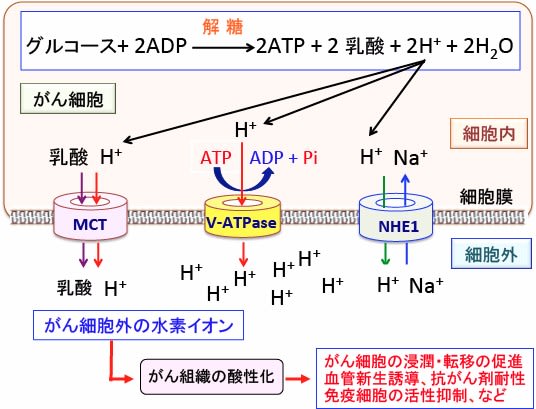
図:がん細胞は解糖系によるグルコース代謝が亢進して乳酸と水素イオン(プロトン、H+)の産生量が増える。細胞内の酸性化は細胞にとって障害になるので、細胞はV型ATPアーゼ(vacuolar ATPase:液胞型ATPアーゼ)やモノカルボン酸トランスポーター(MCT)やNa+-H+ 交換輸送体1(Na+-H+ exchanger 1:NHE1)などの仕組みを使って、細胞内の乳酸や水素イオン(プロトン)を細胞外に排出する。その結果、がん細胞の周囲はpHが低下してがん組織は酸性化している。組織が酸性化すると、免疫細胞の働きが抑制され、血管新生が促進し、がん細胞の浸潤や転移も促進される。
正常な細胞はpHが7.4というややアルカリ側でないと働くことができません。実際に、がん組織ではがん細胞外のpHが6.2〜6.9と酸性になっています。このような酸性の状態では、リンパ球は正常な働きができません。
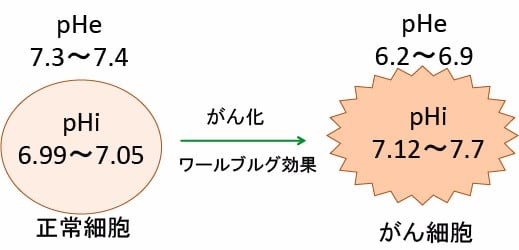
図:正常細胞では細胞内pH(pHi)は6.99〜7.05とほぼ中性で、細胞外pH(pHe)は7.3〜7.4とアルカリ性になっていて、pHeがpHiより高い。一方、がん細胞では細胞内pHは7.12〜7.7とアルカリ性になって、細胞外pHは6.2〜6.9と酸性になって、pHiがpHeより高い。
組織が酸性になるとがん細胞を攻撃しにきた免疫細胞の働きが弱ります。
さらに乳酸には、がん細胞を攻撃する細胞傷害性T細胞の増殖や、免疫細胞の働きを高めるサイトカインの産生を抑制する作用があり、がんに対する免疫応答を低下させる作用もあります。
がん組織にはマクロファージなどの炎症細胞からプロスタグランジンE2(PGE2)の産生が増えています。PGE2は、免疫担当細胞(樹状細胞、リンパ球、NK細胞など)の働きを抑制します。
一方、PGE2は骨髄由来抑制細胞を動員しがん組織内で増えます。
骨髄由来抑制細胞(Myeloid-derived suppressor cells: MDSCs)は顆粒球のマーカーと単球/マクロファージのマーカーとを同時に発現している未熟な段階の骨髄由来細胞で、免疫反応を強力に抑制する働きを持っています。
骨髄由来抑制細胞はアルギナーゼや活性酸素、一酸化窒素、IL-10、TGF-βなどの産生を介して免疫担当細胞の活性を阻害したり、制御性T細胞(Treg)の誘導をきたすことによって免疫抑制作用を発揮します。制御性T細胞は免疫応答を抑制的に制御しているT細胞の一種です。
このように、がん組織は免疫細胞の働きを抑制するような微小環境を自ら作り出しており、がん細胞を攻撃する目的で免疫担当細胞ががん組織に入っていっても十分な働きができないようになっているのです。

左図:がん組織内ではシクロオキシゲナーゼ-2(COX-2)の発現と活性が亢進している(①)。COX-2はプロスタグランジンE2(PGE2)の産生を増やし、PGE2は免疫担当細胞(樹状細胞、リンパ球、NK細胞など)の働きを抑制する(②)。一方、PGE2は骨髄由来抑制細胞を動員しがん組織内で増える(③)。この骨髄由来抑制細胞は免疫担当細胞の働きを抑制する(④)。がん細胞は解糖系が亢進し、乳酸や水素イオン(H+)の産生が増え、がん組織は酸性化している(⑤)。組織の酸性化は、免疫担当細胞の働きを抑制するが、骨髄由来抑制細胞の働きは活性化する。したがって、PGE2の産生やがん組織の酸性化や骨髄由来抑制細胞の動員を阻止すれば、がん細胞を攻撃・排除する免疫担当細胞の働きを高めることができる。
右図:がん細胞はグルコースの取込みと解糖系が亢進し(⑥)、乳酸と水素イオン(プロトン)の産生が増え、細胞外に排出される(⑦)。細胞外に排出された乳酸と水素イオンはがん組織を酸性化し、Tリンパ球やNK細胞や樹状細胞などの免疫担当細胞の働きを阻害する(⑧)。一方、乳酸やプロトン(H+)の産生増加によってpHが低下し酸性になると骨髄由来抑制細胞が動員され活性が亢進する(⑨)。骨髄由来抑制細胞は制御性T細胞を誘導して免疫担当細胞の働きを阻害する(⑩)。
このような複数のメカニズムでがん組織内ではエフェクター細胞の働きは抑制され、がん細胞を排除できない環境になっている。
【重炭酸ナトリウムによるがん組織のアルカリ化は免疫療法の効き目を高める】
免疫療法として注目されているオプジーボやヤーボイや養子免疫療法のときに、重曹(重炭酸ナトリウム)治療を併用する価値はありそうです。以下のような報告があります。
Neutralization of Tumor Acidity Improves Antitumor Responses to Immunotherapy.(腫瘍組織の酸性度の中性化は免疫療法の抗腫瘍応答を改善する)Cancer Res. 2016 Mar 15;76(6):1381-90.
【要旨】
免疫チェックポイント阻害剤や養子T細胞療法のようながんの免疫療法は、臨床効果を発揮する場合もあるが、まだ解明されていない抑制メカニズムの存在によって、その有効性は低い。
固形がんの微小環境は高度に酸性化している特徴があり、この環境が抗腫瘍免疫の効果を妨げている可能性がある。
この研究においては、免疫療法における腫瘍組織の酸性化の影響を検討した。
培養細胞を使った実験で、pHが酸性の条件では、T細胞の活性化が阻害され、解糖によるグルコース代謝が抑制された。
酸性pHによるインターフェロン-γの産生阻害は、mRNA転写のレベルではなく、たんぱく質の翻訳後の阻害であることが示された。
がん組織の酸性化は細胞内pHには影響しない。これは、細胞膜に発現している特殊なpH感受性受容体が細胞外の酸性化を感知して細胞内にシグナルを送ることを示唆している。T細胞にはこのようなpH感受性受容体が4種類発現している。
注目すべきことに、マウスにがん細胞を移植した実験系で、重炭酸ナトリウム治療で腫瘍の酸性度を中和すると、移植腫瘍の増殖が抑制され、この腫瘍組織内でTリンパ球の浸潤の増加が認められた。
さらに、抗CTLA-4抗体や抗PD1抗体による治療や養子T細胞療法に重炭酸治療を併用すると、多くの実験モデルにおいて抗腫瘍応答を増強し、いくつかの実験系ではがんが治癒した。
以上の結果から、pHをアルカリ化する緩衝剤を経口摂取することによって腫瘍組織内のpHを高めることは、免疫療法の効果を高めることができる。速やかに臨床で使用する価値がある。
重炭酸ナトリウム(sodium bicarbonate)は重炭酸ソーダ(略して重曹)や炭酸水素ナトリウム(sodium hydrogen carbonate)とも呼ばれます。
日本語では、炭酸水素ナトリウムや重曹の呼び名が多いようですが、英文の論文ではほとんどがsodium bicarbonateとなっていますので、ここでは「重炭酸ナトリウム(sodium bicarbonate)」や重曹を使っています。
化学式は NaHCO3で表わされます。ナトリウムの炭酸水素塩です。
重炭酸ナトリウムは加熱によって二酸化炭素を発生する性質を利用してベーキングパウダーとして調理に使用されます。口中で炭酸ガスを発生させるソーダ飴などには粉末で封入されます。
水に重炭酸ナトリウムとクエン酸を混ぜると炭酸ガスが発生し炭酸水となるので、飲料の材料としても用いられちます。砂糖を加え「サイダー」にしたり、レモンを加え「レモンソーダ」にするということもできます。
医薬品としては、胃酸過多に対して制酸剤として使われたり、酸性血症(アシドーシス)の治療に使われています。過剰に摂取するとナトリウムの過剰摂取が問題になりますが、適切な量であれば、安全性の高い化合物です。
重炭酸ナトリウムは水素イオン(プロトン)と反応して、二酸化炭素(CO2)と水(H2O)になります。この反応を利用して、がん組織に多く蓄積している水素イオンを除去してがん組織の酸性化を阻止することができます。
このような重炭酸ナトリウム(重曹)を摂取するがん治療の有効性を示す報告が増えています。

図:重炭酸ナトリウムを経口摂取すると、血中に入った重炭酸イオン(HCO3-)ががん組織に蓄積している水素イオン(プロトン)と反応して二酸化炭素(CO2)と水(H2O)になり、二酸化炭素は呼気に排出され、水は血液に拡散する。この反応によってがん組織の酸性化を抑制できる。
【重炭酸ナトリウムはがん細胞の転移を抑制する】
がん組織の酸性化はがん細胞の浸潤や転移を促進します。重炭酸ナトリウム(重曹)を経口摂取するとがん細胞の浸潤や転移を抑制できることが動物実験で報告されています。以下のような報告があります。
Bicarbonate Increases Tumor pH and Inhibits Spontaneous Metastases.(重炭酸ナトリウムは腫瘍のpHを高めて転移を阻止する)Cancer Res. 2009 Mar 15; 69(6): 2260–2268.
【要旨の抜粋】
がん細胞における解糖によるグルコース代謝の亢進と、がん組織では血液やリンパ液の循環が悪いので、がん細胞の外側に水素イオンが蓄積し、その結果、固形がんの周囲は酸性になっている。
培養細胞や動物実験で、組織の酸性化は、がん細胞の浸潤や転移を促進することが明らかになっている。
本研究では、マウスの動物実験モデルを用いて、腫瘍組織の酸性化の阻止ががん細胞の転移を抑制できるかどうかを明らかにする目的で行った。
転移性乳がんのマウスの実験モデルを用いて、重炭酸ナトリウム(NaHCO3)を担がんマウスに経口で投与すると、腫瘍組織のpHは上昇し(アルカリ化し)、自然発生的な転移の形成が減少した。
この治療法はがん細胞外のpHを有意に上昇させ、細胞内pHは上昇させなかった。
重炭酸ナトリウム治療は、血中を循環するがん細胞の数を減らすことはなかった。
一方、がん細胞を脾臓内に注入して肝臓転移を起こす実験系で、肝臓転移が有意に減少した。これは、がん細胞の血管外遊出と着床の段階を阻止していることを示唆している。
この実験では、重炭酸ナトリウムの摂取が血中のpHを上げることはなく、また原発腫瘍の増殖を抑制することは認めませんでした。ただし、転移の発生を有意に抑制しました。
がん組織の酸性化はカテプシンBなどの細胞外マトリックスを分解するタンパク分解酵素を活性化する作用があるので、転移の過程を促進すると考えられています。
経口で重炭酸ナトリウムを摂取すると、酸性化したがん組織がアルカリ性になるので、転移が抑制されるという機序です。
この実験では、コントロールのがん組織のpHは7.0 ± 0.11で、重炭酸ナトリウムを投与したマウスのがん組織のpHは7.4 ± 0.06でした。
細胞内pH(pHi)はコントロール群が7.1 ± 0.09で、重炭酸ナトリウムを投与したマウスのがん細胞では7.0 ± 0.06で有意な差は認めていません。
同じマウスの正常組織(後脚の筋肉組織)の細胞内pHは7.22 ± 0.04、細胞外pHは7.40 ± 0.08で、重炭酸ナトリウムの投与で影響を受けませんでした。
このマウスを使った実験では、200 mmol/Lの濃度の重炭酸ナトリウム(NaHCO3)が入った飲料水を自由摂取で与えています。
重炭酸ナトリウムの分子量は84ですので、200mmol/Lは16.8g/Lを自由摂取しています。
マウスは人間に比べて体重当たりの飲水摂取量が5〜10倍くらいあります。エサも体重当たりで換算すると5〜10倍くらいです。
この実験では1日の飲水摂取量は4.2 ± 0.2 mLでした。マウスの体重は20g程度ですので、体重の5分の1程度の水を1日に飲みます。60kgの人間で12リットルに換算されます。
ネズミと人間は体重当たりの代謝率が異なり、小さい動物ほど体重当たりの飲水やエサの摂取量は多くなります。
標準代謝量は体重の3/4乗(正確には0.751乗)に比例するという法則があり、一般にマウスの体重当たりのエネルギー消費量や薬物の代謝速度は人間の約7倍と言われています。体表面積ではほぼ同じになります。これについては293話で解説しています。
このような計算では、この実験でマウスが摂取した重炭酸ナトリウムは体表面積1m2当たり、1日に9.4gになります。9.4 g/m2/dは70kgの人間で1日12.5gになるとこの論文の考察に記述されています。
上記のように炭酸水素ナトリウム(重曹)はがん組織内の水素イオンを中和して酸性化を抑制します。
2-デオキシグルコース、ジクロロ酢酸ナトリウム、クエン酸は解糖系を抑制し、乳酸産生を抑制します。
メトホルミンは物質合成(同化)を抑制します。これらを組み合わせると、がん組織の免疫抑制性の微小環境を改善し、免疫チェックポイント阻害剤を使った免疫療法の効き目を高めることができます(トップの図)。
著書紹介:

詳しくはこちらへ:
| « 645)がんのク... | 647)ビタミンD... » |



