がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
795)再利用医薬品による微小管阻害:メベンダゾール+イベルメクチン+ノスカピン
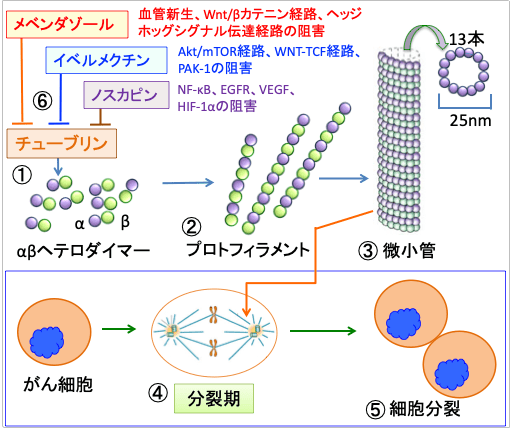
図:微小管はαチューブリンとβチューブリンが結合したヘテロ二量体(ヘテロダイマー)を基本単位として構成され(①)、チューブリンのヘテロ二量体が繊維状につながったものをプロトフィラメントと呼び(②)、これが13本集まって管状の構造(直径25nm)を取ったものが微小管となる(③)。細胞分裂が行われる際、細胞の中ではDNAが複製され、複製されたDNA(染色体)は微小管によって引き寄せられ(④)、分裂後のそれぞれの細胞に分けられる(⑤)。メベンダゾールとイベルメクチンとノスカピンはチューブリンに結合して微小管の重合・脱重合過程を阻害する(⑥)。その結果、細胞分裂のM期を停止させて細胞死(アポトーシス)を起こす。微小管阻害作用の他に、メベンダゾールは血管新生阻害、Wnt/βカテニン経路阻害、ヘッジホッグシグナル伝達系阻害などの作用がある。イベルメクチンは、Akt/mTOR経路やWNT-TCF経路の阻害、RASシグナル伝達系の中心的役割を担うp21活性化キナーゼ(PAK-1)の阻害作用、血管新生阻害作用、抗腫瘍免疫を活性化するがん細胞の免疫原性細胞死の誘導など様々な機序で抗がん作用が報告されている。ノスカピンは転写因子のNF-κB、上皮成長因子受容体(EGFR)、血管内皮増殖因子(VEGF)、低酸素誘導因子-1α(HIF-1α)、多剤耐性に関与するP糖タンパクなどを阻害する作用がある。従って、メベンダゾールとイベルメクチンとノスカピンの組み合わせは、微小管をターゲットにした相乗効果に加えて、様々なメカニズムによる総合的効果で抗がん作用を発揮する。
795)再利用医薬品による微小管阻害:メベンダゾール+イベルメクチン+ノスカピン
【再利用医薬品によるがん治療】
乳がんの代表的な抗がん剤治療にAC 療法があります。AC療法とは、アドリアマイシン(Adriamycin)とシクロホスファミド(Cyclophosphamide)という2種類の異なる作用機序の抗がん剤を組み合わせた治療であり、その頭文字をとって AC 療法と呼んでいます。
シクロホスファミド(エンドキサン)は日本では1962年に発売されており、アドリアマイシン(ドキソルビシン)の日本での発売は1975年です。
多くのがんの治療に使用されているシスプラチンは1978年に米国とカナダで承認されています。
つまり、50年近く前から使用されている抗がん剤がいまだにがん治療薬の中心として使用されています。
これらの抗がん剤が非常に優れた治療効果を発揮しているのであれば、それ以上の薬が出てこなくても納得できます。しかし、これらの抗がん剤を使用しても、進行がんの場合は、せいぜい数ヶ月の延命効果しかありません。
このように抗がん剤はより有効性の高い薬を開発する余地は大きいのですが、なかなか画期的な薬は出てきません。最近は細胞の受容体やシグナル伝達物質をターゲットにした分子標的薬が開発されていますが、それほど大きな治療効果は得られていません。
がん治療薬の開発において、近年注目されているのが、すでに使用されている薬の新規な効能を見つけて、別の疾患の治療薬にする医薬品再利用です。
がん以外の疾患の治療に用いられている既存薬や、がん以外の疾患の治療薬として開発されて臨床試験まで行ったが有効性が証明できなくて開発中止になった物質を、がんの治療薬として再利用する研究が注目されています。
医薬品再利用は「ドラッグ・リポジショニング(Drug Repositioning)」あるいは「ドラッグ・リパーポジング(Drug Repurposing)」の日本語訳です。「Repositioning」や「Repurposing」というのは、位置や立場(position)や目的や意図(purpose)を新たにする(re-)という意味です。医薬品の再利用という意味です。
新規の開発よりも、開発の費用を減らし期間も短縮できるというメリットがあります。
がん治療薬の場合、そのような既存薬や薬の候補成分を、培養がん細胞(in vitro)や移植腫瘍などを使った動物実験(in vivo)で抗がん活性を見つければ、すでに安全性や薬物動態が判っているので比較的早く臨床試験を実施できます。
最近は、薬剤の候補物質がデータベース化され、細胞の受容体やシグナル伝達物質の構造のデータベースや、抗がん剤による遺伝子発現パターンのデータベースなど様々な情報をコンピューターを使って探索する方法(in silico)もあります。
「in silico」という用語は,「コンピュータ(シリコンチップ)の中で」の意味で、in vitro(試験管内で)やin vivo(生体内で)に対応して作られた用語で、コンピューターを駆使した研究です。
米国では、FDA(米国食品医薬品局)が承認した既存薬や、開発に失敗して製薬企業内で保存されている物質のデーターベースが公開されており、様々な手法で新たな薬効を見つける研究が進んでいます。
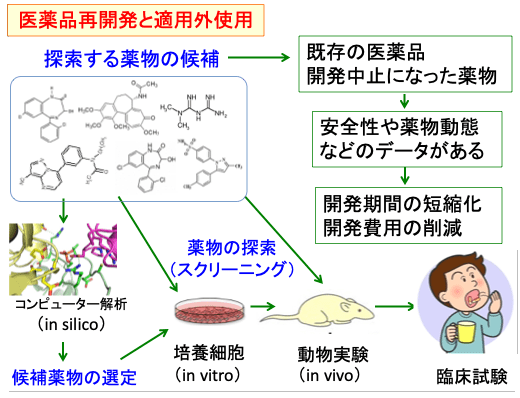
図:がん以外の疾患を対象に開発された医薬品あるいは薬の候補を、培養細胞(in vivo)や動物実験(in vitro)やコンピューターを使った解析(in silico)などで抗がん活性をスクリーニングする。もし抗がん活性が見つかれば、安全性や薬物動態のデータがあるので、臨床試験などの研究開発の期間を短縮でき、開発費用も節減できる。既に他の治療薬として使用されている場合は、保険適用外の使用でがん治療に直ちに応用できる場合もある。
がん治療以外で承認されている2000以上の医薬品のうち、少なくとも235個の薬において、in vitro、in vivoまたは臨床的に抗腫瘍活性が証明されています。
この235種類の医薬品のうち、67(29%)はWHO必須医薬品リストの薬であり、176(75%)は特許期限切れの医薬品で、133(57%)はがん患者での臨床データがあります。4種類(サリドマイド、全トランス・レチノイン酸、ゾレドロン酸、非ステロイド性抗炎症剤)はがん治療における使用法のガイドラインが既に存在します。
その他に、ランダム化臨床試験でがん治療に有効性が報告されている再利用医薬品としてシメチジン(大腸がん)、プロゲステロン(乳がん)、イトラコナゾール(肺がん)などが報告されています。
(出典:Repurposing non-cancer drugs in oncology - How many drugs are out there? bioRxiv. 2017:197434.)
このような薬をがん治療の目的で使用しようとすると、日本では保険適用の疾患を持っていなければ処方はできません。例えば、メトホルミンを保険で処方するには「糖尿病」という病名が必要です。保険診療の医療機関では、保険適用の病気を持っていなければ、たとえがんに対する効果が証明されていても使えないことになります。
しかし、自由診療の医療機関であれば保険適用外の処方も可能になります。自由診療(自費診療)であれば、医師は保険適用外(off-label)での医薬品の処方はできます。
このようながん治療において有用な保険適用外使用の例は多くあり、このような薬ががんの代替医療で利用されています。
【寄生虫治療薬はがんにも効く?】
心臓病や脳疾患や代謝性疾患など多くの疾患は、臓器や組織の機能の低下や喪失が発症の原因となっています。
一方、がんは異常細胞の塊によって構成される新たな組織の発生によって引き起こされます。がん組織は異常な増殖能を持った細胞の塊ですが、正常な間質細胞(線維芽細胞や炎症細胞など)や血管を取り込んで、一つの組織といえる新しい集合体を作っています。そして、自律増殖能を有し、浸潤・転移によって全身に広がり、宿主である私たちの体が死ぬまで無制限に増殖します。
このような性質は、寄生虫や細菌など感染性疾患と似ています。
つまり、がんは寄生虫のように体に寄生し、正常な体を蝕んでいく性質を持っています。
それが理由がどうかは不明ですが、なぜか寄生虫の治療に使われる薬ががんにも効くという例が数多く知られています。
これらは副作用が少なく安全性が高く、比較的安価なので、これらの寄生虫治療薬を複数組み合わせたがん治療の可能性が指摘されています。
メベンダゾールはベンズイミダゾール系の広範囲作用型の寄生虫治療薬(駆虫薬)です。線虫、条虫(サナダムシ)、回虫など多くの寄生虫に広く作用します。培養細胞(in vitro)や動物実験(in vivo)やコンピュータ解析(in silico)など複数の実験系で強い抗がん活性が報告されています。
メベンダゾールが寄生虫を死滅させる作用機序として、チュブーリンの重合を阻害して、細胞の分裂に重要な役割を果たす微小管の働きを阻害する効果が提示されています。
微小管阻害としてパクリタキセル(商品名;タキソール)やビンクリスチンなどがあります。
パクリタキセル(paclitaxel)はチューブリン (tubulin) の重合を促進することにより微小管 (microtubule) を安定化し、がん細胞の分裂を阻害します。微小管はαとβのチューブリンの2量体から形成され、タキソールはその内β-チューブリンに結合し、その重合を促進することにより抗がん作用を示します。
一方、メベンダゾールはチューブリンに結合して微小管の重合を阻害します。メベンダゾールはチューブリンのコルヒチン結合ドメインに結合します。
メベンダゾールはその他に、血管新生阻害、Wnt/βカテニン経路阻害、ヘッジホッグシグナル伝達系阻害など多彩なメカニズムによる抗がん作用があります。(下図)

図:細胞分裂の際に複製されたDNA(染色体)は微小管によってそれぞれの細胞に分けられる(①)。微小管はαチューブリンとβチューブリンが結合したヘテロ二量体を基本単位として構成され、チュブリンのヘテロ二量体が繊維状につながったものをプロトフィラメントと呼び、これが13本集まって管状の構造(直径25nm)になったものが微小管となる。メベンダゾールはチューブリンに結合して微小管の重合を阻害し、細胞分裂のM期を停止させてアポトーシスを起こす(②)。血管内皮細胞の血管内皮細胞増殖因子受容体-2(VEGFR-2)に血管内皮細胞増殖因子(VEGF)が結合するとVEGFR-2は二量体を形成し、チロシンキナーゼドメインに存在するチロシン残基の自己リン酸化が引き起こされ、細胞内のシグナル伝達系が活性化され、血管内皮細胞の増殖や血管形成が促進されて血管新生が促進する(③)。メベンダゾールはVEGFR-2の活性化を阻止して血管新生を阻害する(④)。Wntが受容体のFrizzledとLRP5/6に結合してWntシグナルが活性化されるとβ-カテニンが細胞質内で増加して核内に移行して転写因子のTCFに結合し、β-カテニン/TCFのターゲット遺伝子(c-mycやサイクリンD1など)の転写を活性化して、細胞の増殖を亢進する(⑤)。 メベンダゾールはTCFを活性化するキナーゼのTNIK (Traf2- and Nck-interacting kinase)を阻害してTCFの転写活性を阻害する(⑥)。このように、メベンダゾールは多彩なメカニズムで、がん細胞の増殖を阻止し、細胞死を誘導する。
【イベルメクチンは様々な機序で抗がん作用を発揮する】
イベルメクチンは、土壌から分離された放線菌Streptomyces avermitilisの発酵産物から単離されたアベルメクチン類から誘導されました。日本国内では、腸管糞線虫症と疥癬の治療薬として保険適用されています。
イベルメクチンは、中南米やアフリカのナイジェリアやエチオピアで感染者が多く発生している糸状虫症の特効薬です。糸状虫症はオンコセルカ症や河川盲目症とも呼ばれ、激しい掻痒、外観を損なう皮膚の変化、永久失明を含む視覚障害を起こします。その他、リンパ系フィラリア症など多くの種類の寄生虫疾患に有効で、人間だけでなく、動物の寄生虫疾患治療薬として広く使用されています。
イベルメクチンは、無脊椎動物の神経・筋細胞に存在するグルタミン酸作動性クロール(Cl)チャネルに選択的かつ高い親和性を持って結合します。その結果、クロール(Clに対する細胞膜の透過性が上昇して神経又は筋細胞の過分極が生じ、その結果、寄生虫が麻痺を起こし、死に至ります。哺乳類ではグルタミン酸作動性Cl−チャネルの存在が報告されていないので、安全性は極めて高いと言えます。
このように、イベルメクチンの安全性は非常に高く、寄生虫に感染した人間に対して、寄生虫が死滅する過程で引き起こされる免疫応答や炎症反応に起因する症状以外には、副作用をほとんど起こらないと言われています。
さらに、多数の前臨床試験で抗がん作用が確認されています。
培養細胞を使った実験では、乳がん、卵巣がん、前立腺がん、頭頸部がん、大腸がん、膵臓がん、悪性黒色腫など多くのがん種で抗腫瘍効果が報告されています。臨床で人間が服用して達しうる血中濃度で抗腫瘍効果が認められています。
増殖抑制やアポトーシス誘導だけでなく血管新生阻害作用を示すことも報告されています。動物実験でも抗腫瘍効果が認められています。
イベルメクチンの抗がん作用のメカニズムとして、ミトコンドリア呼吸阻害、酸化ストレスの誘導、Akt / mTOR経路の阻害、WNT-TCF経路の阻害、PAK-1阻害、血管新生阻害などが報告されています。以下のような総説論文があります。
The multitargeted drug ivermectin: from an antiparasitic agent to a repositioned cancer drug(多標的薬物イベルメクチン:抗寄生虫剤から再利用抗がん剤まで)Am J Cancer Res. 2018; 8(2): 317–331.
【要旨】
医薬品再利用(drug repositioning)は、抗がん剤を発見し開発する手段の一つとして盛んに研究が行われている。この医薬品開発の方法によって、既存の医薬品から新たな適用疾患が見つかっている。イベルメクチン(Ivermectin)は1967年に発見された16員環性の大環状ラクトン(16-membered macrocyclic lactone)の一種のアベルメクチン(avermectin)のグループの化合物で、人間への使用が1987年にFDA(米国食品医薬品局)によって承認された。
イベルメクチンは世界中において、多数の患者によって使用され、その臨床的安全性は極めて高い。この総説では、イベルメクチンが多種類のがんにおいて多彩なメカニズムで抗腫瘍効果を発揮するin vitroとin vivoのエビデンスをまとめる。
イベルメクチンは、多剤耐性タンパク質(MDR)、Akt / mTORおよびWNT-TCF経路、プリン作動性受容体、PAK-1タンパク質、SIN3AおよびSIN3Bのようながん関連エピジェネティックな調節解除因子、RNAヘリカーゼ活性、塩化物チャネル受容体などのいくつかの標的に作用し、特にがん幹細胞の特性を有するがん細胞をターゲットにする。
重要なことには、イベルメクチンのin vitroおよびin vivoの抗腫瘍活性は、健康な人間および寄生虫感染患者で行われたヒト薬物動態研究に基づいて臨床的に到達可能な濃度で達成される。したがって、イベルメクチンに関する既存の情報により、がん患者の臨床試験への迅速な移行が可能になる。
ターゲットが単一で非常に選択的な抗がん剤は、抵抗性を獲得したがん細胞の出現が早いという欠点が知られています。したがって、ターゲットが複数の多彩なメカニズムで抗がん作用を発揮する抗がん剤を開発することの重要性が指摘されています。
この観点で、イベルメクチンは、多剤耐性タンパク質(MDR)、Akt / mTORおよびWNT-TCF経路、プリン作動性受容体、PAK-1タンパク質、SIN3AおよびSIN3Bのようながん関連エピジェネティックな調節解除因子、RNAヘリカーゼ活性などのいくつかの標的を調節し、さらに、細胞の過分極につながる塩化物チャネル受容体を刺激し、少なくとも乳がんにおいては、がん幹細胞の特性を維持する遺伝子の発現を抑制することが報告されています。
さらに重要なことには、イベルメクチンのin vitroおよびin vivoの抗腫瘍活性は、健康な患者および寄生虫患者で行われたヒト薬物動態研究に基づいて臨床的に到達可能な濃度で達成されることです。
したがって、イベルメクチンをがん治療薬として臨床試験を開始するエビデンスは十分にあると言えます。
【イベルメクチンは微小管を阻害する】
イベルメクチンがチューブリンと結合して微小管の働きを阻害する作用が報告されています。以下のような報告があります。
Ivermectin exhibits potent anti-mitotic activity(イベルメクチンは強力な細胞分裂阻害活性を示す)Vet Parasitol. 2016 Aug 15;226:1-4.
【要旨】
イベルメクチンは、家畜やペットやヒトの駆虫薬として使用されている。イベルメクチンの主要な作用部位は、グルタミン酸依存性クロライドチャネルであると考えられている。しかし最近、イベルメクチンと線虫のチューブリンがマイクロモルの親和性で直接相互作用することが報告された。ここでは、イベルメクチンが哺乳類のチューブリンとも相互作用することを報告する。
この可能性をテストするために、チューブリン重合アッセイを使用し、イベルメクチンが哺乳類のチューブリンの重合度を増加させることを発見した。
さらに、HeLa細胞をイベルメクチンに曝露すると、低温によるチューブリン脱重合反応に対して哺乳類のチューブリンを安定化し、in vitroでのHeLa細胞の複製が阻止された。しかし、HeLa細胞のイベルメクチンによる細胞分裂の阻害は可逆的であった。
実験データは、イベルメクチンが哺乳類の微小管に結合し、マイクロモル濃度でイベルメクチンによって安定化されたことを示唆している。
したがって、イベルメクチンはチューブリンの重合と脱重合のダイナミクスに影響を与えることによって、細胞死を引き起こす可能性が示唆された。 イベルメクチンはすでにヒトでの使用が承認されていることを考えると、有糸分裂阻害剤としての開発は潜在的に魅力的な選択肢である。
Ivermectin binds to Haemonchus contortus tubulins and promotes stability of microtubules(イベルメクチンは捻転胃虫のチューブリンに結合し、微小管の安定性を促進する)Int J Parasitol. 2015 Aug;45(9-10):647-54.
【要旨の抜粋】
捻転胃虫は家畜の線虫であり、重篤な病気や死亡を引き起こす。グルタミン酸依存性塩化物チャネルを標的とする抗寄生虫薬であるイベルメクチンは、ヒト、家畜、ペットおよび農業で広く使用されている。チューブリン/微小管は、寄生虫および癌の治療で使用される多くの抗有糸分裂薬の重要な標的である。イベルメクチン曝露が捻転胃虫の組換えα-およびβ-チューブリンの重合の速度と程度を増加させ、寄生虫のα-およびβ-チューブリンを限定的なトリプシンタンパク質分解から保護したことを報告する。
イベルメクチンとチューブリンモノマーは低マイクロモル濃度の親和性で直接結合した。
イベルメクチンとタキソールはチューブリンへの結合をめぐって競合することが示され、イベルメクチンが寄生性チューブリンと哺乳類チューブリンの両方のタキソール結合ポケットと相互作用することが示唆された。
まとめると、私たちのデータは、イベルメクチンが微小管に結合して安定化することができ(つまり、チューブリンの重合平衡を変える)、これが有糸分裂の停止につながる可能性があることを示している。この実験結果は、イベルメクチンの既知の薬理学的効果の範囲を拡張し、抗有糸分裂剤としての可能性を明らかにした。
つまり、イベルメクチンには多彩なメカニズムで抗がん作用を発揮し、微小管もイベルメクチンのターゲットの一つと言えます。

図:イベルメクチンは糞線虫症、糸状虫症、疥癬症など多くの寄生虫疾患の治療に使用されている。イベルメクチンは、Akt/mTOR経路やWNT-TCF経路の阻害、RASシグナル伝達系の中心的役割を担うp21活性化キナーゼ(PAK-1)の阻害作用、血管新生阻害作用、微小管阻害、がん細胞の免疫原性細胞死の誘導など様々な機序で抗腫瘍活性を発揮する。
【微小管は細胞分裂に必須】
微小管は、α-チューブリンとβ-チューブリンのヘテロダイマー(ヘテロ二量体)で構成される非常に動的な構造であり、細胞の移動と細胞内輸送に関与しており、細胞分裂に不可欠です。G2 / M期の細胞分裂において重要な役割を果たすので、微小管は抗がん剤開発の重要なターゲットになっています。
ビンカアルカロイド、パクリタキセル、コンブレタスタチン、コルヒチンなど、さまざまな天然分子が微小管の働きを阻害することが知られています。
これらの微小管標的薬は、チューブリンの重合を阻害するものと、チューブリンの脱重合を阻害する物があり、基本的にチューブリンに結合して、チューブリンの重合反応や脱重合反応を阻害します。微小管阻害剤のチューブリンにおける結合部位が報告されています。

図:チューブリン上の微小管標的化剤の既知の結合部位。(出典:Trends Cell Biol. 2018;28:776–792.)
タキソール誘導体やビンカアルカロイドなどの微小管に作用する薬剤は、様々がんに使用される強力な抗がん剤です。しかしながら、これらの薬物は、末梢神経障害、胃腸毒性、骨髄抑制、免疫抑制などの毒性があります。
一方、メベンダゾール、イベルメクチン、ノスカピンはノスカピンは微小管の働きを阻害しますが、他の微小管阻害剤(パクリタキセル、ドセタキセル、ビンカアルカロイドなど)のような末梢神経障害や消化管障害や骨髄抑制などの副作用はほとんど出ません。
ノスカピンの微小管阻害作用については前回(794話)解説しています。
細胞分裂するときに必要な微小管の働きを阻害するのであれば、他の抗がん剤と同じような副作用が出ないのは不思議です。その理由として、微小管阻害のターゲット部位がパクリタキセルやドセタキセルやビノレルビンとは異なる点が指摘されています。
メベンダゾール+イベルメクチン+ノスカピンの組み合わせは、微小管の働きを相乗的に阻害します。これら3種類は再利用医薬品を使ったがん治療では有名な薬です。微小管阻害以外にも多くのメカニズムで抗腫瘍活性を発揮します。しかも副作用は極めて軽微です。
さらに、メベンダゾールとイベルメクチンの血中濃度を高める抗真菌薬のイトラコナゾールと、ノスカピンのがん細胞内取り込みを高める重曹の併用も有効です。
イトラコナゾールはそれ自体で様々な機序で抗腫瘍効果を発揮します。(727話参照)

図:血液中のコレステロール(低密度リポタンパク質(LDL)-コレステロール)は、細胞膜のクラスリン被覆ピット(clathrin-coated pits)のLDL受容体に結合し、エンドサイトーシスを介して細胞内に移行する(①)。 その後、エンドソームは成熟し(②)、リソソームと融合する(③)。リソソームでは、リソソームの酵素によって遊離コレステロールが細胞質へ放出され、細胞小器官(小胞体、ゴルジ、ミトコンドリア)と原形質膜に輸送される(④)。 解離した受容体は細胞膜へ戻され、再利用される(⑤)。イトラコナゾールはリソソームから細胞質へのコレステロールの細胞内輸送の過程を阻害し(⑥)、その結果、mTORシグナル伝達系と血管新生を阻害し、がん細胞の増殖を抑制する(⑦)。
副作用の少ないがんの代替療法として、メベンダゾール+イベルメクチン+ノスカピン+イトラコナゾール+重曹の組み合わせは、試してみる価値はあります。実際に進行がんに使って、抗腫瘍効果を確認しています。重い副作用はほとんど経験しません。
| « 794)ノスカピ... | 796)オメガ3... » |



