がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
882)カンナビジオールとがん治療(その5):がんの酸化治療
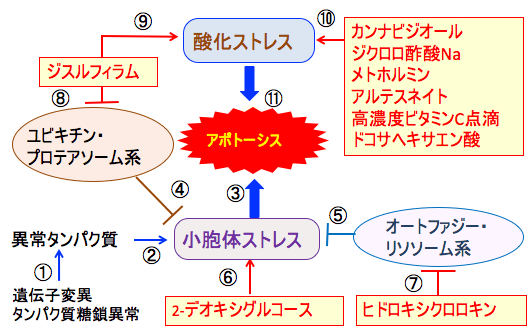
図:がん細胞は遺伝子変異やタンパク質の糖鎖異常によってできた異常タンパク質(①)が小胞体に蓄積して小胞体ストレスを引き起こす(②)。小胞体ストレスが強度になるとアポトーシス(細胞死)が誘導される(③)。異常タンパク質はユビキチン・プロテアソーム系(④)やオートファジー・リソソーム系(⑤)で分解されることによって小胞体ストレスは軽減される。2-デオキシグルコースは糖鎖異常の糖タンパク質を増やして小胞体ストレスを増強する(⑥)。ヒドロキシクロロキンはオートファジー・リソソーム系を阻害する(⑦)。ジスルフィラムはユビキチン・プロテアソオーム系を阻害し(⑧)、活性酸素の産生を増やして酸化ストレスを亢進する(⑨)。カンナビジオール、ジクロロ酢酸Na、メトホルミン、アルテスネイト、高濃度ビタミンC点滴、ドコサヘキサエン酸は酸化ストレスを高める(⑩)。これらを組み合わせると、がん細胞の小胞体ストレスと酸化ストレスが亢進して細胞死(アポトーシス)を誘導できる(⑪)。
882)カンナビジオールとがん治療(その5):がんの酸化治療
【不対電子を持つ原子や分子をフリーラジカルと言う】
酸素の働きの一つに「酸化」という作用があります。鉄くぎがいつのまにか赤くさびたり、ゴムが古くなると弾力を失ってボロボロになったりするのも酸化の結果です。
私たちの体内でも、呼吸によって取り入れられた酸素の一部が「活性酸素」と呼ばれる酸化力の強い分子に変化し、細胞成分を酸化することによって老化を促進し、がんや動脈硬化など多くの病気の原因となっています。機械もサビついてくると故障が多くなるのと同じです。
全ての物質は原子からできています。原子というのは物質を構成する最小の単位であり、原子核を中心にその周りを電気的に負(マイナス)に帯電した電子が回っているという形で現されます。
通常、電子は一つの軌道に2個づつ対をなして収容されますが、原子の種類によっては一つの軌道に電子が一個しか存在しないことがあります。このような「不対電子」を持つ原子または分子をフリーラジカル(遊離活性基)と定義しています。
本来、電子は軌道で対をなっている時がエネルギー的に最も安定した状態になります。そのためにフリーラジカルは一般的には不安定で、他の分子から電子を取って自分は安定になろうとします。フリーラジカルとは、不対電子をもっているために非常に反応性の高まっている原子や分子なのです。(下図)

図:不対電子(①)をもつ原子や分子はフリーラジカルと呼ばれ(②)、他の物質から電子を奪おうとする(③)。電子を奪われた物質は酸化されたことになる(④)。電子を受け取ると還元されたことになる(⑤)。
「酸化」するというのは活性酸素やフリーラジカルが、ある物質の持っている電子を奪い取ることを意味します。酸化の本来の定義は「電子を奪うこと」なのです。一方、ある物質が別の物質から電子をもらうことを「還元」といいます。
フリーラジカルというのは、言い換えれば相手の電子を奪う(酸化する)性質が非常に強い性質のものです。
【ミトコンドリアの酸素呼吸で活性酸素が発生する】
細胞が生きていくために必要なエネルギーであるATP(アデノシン3リン酸)は、細胞内のミトコンドリアで酸素を還元して水になる反応(電子伝達系)を使って産生しています。この過程では1分子の酸素(O2)は4つの電子(e-)をもらって還元され、さらに水素イオン(H+)と結合して水(H2O)になります。(下図)

図:TCA回路(クエン酸回路)でNADHとFADHとして捕捉された電子(e-)は、ミトコンドリア内の電子伝達系で酸素を4原子還元して水(H2O)を生成する過程で、スーパーオキシドや過酸化水素やヒドロキシルラジカルといった活性酸素が発生している。
この反応では必ずしも酸素分子に電子がきっちり4個渡されるとは限りません。酸素分子に不完全に電子が渡され、部分的に還元されたものが発生し、これが活性酸素になります。例えば、ふつうの酸素分子は16個の電子を持っていますが、スーパーオキシド(O2-)は17個の電子をもっており、そのうち1個が不対電子になりフリーラジカルとなるのです。
スーパーオキシド・ラジカルは体内の消去酵素(スーパーオキシド・ディスムターゼ、略してSOD)によって過酸化水素(H2O2)に変わり、過酸化水素はカタラーゼという消去酵素によって除去されます。しかし、スーパーオキシドや過酸化水素の一部は鉄イオンや銅イオンと反応して、ヒドロキシルラジカル(・OH)が発生します。
本来、鉄や銅などの遷移金属はタンパク質を結合して存在しますが、がん組織や炎症が起こっている部位ではこれらの遷移金属はイオンの形で存在するようになり、これら遷移金属イオンが触媒となって、大量のヒドロキシラジカルが産生されるようになるのです。
ヒドロキシルラジカルも一つの不対電子をもっており、その酸化力は活性酸素のなかで最も強力で、細胞を構成する全ての物質を手当たりしだいに酸化して障害を起こします。
また、誘導型一酸化窒素合成酵素(iNOS)によって炎症細胞から産生される一酸化窒素(NO)とスーパーオキシド・ラジカル(O2-)が反応すると、ペルオキシナイトライト(・ONOO2-)という酸化力の強いフリーラジカルが発生します。ペルオキシナイトライトは炎症疾患における組織の酸化障害や発がん促進の原因となります。(下図)

図:酸素(O2)がエネルギーを産生する過程や酵素反応や炎症などで1電子還元されて スーパーオキシド(O2-)が発生する(①)。スーパーオキシドは体内の消去酵素(スーパーオキシド・ディスムターゼ)によって過酸化水素(H2O2)に変わり(②)、過酸化水素はカタラーゼやグルタチオン・ペルオキシダーゼという消去酵素によって水(H2O)と酸素(O2)に変換されて無毒化される(③)。スーパーオキシドや過酸化水素の一部は鉄イオンや銅イオンと反応して、ヒドロキシルラジカル(・OH)が発生する(④)。さらに、誘導型一酸化窒素合成酵素によって炎症細胞から産生される一酸化窒素(NO)とスーパーオキシドが反応すると、ペルオキシナイトライト(・ONOO2-)という酸化力の強いフリーラジカルが発生する(⑤)。ヒドロキシルラジカルとペルオキシナイトライトは細胞や組織を酸化してダメージを与える(⑥)。
【がん細胞のミトコンドリアは活性酸素が出やすい】
正常細胞においては、ミトコンドリアにおける物質代謝やエネルギー産生過程は整然とコントロールされており、活性酸素の発生は最小限に抑えられています。
一方、がん細胞ではミトコンドリアに様々な異常が起こっています。ATPを産生する呼吸鎖にも異常が起こっており、酸素を使ったエネルギー産生過程で大量の活性酸素が産生されやすくなっています。これは、排気ガス処理装置が壊れた自動車が排気ガスをまき散らすのと同じ状態です。
つまり、がん細胞ではミトコンドリアでの酸素消費を増やせば、活性酸素の産生が増えて、酸化ストレスによった細胞が強いダメージを受け、自滅するリスクが高いのです。
がん細胞では、このような酸化ストレスの増加を防ぐために、酸素を使わない解糖系でのエネルギー産生を増やしています。酸素が十分に利用できる条件でも解糖系でのATP産生を増やし、酸素を使ったミトコンドリアでのATP産生を抑制している理由の一つは、酸化ストレスを高めたくないからです。
ミトコンドリアでのエネルギー産生を抑制するため、効率の悪い解糖系でエネルギー産生を行う必要があるために、グルコースの取込みと解糖系の亢進が起こっているということになります。
またグルコース-6-リン酸からのペントース・リン酸経路での代謝も亢進しており、この系で産生されるNADPHが細胞内の酸化ストレスを軽減するために利用されます。
つまり、がん細胞はミトコンドリアでの酸素呼吸を抑制することによって活性酸素の発生を防ぐ必要があるため、必然的に酸素を使わない解糖系の活性が亢進しているのです。(下図)

図:がん細胞はミトコンドリアの呼吸鎖の異常によって酸素を使ってATPを産生すると活性酸素の産生量が増える(①)。がん細胞は解糖系(②)が亢進し乳酸(③)の産生が増えている。また、ペントース・リン酸経路(④)が亢進し、この経路でできるNADPH(⑤)はグルタチオンやチオレドキシンを還元して活性酸素を消去する(⑥)。
【放射線と抗がん剤は活性酸素でがん細胞を死滅する】
がん細胞に対する放射線治療の効果は、細胞のDNA分子の傷が多く蓄積することによって現れます。DNA傷害に際しては、放射線が直接DNA鎖を傷害する直接作用と、DNA近傍で発生する活性酸素を介してDNA鎖を傷害する間接作用の二つが関係していると考えられています。
さらに、多くの抗がん剤においても、細胞に傷害を与え、細胞死が実行される過程で活性酸素種が関与しています。(下図)

図:放射線がDNAを構成する分子の電子をはじき飛ばす(電離)ことによって、分子間の結合を切断して直接的にDNAを傷害する(①)。さらに、放射線は組織の水分子(H2O)を電離してヒドロキシルラジカル(OH・)を発生し、このヒドロキシルラジカルがDNA分子に間接的にダメージを与える(②)。抗がん剤の多くも、細胞死を誘導する過程で活性酸素の発生が関与している(③)。
【酸化ストレスにはがん細胞に対して促進と抑制の2面性がある】
細胞内外からの活性酸素やフリーラジカルによって細胞が酸化傷害を受ける状況を酸化ストレスと言います。細胞がミトコンドリアで酸素呼吸を行うと活性酸素が発生し、炎症が起こると炎症細胞から活性酸素やフリーラジカルの産生が増えます。活性酸素やフリーラジカルは、DNAやタンパク質や脂質と反応してDNAの変異や細胞のダメージを生じさせるので、その結果としてがんの発生や再発を促進し、がん細胞の増殖や悪性進展を促進します。
そして、この酸化ストレスの増加に対しては、細胞は活性酸素を消去する酵素(スーパーオキシド・ディスムターゼ、カタラーゼ、グルタチオン・ペルオキシダーゼ、チオレドキシン還元酵素など)の発現や活性を高めたり、フリーラジカルを消去するグルタチオンなどの物質の生成を高めたりして、酸化ストレスを軽減しようとします。
細胞の抗酸化力を高めることはがん細胞の発生や増殖の抑制につながるので、「抗酸化力を高めることは、がんの発生や再発の予防に役に立つ」というのが研究者のコンセンサスになっています。
しかし一方、がん細胞はこの抗酸化力を利用して治療に抵抗性になっていることが明らかになっています。前述のように、放射線治療や抗がん剤治療はがん細胞に酸化ストレスを誘導し、その酸化ストレスによる細胞のダメージががん細胞を死滅させる作用として重要です。
がん細胞は正常細胞と同様に、酸化ストレスを軽減する仕組みを利用して、放射線や抗がん剤に対して抵抗性を獲得しています。
したがって、「放射線治療や抗がん剤治療を行うときには、がん細胞の抗酸化力を弱める方法は抗腫瘍効果を高めることができる」ということになります。がん細胞は酸化ストレスに対する抵抗力(抗酸化力)を高めることによって放射線や抗がん剤に抵抗性になっているので、抗酸化力を阻害することはがん治療に役立つと考えられています。
つまり、がんの発生や再発予防の目的では酸化ストレスを軽減することが良いのですが、放射線治療や抗がん剤治療などがん細胞を死滅させる目的ではがん細胞の酸化ストレスを高める方が良いのです。これが、がん治療における『酸化ストレスの2面性』です。(下図)

図:がん細胞において酸化ストレスが増大すると、遺伝子変異の発生、がん遺伝子の活性化、細胞増殖や転移の促進が誘導され、がん細胞の悪性進展を亢進する(①)。酸化ストレスが増大して、ある閾値を超えると、細胞の酸化傷害が高度になって細胞機能が障害され、増殖が停止し、細胞死が誘導される(②)。がんの発生や再発を予防する目的ではがん細胞の酸化ストレスを軽減する治療が有効であり、がん細胞を死滅させる目的ではがん細胞の酸化ストレスを高める治療が有効という酸化ストレスの2面性がある(③)。抗酸化剤は酸化ストレスを軽減するため、中等度の酸化ストレスでがん細胞の活動性が高まる状態を抑制する(④)。一方、抗がん剤や放射線治療で高度の酸化ストレスを与えているときは抗酸化剤は治療効果を阻害する(⑤)。
【中途半端では逆効果になる】
がん細胞内では活性酸素の産生量が増えており、抗酸化システムを亢進して酸化傷害を防いでいます。がん細胞は酸化ストレスを軽減するために余分のエネルギーを使うことになるので、酸化ストレスは増殖や転移を抑制する作用があります。がん細胞でミトコンドリアでの酸素を使ったATP産生が抑制されている理由の一つは、酸化ストレスを高めないためです。
したがって、がん細胞のミトコンドリアでの酸化的代謝を亢進すると、増殖や転移を抑制できます。がん細胞に高度に酸化ストレスを高めることができれば、死滅させることができます。
しかし、中途半端な酸化ストレスだと逆に増殖や転移を促進することになります。それは、中等度の酸化ストレスは逆にがん細胞の活動性を高める作用があるからです。(下図)
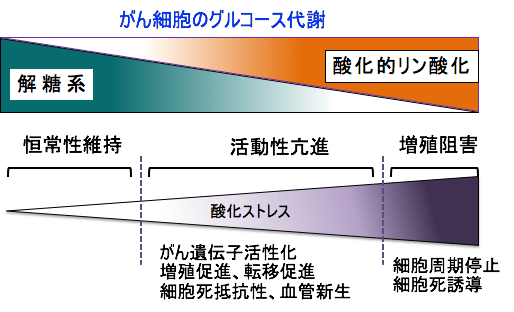
図:がん細胞は酸素を使わない解糖系でグルコース(ブドウ糖)を代謝し、ミトコンドリアでの酸素を使ったエネルギー産生(酸化的リン酸化)が抑制されている。がん細胞で酸化的リン酸化によるエネルギー産生を増やすと、活性酸素の産生が増え、酸化ストレスが高まる。中等度の酸化ストレス亢進はがん細胞の活動性を亢進し、増殖シグナルや血管新生を亢進する。高度の酸化ストレスの場合は酸化傷害によるダメージを受け、増殖が抑制され、細胞死(アポトーシス)が誘導されて自滅する。がん細胞の酸化ストレスを高める治療では、徹底した酸化ストレスの亢進を目標にしなければならない。
【抗酸化システムを利用して放射線や抗がん剤に抵抗性になる】
細胞内で活性酸素の発生量が増えると、細胞は活性酸素を消去する酵素(スーパーオキシド・ディスムターゼ、カタラーゼなど)の発現や活性を高めたり、フリーラジカルを消去するグルタチオンなどの抗酸化物質の合成を高めて、活性酸素の害を軽減しようとします。
放射線治療も抗がん剤治療も活性酸素の産生を高め、細胞を死滅します。しかし、がん細胞は細胞に備わった抗酸化システムを利用して酸化ストレスを軽減し、細胞死から免れようとします。(下図)

図:抗がん剤や放射線は活性酸素の産生を高め(①)、細胞の酸化傷害を引き起こして、細胞増殖を抑制し、細胞死を誘導する(②)。がん細胞は、スーパーオキシド・ディスムターゼやカタラーゼやグルタチオン・ペルオキシダーゼなどの活性酸素消去酵素やグルタチオンやチオレドキシンなどの抗酸化物質の産生を高めて、活性酸素による害(酸化ストレス)を軽減している(③)。この抗酸化システムの亢進によって、がん細胞は抗がん剤や放射線治療に抵抗性になる。
そこで、ミトコンドリアでの酸素呼吸(酸化的リン酸化)を亢進したり細胞内で活性酸素の産生を高める薬剤(アルテスネイト、メトホルミン、ジクロロ酢酸ナトリウム、高濃度ビタミンC点滴など)を使って細胞内の活性酸素の産生量を高め、同時に、活性酸素を消去する細胞内の抗酸化システム抑制すると、細胞内の酸化ストレスが高度に亢進し、酸化傷害によってがん細胞を死滅できます。これが「がんの酸化治療」になります。
【カンナビジオールの抗腫瘍活性は抗酸化剤で消去される】
カンナビジオール(CBD)の抗がん作用に関しては様々なメカニズムが報告されています。その一つに、CBDががん細胞に活性酸素の産生を亢進して酸化ストレスを高めてがん細胞を死滅させるメカニズムが報告されています。CBDががん細胞に活性酸素の産生を高める作用について、以下のような報告があります。
Reactive oxygen species-mediated therapeutic response and resistance in glioblastoma(グリオブラストーマにおける活性酸素種による治療効果と治療抵抗性)Cell Death Dis. 2015 Jan; 6(1): e1601.
【要旨】
膠芽腫(グリオブラストーマ)は治療に抵抗性で、再発が多く、診断後5年以内に90%の患者が死亡しており、極めて予後不良の腫瘍である。膠芽腫の腫瘍組織の中には幹細胞様の性質をもったがん幹細胞が存在し、このがん幹細胞が治療に抵抗性を示している。
幾つかの抗がん剤は、活性酸素種の細胞内濃度を高めることによって抗がん作用を発揮し、これらは酸化還元治療薬(redox therapeutics)と総称されている。
本研究においては、カンナビジオールに対する膠芽腫幹細胞の感受性と抵抗性の作用メカニズムを検討した。カンナビジオールは毒性や精神作用が無いカンナビノイドの一種で酸化還元制御作用を持っている。
膠芽腫の原発組織から採取した膠芽腫幹細胞を用いた実験で、カンナビジオールは活性酸素種の産生を顕著に増加させ、細胞生存とリン酸化されたAKTと自己複製を阻害し、膠芽腫幹細胞を移植したマウスの生存率を向上させた。
膠芽腫幹細胞の自己複製の阻害は、リン酸化p38経路の活性化と、Sox2とID1とp-STAT3の抑制によって引き起こされていた。
カンナビジオールを投与すると、一部の膠芽腫幹細胞は適応して抵抗性を示し、再増殖を開始する。
解析の結果、カンナビジオールに対する抵抗性は、抗酸化応答システムのXc活性部位のサブユニットxCTの過剰発現や活性酸素種依存性の様々なマーカーの変化を伴っていた。
このような膠芽腫幹細胞の再プログラム化は培養細胞とマウスの移植腫瘍で認められ、NRF2 (nuclear factor, erythroid 2-like)の活性化がその一部の作用メカニズムとなっていた。
さらに、カンナビジオール投与と抗酸化応答システムXc(シスチン・グルタミン酸トランスポーター系)の阻害を併用すると、相乗効果によって活性酸素種の産生が亢進し、抗腫瘍活性が増強し、膠芽腫幹細胞の生存と自己複製と浸潤が阻害される。
我々の研究結果は、酸化還元治療薬の抗腫瘍活性の新規なメカニズムを提供するものであり、膠芽腫の治療において活性酸素種の産生を高める治療法の併用の有用性を示唆している。
この論文の内容を簡単にまとめると、カンナビジオールは膠芽腫(グリオブラストーマ)細胞に活性酸素の産生を高めて抗腫瘍作用を示しますが、膠芽腫細胞はシスチン・グルタミン酸トランスポーター系(Xcシステム)やNRF2系などの抗酸化システムを活性化して酸化ストレスを軽減し、カンナビジオールの抗腫瘍活性に抵抗性を示すように適応します。そこで、このような抗酸化システムを阻害する治療を併用すると、カンナビジオールの抗腫瘍作用は元に戻るということです。(下図)
図:カンナビジオールはグリオブラストーマ(膠芽腫)細胞に活性酸素の産生を高めて酸化ストレスを亢進する(①)。酸化ストレスが高度に亢進すると細胞の酸化傷害が起こり細胞死が誘導される(②)。がん細胞は抗酸化システムを活性化して酸化傷害に抵抗性を示す(③)。したがって、がん細胞の抗酸化システムを阻害する方法を併用すると、カンナビジオールの抗腫瘍効果を高めることができる。
【活性酸素の産生を増やすがん治療】
がん細胞の酸化ストレスを高めてがん細胞を死滅させる治療法は「oxidation therapy(酸化治療)」と呼ばれています。
がん細胞ではミトコンドリアの機能異常などによって酸素呼吸を行うと活性酸素の産生が高まります。
がん細胞は酸化ストレスを高めたくないので、ミトコンドリアでの代謝を抑制し、酸素を使わない解糖系での代謝を亢進させています。
したがって、解糖系を抑制しミトコンドリアでの酸化的リン酸化(酸素を使ったエネルギー産生)を亢進すれば、がん細胞内の酸化ストレスを能動的に高め、がん細胞を死滅させることができます。
放射線治療と一部の抗がん剤(ビンブラスチン、シスプラチン、マイトマイシンC、ドキソルビシン、カンプトテシンなど)は、がん細胞に酸化傷害を引き起こして細胞にダメージを与えて死滅させます。その他の抗がん剤も、細胞死を引き起こすときに活性酸素が使われます。
したがって、放射線治療や抗がん剤治療の最中は、抗酸化作用のあるサプリメントの摂取は細胞死を阻害します。一方、酸化ストレスを増強すれば、放射線治療や抗がん剤治療の効き目を高めることができます。
ここ数年の動きとして、がん細胞の酸化ストレスを高める治療が注目されています。
基本は、解糖系を阻害(2-DG)し、ミトコンドリアの活性化などによって活性酸素の産生を高め(ジクロロ酢酸、メトホルミン、カンナビジオール)、がん細胞の抗酸化システムを阻害する方法(ジスルフィラム)の併用が有効です。
さらにがん細胞に酸化ストレスを高めるケトン食、アルテスネイト、高濃度ビタミンC点滴、半枝蓮の煎じ薬を併用すると、がん細胞に酸化傷害を与えて、増殖を抑制し、細胞死を誘導できます。(下図)

図:放射線や抗がん剤は、活性酸素の産生を高めて酸化ストレスを亢進し、細胞の酸化傷害を引き起こして細胞死を誘導する(①)。酸化ストレスを軽減するために転写因子のNrf2の活性を亢進し、グルタチオンやチオレドキシンシステムを亢進して活性酸素による酸化傷害に抵抗する(②)。カンナビジオールは細胞内の活性酸素の産生を高める(③)。ジクロロ酢酸ナトリウムはミトコンドリアの酸素呼吸を亢進して活性酸素の産生を高める(④)。メトホルミンや2-デオキシ-D-グルコースやケトン食はNrf2の活性化を阻害する(⑤)。ジスルフィラムはグルタチオンやチオレドキシンによる抗酸化システムを阻害することによって酸化ストレスを高める(⑥)。これらを組み合せると、がん細胞に効率的に酸化ストレスを増強して、がん細胞の増殖を抑制できる。
糖質摂取を極端に減らして中鎖脂肪酸(MCTオイル)の摂取を増やすケトン食は、血中のケトン体の濃度を高め、がん細胞に比較的特異的に酸化ストレスを高めることができます。
解糖系を阻害する2-デオキシ-D-グルコース、ミトコンドリアの代謝を活性化するジクロロ酢酸ナトリウム、呼吸鎖を阻害して活性酸素の産生を増やすメトホルミン、フリーラジカルの産生を増やして酸化ストレスを高めるアルテスネイト、がん組織の過酸化水素の産生を高める高濃度ビタミンC点滴などを併用するとカンナビジオールの抗腫瘍効果を高めることができます。これらは全て、がん細胞に酸化ストレスを高めるため相乗効果が期待できます。
2-デオキシ-D-グルコースは糖鎖異常の糖タンパク質を増やして小胞体ストレスを誘導する作用もあります。これに対して、ユビキチン・プロテアソーム系とオートファジー・リソソーム系で異常タンパク質を分解することによって小胞体ストレスを軽減できます。
アルコール依存症治療薬のジスルフィラムはユビキチン・プロテアソオーム系を阻害し、全身性エリテマトーデスの治療に使われるヒドロキシクロロキンはオートファジー・リソソーム系を阻害します。これらを組み合わせると、がん細胞の小胞体ストレスが亢進して細胞死(アポトーシス)の誘導を増強できます。これらの組み合わせによるがん治療はトップの図にまとめています。
カンナビジオールの抗がん作用のメカニズムは多彩です。まず、内因性カンナビノイドシステムの複数の受容体やイオンチャネルに作用して、細胞増殖のシグナル伝達系を阻害し、がん細胞の増殖抑制や細胞死(アポトーシス)誘導の効果を発揮します。
しかし、カンナビジオール単独の抗腫瘍効果は限定的です。そこで、他の治療法との併用が必要です。まず、大麻成分や内因性カンナビノイドの相互作用で言及されるアントラージュ効果の活用は重要です。その観点では、テルペンのベータ・カリオフィレンとカンナビジオールの併用はがん治療において有効な組み合わせです。この2つはもともと大麻に含まれ、鎮痛や抗不安や抗炎症や抗がん作用において相乗効果を発揮します。
さらに、カンナビジオールはがん細胞に活性酸素の産生を増やし、酸化ストレスを高めます。この作用は、抗がん剤治療や放射線治療の抗腫瘍効果をカンナビジオールが増強するメカニズムになります。がんの代替療法ではがん細胞に酸化ストレスを高めてがん細胞を死滅する「がんの酸化治療」が行われています。このがんの酸化治療をカンナビジオールが増強する十分な根拠があります。
がんを死滅し、縮小する効果だけでなく、カンナビジオールはがん患者の疼痛緩和、不安感の軽減、睡眠の改善、吐き気の軽減、抗炎症作用によるがん性悪液質の軽減など、がん患者に数多くのメリットを与える潜在的可能性を有しています。工夫次第でさらにカンナビジオールの可能性を高めることができます。
新刊紹介

| « 881)カンナビ... | 883)シンバス... » |



