がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
881)カンナビジオールとがん治療(その4):神経保護作用

図:抗がん剤は中枢神経系(脳と脊髄)と末梢神経系(運動神経、感覚神経、自律神経)の両方の神経細胞にダメージを与えて様々な症状を引き起こす。抗がん剤による神経障害を軽減する補完医療として、カンナビジオール、アセチル-L-カルニチン、R体アルファリポ酸、メラトニン、漢方薬、ビタミンB製剤などが利用されている。これらは様々なメカニズムで抗がん剤による神経障害を予防・軽減する。さらに、これらはいずれも抗がん剤の副作用を軽減し、抗腫瘍効果を増強する作用がある。
881)カンナビジオールとがん治療(その4):神経保護作用
【抗がん剤は末梢神経障害を引き起こす】
神経系とは体内の情報伝達を行う組織で、中枢神経系と末梢神経系に分類されます。
中枢神経系は、多数の神経細胞が集まって大きなまとまりになっている領域で、脳と脊髄が中枢神経系になります。
中枢神経系(脳と脊髄)から出て、手や足の筋肉や皮膚などに分布し、運動や感覚を伝える“電線”のような働きをするのが末梢神経系です。末梢神経には、全身の筋肉を動かす運動神経、痛みや触れた感触などを感じる感覚神経、血圧・体温の調節や臓器の働きを調整する自律神経があります(図)。
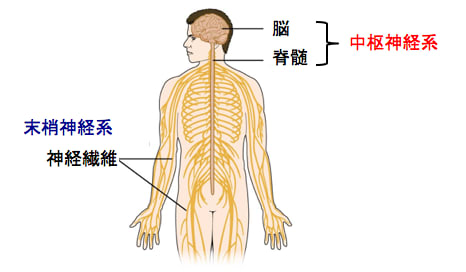
図:神経系は中枢神経系と末梢神経系に大別される。
抗がん剤治療は神経細胞を傷害します。末梢神経がダメージを受けたり、働きに異常をおこした病態を「末梢神経障害」といいます。
運動神経が障害されると、「手や足の力が入らない」「物をよく落とす」「歩行や駆け足がうまくできない・つまづくことが多い」「椅子から立ち上がれない」「階段が登れない」などの症状が起こります。
感覚神経が障害されると手や足が「ピリピリしびれる」「ジンジンと痛む」「感覚がなくなる」などの感覚障害が起こります。
自律神経が障害されると「手や足が冷たい」「下半身に汗をかかない」「便秘や排尿障害」などの自律神経障害が起こります。
【抗がん剤は神経細胞の微小管を傷害する】
神経細胞や筋肉細胞は細胞分裂を行わないため、抗がん剤や放射線治療を受けても細胞死は起こりにくいと考えられています。しかし、パクリタキセルやドセタキセルなどのタキサン製剤、ビンクリスチンやビノレルビンなどのビンカアルカロイド製剤、シスプラチンやカルボプラチンやオキサリプラチンなどの白金製剤、プロテアソーム阻害剤のボルテゾミブでは高頻度に末梢神経障害が発現します。
末梢神経障害の原因として、神経軸索の微小管の傷害や神経細胞の直接傷害などが関連しています。微小管は細胞骨格を形成するタンパク質であり、チューブリンというタンパク質が集まった長い直径約25nmの管状構造をもっています。
微小管は細胞内のタンパク質の輸送や細胞内小器官輸送のレールとして機能しており、細胞分裂の時の染色体の移動に必要です。細胞分裂する際に、複製されたDNAは染色体と呼ばれる構造に凝集し、細胞の両極へと引き寄せられ二等分されますが、このとき染色体を分裂した2つの細胞に分離する働きをするのが微小管です。
微小管は抗がん剤治療の重要な標的の一つです。がん細胞が分裂する時に、チューブリンから微小管が形成される過程を阻害すれば、細胞分裂を防ぐことができるからです。
しかし、微小管の形成を阻害することは、細胞分裂の阻害だけでなく、神経障害の原因にもなります。神経の軸索(神経線維)は他の神経細胞や筋肉に信号を伝達するケーブルのようなものです。軸索の中の微小管は軸索の発育や物質の輸送に重要な役割を果たしています。
したがって、微小管をターゲットにする抗がん剤は神経細胞の軸索の働きを傷害し、神経の信号が正しく伝達できなくなって、しびれや感覚障害や痛みなどの副作用を引き起こします。(図)
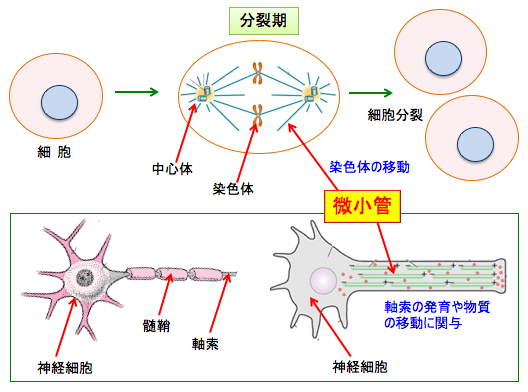
図:微小管は細胞が分裂する時に染色体の移動に必要なため、微小管の形成を妨げると細胞分裂が阻害される。また、神経細胞の信号を伝達する軸索の中にも微小管があり、軸索の発育や物質の輸送に関連している。したがって、微小管をターゲットにする抗がん剤は、しびれや感覚低下や痛みなどの末梢神経障害の副作用が発生する。
【抗がん剤による認知機能の低下が増えている】
ケモブレイン(chemobrain)とは、chemotherapy(化学療法)の「chemo」と、「brain(脳)」を組み合わせて作られた用語です。「化学療法後の脳機能障害」という意味で、抗がん剤治療中や治療後に起こる記憶や認知力の低下のことを指しています。
抗がん剤治療中あるいは治療後に、物忘れが強くなったというがん患者が増えています。抗がん剤治療の進歩により生存期間が延長してくると、抗がん剤治療の長期後遺症の一つとして、記憶力や認知力の低下が問題になってきました。命に関わることでは無いのですが、生活の質を低下させる点で患者にとっては深刻な問題になっています。
とくにこの問題は乳がん患者の間で、1980年代後半から問題になってきました。乳がんの治療では、神経細胞のダメージを起こしやすい抗がん剤が複数使用されることが多いことと、抗がん剤治療後に長期間延命する患者(乳がんのサバイバー)が多いためです。
記憶力や認知力が低下すると、物忘れ、言葉がすぐに出て来ない、物事に集中できない、一度に複数の仕事や作業ができない、新しいことを覚えられないといった症状が出ます。倦怠感や抑うつも症状の一つとなる可能性があります。
このような症状が、抗がん剤治療を受けている乳がん患者の10~40%で見られると報告されています。乳がんで抗がん剤治療を受けた患者の70%くらいに認知機能の低下が認められたという報告もあります。自分では気づかなくても、記憶力や認知機能を検査すると低下があることが示されています。認知症の初期は自分でほとんど気づかないのと同じです。
ケモブレインの主な原因は、抗がん剤による神経細胞のダメージ(神経毒性)です。一般的には、細胞分裂を行わない神経細胞は抗がん剤や放射線照射によって細胞死は起こりにくいのですが、メソトレキセート、パクリタキセル、5-FUなど、神経細胞に毒性を示す抗がん剤は多くあります。
ケモブレインは末梢神経障害とはメカニズムが異なる可能性も指摘されています。メソトレキセート、5−FU、シクロフォスファミドのように末梢神経障害を引き起こすことが少ない抗がん剤治療が、神経系の炎症や神経細胞の新生(neurogenesis)を阻害して認知機能を低下させることが指摘されています。
症状が軽い場合には、抗がん剤の副作用なのか老化現象なのか判断が困難な場合が少なくありません。抗がん剤による神経のダメージだけでなく、治療に伴うストレスが関与している場合もあります。さらに、抗がん剤によって卵巣機能が低下してホルモンバランスが障害されて、更年期症状として記憶力の低下が起こることもあります。
いずれにしても、ケモブレインの症状は、老化に伴う記憶力や認知力の低下と似ているため、生活の質を悪化させる要因になっていることは間違いありません。その症状の発症には複数の要因が絡んでいる場合も多いため、有効な治療法がないのが実情です。
【カンナビジオールは抗がん剤による神経障害を緩和する】
パクリタキセルは末梢神経にダメージを与えて痛みを引き起こす副作用があり、これによって抗がん剤治療を中断せざるを得ない場合もあります。マウスを使った実験で、パクリタキセルで誘発される機械的刺激に対する疼痛感受性の亢進がカンナビジオール(2.5~10mg/体重1kg)の投与によって阻止されることが報告されています。
Cannabidiol inhibits paclitaxel-induced neuropathic pain through 5-HT(1A) receptors without diminishing nervous system function or chemotherapy efficacy.(カンナビジオールは、神経系の機能や化学療法の有効性を低下させることなく、5-HT(1A) 受容体を介してパクリタキセル誘発性の神経因性疼痛を抑制する) Br J Pharmacol. 2014 Feb;171(3):636-45.
この効果は5−HT1A受容体の阻害剤の同時投与によって減弱しましたが、カンナビノイド受容体のCB1の阻害剤やCB2の阻害剤では減弱しませんでした。また、カンナビジオールの投与によってマウスの学習機能や認知機能などに低下は認められませんでした。さらに、培養乳がん細胞を用いた実験では、パクリタキセルとカンナビジオールの併用は、相加あるいは相乗的な抗腫瘍効果の増強を示しました。
これらの実験結果より、カンナビジオールはパクリタキセルによって引き起こされる神経障害を予防する効果を示し、その作用機序として5-HT1A受容体を介する機序が示唆されました。さらに、乳がん細胞に対するパクリタキセルの抗腫瘍効果を減弱させることはありませんでした。
つまり、パクリタキセルによる抗がん剤治療にカンナビジオールを併用することは、神経障害の発生予防や軽減において有効で安全な治療法という結論です。
この論文では、5-HT1A受容体の拮抗薬によってカンナビジオールの神経障害抑制効果が減弱(阻止)されたので、カンナビジオールの神経障害抑制作用はこの5-HT1A受容体の関与を示唆しています。
5-HT1A受容体はセロトニン受容体の一種で、5-HT1A作動薬は抗不安や抗うつ作用などの作用があります。5-HT1A受容体は不安障害やうつ病の治療標的分子として長く研究されてきましたが、最近の研究によって統合失調症やパーキンソン病の新たな治療ターゲットとしても注目されるようになってきました。実際にカンナビジオールが統合失調症など精神疾患に有効であることが報告されています。
【カンナビジオールは抗がん剤による味覚障害を軽減する】
舌には食べ物の味を感じる味蕾という小さな器官があります。これは味細胞と支持細胞からなる花の蕾のような小さな器官で、味覚の化学受容体として働きます。人間の舌には約1万個の味蕾があると言われており、食品中の物質がこの味蕾を刺激すると、味覚神経に伝わって、大脳の味覚中枢へと信号が伝わり、味を感じます。
味覚には「甘味」「塩味(辛味)」「酸味」「苦味」「旨味」の5種の基本の味覚があり、それぞれ別個の受容体(味蕾)が存在します。
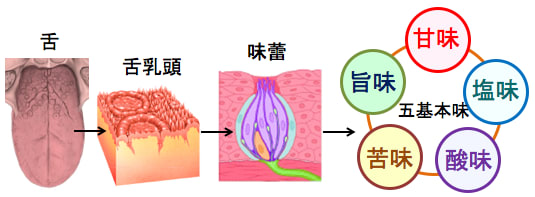
図:味覚の基本は甘味・塩味・酸味・旨味・苦味の5種類で、舌の舌乳頭という小さな突起部に存在する味蕾(みらい)という味を検出するセンサー(化学受容体)でこれらの味覚を感じている。
味覚の基本的な役割は、食欲を高めるためと、食べ物と毒を見分けるためと思われます。
5種類の味覚のうち、甘味・旨味・塩味・酸味は体に必要な糖分や塩分やその他の栄養素をとることができるような食べ物を選ぶため、さらに食欲を高めるために存在するようです。
しかし苦味だけは例外で、人類が苦味を感じる力を身につけたのは、植物の毒を検知して食べないようにするためだと考えられています。
抗がん剤の副作用として味覚障害は高頻度に発生します。味覚障害は食欲を低下させて栄養状態を悪化させ、体重を減らす原因になります。栄養失調と体重減少は、抗がん剤治療に対する抵抗力を低下させ、骨髄抑制(白血球減少や貧血)や免疫力低下の副作用を増強します。したがって、抗がん剤による味覚障害を軽減することは、がん治療の効果を高め、患者の延命にも効果があります。
化学療法誘発性の味覚変化を予防する効果的な治療法はありませんが、カンナビジオール(CBD)が抗がん剤治療によって誘発される味覚障害を予防または改善することが臨床試験で報告されています。
Prevention of Taste Alterations in Patients with Cancer Receiving Paclitaxel- or Oxaliplatin-Based Chemotherapy-A Pilot Trial of Cannabidiol.(パクリタキセルまたはオキサリプラチンベースの化学療法を受けているがん患者における味覚変化の予防 - カンナビジオールのパイロット試験)Nutrients. 2023 Jul 1;15(13):3014.
この臨床試験ではパクリタキセルまたはオキサリプラチンをベースにした化学療法を受けているがん患者の味覚変化を検討しています。
味覚知覚は6つの味サンプル (甘味、塩味、旨味のそれぞれ薄い濃度と濃い濃度)をランダムな順序で味見し、薄い味と濃い味の区別ができるかどうかで評価しています。
対照群(n=10)では3サイクルの化学療法後に薄い味と濃い味を区別する能力が失われましたが、抗がん剤治療中にCBD(300mg/日を8日間)を投与された介入群(n=22)では味覚の減弱が軽減されました。
この結果は、カンナビジオール(CBD)が化学療法によって誘発される味覚の変化を予防または改善する可能性があることを示しています。CBD のこの効果は神経保護効果によると考えられています。
【カンナビジオールはグリア細胞の活性化を抑制する】
成人男性の脳の重さは1.2kgから1.5kg程度で体重の約2%しかありませんが、酸素の消費量は全身の約20%、グルコース(ブドウ糖)の消費量は全身の約25%と、重量の割に酸素とグルコースの消費が高い臓器です。したがって、酸素やグルコースの供給が減ると神経細胞は機能が低下し、高度になると神経細胞は死滅します。
例えば、一酸化炭素中毒は酸素を運ぶヘモグロビンに一酸化炭素が結合して、酸素の運搬を阻害することによる低酸素によって起こる障害です。脳梗塞は脳血管が閉塞することによって神経細胞が死滅していきます。つまり、脳組織の低酸素や虚血は神経細胞を死滅させる最も一般的な原因となっています。
神経組織には神経細胞とグリア細胞という細胞が存在します。グリア細胞は様々な種類がありますが、神経細胞を固定して支持する作用、栄養素の供給、神経伝達をサポートする働きなど、神経系の正常な機能を維持するために様々な役割を果たしています。
神経組織が虚血になってグルコースや酸素の供給が止まると、グリア細胞に乳酸が蓄積して酸性になり、興奮性アミノ酸のグルタミン酸を放出します。グルタミン酸はグルタミン酸受容体を介して興奮性の刺激を伝達する物質ですが、細胞外に放出されると神経細胞に非常に危険な毒性を示します。グルタミン酸受容体が活性化されると細胞内のカルシウム濃度が上昇し、細胞死が誘導されます。
カンナビジオールはグリア細胞の活性化を抑制し、グルタミン酸による神経細胞のダメージを抑制する作用が報告されています。
その他にカンナビジオールが作用する受容体やタンパク質が多数報告されています。その中には、細胞内への電解質などの物質の出入りを調節する様々な種類のイオンチャネルやトランスポーター(輸送体)、細胞のシグナル伝達に関与する受容体や酵素などが含まれ、これらの物質を活性化したり抑制する作用が報告されています。
遺伝子発現にも作用します。例えば、炎症反応の過程で活性化される転写因子(NF-κB)の活性を阻害して、一酸化窒素(NO)の産生を抑制する効果が報告されています。細胞内の抗酸化酵素や解毒酵素の発現量を増やす作用も報告されています。
このように、カンナビジオールは抗酸化作用、抗炎症作用、グリア細胞の活性化の抑制作用、グルタミン酸の代謝の調節など多彩な作用によって神経細胞をダメージから保護すると考えられています。
その結果、脳卒中だけでなく、ハンチントン病やパーキンソン病など神経変性疾患の治療にも効果が期待されています。抗がん剤による神経障害による認知機能低下や運動障害の予防にも有効です。
【抗がん剤による神経障害の予防は早い段階から開始する】
抗がん剤による神経障害はいったん発現すると有効な対策が少なく、不可逆的になる場合もあります。したがって、症状が強い場合には、抗がん剤治療の中断や薬剤の変更を余儀なくされます。がん患者が治療を早期に中止する最も多い理由の一つです。
手足の冷感、しびれがある場合は、温かい手袋や靴下を身につけて保温し、血液循環の改善をはかります。低温時には皮膚を露出しないようにし、お湯で温めたりマッサージで血行を良くすることも効果があります。
薬物治療としては、しびれ症状の緩和のためにビタミンB製剤(B1, B6, B12など)を用いたり、疼痛に対しては非ステロイド性抗炎症剤や副腎皮質ホルモン剤が使われることがあります。マッサージや鍼などの補完療法が利用されることもあります。
激痛に対してはオピオイド(麻薬性鎮痛剤)が必要になります。抗うつ薬や抗てんかん薬が試されることもあります。しかし、抗がん剤による末梢神経障害に対するこれらの治療法の有効性は立証されておらず、末梢神経障害の治療に使用される薬剤の中にはそれ自体に副作用がある場合もあります。すなわち、副作用が無く、抗がん剤治療の効果を妨げない方法が求められています。
抗がん剤の副作用の中で、吐き気や胃腸障害は抗がん剤投与が終了すれば起こらなくなり、白血球減少などの骨髄障害も、抗がん剤投与が終了すれば回復してきます。しかし、末梢神経障害は、抗がん剤治療が終了したあとも長く続くことが多く、数ヶ月や数年間ほとんど症状が改善しない場合もあります。抗がん剤による末梢神経系や中枢神経系のダメージを防ぐには、抗がん剤治療中から対処する必要があります。神経障害の症状が強く出てからでは治療は困難です。
動物実験や小規模な臨床試験で有効性が報告されているサプリメントとしてアセチル-L-カルニチン、R体αリポ酸、メラトニン、カンナビジオールがあります。これらは、抗がん剤による神経障害を軽減するだけでなく、倦怠感の軽減など全身状態の改善にも有効で、抗がん剤治療による抗腫瘍効果を高める作用もあります。
しかし、これらの個々の効果は弱く、単独で症状を改善することは限界があります。したがって、これらの複数の方法を組み合わせて、少しでも症状を改善することが重要です。
さらに、神経の再生を促す働きがあるビタミンB1,B6,B12、牛車腎気丸のような血液循環を良くし痺れや痛みに使用される漢方薬や、芍薬甘草湯のように筋肉痛に有効な漢方薬を併用すると、症状を改善する効果を高めることができます。(トップの図)
重要なことは、これらのサプリメントや医薬品は抗がん剤治療中から服用することです。神経のダメージが強くなってからでは、効果は弱くなります。
【米国はカンナビジオールを神経保護剤として特許を登録している】
米国は「Cannabinoids as antioxidants and neuroprotectants(抗酸化剤および神経保護剤としてのカンナビノイド)」という特許を登録しています。特許番号はUS 6630507 B1で、1999年4月に出願し、2003年10月に公開しています。
出願人(Assignee)のDepartment of Health and Human Services(HHS)はアメリカ合衆国の保健福祉省で、アメリカ合衆国連邦政府が管轄する米国政府の機関です。日本の厚生労働省に相当します。
HHSは11の部局から構成されますが、その部局として国立衛生研究所(NIH)や食品医薬品局(FDA)などがあります。
発明者(inventors)の3人が国立精神衛生研究所(NIMH)に所属し、このNIMHはNIH(国立衛生研究所)の管轄で、NIHはHHS(保健福祉省)の1部局なので、出願人がアメリカ合衆国になっているのです。
発明者の3人は1998年に以下のような論文を発表しています。
Cannabidiol and Delta9-tetrahydrocannabinol are neuroprotective antioxidants.(カンナビジオールとデルタ9-テトラヒドロカンナビノールは神経保護作用のある抗酸化剤である) Proc Natl Acad Sci USA. 1998 Jul 7;95(14):8268-73.
培養したラット大脳皮質の神経細胞に興奮性神経伝達物質のグルタミン酸などを投与して神経細胞傷害を引き起こす実験系で、CBDとTHCが神経保護作用を示すことを報告しています。
その作用メカニズムは、カンナビノイド受容体を介するものでなく、抗酸化作用によるものでした。カンナビジオールはビタミンCやビタミンE(αトコフェロール)よりもより強力な抗酸化作用と神経保護作用を示すと言っています。
この論文の内容をもとに、脳卒中や脳外傷のような虚血性脳障害の進行を抑える目的や、アルツハイマー病やパーキンソン病や認知症のような神経変性疾患の治療の目的において、カンナビジオール(CBD)が神経保護剤として利用できるという特許です。
抗酸化剤や神経保護剤として高用量で使用した場合に、精神作用のあるΔ9-テトラヒドロカンナビノール(THC)では問題があるので、CBDの方がより有用という内容です。
新刊紹介

| « 880)カンナビ... | 882)カンナビ... » |



