がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
865)がんに勝つケトン食スープ

図:ケトン食は低糖質+高脂肪(特にMCTオイル、ω3多価不飽和脂肪酸を増やす)の食事となる(①)。グルコース(ブドウ糖)とインスリンとインスリン様成長因子-1(IGF-1)はがん細胞の増殖を促進する。したがって、低糖質食は血糖とインスリンとIGF-1によるシグナル伝達系を抑制して(②)、がん細胞の増殖や浸潤や転移や抗がん剤抵抗性を阻止する(③)。MCTオイル(中鎖脂肪酸中性脂肪)はケトン体のβヒドロキシ酪酸を増やし、βヒドロキシ酪酸は様々なメカニズムでがん細胞の増殖を抑制する(④)。ω(オメガ)3系多価不飽和脂肪酸も抗炎症作用や増殖シグナル伝達系の抑制などの機序によって抗がん作用を発揮する(⑤)。野菜に含まれるファイトケミカルや食物繊維は多彩なメカニズムでがん細胞の増殖を抑制する(⑥)。ケトン食と野菜スープを組み合わせた「ケトン食スープ」は、がんに勝つ最強の食事法となる(⑦)。
865)がんに勝つケトン食スープ
【米食ががんを増やす?】
赤身の肉や動物性脂肪の摂取が大腸がんや乳がんや前立腺がんなど欧米型のがんの発生リスクを高めると考えられており、近年の日本におけるこれら欧米型のがんの増加は食事が欧米化しているためだと考えられています。
大豆や魚の多い和食(日本食)はがん予防の食事として理想に近いと考える研究者も多くいます。
魚油に含まれるドコサヘキサエン酸(DHA)やエイコサペンタエン酸(EPA)や大豆に含まれるイソフラボンのがん予防効果に関しては多くの研究があります。
日本食の場合は塩分が多いのが欠点ですが、欧米の食事に比べて魚や大豆製食品やキノコ類や海草類が多く、赤身の肉や動物性脂肪が少ないという点では健康的と考えられています。
しかし、白米主体の主食や、砂糖やみりんなど糖質の多い味付けなど、糖質摂取量が多いという観点から、日本食のがん予防効果について疑問視する意見が増えています。
糖質は血糖を高めてインスリンの分泌を高めるので、がんを促進する作用があります。主食のご飯(白米)は発がんリスクを高める要因として無視できなくなっています。
米は日本人の主食なので、ご飯が発がんリスクを高めるという意見は受け入れがたい面もありますが、がんの予防や治療の領域においても米食の是非について議論されるようになっています。
【白米は糖尿病を増やし、糖尿病はがんを増やす】
日本を含めて世界中で糖尿病は増えています。
日本では糖尿病は1960年代くらいまでは極めて稀な病気でしたが、現在では5人に一人が糖尿病あるいは糖尿病予備軍と言われるくらいに増えています。
糖尿病ががんの発生を増やすことは多くの研究で明らかになっています。
日本で行なわれた大規模調査では、糖尿病と診断されたことのある人はない人に比べ、20~30パーセントほどがんの発生率が高くなることが報告されています。糖尿病は非ホジキンリンパ腫,膀胱がん,乳がん,大腸がん,子宮内膜がん,肝がん,膵がんなどの発症リスクを高めることが報告されています。
さらに、糖尿病があるとがんの進行が早く転移しやすいことも指摘されています。高血糖や高インスリン血症ががん細胞の増殖を促進するからです。様々なメカニズムで、糖尿病はがんの発生や進展を促進することが明らかになっています。
白米摂取量が多いほど2型糖尿病の発症が増えることが明らかになっています。以下のような報告があります。
White rice consumption and risk of type 2 diabetes: meta-analysis and systematic review.(白米の消費量と2型糖尿病のリスク:メタ解析と系統的レビュー)BMJ. 2012 Mar 15;344:e1454.
米国のハーバード大学からの報告です。2012年1月までに報告された研究の中から、白米摂取と2型糖尿病との関係を検討した4件の前向きコホート研究を抽出し、メタ解析を行っています。これらの研究は米国、オーストラリア、中国、日本で行われたもので、7コホートが含まれていました。
調査開始時に糖尿病でなかった352,384人を対象に4〜22年間の追跡で、13,284例が2型糖尿病を発症しました。白米の平均消費量は西洋諸国とアジア諸国で大きく異なり、西洋では1週間に5杯(1杯=調理した白米158g)未満であったのに対し、中国では1日平均4杯でした。
解析の結果,白米の最低摂取群と比較した最高摂取群の糖尿病の相対リスク(RR)は東洋人が1.55〔95%信頼区間(CI)1.20〜2.01〕、西洋人が1.12(同0.94〜1.33)で、両者の差は統計的に有意でした(P=0.038)。
これは、米を多く食べる東洋人では2型糖尿病リスクが55%高まったが、週に平均5杯と米の摂取量の少ない欧米ではリスク上昇率は12%にとどまるという結果です。
4研究の全参加者を対象とした用量反応性メタ解析では、白米摂取1日1皿増加当たりの糖尿病の相対リスクは1.11(95%CI 1.08〜1.14)でした。
つまり、白米の摂取量が多いほど2型糖尿病の発症リスクが増加し、この関係は東洋人(中国人と日本人)で顕著であるという結果です。そして、1日の白米摂取が1杯増えるごとに2型糖尿病の発症リスクが11%上昇するという結論です。
グリセミック指数が高い食事は2型糖尿病発症リスクの上昇に関連することが知られています。
グリセミック指数(GI値)は、炭水化物が消化されてグルコース(ブドウ糖)に変化する速さを相対的に表す数値で、GI値が高いほど食後血糖値が上昇しやすいことを意味します。
白米は世界的に消費量が多く、グリセミック指数が高い食材です。したがって、世界的な糖尿病患者の増加に白米の摂取が関連しているかどうかを検討した結果、白米摂取量と2型糖尿病発症リスクとの間に有意な関連が認められたということです。
この論文の結論は、「白米の消費量の増加は2型糖尿病の発症リスクの増加と有意に関連しており、特にアジア(中国と日本)の人々ではその関連は顕著である。」となっています。
中国では糖尿病が爆発的な勢いで増加していることが問題になっています。その原因の第一が白米摂取にあることは多くの研究者が指摘しています。 日本でも、国立がん研究センターによる多目的コホート研究(JPHC研究)で、白米の多量摂取が糖尿病の発症率を高めていることが指摘されています。
Low-carbohydrate diet and type 2 diabetes risk in Japanese men and women: the Japan Public Health Center-Based Prospective Study.(日本の男女における低炭水化物食と2型糖尿病の発症リスク:多目的コホート研究)PLoS One. 2015 Feb 19;10(2):e0118377.
この研究では、糖尿病の既往がない45~75歳の男性27,799人と女性36,875人を対象に、食物摂取量は食物摂取頻度調査票を用いて確認し、前向きに追跡し、5年間に診断された2型糖尿病のオッズ比を、ロジスティック回帰を用いて推定しています。
その結果、日本人女性において低炭水化物食と2型糖尿病リスク低下との関連が認められました。
糖質摂取が多い上位5分の1のグループに比較して、糖質摂取が少ない下位5分の1のグループの2型糖尿病の多変量調整オッズ比は、0.63(95%CI:0.46~0.84)でした。この論文の著者らは、2型糖尿病の発症に白米の多量摂取が関連している可能性を指摘しています。
2型糖尿病は米をよく食べるアジア諸国で急増しています。 白米を多く食べるほど2型糖尿病の発症リスクが有意に上昇し、その結果、がんの発症も増えます。「白米摂取ががんを増やす」ということを示しています。 日本食は白米を主食にしている点でがん予防にマイナスと言えます。白米が認知症を増やすデータも報告されています。
【糖質摂取は肥満を増やし、肥満はがんの発症リスクを高める】
肥満ががんの発生を促進することは多くのエビデンスで支持されています。 肥満はインスリン抵抗性を高め、高インスリン血症を引き起こします。インスリンはインスリン様成長因子の活性も高めます。インスリンとインスリン様成長因子はがんの発生や進展を促進します。
多くの疫学研究から、大腸がん、乳がん、膵臓がん、子宮体がん、腎臓がん、胆のうがん、肝臓がんなど多くのがんの発生率が肥満によって増えることが示されています。
肥満ががん治療後の再発率を高め生存期間を短くすることも多くの報告で明らかになっています。
肥満ががんの発生や進展を促進する理由の第一は、インスリンの分泌が増えるからです。
インスリンの働きに影響する様々な生理活性物質が脂肪細胞から分泌されており、肥満によって体脂肪が増えるとインスリンの働きが低下します。脂肪組織から分泌されるアディポネクチンという蛋白質にはインスリンの働きを高める作用がありますが、内蔵脂肪が増えると分泌量が減り、アディポネクチンの血中濃度が低下するとインスリン抵抗性(インスリンの作用低下)が高まります。
インスリンの働きが弱くなると、それを補うために体はインスリンの分泌量を増やして血中のインスリン濃度を高めて代償しようとします。
インスリンは様々なメカニズムでがん細胞の発生や増殖を促進します。インスリンががん細胞の増殖促進や細胞死(アポトーシス)の抑制など、がんを悪化させる様々な作用が明らかになっています。インスリンの分泌を減らすこと自体にがん予防効果があります。
糖質摂取はインスリン分泌を増やして体脂肪を増加させやすいので、摂取カロリーが過剰になると、容易に肥満を発症します。肥満はさらにインスリン分泌を増やし、肥満をさらに助長します。食後の高血糖は酸化ストレスを高めます。このような状況はがん細胞の発生や増殖を促進することになります。(下図)

図:糖質の多い食事は食後血糖値を高める(①)。血糖値の上昇はインスリン分泌を増やす(②)。インスリンは脂肪合成を亢進して肥満を促進する(③)。肥満は脂肪組織において炎症性サイトカインの産生を増やし、アディポネクチンの産生を減らす(④)。その結果、インスリン抵抗性が亢進し(⑤)、さらにインスリン分泌を増やし、悪循環を形成する(⑥)。インスリン産生が増えると、いずれ膵臓のβ細胞が疲弊してインスリン分泌が低下して糖尿病が発症し(⑦)、血糖が上昇する(⑧)。高血糖は炎症と酸化ストレスを亢進する(⑨)。高インスリン血症と高血糖と炎症と酸化ストレスはがん細胞の発生や増殖を促進する(⑩)。つまり、糖質の多い食事はがんの発生と進展を促進する。
【インスリンはインスリン様成長因子-1の活性を高める】
インスリンは肝臓におけるインスリン様成長因子-1結合蛋白やステロイドホルモン結合グロブリンの産生を減らすことによって、インスリン様成長因子-1(IGF-1)や性ホルモンの活性が高まります。インスリンは卵巣におけるアンドロゲンの産生を高める作用もあります。さらに、脂肪組織はエストロゲンの産生部位でもあり、アロマターゼ活性によってエストロゲンの産生が高まります。
IGF-1はがん細胞の増殖や血管新生や転移を促進する作用があります。体の成長を促進する成長ホルモンは肝臓に働きかけてインスリン様成長因子-1(IGF-1)を分泌させ、このIGF-1が標的組織の細胞分裂を刺激します。したがって、多くの臓器や組織の細胞にIGF-1の受容体があり、それらの細胞から発生するがん細胞の多くがIGF-1受容体を持っています。
IGF-1は70個のアミノ酸からなり、インスリンと似た構造をしています。IGF-1受容体とインスリン受容体も類似しており、インスリンがIGF-1受容体にも結合してIGF-1と同じように細胞の増殖を促進することが知られています。インスリンとIGF1はそれぞれの受容体に結合して細胞を刺激すると、細胞増殖と代謝を促進するシグナル伝達経路(PI3K/Akt/mTOR/HIF-1α経路とRas/Raf/MAPK経路)を活性化して栄養素の取り込みやエネルギー産生を高め、細胞増殖や血管新生や転移を促進し、抗がん剤抵抗性を高めます(下図)。

図:グルコースはインスリンの分泌を促し、インスリンはインスリン様成長因子-1(IGF-1)結合蛋白の産生を抑制することによってIGF-1の活性を高める。インスリンとIGF-1はそれぞれの受容体に結合することによって細胞内シグナル伝達系のRas/Raf/MAPK経路とPI3K/AKT/mTOR/HIF-1α経路を活性化し、栄養素の取込みやエネルギー産生を高め、がん細胞の増殖や転移や抗がん剤抵抗性を促進する。
IGF-1の低い人ほどがんによる死亡率が低いという報告があります。
例えば、高齢者男性で、血中のIGF-1の濃度が高い人はがんを発生するリスクが高いという疫学研究の結果が米国から報告されています。この研究では、50歳以上の男性633人を対象に、IGF-1値を測定したのち18年間の追跡調査を行った結果、試験開始時にIGF-1値が100ng/mlを超えていた男性のがん死亡のリスクはIGF-1値が低かった男性のほぼ2倍であったということです。
その他の研究でも、血清IGF-I濃度が高いほど、前立腺がん、乳がん、肺がん、大腸がん、膵臓がんの発生率が高くなることが示されています。
【がんの予防や治療における糖質制限の効果】
がんの予防や治療において、血糖やインスリン分泌を高める糖質の摂り過ぎにもっと注意を払うべきだと思います。
糖質を減らした分のカロリーを油脂で補う場合、抗がん作用や健康増進作用のあるω3系不飽和脂肪酸の豊富な亜麻仁油やエゴマ油や魚油(DHA, EPA)、オリーブオイル、MCTオイルを主体にすると、脂肪を増やしても健康に問題ありません。
動物性の飽和脂肪酸やオメガ6系不飽和脂肪酸は循環器疾患を増やすというデータは多くありますが、ω3系多価不飽和脂肪酸やオリーブオイルは多く摂取するほど健康作用があります。糖質制限やケトン食ががん予防の食事療法として有効であるエビデンスは十分にあります。
がんを縮小させ消滅することを目標とする進行がんの治療では、糖質摂取を10〜20g程度に制限する厳密なケトン食を推奨していますが、がんの発生や再発の予防の目的であれば、糖質摂取を80グラム程度まで許容し、中鎖脂肪酸(MCTオイル)やオメガ3系不飽和脂肪酸やオリーブオイルを増やしたマイルドなケトン食で十分に目標を達成できます。
がん予防の基本は「糖質の取り過ぎに注意する」ことが最も重要だと思います。

図:高糖質食は血糖とインスリンの血中濃度を高めることによって、肥満や2型糖尿病を増やし、がん細胞の発生や増殖・転移を促進する。糖質制限とケトン食は肥満と2型糖尿病の発症を抑制し、がん細胞の発生と増殖を抑える効果がある。
【糖質摂取を減らすとがん細胞の増殖が抑制される】
糖質の多い食事ががんの発生率を高め、がん細胞の増殖や転移や再発を促進することは、多くの動物実験や臨床試験で報告されています。がん細胞が増殖するためにはエネルギーと細胞と作る材料が必要ですが、そのエネルギー産生と物質合成の材料が糖質を分解してできるグルコースだからです。
したがって、糖質摂取を減らしてがん細胞へのグルコースの利用を減らすことでがん細胞の増殖抑制効果が得られる可能性があります。
実際に、マウスにがんを移植する実験系では、エサの糖質のカロリー比を減らすことでがん細胞の増殖抑制効果が認められています。さらに、遺伝子改変によってがんを自然発症するマウスの実験では、糖質摂取を減らすことでがんの発生予防効果が示されています。以下のような報告があります。
A low carbohydrate, high protein diet slows tumor growth and prevents cancer initiation.(低糖質・高タンパク質の食餌はがん細胞の増殖を遅くし、がん細胞の発生を予防する)Cancer Res. 71(13): 4484-93, 2011年
この論文では、カロリー摂取量は変えずに、糖質の摂取量を減らし、減ったカロリー分はタンパク質を増やして補うような食餌のパターンで、糖質制限による抗腫瘍効果を検討しています。各食餌のカロリー比の構成を下に示しています。

通常食のカロリー比は糖質が55.2%、タンパク質が23.2%、脂質が21.6%です。
糖質のカロリー比を15%、10%、8%にしたエサを使っています。これら低糖質食のエサでは、減ったカロリー分をタンパク質で補っています。すなわち、脂肪の摂取量は通常食とほぼ同じで、タンパク質のカロリー比が60~70%程度に高くなっています。つまり、低糖質+高タンパク質の食餌の抗腫瘍効果ということになります。
マウスにがん細胞を移植する実験系では、マウスの扁平上皮がんVII (SCCVII) とヒト大腸がん細胞(HCT-116)が使われ、マウスに移植して週に2~3回腫瘍組織の大きさを測定して体積を計算で求めています。
その結果、下図に示すように、糖質8%の食餌で飼育したマウスに移植したがんは通常食のがんの増殖に比べて、その増殖速度が半分以下になりました。たとえば、がんを移植して16日後の腫瘍の体積は、通常食では364.3 ± 85.01 mm3であったのに対して、8% 糖質群では130.9 ± 21.76 mm3と半分以下でした。

図:マウスにがんを移植する実験系では、エサの糖質のカロリー比を8%に減らし、減ったカロリー分をタンパク質で増やす低糖質・高タンパク食で飼育すると、通常のエサ(糖質のカロリー比が55.2%)で飼育した場合に比べて、腫瘍の増大速度は半分以下に遅くなった。糖質を10%や15%に減らした低糖質食でも同様の腫瘍抑制効果が認められ、糖質摂取量が少ないほど腫瘍抑制効果が高かった。(出典:Cancer Res 71:4484-4493, 2011年)
ただし、8%糖質の場合には、体重の減少が認められたので、カロリー制限の影響があるかもしれないということで、10%糖質と15%糖質での検討が行われています。
糖質のカロリー比が10%と15%の場合は通常食(糖質のカロリー比が55.2%)と比べて体重の差は認めませんでしたが、8%糖質の場合と同様にがん組織の増大速度は低下していました。
例えば、SCCVII細胞を移植して16日後の腫瘍の体積は、通常食群では542.9 ± 78.80 mm3であったのに対して15%糖質群では 321.0 ± 79.79 mm3 でした。
つまり、糖質が少ないほどがん組織の増大速度は低下しますが、10%でも15%でも、体重の変化を起こさずに、有意にがんの増殖を抑えることが確認されています。
別の実験系では、がん遺伝子のHER2/Neuを過剰発現させるように遺伝子改変したマウスが使われています。この遺伝子改変マウスは通常のエサで飼育すると全寿命の期間に70%程度の割合でがんを自然発症します。このがんの発症率(がん組織が触れるようになった時点で発症と認定)が糖質制限で抑制されるかどうかを検討しています。
通常食(糖質のカロリー比が55.2%)では1年後のがん発生率は50%、全寿命の期間では70%のマウスにがんが発生しましたが、糖質を15%に制限した食餌では、1年後の発症率は0%、全寿命期間でも30%でした。糖質摂取の割合を減らすほど、がんの発生率が低下していました。(下図)

図:がんを自然発症するように遺伝子改変マウスを使った実験系では、糖質のカロリー比を減らすと、がんの発生率が低下した。(出典:Cancer Res 71:4484-4493, 2011年)
さらに、がんの治療薬との併用でも、糖質を制限することによって、その治療効果が増強することが示されています。例えば、シクロオキシゲナーゼ-2阻害剤のcelecoxibのがん細胞の転移抑制効果は糖質制限によって増強されました。
以上のような結果から、「糖質制限はがんの発生や増殖を抑制する効果がある」という結論になっています。
人間のがんでも、糖質摂取を減らし、ケトン体が多く産生されるとがん細胞の増殖を抑えられることが報告されています。
米国ニューヨーク州のアルバート・アインシュタイン医科大学の放射線科のグループが、糖質制限食の安全性と有効性を検討する目的で、10例の進行がん患者を対象に臨床試験を行っています。
この研究では、根治治療不可能な進行がん患者でPET検査で腫瘍を検出し、全身状態が比較的良く、諸臓器機能が正常で糖尿病が無く、最近の体重減少を認めず、BMI(Body Mass Index)が20kg/m2以上の条件を満たす10例を対象に、26~28日間の糖質制限食を実施しています。
その結果、食事療法開始前に腫瘍の早い進行を認めていた9例のうち5例で病状安定(stable disease)あるいは部分奏功(partial remission)をPET検査で確認できました。病状安定とはがんが大きくならなかったことで、部分奏功とは画像検査で長径が30%以上(あるいは面積が50%以上)縮小した場合を言います。
効果を認めたこの5例は、進行を続けた4例と比較して、血中のケトン体の量が3倍くらい高かったという結果でした。腫瘍増殖の抑制を認めた5例と進展した4例の間には、カロリー摂取や体重減少の程度には差を認めませんでしたが、ケトン症のレベルは血清インスリンの濃度と逆相関の関係にありました。(Nutrition 28(10): 1028-35, 2012年)
つまり、この臨床試験では、「インスリンの分泌を阻害する食事療法(糖質制限によるケトン食)は進行がん患者において安全に実施できる」「この食事療法による抗腫瘍効果(病状安定および部分奏功)は、摂取カロリーや体重減少の程度とは関係せず、ケトン症の程度(血中ケトン体の濃度)に相関する」という2点が確認されています。
以上のように、インスリンの分泌を低下させれば、がん細胞の増殖を抑える効果が期待できます。そのためには、筋肉細胞のインスリン感受性を高めて必要最小限のインスリン分泌で血糖を調節できるようにすることが重要です。
グリセミック負荷が多い食事(高糖質食)は、大腸がん治療後の再発率を増やし生存期間を短くすることが報告されています。以下のような報告があります。
Dietary Glycemic Load and Cancer Recurrence and Survival in Patients with Stage III Colon Cancer: Findings From CALGB 89803.(ステージIIIの大腸がん患者における食事のグリセミック負荷とがんの再発と生存:CALGB 89803からの結果)J Natl Cancer Inst. 104(22):1702-11, 2012年
この研究は、ボストンのダナ・ファーバーがん研究所やニューヨークのメモリアル・スローン・ケタリングがんセンターなど8施設が参加した多施設協同研究です。
ステージIIIの大腸がん患者1011名を対象に、術後補助化学療法の臨床試験に参加中および臨床試験の終了6ヶ月後に食事の調査を行い、がんの再発率と死亡率に対するグリセミック負荷、グリセミック指数、フルクトース、炭水化物摂取量の影響を統計学的に検討しています。
グリセミック負荷が多い方から少ない方に5段階に分けて、再発率や無病生存期間や生存率などを比較しています。
その結果、グリセミック負荷と全炭水化物摂取量が、再発率および死亡率と正に相関することが示されています。
グリセミック負荷が多い上位20%のグループは、下位20%のグループに比べて、無病生存期間の調整ハザード比は1.79(95%信頼区間:1.29〜2.48)でした。
つまり、グリセミック負荷と全炭水化物摂取量が多いほど、再発率と死亡率が高くなるという結果です。
以下のような報告もあります。
Higher glycemic index and glycemic load diet is associated with increased risk of esophageal squamous cell carcinoma: a case-control study.(高グリセミック指数食と高グリセミック負荷食は食道の扁平上皮がんの発症リスク上昇と関連する:症例-対照研究)Nutr Res. 2013 Sep;33(9):719-25.
イランからの研究で、47例の食道扁平上皮がん患者と、95例の対照を比較しています。その結果、食事のグリセミック指数とグリセミック負荷が食道扁平上皮がんの発症と関連することが示されています。
グリセミック指数が高い上位3分の1のグループでは、下位3分の1のグループに比較して食道がんの発症リスクが2.95倍(95%信頼区間:1.68-3.35)でした。
グリセミック負荷が高い上位3分の1のグループでは、下位3分の1のグループに比較して食道がんの発症リスクが3.49倍(95%信頼区間:2.98-4.41)でした。
グリセミック指数やグリセミック負荷が高い食事が食道の扁平上皮がんの発症リスクを高めるという結論になっています。そのメカニズムとして糖質の多い食事がインスリンやインスリン様成長因子-1の血中濃度を高め、食道がんの発症を促進することを言及しています。
肺がんでも同様な結果が報告されています。以下のような報告があります。
Glycemic Index, Glycemic Load, and Lung Cancer Risk in Non-Hispanic Whites.(非ヒスパニック系白人におけるグリセミック指数とグリセミック負荷と肺がんリスク)Cancer Epidemiol Biomarkers Prev. 2016 Mar;25(3):532-9.
テキサス大学のMDアンダーソンがんセンターで診断された肺がん患者1905人と対照の健常人2413人を比較しています。グリセミック指数の低い下位5分の1のグループに比較して、グリセミック指数の高い上位5分の1のグループは、肺がんの発症率が1.49倍(95%信頼区間:1.21-1.83)でした。非喫煙者のみを対照にするとこの比率は2.25倍(95%信頼区間:1.42-3.57)でした。
この他にも、多くの疫学研究で、グリセミック指数やグリセミック負荷の高い食事が多くのがんの発症リスクを高めることが報告されています。そのメカニズムとして、高血糖と高インスリン血症ががん細胞の発生と増殖を促進することが挙げられています。
【ケトン食はがん細胞の発生や増殖や転移を抑制する】
低糖質+高脂肪食のケトン食は、がん細胞へのブドウ糖(グルコース)の供給を減らし、さらにインスリンやインスリン様成長因子の産生を減らすことによって増殖シグナルを低下させるメカニズムなどによって抗がん作用を発揮します。
ケトン体のβヒドロキシ酪酸は抗炎症作用(NLRP3インフラマソーム阻害作用など)や抗酸化力の増強作用などによってがん予防や抗老化や寿命延長作用が報告されています。
さらに、ケトン食が寿命延長作用と抗がん作用のある高分子量アディポネクチンの産生を増やすという臨床試験の結果は、ケトン食の抗がん作用と寿命延長効果をさらに支持することになります。
βヒドロキシ酪酸はヒストン脱アセチル化酵素を阻害する作用、細胞膜受容体のGPR109Aのリガンドとして作用などによって、直接的にがん細胞の増殖を抑制し、細胞死を誘導することが明らかになっています。
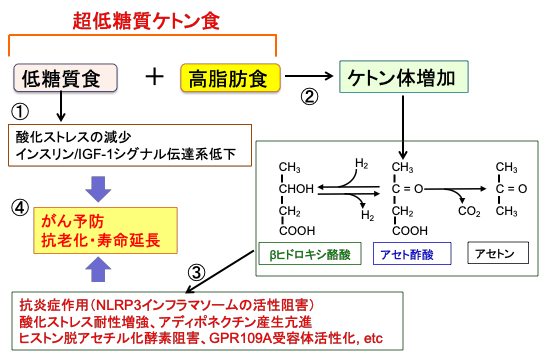
図:超低糖質ケトン食(低糖質食+高脂肪食)はがん予防効果や抗老化作用や寿命延長作用が確認されている。そのメカニズムとして、糖質摂取量が少ないと、酸化ストレスが軽減し、インスリン/インスリン様成長因子-1(IGF-1)シグナル伝達系が抑制される(①)。低糖質・高脂肪食はケトン体の産生を増やす(②)。ケトン体のβヒドロキシ酪酸は、NLRP3インフラマソームの活性阻害などによる抗炎症作用、酸化ストレスに対する抵抗性の亢進、アディポネクチン産生の亢進、ヒストン脱アセチル化酵素阻害、GPR109A受容体活性化などの作用を有する(③)。これらのメカニズムによる総合作用の結果、がん予防や老化抑制や寿命を延ばす作用がある(④)。
動物実験ではケトン食の抗腫瘍効果を示唆する結果が数多く報告されていますが、動物実験の個体数が少なかったり、結果が一致しなかったりという理由で、まだ確定的な結論は出せない状況です。 そこで、複数の実験をまとめて解析するメタ解析で、動物実験におけるケトン食の有効性を検証することが行われています。以下のような論文があります。
Roles of Caloric Restriction, Ketogenic Diet and Intermittent Fasting during Initiation, Progression and Metastasis of Cancer in Animal Models: A Systematic Review and Meta-Analysis(動物実験モデルにおけるがん細胞の発生と進展と転移の過程におけるカロリー制限とケトン食と間歇的断食の効果:系統的レヴューとメタ解析)PLoS One. 2014; 9(12): e115147.
動物を使った発がん実験で、カロリー制限やケトン食や間歇的断食(intermittent fasting)などの食事療法のがん予防効果が研究されています。しかし、結果が一致しない報告もあるので、それらの有効性については、まだ結論が出せない状況です。
そこで、今まで報告された実験結果をメタ解析で統計的に解析してみたという研究報告です。
20年間に報告された「食事と発がん」に関する59件の論文の実験結果を統計的に解析しています。
その結果、カロリー制限とケトン食では発がん予防効果が認められ、間歇的断食では発がん予防効果は認められなかったという結論になっています。
カロリー制限は代謝と酸化ストレスを低下させる機序で発がん予防効果を発揮します。
間歇的な断食はがん細胞への短期間のグルコース供給の制限によりがん細胞の増殖を遅らせると考えられています。
ケトン食は、超低糖質+高脂肪食で、がん細胞に対するグルコース供給の制限と、ケトン体による抗腫瘍効果によってがん予防効果を発揮すると考えられています。
以下のような論文もあります。
Anti-Tumor Effects of Ketogenic Diets in Mice: A Meta-Analysis(マウスにおけるケトン食の抗腫瘍効果:メタ解析)PLoS One. 2016; 11(5): e0155050.
ケトン食単独の抗腫瘍効果を検討したマウスの実験の結果をメタ解析しています。マウスの実験では、ケトン食は腫瘍の増大速度を遅くする効果が認められています。
【野菜はがん予防成分の宝庫】
がんの発生や再発を促進する要因としては、糖質や動物性脂肪や赤味の肉の取り過ぎ、喫煙、飲酒、運動不足や肥満が上げられます。
一方、野菜や果物や豆類など植物性食品、精製度の低い穀物、魚油や紫蘇油や亜麻仁油に多く含まれるω3不飽和脂肪酸は、がんの発生や再発を予防する効果が指摘されています。
特に、野菜や果物には、免疫力を高める成分、活性酸素やフリーラジカルの害を防ぐ成分、発がん物質を不活性化する成分、がん細胞の増殖を抑える効果をもつ成分などが多く見つかっており、これらの成分を多く摂取することががんの発生や再発の予防に寄与すると考えられています。つまり、植物には、「免疫増強作用」「抗炎症作用」「抗酸化作用」「解毒作用」「がん細胞増殖抑制作用」などのがん予防に役立つ成分が多く含まれているのです。
植物に含まれるこのような薬効成分をファイト・ケミカル(phyto-chemical)と呼んでいます。Phytoは植物、chhemicalは化学を意味する言葉で、したがって、ファイトケミカルとは植物に含まれる化学成分を意味しています。
これらのファイトケミカルから、がん予防効果をもった成分が多くみつかっており、それらはサプリメントとしても利用されるようになっています。例えば、大豆のイソフラボン、ゴマのリグナン、トマトのリコピン、ブロッコリーのスルフォラファン、お茶のカテキン、緑黄色野菜のカロテノイド、ブルーベリーのアントシアニン、赤ワインのポリフェノール、キノコのβグルカンなどが有名です。
日頃の食事で、抗がん作用のあるファイト・ケミカルを多く摂取することは、がん細胞の発生や増殖の抑制に有効です。

図:野菜には、抗酸化や抗炎症や解毒や免疫増強などの作用を持った成分が豊富に含まれる。これらの成分を日頃から多く摂取すると、がんの発生や再発の予防に効果がある。
【ファイト・ケミカルを効果的に摂取できる野菜スープ】
日頃の食生活において、新鮮な旬の野菜を多く食べることが大切であり、1日5皿とか1日350gとか具体的な目標が述べられています。ただし、生野菜では野菜中の成分の消化管からの吸収(生体利用性)が低いことに注意が必要です。
植物の細胞は硬い細胞壁で囲まれています。植物の細胞壁はいくつかの繊維成分からなっており、その主要成分であるセルロースを消化する酵素「セルラーゼ」を人間は持っていません。
草食性の動物は、消化管の中にセルロースを分解する微生物を棲まわせていて、胃や盲腸で発酵を行っているため、生の植物を摂取しても、その細胞の中から有効成分を体内に取り入れることができます。
ヒトは硬い繊維質を十分に発酵させるほどには大腸は長くはなく、セルラーゼを産生する腸内微生物を棲まわせていないため、植物を生のまま食べたのでは、細胞内の成分はそう容易には溶け出しません。良く噛む程度では硬い細胞壁を壊して内容成分を溶け出すことは十分にはできないからです。
つまり、野菜に含まれる抗酸化やがん予防効果をもつ薬効成分(ファイトトケミカル)の多くは、生の野菜を食べた場合にはあまり体内に吸収されないということになります。
野菜を水に入れて加熱すると、野菜の細胞壁を構成しているヘミセルロースやペクチンが溶け出し、さらに、細胞内のガスの膨張による細胞壁の破壊などの作用も組み合わさって細胞壁の破壊が起こります。熱によって植物の細胞壁が壊され有効成分が抽出されて、生体に利用可能な状態になるのです。
また複数の研究で、トマトは加熱した方がリコピン(カロテノイドの一種)やナリンゲニン(フラボノイドの一種)やクロロゲン酸(フェノール類)などの薬効成分の体内吸収が高まることが知られています。
野菜の煮汁(スープ)には、抗酸化能で言えば、生野菜と比べて数倍から100倍以上も有効成分が溶け出しているという報告もあります。

図:植物の細胞は硬い細胞壁で囲まれていて、ヒトの消化酵素では細胞壁を壊すことはできない。加熱することによって細胞壁が壊れ、細胞内の成分が溶け出しやすくなる。加熱してスープにした方が生野菜で食べるより、植物中の薬効成分の体内吸収の効率が格段に高くなる。
以上から、「ケトン食」と「野菜スープ」を組み合わせた「ケトン食スープ」は、がんの予防や治療に役立つ食事法と言えます。
新刊紹介:
スープ1杯に抗がんエキスが凝縮!
ケトン体を増やし、ファイトケミカルがたっぷり摂れる、がんの予防にも治療にも役立つ最強の食事法。
かんたん作り置き「福田式ケトン食スープの素」で毎日、楽に続けやすい。
詳しくはこちらへ:
| « 864)cGAS-STIN... | 866)活性酸素... » |




