がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
711)代謝をターゲットにしたがん治療のまとめ:ケトン食+2-DG+DCA+メトホルミン+α
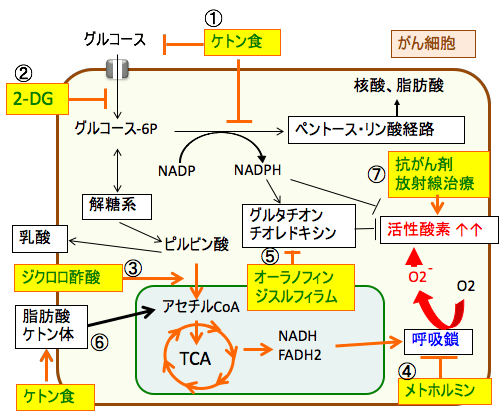
図:がん細胞の代謝の特徴であるワールブルグ効果(解糖系の亢進と酸化的リン酸化の抑制)を正常化し、がん細胞の酸化ストレスを高める方法として、がん細胞の解糖系やペントース・リン酸経路を阻害するケトン食(①)と2-デオキシグルコース(2-DG:②)、ミトコンドリアでの代謝を促進するジクロロ酢酸(③)、呼吸鎖を阻害して活性酸素の産生を高めるメトホルミン(④)がある。オーラノフィンとジスルフィラムはグルタチオンやチオレドキシンによる抗酸化システムを阻害する(⑤)。ケトン食は脂肪酸とケトン体の産生を増やしてミトコンドリアでの代謝を亢進する(⑥)。抗がん剤と放射線治療は活性酸素を産生してがん細胞を死滅する(⑦)。したがって、ケトン食+2-DG+ジクロロ酢酸+メトホルミン+オーラノフィン+ジスルフィラムの組み合わせは、がん細胞のエネルギー産生と物質合成を阻害し、さらに酸化ストレスを高めてがん細胞を死滅させることができる。抗がん剤治療や放射線治療の抗腫瘍効果を高めることもできる。
711)代謝をターゲットにしたがん治療のまとめ:ケトン食+2-DG+DCA+メトホルミン+α
【がん細胞は酸素を使わない生き物】
細胞のエネルギー源は主にグルコースであり、グルコースを分解してエネルギー(ATP)を産生します。
この際、細胞質では酸素を使わない解糖(Glycolysis)でATPが少量産生され、さらにミトコンドリアで酸素を使った酸化的リン酸化で大量のATPが産生されます。

図:細胞質では酸素を使わない解糖系でエネルギー(ATP)を産生、ミトコンドリアでは酸素を使ってATPを産生する。
グルコースからピルビン酸に変換される過程を解糖(Glycolysis)と言います。Glycoは「糖」、lysisは「分ける・分解する」という意味で、1分子のグルコースを2分子のピルビン酸に分解する過程で解糖です。
酸素が十分に使える条件では、ピルビン酸はミトコンドリアに入り、アセチルCoAに変換されてTCA回路で代謝され、さらに酸化的リン酸化によってATPが産生されます。
1分子のグルコース当たり、解糖系だけでは2分子のATPが産生されますが、ミトコンドリアで酸化的リン酸化で完全に分解されると、1分子のグルコース当たり、32〜最大で38分子のATPが産生されます。

図:がん細胞ではピルビン酸からアセチルCoAへの変換が抑制され、ミトコンドリアでの酸化的リン酸化によるエネルギー(ATP)産生が抑制されている。一方、乳酸脱水素酵素(LDH)の活性が亢進して、乳酸の産生が増えている。
正常細胞でも、短距離を全力でダッシュするときの筋肉のように、酸素の供給が間に合わないときは、酸素を使わない解糖でグルコースからATPを産生します。これを嫌気性解糖(Anaerobic glycolysis)と言います。
嫌気性解糖では1分子のグルコースから2分子の乳酸と2分子のATPが産生されます。乳酸は増えると乳酸アシドーシスを引き起こすので、肝臓などで乳酸からグルコースが作られます(糖新生)。これをコリ回路(Cori cycle)と言います。
糖新生は同化反応でATPを消費します。2分子の乳酸から1分子のグルコースを作るのに6分子のATPを消費します。したがって、ある局所で嫌気性解糖が亢進していると、体全体ではATPを消費することになります。

図: 無酸素運動では解糖系が亢進して(①)乳酸の産生が増える(②)。乳酸によるアシドーシス(酸性血症)を防ぐため、肝臓で乳酸をグルコースに変換する(糖新生)。これをコリ回路という(③)。糖新生は同化作用なのでATPを消費する(④)。
がん細胞は、筋肉の嫌気的解糖と同様に、乳酸の産生が増えています。筋肉の場合は、有酸素運動のように酸素が十分に利用できる状況では、ミトコンドリアでの酸化的リン酸化でのATP産生に切り替わります。
しかし、がん細胞の場合は、酸素が十分に利用できる状況でも、ミトコンドリアでの酸化的リン酸化は抑制され、酸素を使わない解糖系でのATP産生が亢進し、乳酸の産生が亢進しています。これを好気的解糖(Aerobic glycolysis)あるいはこれを発見したオットー・ワールブルグ博士にちなんでワールブルグ効果(Warburg effect)と言います。
がんが大きくなって、解糖系が亢進していると、乳酸からグルコースへの変換でATPを消費するので、進行がんでの体重減少や倦怠感の原因の一つになります。

図:がん細胞はピルビン酸からアセチルCoAの変換が抑制され(①)、ミトコンドリアでの酸化的リン酸化(OXPHOS)が低下し、解糖が亢進し、乳酸産生が増えている(②)。これを好気的解糖(Warburug効果)と言う(③)。乳酸は肝臓で糖新生に使用される(④)。糖新生はATPを消費するので(⑤)、進行がんでの体重減少や倦怠感の原因となる。
酵母は酸素が無いと発酵(Fermentation)でATPを産生しますが、酸素が利用できると酸素呼吸(Respiration)でATPを産生します。
筋肉は酸素が使えない状況では発酵(嫌気的解糖)でATPを産生しますが、酸素が使える有酸素運動では酸素呼吸(Respiration)でATPを産生します。
しかし、がん細胞では、酸素が使えない場合も、使える場合も、どちらも酸素を使わない解糖系でのATP産生が亢進しています。
酸素が無い状況では嫌気的解糖(Anaerobic glycolysis)と言い、酸素が使える状況でも解糖系でATPを産生することを好気的解糖(Aerobic glycolysis)と言います。
つまり、がん細胞は酸素を使いたがらない生き物です。

図:がん細胞は酸素が十分に利用できる状況でも酸素を使わない解糖でグルコースを分解してATPを産生している。これを好気的解糖あるいはWarburg(ワールブルグ)効果という。
【がん細胞はグルコースとグルタミンの取り込みが増えている】
がん細胞は正常細胞に比較して、大量のグルコースを取込みます。この特徴を利用した検査法がPET検査(Positron Emission Tomography)です。
これはフッ素の同位体で標識したグルコース(18F-fluorodeoxy glucose)を注射して、この薬剤ががん組織に集まるところを画像化することで、がんの有無や位置を調べる検査法です。
正常細胞に比べてグルコースの取り込みが非常に高いがん細胞の特性を利用した検査法です。

図:正常細胞に比べて、がん細胞はグルコース取り込みが上昇している(①)。グルコースの2位のOH基を陽電子放出同位体フッ素18(18F)で置換された18F-フルオロデオキシグルコース(FDG)という薬剤(②)を注射すると、がん細胞に集積する(③)。FDGの集積をPET装置で撮影し、画像化したものがPET検査( Positron Emission Tomography )で、日本語では陽電子放射線断層撮影と言う。
がん細胞は増殖するためにATP産生と、たんぱく質や脂質や核酸などの物質の合成を高める為に、特にグルコースとグルタミンの利用が増えています。
がん細胞にとって、2大栄養素はグルコースとグルタミンです。

図:糖質が分解してできるグルコース(ブドウ糖)と、たんぱく質が分解してできるアミノ酸のグルタミンががん細胞の物質合成とエネルギー(ATP)産生の主要な原料となる。
がん細胞ではグルコースの取込みと解糖系が亢進し、乳酸の産生が増えています。解糖系から派生するペントースリン酸回路などで核酸やアミノ酸などの物質合成が亢進しています。
グルタミンはTCA回路に入ってアミノ酸の合成や、クエン酸から脂肪酸合成を亢進しています。
TCA回路で産生されるクエン酸は細胞質に出てアセチルCoAに変換されて脂肪酸合成に使用されます。
急激に増殖するがん細胞のミトコンドリアでは、通常の「時計回り」のTCA回路に加えて、逆の向きの「反時計回り」の還元的カルボキシル化という経路で脂肪酸合成が亢進しています。

図:がん細胞では、グルコース(①)とグルタミン(②)の取り込みが亢進し、解糖(③)の亢進により乳酸(④)の産生が増えている。グルタミンの還元的カルボキシル化によってクエン酸が増え、細胞質に移行して脂肪酸の合成が亢進している(⑤)。解糖系から派生するペントースリン酸回路などで核酸やアミノ酸などの物質合成が亢進している(⑥)。
【がん細胞は乳酸の産生が増えている】
非増殖細胞ではグルコースはミトコンドリアでTCA回路と酸化的リン酸化でATPが産生されます。
がん細胞ではグルコースの取込みと解糖系での代謝が亢進し、乳酸の産生が増えています。物質合成を亢進し、細胞増殖を促進します。
乳酸は組織を酸性化し、がん細胞の浸潤や血管新生を亢進し、免疫細胞の活性を低下させ、がん細胞の増殖や転移を促進します。

図:(上)非増殖細胞(正常細胞)では、グルコースは解糖系でピルビン酸に変換されたあと、ほとんどのピルビン酸はミトコンドリアに入り、TCA回路と酸化的リン酸化(OXPHOS)でATP産生に使われる(①)。酸化的リン酸化の過程で活性酸素が発生する(②)。細胞には活性酸素を消去する抗酸化システムが備わっている(③)。ATPが過剰に産生されると、フィードバック機序で解糖系の活性を抑制する(④)。
(下)がん細胞では、グルコースの取込みと解糖系での代謝が亢進し、グルコースの多くは細胞増殖のための物質合成に使われる(⑤)。ピルビン酸は乳酸生成に向けられ、ミトコンドリアへの移行は制限されている(⑥)。グルタミンはTCA回路に入り物質合成に利用される(⑦)。ミトコンドリアでの活性酸素の産生亢進による酸化ストレスは、がん細胞の増殖や転移を抑制する(⑧)。がん細胞では酸化ストレスを軽減するために抗酸化システムが亢進している(⑨)。がん細胞における抗酸化システムの亢進および抗酸化性サプリメントの摂取はがん細胞の増殖・転移を促進することになる。
嫌気性解糖でピルビン酸から乳酸に変換する乳酸脱水素酵素の量と活性が亢進しています。
なぜ、ピルビン酸で止まらないで乳酸に変換されるかというと、その理由は、解糖系で還元されたNADH(還元型ニコチンアミドジヌクレオチド)を酸化型のNAD+に戻すためです。NAD+が枯渇すると解糖系が進行しなくなります。
この反応によって、酸素が無い状況でもグルコースを分解してATPの産生を続けることができます。その結果、がん細胞では、酸素が無くても増殖でき、乳酸の産生が増えています。

図:1分子のグルコース(C6H12O6)が解糖系で2分子のピルビン酸(C3H4O3)に分解され(①)、この間に2分子のATPが産生される(②)。解糖系では脱水素酵素の働きで水素原子が外され、外された水素原子は水素イオンと電子に分かれ、補酵素であるNAD+(ニコチンアミドアデニンジヌクレオチド)と結合し、NADH + H+ になる(③)。ピルビン酸は乳酸脱水素酵素の働きでNADH + H+ の水素と結合して(④)乳酸(C3H6O3)に変化する(⑤)。つまり、乳酸発酵では1分子のグルコースから2分子の乳酸と2分子のATPが産生される。
がん細胞では、グルコースの取込みと解糖系での代謝が亢進し、乳酸の産生が増えています。
がん細胞ではピルビン酸のミトコンドリアへの取込みが阻害されており、さらにピルビン酸脱水素酵素の活性が阻害されているので、ピルビン酸からアセチルCoAへの変換が抑制されています。
一方、アミノ酸のグルタミンはTCA回路を利用してアミノ酸や脂肪酸の合成を増やしています。

図:がん細胞ではグルコースの取り込みと解糖が亢進し、乳酸の産生が増えている。ピルビン酸からアセチルCoAの変換が阻害されている。
【がん細胞は抗酸化システムを強化して酸化ストレスを軽減している】
正常細胞では、グルコースが解糖系で産生されたピルビン酸はミトコンドリアに取込まれて、TCA回路と酸化的リン酸化でATPが産生されます。
脂肪酸やケトン体もアセチルCoAに分解されてミトコンドリアで代謝されます。
ミトコンドリアでの酸素呼吸では活性酸素が産生されます。この活性酸素による酸化ストレスを軽減するために、細胞はグルタチオンやチオレドキシンやスーパーオキシドディスムターゼなどの抗酸化システムを持っています。
解糖系から派生するペントース・リン酸経路では、抗酸化システムに必要なNADPHを産生し、さらに、核酸などの合成に使われます。

図:正常細胞では、細胞内に取り込まれたグルコースは解糖でピルビン酸に変換され(①)、ミトコンドリアでピルビン酸はアセチルCoAに変換されて(②)TCA回路で代謝され、NADHとFADH2に捕捉された水素を使って呼吸鎖でATPを産生する(③)。脂肪酸やケトン体もアセチルCoAを産生してATP産生の原料となる(④)。呼吸鎖で活性酸素種が発生する(⑤)。細胞内には様々な抗酸化システムが存在し活性酸素種を消去している(⑥)。解糖系から派生するペントースリン酸経路(⑦)では核酸とNADPHが産生される。NADPHは活性酸素種を消去する時に利用される(⑧)。
一方、がん細胞では、グルコースの取込みと解糖系が亢進し、乳酸の産生が増えています。ペントース・リン酸経路も亢進してNADPHの産生や、核酸の合成が亢進しています。
ミトコンドリアでの酸化的リン酸化によるATP産生は抑制されていますが、ある程度のATP産生は行われており、活性酸素の産生が増えています。
がん細胞では呼吸鎖の異常などがあるため、正常細胞に比べてミトコンドリアでの酸素呼吸を増やすと活性酸素の産生が増え、酸化ストレスが亢進しやすい状況になっています。
脂肪酸やケトン体はミトコンドリアで代謝されるため、がん細胞が脂肪酸やケトン体を多く使うと酸化ストレスを高める結果になります。
酸化ストレスを軽減するため、NADPHの産生を増やし、グルタチオンやチオレドキシンなどの抗酸化システムの抗酸化力を高めています。

図:がん細胞はグルコースの取り込みと解糖とペントース・リン酸経路が亢進し、ミトコンドリアでの酸化的リン酸化は抑制されている。
がん細胞の解糖系を阻害し、ミトコンドリアでの酸化的リン酸化を亢進すると、がん細胞の酸化ストレスが亢進します。
解糖系やペントース・リン酸経路を阻害すると物質合成を阻害し、乳酸の産生が減ると、がん細胞の浸潤や転移が抑制できます。
さらにミトコンドリアでの酸素呼吸で活性酸素の産生が増え、酸化ストレスが亢進すると、がん細胞の増殖や転移が抑制されます。酸化ストレスはがん細胞にとって負荷になるためです。
そこで、がん細胞は抗酸化システムを亢進しています。したがって、抗酸化システムの阻害はがん細胞の酸化ストレスを亢進できます。
つまり、がん細胞の解糖系と抗酸化システムを阻害して、ミトコンドリアでの酸素呼吸を増やすと、がん細胞は酸化ストレスによって増殖が抑制されます。

図;がん細胞では、グルコースの取込みと解糖系での代謝が亢進し、グルコースの多くは細胞増殖のための物質合成に使われる(①)。ピルビン酸は乳酸生成に向けられ、ミトコンドリアへの移行は制限されている(②)。グルタミンはTCA回路に入り物質合成に利用される(③)。ミトコンドリアでの活性酸素の産生亢進による酸化ストレスは、がん細胞の増殖や転移を抑制する(④)。がん細胞では酸化ストレスを軽減するために抗酸化システムが亢進している(⑤)。乳酸はがん細胞の浸潤や血管新生を促進し、免疫を抑制する(⑥)。
したがって、ミトコンドリアの代謝と酸化的リン酸化を促進し、解糖系を阻害すると、がん細胞の物質合成を阻害し(⑦)、乳酸産生を低下するとがん細胞の浸潤や血管新生や免疫抑制を阻止できる(⑧)。さらに抗酸化システムを阻害すると(⑨)、がん細胞の酸化ストレスを亢進して、がん細胞の増殖・転移を阻害し、細胞死を誘導できる(⑩)。
解糖系は酸素を使わない代謝なので、活性酸素は産生しません。
一方、ミトコンドリアでの酸化的リン酸化は酸素呼吸であり、活性酸素の産生が増え、酸化ストレスが亢進します。
軽度の酸化ストレスはがん遺伝子を活性化し、細胞増殖や血管新生や転移を亢進します。
しかし、高度の酸化ストレスは細胞にダメージを与え、細胞周期の停止、細胞老化、細胞死を誘導します。
つまり、がん細胞の酸化的リン酸化を亢進して酸化ストレスを高めることは、がん細胞の増殖や転移を抑制し、細胞死を誘導することになります。
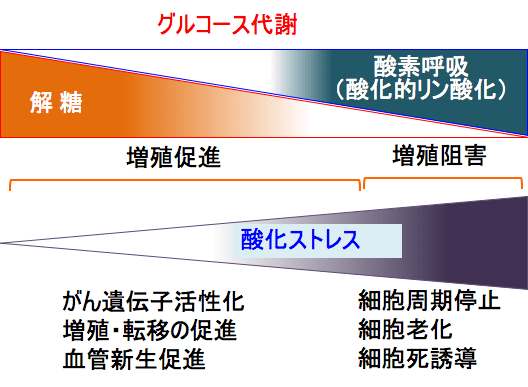
図:がん細胞ではミトコンドリアでの酸素呼吸(酸化的リン酸化)が抑制されている。酸素呼吸を亢進すると、酸化ストレスによって細胞増殖が停止し細胞死が誘導される
【絶食とケトン食はがん細胞のワールブルグ効果を是正し、酸化ストレスを高める】
ワールブルグ効果を是正するために解糖系を阻害して酸素呼吸を亢進すると、がん細胞は自滅します。その一つの方法として絶食(断食)があります。
断食はがん細胞のグルコースの利用を低下させ、ケトン体産生やオートファジーの亢進などによって抗腫瘍効果を発揮します。ただし、断食の長期間の実施は体重や体力や栄養状態を低下させるデメリットがあります。しかし、2〜3日程度の短期間の断食が抗がん剤や放射線治療の副作用を軽減し、抗腫瘍効果を高めることは人間でも証明されています。
絶食はがん細胞の解糖系とグルタミン代謝を抑制し、ミトコンドリアでの酸素呼吸を亢進し、活性酸素の産生を増やして酸化ストレスを高め、ATP産生を低下させる効果によってがん細胞にアポトーシスを誘導することが明らかになっています。

図:絶食(断食)はがん細胞におけるグルコースの取込み(①)と解糖系(②)とペントースリン酸経路(③)とグルタミン代謝(④)を抑制し、ミトコンドリアでの酸素呼吸(酸化的リン酸化)を亢進し(⑤)、活性酸素の産生を増やして酸化ストレスを高め(⑥)、ATP産生を抑制して細胞増殖を抑制し、アポトーシスを誘導する(⑦)。
絶食(Fasting)すると体脂肪が燃焼してケトン体が産生されます。ケトン体はβヒドロキシ酪酸とアセト酢酸とアセトンです。
ケトン食は、超低糖質で高脂肪食の食事で、絶食せずにケトン体の産生を増やす食事療法です。
絶食では体脂肪が燃焼してケトン体が産生されますが、ケトン食では、食事から摂取した脂肪を燃焼させます。糖質を極端に減らして、脂肪の多い食事をすると、絶食と同様にケトン体を産生できます。
ケトン食は難治性てんかんの治療法として100年以上前から行われている食事法です。
絶食するとてんかんを抑制できますが、絶食は体重を減らすので長期間実施することはできません。ケトン食は体重を減らさずに絶食と同じ効果が期待できます。

絶食すると、筋肉や肝臓のグリコーゲンは半日から1日程度で枯渇し、体脂肪から脂肪酸が遊離し、肝臓や腎臓などでケトン体が合成されます。
血糖は肝臓と腎臓における糖新生によって正常の下限域で維持されます。
ケトン体のβヒドロキシ酪酸やアセト酢酸の血中濃度は時間とともに増加し、特にβヒドロキシ酪酸は絶食後1週間程度で血糖より濃度が高くなります。
ケトン体は脳の神経細胞など多くの臓器の細胞のエネルギー源として利用されます。

図:肥満者に40日間の絶食を行った場合のβ-ヒドロキシ酪酸、アセト酢酸、グルコース、遊離脂肪酸の血中濃度の推移。(出典:N Eng J Med. 282: 668-675, 1970年)
絶食や低糖質食でグルコースの供給が無いと、TCA回路を回すために必要なオキサロ酢酸が欠乏し、脂肪酸の分解でできたアセチルCoAは肝臓でケトン体合成に利用されます。
グルコースが十分に供給されている条件では、脂肪酸が燃焼してもケトン体の合成は起こりません。
グルコースの供給が制限された条件で脂肪酸が燃焼するとケトン体が合成され、血中のケトン体濃度が上昇します。

図:TCA回路の最初のステップはアセチルCoAとオキサロ酢酸が結合してクエン酸になる反応で(①)、オキサロ酢酸はピルビン酸からできるので、グルコース(ブドウ糖)が枯渇した条件では、アセチルCoAはケトン体合成へ振り分けられる(②)。すなわち、肝臓では脂肪酸のβ酸化で産生されたアセチルCoAからアセト酢酸の合成が亢進する(③)。アセト酢酸は脱炭酸によってアセトンへ(④)、還元されてβヒドロキシ酪酸へと変換される(⑤)。このアセト酢酸、βヒドロキシ酪酸、アセトンの3つをケトン体と言う(⑥)。アセトンは呼気から排泄され、アセト酢酸とβ-ヒドロキシ酪酸は肝細胞から血液で他の組織や臓器に運ばれて、その細胞のミトコンドリアで代謝されてエネルギー源となる。
ケトン食は超低糖質で高脂肪の食事です。
オリーブオイル、ココナッツオイル、中鎖脂肪酸、ω3系不飽和脂肪酸の魚油、ナッツ類、アボカドなどの脂肪の多い食品を多く摂取します。肉や卵や魚などのたんぱく質も問題ありません。
糖質の少ない葉物野菜や食物繊維の多い海草類やキノコ類も多く摂取して構いません。
しかし、食後に血糖を高める糖質は極端に減らします。穀類、イモ類、根菜類、砂糖、甘い果物などは食べません。

食事から摂取した栄養素のうち、エネルギー源になるのは糖質と脂肪とたんぱく質です。
糖質は消化管でグルコースに分解されて吸収されます。
たんぱく質はアミノ酸に分解されて吸収され、肝臓でたんぱく質合成に利用されます。一部のアミノ酸はグルコースに変換されてエネルギー源になります。
脂肪は脂肪酸とグリセロールに分解され、グリセロールは糖新生でグルコースに変換されます。
脂肪酸はミトコンドリアで分解されてアセチルCoAになってエネルギー産生に使用されます。この際、グルコースの供給が少ないと、肝臓でケトン体合成に使用せれます。
正常細胞はグルコースもケトン体も利用できます。がん細胞はグルコースの利用が増えていますが、ケトン体の利用は制限されています。ミトコンドリアでの酸素呼吸を抑制しているからです。
ケトン体(特にβヒドロキシ酪酸)はがん細胞の増殖を抑制する作用が報告されています。

図:正常細胞はグルコースとケトン体を利用できる。がん細胞はグルコースの取り込みが亢進しているが、ケトン体はエネルギー源として利用できない。ケトン体はがん細胞の増殖を阻害する作用がある、
ケトン食はグルコースの取込みと解糖系とペントース・リン酸経路の代謝を阻害します。
脂肪酸やケトン体がミトコンドリアで代謝されると、活性酸素の発生が増えて、酸化ストレスが亢進します。
ペントース・リン酸経路の阻害と酸素呼吸の増加は酸化ストレスを亢進し、がん細胞の増殖を抑制し、細胞死(アポトーシス)を誘導します。

図:糖質摂取を極力減らし、脂肪の摂取を増やしてケトン体の産生を増やすケトン食は、グルコースの取込みや解糖系を抑制(=正常化)し(①)、ペントース・リン酸経路を阻害してNADPHの産生を低下させ、がん細胞内の活性酸素消去能を低下させる(②)。さらに、ケトン食の主要なエネルギー源となる脂肪酸とケトン体はミトコンドリアでアセチルCoAに変換されて代謝されるため、これらをエネルギー源として利用すると活性酸素の産生が亢進して酸化ストレスによるダメージを受けることになる(③)。つまり、ケトン食はがん細胞に対してエネルギー産生を抑制し、活性酸素の産生を高めて酸化ストレスを亢進する2つの機序によってがん細胞を自滅させることができる(④)。(参考:Redox Biology 2: 963-970, 2014年)
がんのケトン食では、抗腫瘍効果のあるω3系多価不飽和脂肪酸の多い、亜麻仁油、くるみ、魚油を多く摂取します。
ココナッツオイルや中鎖脂肪酸(MCTオイル)を多く摂取するとケトン体の産生を増やすことができます。その他、オリーブオイルも多く摂取します。

図:ココナッツオイルやMCTオイル(100%中鎖脂肪酸)の中鎖脂肪酸は糖質制限の条件下でケトン体(βヒドロキシ酪酸やアセト酢酸)を多く産生する。ω3系不飽和脂肪酸のドコサヘキサエン酸(DHA)とエイコサペンタエン酸(EPA)はレゾルビンやプロテクチンなどの抗炎症性の脂質メディエーターを産生する。ケトン体やDHA/EPA由来の抗炎症性メディエーターは抗炎症作用や抗がん作用を有する。さらに、ω3系多価不飽和脂肪酸自体に抗酸化作用があり、アラキドン酸と競合することによって抗炎症作用や抗がん作用を発揮する。がんのケトン食療法において、ω3系多価不飽和脂肪酸(αリノレン酸、DHA、EPA)と中鎖脂肪酸を多く摂取するメリットは大きい。
中鎖脂肪酸を100%含有する中鎖脂肪酸中性脂肪(MCTオイル)が販売されています。
MCTオイルは炭素数8個のカプリル酸(caprylic acid)と炭素数10個のカプリン酸(capric acid)が主体です。
ココナッツオイルは炭素数12個のラウリン酸(lauric acid)が主体です。
βヒドロキシ酪酸のサプリメントも販売されています。

長鎖脂肪酸中性脂肪(Long-chain Triglyceride)は小腸でリパーゼで分解されたあと、リンパ管経由で吸収されますが、中鎖脂肪酸中性脂肪(Medium-chain Triglyceride)はリパーゼで分解されたあと、門脈から吸収されて、すぐに肝臓で分解されてケトン体合成に使用されます。
長鎖脂肪酸はミトコンドリアに入るのにカルニチンが必要ですが、中鎖脂肪酸はカルニチンが不要です。肝臓で直ぐに分解されて3時間くらいで血中のケトン体が増えてきます。
長鎖脂肪酸は感染防御や免疫系に負荷がかかりますが中鎖脂肪は影響が少なく、また組織への蓄積傾向や臓器障害のもととなる脂質過酸化反応も少ないためより安全に摂取できます。

体内のケトン体が増えると尿中に排泄されます。尿中のケトン体の量を測定する試験紙が販売されています(アマゾンなどインターネットで購入できます)。尿中のケトン体の量で、体内のケトン体濃度を大まかに推定できます。
血中のケトン体を簡易に測定する機器もあります。指から少量の血液を採取してβヒドロキシ酪酸の濃度を測ります。通常では0.1〜0.2mM程度です。絶食すると1週間程度で5〜6mM程度に上昇します。

(1)血液中のグルコースとβヒドロキシ酪酸を測定できるフリースタイルプレシジョンネオ(アボット社)とその電極と、指から採血する穿刺用器具(テルモのメディセーフファインタッチ)。(2)穿刺用器具に専用の針をつけて、指に当ててボタンを押すと針が出て指の皮膚を穿刺する。(3)測定に必要な血液は1.5μLで径2mmくらいの血液が出れば十分。(4)電極はβヒドロキシ酪酸測定用とグルコース測定用が別に用意されており、写真はβヒドロキシ酪酸測定用電極。この電極の先端の白いエリアに血液をつけると電極に血液が吸収される。(5)10秒後に結果が表示される。写真は、2.3mM(mmol/L)のβヒドロキシ酪酸の血中濃度を示している。
【ケトン食+2-デオキシ-D-グルコース+ジクロロ酢酸+メトホルミンはがん細胞のワールブルグ効果を正常化する】
2-デオキシ-D-グルコース(2-DG)はグルコースの2位のOHがHになったグルコース類縁体です。
2−DGはヘキソキナーゼで2-DG-6リン酸に変換されたあと、それ以降の解糖系酵素で代謝されないので、細胞内に蓄積します。その結果、2-DG-6リン酸はフィードバックでヘキソキナーゼを阻害し、グルコースの代謝も阻害します。
また、2-DGは小胞体におけるたんぱく質の糖鎖結合(N-グリコシル化)を阻害して小胞体ストレスを引き起こします。これらの作用によって細胞死を誘導します。
2-DGは他の組織の代謝が低下する就寝時に服用すると、がん細胞に多く取込まれて、抗腫瘍効果を発揮します。
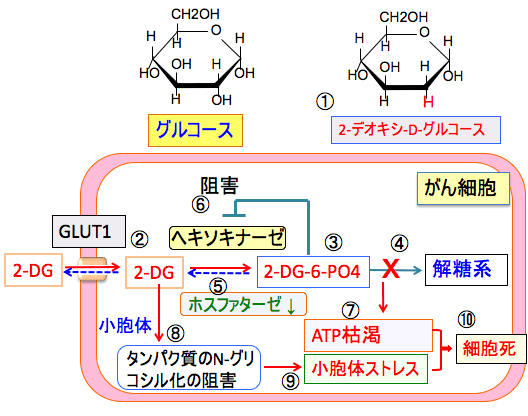
図:2-デオキシ-D-グルコース(2-DG)はグルコースの2位の水酸基(OH)が水素原子(H)に置換されたグルコース誘導体(①)で、グルコースと同様にグルコース・トランスポーター(GLUT1)によって細胞内に取り込まれる(②)。がん細胞はGLUT1の発現量が増え、グルコースと同時に2-DGも多く取り込む。2-DGはヘキソキナーゼで2-DG-6リン酸に変換されるが(③)、それ以上代謝されない(④)。がん細胞はフォスファターゼの活性が低いので(⑤)、2-DG-6-リン酸ががん細胞内に蓄積する。蓄積した2-DG-6-リン酸はヘキソキナーゼをフィードバック阻害する(⑥)ので、 2-DG-6-リン酸を取り込んだがん細胞はグルコースの解糖系での代謝が阻害される。その結果、がん細胞のエネルギー産生と物質合成は阻害され、ATPが枯渇する(⑦)。さらに、タンパク質のN-グリコシル化を阻害して(⑧)タンパク質の折り畳みの異常による小胞体ストレスを引き起こす(⑨)。ATP枯渇と物質合成阻害と小胞体ストレスはがん細胞の細胞死を誘導する(⑩)。
がん細胞ではHIF-1(低酸素誘導因子-1)の発現と活性が亢進しています。HIF-1はLDH(乳酸脱水素酵素)や解糖系の酵素の発現を亢進して、乳酸の産生を増やしています。
さらに、HIF-1はピルビン酸脱水素酵素キナーゼの発現を亢進します。ピルビン酸脱水素酵素キナーゼはピルビン酸脱水素酵素をリン酸化して活性を阻害します。
ピルビン酸脱水素酵素はピルビン酸をアセチルCoAに変換する酵素です。したがって、ピリビン酸脱水素酵素の阻害はミトコンドリアでの代謝を抑制します。
正常細胞では低酸素の状態にならないとHIF-1は活性化しませんが、がん細胞では低酸素でなくてもHIF-1は活性化しています。そのため、がん細胞ではピルビン酸脱水素酵素の活性が低下して、ミトコンドリアでの代謝が低下しています。

図:がん細胞ではグルコースの取り込みと解糖系が亢進している(①)。がん細胞では低酸素誘導因子-1(HIF-1)の活性が亢進し、HIF-1は乳酸脱水素酵素の発現と活性を亢進して乳酸産生を増やしている(②)。HIF-1はピルビン酸脱水素酵素キナーゼの発現と活性を亢進し(③)、ピルビン酸脱水素酵素キナーゼはピルビン酸脱水素酵素を阻害する(④)。その結果、ピルビン酸からアセチルCoAの変換が抑制され、ミトコンドリアでのエネルギー産生が抑制されている。
ミトコンドリアのTCA回路によりNADHやFADH2の形で捕捉された水素は,一連の酵素系(呼吸酵素複合体 I~IV)の連鎖を経て,最終受容体である酸素(O2)に渡されて水 H2Oになります。 複合体 I~IVの段階は,ミトコンドリア内膜のタンパク質や補酵素間で電子のやり取りが起こる過程であるため呼吸鎖や電子伝達系と呼ばれます。
ミトコンドリアの呼吸鎖や酸化的リン酸化の過程が阻害されると、活性酸素種の産生が増加します。メトホルミンは呼吸鎖の呼吸酵素複合体Iを阻害する作用があります。その結果、ミトコンドリアでの酸素呼吸で活性酸素の産生が増えます。

図:ミトコンドリアのTCA回路によりNADHやFADH2の形で捕捉された水素は,電子伝達系(呼吸鎖複合体 I~IV)によって、ミトコンドリア・マトリックスから膜間空間にプロトン(水素イオン)がくみ出され、ミトコンドリア内膜の内外に電気化学的ポテンシャル(プロトンによって生じる電荷の差)が作り出される。マトリックス側に戻るプロトンの駆動力を利用してATP合成酵素がADPと無機リン酸からATPを合成する。これを酸化的リン酸化と言う。メトホルミンは呼吸酵素複合体Iを阻害してミトコンドリアからの活性酸素の発生を増やす。
ジクロロ酢酸ナトリウムはピリビン酸脱水素酵素キナーゼを阻害する作用があります。その結果、ピルビンン酸脱水素酵素の活性を高め、ミトコンドリアでの酸素呼吸を増やし、活性酸素の産生を高めます。
メトホルミンは呼吸酵素複合体Iを阻害して、活性酸素の産生を高めます。
したがって、ジクロロ酢酸ナトリウムとメトホルミンの併用はがん細胞のミトコンドリアでの活性酸素の産生を高めます。
酸化ストレスが高度になれば、増殖抑制や細胞死が誘導されます。
また、乳酸の産生が抑制されると、がん細胞の浸潤や転移は抑制されます。
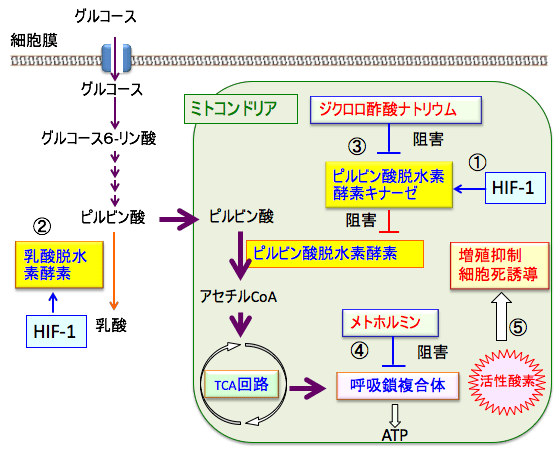
図:がん細胞では低酸素誘導因子-1(HIF-1)が恒常的に活性化しており、ピルビン酸脱水素酵素キナーゼ(①)と乳酸脱水素酵素(②)の活性が亢進して、解糖系が亢進し、ミトコンドリアでの酸素呼吸が抑制されている。ジクロロ酢酸はピルビン酸脱水素酵素キナーゼを阻害してピルビン酸脱水素酵素の活性を高めて、ミトコンドリアでの酸素呼吸を亢進する(③)。メトホルミンは呼吸酵素複合体Iを阻害してATP産生を阻害し、同時に活性酸素の産生を高める(④)。したがって、メトホルミンとジクロロ酢酸の併用は、がん細胞において活性酸素の産生を高めて、酸化ストレスを亢進し、細胞増殖を抑制し、細胞死を誘導する(⑤)。
2-デオキシ-D-グルコースは解糖系を阻害し、ジクロロ酢酸ナトリウムはピルビン酸脱水素酵素を活性化してピルビン酸からアセチルCoAへの変換を亢進して酸化的リン酸化を亢進します。
ケトン食はがん細胞の解糖系を阻害すると同時に、脂肪酸やケトン体はミトコンドリアでしか代謝できないため、酸化的リン酸化を亢進します。
酸素呼吸(酸化的リン酸化)は活性酸素の産生を増やし、酸化ストレスを亢進します。酸化ストレスの亢進はがん細胞に負担になるので、がん細胞の増殖を抑制し細胞死を誘導します。
メトホルミンは糖新生を阻害する作用があります。乳酸産生が亢進した状況でメトホルミンで糖新生を阻害すると乳酸アシドーシスを引き起こします。
2−デオキシ-D-グルコースやジクロロ酢酸ナトリウムやケトン食で解糖系を阻害し、ミトコンドリアでの代謝を亢進し、乳酸産生を阻止すれば、乳酸アシドーシスの発生を阻止できます。
ジクロロ酢酸ナトリウムは乳酸アシドーシスの治療に使用されています。
したがって、これらの組合せは、副作用を防ぎ、抗がん作用を相乗的に高めます。

図: がん細胞は解糖系が亢進して乳酸の産生が増えている(①)。乳酸によるアシドーシス(酸性血症)を防ぐため、肝臓で乳酸をグルコースに変換する。これをコリ回路という(②)。メトホルミンは糖新生を阻害するので、乳酸アシドーシスの副作用を起こしやすい(③)。ケトン食はグルコースの利用を阻害し、脂肪酸とケトン体はミトコンドリアの酸素呼吸(酸化的リン酸化)を亢進する(④)。2-デオキシ-D-グルコース(2-DG)はがん細胞の解糖系を阻害し(⑤)、ジクロロ酢酸ナトリウム(DCA)はピルビン酸脱水素酵素を活性化してピルビン酸からアセチルCoAへの変換を促進する(⑥)。その結果、2-DGとDCAはメトホルミンによる乳酸アシドーシスを防ぎ、活性酸素の産生を高めて酸化ストレスを亢進する(⑦)。これらは相乗効果で、がん細胞の増殖を抑制できる(⑧)。
ケトン食だけでは抗腫瘍効果は弱いのですが、2-デオキシグルコースとメトホルミンとジクロロ酢酸ナトリウムを併用すると、がん細胞の増殖を抑制できます。さらに抗酸化システムを阻害するジスルフィラムやオーラノフィンを併用すると、がん細胞を酸化ストレスで自滅できます。
抗がん剤や放射線治療ではがん細胞に酸化ストレスを高めて細胞死を誘導します。
がん細胞はチオレドキシンやグルタチオンなどの抗酸化システムを亢進して酸化ストレスによるダメージを軽減しています。
リュウマチ治療薬のオーラノフィンはチオレドキシン還元酵素(を阻害することによって、抗酸化力を低下させ、細胞内の活性酸素の産生を増やします。

図:放射線や多くの抗がん剤は活性酸素種を産生してがん細胞にダメージを与えて死滅させる(①)。がん細胞はチオレドキシン活性を高めて、活性酸素種によるダメージに抵抗性を示す(②)。オーラノフィンはチオレドキシン還元酵素の活性を阻害して、がん細胞の抗酸化力を減弱させる(③)。ケトン食や2-デオキシグルコースはペントースリン酸経路での還元剤のNADPHの産生を低下させる(④)。したがって、オーラノフィンとケトン食と2―デオキシグルコースの併用は放射線や抗がん剤の抗腫瘍効果を増強する。
酸化ストレスはがん細胞にとって負荷になります。したがって、酸化ストレスはがん細胞の増殖や浸潤や転移を抑制します。
がん細胞は抗酸化システムを増強して酸化ストレスを抑制しています。したがって、がん細胞の抗酸化システムを阻害すれば、がん細胞の増殖や転移を抑制できます。
ケトン食やオーラノフィンやジスルフラムはがん細胞の抗酸化システムを阻害する作用があります。 これらを組み合わせて、がん細胞の酸化ストレスを高めると、がん細胞の増殖や転移を抑制し、死滅させることができます。

図:酸化ストレスはがん細胞の増殖や浸潤・転移を阻害する(①②)。ジクロロ酢酸ナトリウムはピルビン酸脱水素酵素の活性を高め、ミコトンドリアでの酸素呼吸を亢進し、酸化ストレスを高めて、がん細胞の増殖や浸潤や転移を阻害する(③)。がん細胞はグルタチオンやチオレドキシンなどの抗酸化酵素の発現亢進などによって抗酸化力を高めて、酸化傷害から細胞を守ろうとしている(④)。ジクロロ酢酸、メトホルミン、2-デオキシ-D-グルコース、ケトン食、スリンダクなど活性酸素の産生を高める方法(③⑤)と、ジスルフィラムやオーラノフィンなど抗酸化力を弱める方法(⑥)を併用すると、がん細胞の増殖や浸潤・転移を抑制し、アポトーシスを誘導できる。
以上の治療法はトップの図にまとめています。
目標は、がん細胞の解糖系と抗酸化システムを阻害し、ミトコンドリアでの酸素呼吸を亢進して活性酸素の産生を高め、酸化ストレスを亢進して、がん細胞の増殖や転移を抑制し、死滅させることです。
ケトン食と2-デオキシ-D-グルコースは、がん細胞の解糖系やペントース・リン酸回路を阻害します。
ジクロロ酢酸はミトコンドリアでの代謝を促進します。ケトン食で脂肪酸やケトン体の利用が亢進すると、ミトコンドリアでの酸素呼吸を高めることになります。
メトホルミンは呼吸鎖を阻害して活性酸素の産生を高めます。
オーラノフィンやジスルフィラムは、グルタチオンやチオレドキシンによる抗酸化システムを阻害して酸化ストレスを亢進します。
これらの治療法を組み合わせると、がん細胞のエネルギー産生と物質合成を阻害し、さらに酸化ストレスを高めてがん細胞を死滅させることができます。(トップの図を参照)
以下の図も参照してください。

① グルコースが解糖系で代謝されてピルビン酸に変換された後、ピルビン酸脱水素酵素によってミトコンドリア内でアセチルCoAに変換される。
② アセチルCoAはミトコンドリア内でTCA回路と呼吸酵素複合体における酸化的リン酸化によってATPが産生される。
③ R体αリポ酸とビタミンB1はピルビン酸脱水素酵素の活性に必要な補因子。
④ ピルビン酸脱水素酵素はピルビン酸脱水素酵素キナーゼによってリン酸化されることによって活性が阻害されている。
⑤ ジクロロ酢酸ナトリウムはピルビン酸脱水素酵素キナーゼを阻害する作用があり、その結果ピルビン酸脱水素酵素を活性化する。
⑥ メトホルミンは呼吸酵素複合体Iを阻害してミトコンドリアでの活性酸素の産生を増やす。
⑦ 2-デオキシ-D-グルコースは解答系を阻害してATP産生と物質合成を阻害する。
⑧ 抗がん剤や放射線治療が最終的にがん細胞を死滅するときに活性酸素によって細胞死が誘導される。
したがって、抗がん剤治療や放射線治療を行うときに、2-デオキシ-D-グルコース、ジクロロ酢酸ナトリウム、R体αリポ酸、ビタミンB1、メトホルミンを併用すると、抗腫瘍効果を増強できる。
| « 710)がん幹細... | 712)筋萎縮性... » |



