がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
689)骨髄由来抑制細胞を抑制するがん治療
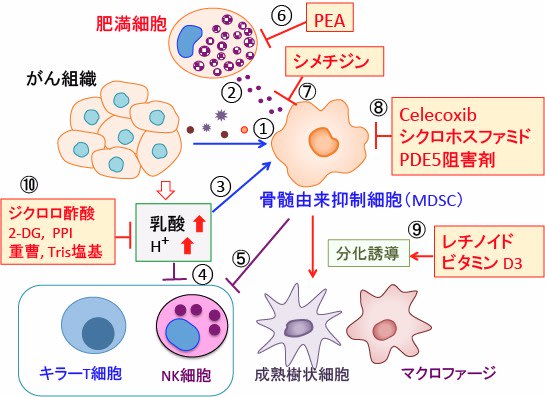
図:がん組織から産生される様々な因子が骨髄由来抑制細胞(MDSC)を動員し活性化する(①)。肥満細胞はヒスタミンなどのケミカルメディエーターを分泌してMDSCを活性化する(②)。がん組織から分泌される乳酸とプロトン(H+)はMDSCを活性化し(③)、がん細胞を攻撃するキラーT細胞やナチュラルキラー細胞(NK細胞)の働きを抑制する(④)。MDSCはキラーT細胞やNK細胞を抑制する(⑤)。PEA(パルミトイルエタノールアミド)は肥満細胞の活性を抑制する(⑥)。シメチジンはヒスタミンとヒスタミン受容体の結合を阻害してMDSCの働きを阻害する(⑦)。COX-2阻害剤のCelecoxibやシクロホスファミドやホスホジエステラーゼ5(PDE5)阻害剤(バイアグラ、シアリスなど)はMDSCの働きを抑制する(⑧)。レチノイドとビタミンD3はMDSCの細胞分化を誘導してMDSCの活性を阻害する(⑨)。ジクロロ酢酸、2-デオキシグルコース(2-DG)、プロトンポンプ阻害剤(PPI)はがん組織からの乳酸とプロトン(H+)の産生を抑制し、重曹やTris塩基はがん組織の酸性化を抑制する(⑩)。これらの組合せで骨髄由来抑制細胞の働きを阻害するとキラーT細胞やNK細胞によるがん細胞の排除を亢進できる。
689)骨髄由来抑制細胞を抑制するがん治療
【腫瘍組織内のNK細胞はがん細胞の増殖促進に加担している?】
マクロファージはがん細胞を排除する自然免疫と獲得免疫の中心で働いています。マクロファージはがん細胞や病原菌を貪食して排除することによって、正常組織を病原菌やがん細胞の攻撃から守る働きを担っていると考えられています。
しかし、がん組織に浸潤したマクロファージ(腫瘍関連マクロファージ)は、血管新生促進、増殖因子産生亢進、免疫抑制、転移促進などのさまざまな作用によりがん細胞の発生と悪性化を促進する働きをしていることが明らかになっています。(687話、688話参照)
自然免疫は先天的に備わった免疫で、微生物などに特有の分子パターンを認識して異物を攻撃します。マクロファージや好中球には細菌などの病原体に共通した情報を認識できる受容体を細胞表面に持っていて、病原体を認識して貪食します。
さらにマクロファージはナチュラルキラー細胞を活性化します。
ナチュラルキラー(natural killer)細胞(略してNK細胞)は、ターゲットの細胞を殺すのにT細胞と異なり事前に感作させておく必要が無いことから、生まれつき(natural)の細胞傷害性細胞(killer cell)という意味で名付けられました。
「感作」というのは、前もって抗原に対する認識能を高めておくことで、感作させておく必要がないというのは、初めて出あった細胞でも、直ちにその異常細胞を認識して攻撃できるということです。
ナチュラルキラー細胞(NK細胞)は、MHCクラスI分子が喪失した細胞(自己性を喪失した異常な細胞)を認識して攻撃します。
NK細胞の細胞質にはパーフォリンやグランザイムといった細胞傷害性のタンパク質をもち、これらを放出してターゲットの細胞を死滅させます。
したがって、NK細胞の活性を高めることはがん治療に有効と言えます。
しかし、腫瘍微小環境内では、NK細胞もがん細胞の増殖を促進していることが報告されています。
以下のような報告があります。
Natural Killer Cells as Key Players of Tumor Progression and Angiogenesis: Old and Novel Tools to Divert Their Pro-Tumor Activities into Potent Anti-Tumor Effects(腫瘍の進行と血管新生のキープレーヤーとしてのナチュラルキラー細胞:腫瘍促進活性を強力な抗腫瘍効果に転換するための古くて新しいツール)Cancers (Basel). 2019 Apr; 11(4): 461.
免疫細胞は、その可塑性の結果として、腫瘍微小環境内ではその表現型/機能が変化する可能性があります。実際に腫瘍組織内において、がん細胞を攻撃するはずの免疫細胞に、腫瘍細胞の標的化や殺傷能力の低下が起こっています。
ナチュラルキラー(NK)細胞は、腫瘍の免疫監視に関与するエフェクターリンパ球です。
固形悪性腫瘍では、末梢血における腫瘍関連NK細胞(tumor-associated NK cells :TANK cells)および腫瘍浸潤NK細胞(tumor-infiltrating NK cells:TINK)は表現型の変化を示し、抗腫瘍免疫の低下または細胞傷害性の低下が起こっています。
NK細胞は、腫瘍微小環境内では、抗腫瘍免疫を抑制し、血管新生の誘導によって腫瘍促進に関連することが報告されています。
以下のような報告もあります。
Myeloid Derived Suppressor Cells Interactions With Natural Killer Cells and Pro-angiogenic Activities: Roles in Tumor Progression(骨髄由来抑制細胞はナチュラルキラー細胞と相互作用して血管新生促進活性を示す:腫瘍進行における役割)Front Immunol. 2019; 10: 771.
骨髄由来抑制細胞はがん細胞に対する免疫応答を抑制し、がん細胞の増殖を促進する作用を持ちます。骨髄由来抑制細胞がNK細胞に作用して、血管新生を促進して、がん細胞の増殖を亢進することを報告しています。
つまり、がん組織の微小環境では、NK細胞までががんを増悪する作用を示す可能性があるということです。
【がん組織は免疫細胞の働きを抑制する微小環境を作っている】
免疫チェックポイント阻害剤を用いた免疫療法はがん細胞に特異的なT細胞の働きを活性化してがん細胞を死滅させる効果を増強します。しかし、全ての症例に効くわけではありません。むしろ効くのは一部です。
その理由としてもっとも重要なのが、免疫抑制性の微小環境の存在です。がん組織の微小環境がT細胞の働きを弱めているのです。
まず、がん細胞はグルコース(ブドウ糖)やアミノ酸の取り込みが亢進し、エネルギー産生と細胞分裂の材料に使っています。これらの栄養素は、リンパ球が増殖し、がん細胞を排除する働きを実行する上でも必要です。従って、がん組織ではT細胞が働くために必要な栄養素が枯渇しているのです。
さらに、がん細胞では解糖系でのグルコース(ブドウ糖)代謝の亢進で、乳酸の産生が亢進しています。がん細胞内に乳酸が蓄積すると細胞毒になるので、がん細胞は乳酸を細胞外に排出しています。従って、がん組織には乳酸が増え、その結果、がん細胞の周囲は酸性になっています。

図:がん細胞は解糖系によるグルコース代謝が亢進して乳酸と水素イオン(プロトン、H+)の産生量が増える(①)。細胞内の酸性化は細胞にとって障害になるので、細胞はV型ATPアーゼ(vacuolar ATPase)やモノカルボン酸トランスポーター(MCT)やNa+-H+ 交換輸送体1(Na+-H+ exchanger 1:NHE1)などの仕組みを使って、細胞内の乳酸や水素イオン(プロトン)を細胞外に排出する(②)。その結果、がん細胞の周囲はpHが低下してがん組織は酸性化している(③)。組織が酸性化すると、免疫細胞の働きが抑制され、血管新生が促進し、がん細胞の浸潤や転移も促進される(④)。
正常な細胞はpHが7.4というややアルカリ側でないと働くことができません。実際に、がん組織ではがん細胞外のpHが6.2〜6.9と酸性になっています。このような酸性の状態では、リンパ球は正常な働きができません。
組織が酸性になるとがん細胞を攻撃しにきた免疫細胞の働きが弱ります。
さらに乳酸には、がん細胞を攻撃する細胞傷害性T細胞の増殖や、免疫細胞の働きを高めるサイトカインの産生を抑制する作用があり、がんに対する免疫応答を低下させる作用もあります。
がん組織にはマクロファージなどの炎症細胞からプロスタグランジンE2(PGE2)の産生が増えています。PGE2は、免疫担当細胞(樹状細胞、リンパ球、NK細胞など)の働きを抑制します。
一方、PGE2は骨髄由来抑制細胞を動員しがん組織内で増えます。
骨髄由来抑制細胞(Myeloid-derived suppressor cells: MDSCs)は顆粒球のマーカーと単球/マクロファージのマーカーとを同時に発現している未熟な段階の骨髄由来細胞で、免疫反応を強力に抑制する働きを持っています。
骨髄由来抑制細胞はアルギナーゼや活性酸素、一酸化窒素、IL-10、TGF-βなどの産生を介して免疫担当細胞の活性を阻害したり、制御性T細胞(Treg)の誘導をきたすことによって免疫抑制作用を発揮します。制御性T細胞は免疫応答を抑制的に制御しているT細胞の一種です。
このように、がん組織は免疫細胞の働きを抑制するような微小環境を自ら作り出しており、がん細胞を攻撃する目的で免疫担当細胞ががん組織に入っていっても十分な働きができないようになっているのです。

左図:がん組織内ではシクロオキシゲナーゼ-2(COX-2)の発現と活性が亢進している(①)。COX-2はプロスタグランジンE2(PGE2)の産生を増やし、PGE2は免疫担当細胞(樹状細胞、リンパ球、NK細胞など)の働きを抑制する(②)。一方、PGE2は骨髄由来抑制細胞を動員しがん組織内で増える(③)。この骨髄由来抑制細胞は免疫担当細胞の働きを抑制する(④)。がん細胞は解糖系が亢進し、乳酸や水素イオン(H+)の産生が増え、がん組織は酸性化している(⑤)。組織の酸性化は、免疫担当細胞の働きを抑制するが、骨髄由来抑制細胞の働きは活性化する。したがって、PGE2の産生やがん組織の酸性化や骨髄由来抑制細胞の動員を阻止すれば、がん細胞を攻撃・排除する免疫担当細胞の働きを高めることができる。
右図:がん細胞はグルコースの取込みと解糖系が亢進し(⑥)、乳酸と水素イオン(プロトン)の産生が増え、細胞外に排出される(⑦)。細胞外に排出された乳酸と水素イオンはがん組織を酸性化し、Tリンパ球やNK細胞や樹状細胞などの免疫担当細胞の働きを阻害する(⑧)。一方、乳酸やプロトン(H+)の産生増加によってpHが低下し酸性になると骨髄由来抑制細胞が動員され活性が亢進する(⑨)。骨髄由来抑制細胞は制御性T細胞を誘導して免疫担当細胞の働きを阻害する(⑩)。
このような複数のメカニズムでがん組織内ではエフェクター細胞の働きは抑制され、がん細胞を排除できない環境になっている。
【重炭酸ナトリウムによるがん組織のアルカリ化は免疫療法の効き目を高める】
免疫療法として注目されているオプジーボやヤーボイや養子免疫療法のときに、重曹(重炭酸ナトリウム)治療を併用する価値はありそうです。以下のような報告があります。
Neutralization of Tumor Acidity Improves Antitumor Responses to Immunotherapy.(腫瘍組織の酸性度の中性化は免疫療法の抗腫瘍応答を改善する)Cancer Res. 2016 Mar 15;76(6):1381-90.
【要旨の抜粋】
免疫チェックポイント阻害剤や養子T細胞療法のようながんの免疫療法は、臨床効果を発揮する場合もあるが、まだ解明されていない抑制メカニズムの存在によって、その有効性は低い。
固形がんの微小環境は高度に酸性化している特徴があり、この環境が抗腫瘍免疫の効果を妨げている可能性がある。
この研究においては、免疫療法における腫瘍組織の酸性化の影響を検討した。
注目すべきことに、マウスにがん細胞を移植した実験系で、重炭酸ナトリウム治療で腫瘍の酸性度を中和すると、移植腫瘍の増殖が抑制され、この腫瘍組織内でTリンパ球の浸潤の増加が認められた。
さらに、抗CTLA-4抗体や抗PD1抗体による治療や養子T細胞療法に重炭酸治療を併用すると、多くの実験モデルにおいて抗腫瘍応答を増強し、いくつかの実験系ではがんが治癒した。
以上の結果から、pHをアルカリ化する緩衝剤を経口摂取することによって腫瘍組織内のpHを高めることは、免疫療法の効果を高めることができる。速やかに臨床で使用する価値がある。
重炭酸ナトリウム(sodium bicarbonate)は重炭酸ソーダ(略して重曹)や炭酸水素ナトリウム(sodium hydrogen carbonate)とも呼ばれます。
化学式は NaHCO3で表わされます。ナトリウムの炭酸水素塩です。
重炭酸ナトリウムは加熱によって二酸化炭素を発生する性質を利用してベーキングパウダーとして調理に使用されます。
水に重炭酸ナトリウムとクエン酸を混ぜると炭酸ガスが発生し炭酸水となるので、飲料の材料としても用いられれます。砂糖を加え「サイダー」にしたり、レモンを加え「レモンソーダ」にするということもできます。
医薬品としては、胃酸過多に対して制酸剤として使われたり、酸性血症(アシドーシス)の治療に使われています。過剰に摂取するとナトリウムの過剰摂取が問題になりますが、適切な量であれば、安全性の高い化合物です。
重炭酸ナトリウムは水素イオン(プロトン)と反応して、二酸化炭素(CO2)と水(H2O)になります。この反応を利用して、がん組織に多く蓄積している水素イオンを除去してがん組織の酸性化を阻止することができます。
このような重炭酸ナトリウム(重曹)を摂取するがん治療の有効性を示す報告が増えています。

図:重炭酸ナトリウムを経口摂取すると、血中に入った重炭酸イオン(HCO3-)ががん組織に蓄積している水素イオン(プロトン)と反応して二酸化炭素(CO2)と水(H2O)になり、二酸化炭素は呼気に排出され、水は血液に拡散する。この反応によってがん組織の酸性化を抑制できる。
がん組織の酸性化を改善する作用が重炭酸ナトリウムより強い緩衝液としてトリス塩基緩衝液があります。これを使うとがん組織における免疫応答をさらに強化できる可能性があります。(666話参照)
【がん組織には骨髄由来抑制細胞が増えている】
免疫抑制性の細胞は、免疫反応を適切な時期に終息させたり、自己のたんぱく質や食物に反応しないようにする働きがあります。もし異常に免疫系が活性化され続けたり、自己のたんぱく質と反応すると、自己免疫疾患やアレルギー性疾患を引き起こします。
つまり、免疫応答を実行する細胞が暴走しないように抑制性の細胞やサイトカインや伝達物質が存在し、それによって免疫系が正常に働くことができるのです。
免疫抑制のメカニズムの一つに骨髄由来抑制細胞(Myeloid derived suppressor cell: MDSC)があります。この細胞は顆粒球のマーカーと単球/マクロファージのマーカーとを同時に発現している未熟な段階の骨髄由来細胞で、免疫反応を強力に抑制する働きを持っています。
骨髄由来抑制細胞はアルギナーゼや活性酸素、一酸化窒素、IL-10、TGF-βなどの産生を介して免疫担当細胞の活性を阻害したり、制御性T細胞(Treg)の誘導をきたすことによって免疫抑制作用を発揮します。
正常な場合には、免疫系が過剰に働いて自らの体を攻撃してしまう自己免疫疾患にならないように、骨髄由来抑制細胞や制御性T細胞がブレーキをかけています。つまりこれらの免疫抑制細胞は、健康な人にとっては、むしろ良い働きを担っています。
一方、担がん(体内にがんがある)状態では、骨髄由来抑制細胞ががん病巣部位のみならず循環血中やリンパ組織(リンパ節や脾臓など)においても増加することが報告されています。
末梢血中の骨髄由来抑制細胞の数が多いと予後が悪いという報告もあります。
がん細胞は免疫抑制性の骨髄由来抑制細胞をがん組織内に動員させることによって、キラーT細胞やNK細胞からの攻撃を抑えていることが明らかになっています。
つまり、がん細胞を攻撃・排除しようとするナチュラルキラー細胞(NK細胞)や細胞傷害性T細胞(キラーT細胞)の働きが、がん組織内では骨髄由来抑制細胞の増加によって抑制されているのです。

図:腫瘍組織からプロスタグランジンE2、IL-6、TGF-β、VEGF、GM−CSFなどの因子が産生される(①)。これらの腫瘍由来因子は血流によって骨髄に達し(②)、骨髄の前駆細胞から骨髄由来抑制細胞(MDSC)の増殖を促進する(③)。腫瘍組織から産生されるケモカイン(CXCL1/2やCXCL12など)がMDSCを腫瘍組織に誘導して集める(④)。腫瘍組織に集まったMDSCは細胞傷害性T細胞(CD8+T細胞)やナチュラルキラー細胞(NK細胞)の働きを阻害して抗腫瘍免疫を抑制する(⑤)。MDSCは成熟した樹状細胞やマクロファージに分化させることもできる(⑥)。
【肥満細胞はヒスタミンによって骨髄由来抑制細胞の活性を増強する】
ヒスタミンが骨髄由来抑制細胞の活性を高めることが報告されています。
ヒスタミンは、炎症反応や胃酸分泌、アレルギー反応など様々な生理反応に関与しています。ヒスタミンは細胞表面にある受容体に結合することによって細胞にヒスタミンの刺激を伝えます。
ヒスタミンは主に肥満細胞から分泌されます。
肥満細胞(マスト細胞, mast cell)は全身の粘膜下組織や結合組織に存在する骨髄由来の細胞です。
肥満細胞の中にはヒスタミンや炎症性サイトカインなどの各種化学伝達物質を含む顆粒が多く存在し、膨れた形態が肥満を連想させるため肥満細胞という名称になっています。
肥満細胞は細胞表面にIgE受容体が存在し、これに抗原が結合したIgEを介して受容体の架橋が成立すると、それがトリガーとなって細胞膜酵素の活性化がうながされ、内容物である顆粒からヒスタミンなどが放出されます。これを脱顆粒と言います。
花粉症や蕁麻疹は抗原刺激による肥満細胞の脱顆粒によるヒスタミン放出によって発症します。
肥満細胞はこのような即時型アレルギー反応の中心となって働く細胞ですが、近年では、アレルギー以外の様々な免疫応答や炎症反応に関与することが明らかになっています。

図:肥満細胞(マスト細胞)は中身の詰まった顆粒を多数有しており、この顆粒の中にはヒスタミンなどの炎症性メディエーターが含まれている。肥満細胞はIgEに対する高親和性受容体を発現しており、抗原が結合したIgEを介して受容体が架橋することにより、肥満細胞が活性化され、「脱顆粒」と呼ばれるプロセスを経て、顆粒内部のヒスタミンをはじめとする炎症性メディエーターが遊離する。その結果、炎症や免疫応答などに関与する。
肥満細胞がヒスタミン分泌を介して骨髄由来抑制細胞の活性を高めることが報告されています。次のような論文があります。
Mast cell histamine promotes the immunoregulatory activity of myeloid-derived suppressor cells. (肥満細胞のヒスタミンは骨髄由来抑制細胞の免疫制御活性を促進する)Journal of Leukocyte Biology. 96(1):151-159. 2014年
骨髄由来抑制細胞(MDSC)の免疫応答の制御において、肥満細胞が重要な役割を担っています。肥満細胞の欠如はMDSC(骨髄由来抑制細胞)の移動や動員にも影響します。
この論文では、MDSCの移動と活性化には肥満細胞から分泌されるメディエーターのヒスタミンが重要な役割を担っていることを報告しています。
Mast cells boost myeloid-derived suppressor cell activity and contribute to the development of tumor-favoring microenvironment.(肥満細胞は骨髄由来抑制細胞の活性を高めて、がん細胞に都合の良い微小環境の形成に関与している)Cancer Immunol Res. 3(1):85-95. 2015年
この論文では、大腸がん患者の粘膜組織と担がんマウスの大腸と脾臓における、骨髄由来抑制細胞と肥満細胞との相互作用について検討しています。
肥満細胞は、インターフェロン-γと一酸化窒素の産生が関連するメカニズムで、脾臓由来の単球性骨髄由来抑制細胞の免疫抑制活性を亢進しました。
さらに、CD40とCD40リガンドを介した肥満細胞と骨髄由来抑制細胞の相互作用が、がん組織における炎症状態を亢進し、骨髄由来抑制細胞の動員とがん細胞の増殖を促進するメディエーターの産生を高めることに関与していることを示しています。
つまり、骨髄由来抑制細胞と肥満細胞の相互作用を阻止する方法は、骨髄由来抑制細胞による免疫抑制を阻止し、抗腫瘍免疫を活性化するうえで有効であると言っています。
多くのがん患者において、末梢血中のMDSC(骨髄由来抑制細胞)が増えており、MDSCの数が多いほど予後が悪いという報告があります。
上述の論文のように、肥満細胞からのヒスタミンがMDSCの移動や増殖を促進し、遺伝子発現に影響することが明らかになってきました。
炎症とがんの関連については、多くのメカニズムがありますが、肥満細胞と骨髄由来抑制細胞の相互作用も重要だということです。
肥満細胞の働きを阻害してヒスタミンの分泌を抑制したり、ヒスタミン受容体の阻害剤が骨髄由来抑制細胞の働きを抑制すると、抗腫瘍免疫を高める作用があるようです。
【パルミトイルエタノールアミドとシメチジンはMDSCの活性化を阻害する】
肥満細胞とそれから産生されるヒスタミンが骨髄由来抑制細胞(MDSC)を活性化することが、がん組織において抗腫瘍免疫が十分に作動しない理由の一つになっています。したがって、肥満細胞の働きを抑制したり、ヒスタミンの作用を阻害する治療法は、がん細胞に対する免疫的攻撃を増強できると言えます。
肥満細胞の働きを抑制する方法として、パルミトイルエタノールアミドがあります。
パルミトイルエタノールアミド(Palmitoylethanolaide; PEA)は炭素数16の脂肪酸のパルミチン酸にエタノールアミンが結合した体内成分で、古くから鎮痛作用や抗炎症作用が知られており、その作用機序として肥満細胞の脱顆粒を抑制して、抗炎症作用を示すことが報告されています。(440話参照)
ヒスタミン受容体拮抗薬のシメチジンには様々な抗腫瘍効果が報告されていますが、抗腫瘍免疫を高める作用があり、そのメカニズムの一つとして骨髄由来抑制細胞の抑制作用が報告されています。以下のような報告があります。
Cimetidine suppresses lung tumor growth in mice through proapoptosis of myeloid-derived suppressor cells.(シメチジンは骨髄由来抑制細胞のアポトーシスを誘導することによってマウスにおける肺がん細胞の増殖を抑制する)Mol Immunol. 54(1):74-83.2013年
この論文は、シメチジンはがん細胞の増殖を直接抑制する作用は無いが、骨髄由来抑制細胞のアポトーシスを誘導して抗腫瘍免疫を高める作用メカニズムによって、がん細胞の増殖を抑える効果があるという内容です。
生体内アミンであるヒスタミンは、炎症反応や胃酸分泌、アレルギー反応など様々な生理反応に関与しています。ヒスタミンは細胞表面にある受容体に結合することによって細胞にヒスタミンの刺激を伝えます。
ヒスタミンの受容体は現在までに 3 種類のサブタイプ(H1~H3)が見つかっていますが、そのうち H2 受容体は胃酸分泌において中心的な役割を担っており、その拮抗薬であるシメチジンは胃酸の分泌を抑える効果により胃炎や消化性潰瘍や逆流性食堂炎などの治療薬として使用されています。
1980 年代後半に デンマークのTonnesen らにより、シメチジンが胃がん患者に対し延命効果を示すことが報告され、その後、大腸がん、悪性黒色腫に対しても同様の効果を示すことが報告されています。
例えば、治癒切除術後5-FU(200mg/日)投与を受けている原発性大腸がん患者(シメチジン800mg/日併用群34例、非併用群30例の計64例)において、平均10.7年の観察期間での10年生存率は、シメチジン併用群で84.6%、シメチジン非併用群で49.8%でした(P<00001)。
切除手術を受けた大腸がん患者を対象にした臨床試験のメタ解析によると、シメチジンを服用することによって死亡リスクが0.53に低下すると報告されています。
ヒスタミンにはがん細胞の増殖を促進する作用や、細胞性免疫を抑制するリンパ球(骨髄由来抑制細胞や制御性T細胞)を活性化することなどが報告されており、そのためシメチジンの延命効果は、がん細胞に対するヒスタミンの細胞増殖促進作用を阻害する機序や、がん細胞に対する免疫力を活性化させる可能性などが指摘されています。
大腸がん細胞はヒスタミンを分泌し、がん組織の中のヒスタミンのレベルが高いことが報告されています。つまり、がん患者や手術後の病態における免疫抑制には、ヒスタミンが関与している可能性があり、H2ブロッカーによって、免疫力低下の機序を解除できる可能性が指摘されています。
さらに、シメチジンが接着因子 E-セレクチンの発現を抑制することによりがんの転移を抑制する抑える機序や、インターロイキン 12の発現上昇を介したナチュラルキラー細胞活性化、血管新生阻害作用によって腫瘍組織の増大を阻止する可能性、がん細胞にアポトーシス(細胞死)を誘導する作用など、新たなメカニズムも報告されています。
ラニチジンやファモチジンなど他のヒスタミンH2 受容体拮抗薬を用いた検討においては、それらがシメチジンと同等もしくはそれ以上に強力な薬理作用を有するにも関わらず、がん患者に対し同様の効果 が認められないという報告がなされています。
すなわちシメチジンの有する延命効果や腫瘍増殖抑制作用などは、そのH2受容体拮抗作用によるものではなくシメチジン特有のものである可能性も指摘されています。
シメチジンには、骨髄由来抑制細胞の抑制以外にも様々なメカニズムで抗腫瘍免疫を増強することが報告されています。
がん治療において、がん細胞に対する免疫応答を増強する目的でシメチジンを服用するエビデンスは高いと思います。極めて安価なので、進行がんの治療や再発予防に使用する価値はあると思います。
【COX-2阻害剤のセレコキシブは骨髄由来抑制細胞の働きを抑制する】
がん組織ではがん細胞やマクロファージが産生するシクロオキシゲナーゼ-2(COX-2)の活性亢進によってプロスタグランジンE2(PGE2)の産生が高まっています。
PGE2ががん組織に骨髄由来免疫抑制細胞を動員し、免疫担当細胞の働きを弱めることによって、免疫細胞の攻撃からがん細胞を守っていることが明らかになっています。
COX-2阻害剤のセレコキシブ(celecoxib)が骨髄由来抑制細胞の働きを阻害して、免疫療法の効き目を高めることが報告されています。以下のような報告があります。
COX-2 inhibition improves immunotherapy and is associated with decreased numbers of myeloid-derived suppressor cells in mesothelioma. Celecoxib influences MDSC function.(中皮腫において、COX-2阻害は、免疫療法の効果を高め骨髄由来抑制細胞の数の減少に関連する。 セレコキシブは骨髄由来抑制細胞の機能に影響を与える。) BMC Cancer. 2010 Aug 30;10:464. doi: 10.1186/1471-2407-10-464.
【要旨】
研究の背景:骨髄由来抑制細胞(MDSC)は、腫瘍組織に集積する不均一で未成熟な細胞集団である。これらの細胞は、腫瘍由来因子(例えば、プロスタグランジン)によって誘導され、免疫抑制において重要な役割を果たす。 MDSCは、アルギナーゼIの発現の増加および活性酸素種(ROS)および酸化窒素(NO)の産生を介して、T細胞およびNK細胞の機能を抑制する。
MDSCによる免疫抑制は、免疫療法に対する不応性の主な要因の1つである。
そこで、MDSCサブタイプによる活性酸素種産生に焦点を当て、特異的COX-2阻害によるプロスタグランジン合成を阻害することによって、MDSCの生体内免疫抑制機能が阻止できるかどうかを調べた。さらに、セレコキシブが免疫治療戦略の改良につながるかどうかを検討した。
方法:マウスの中皮腫移植腫瘍モデルにおいて、MDSCの数および機能を解析した。マウスに中皮腫腫瘍細胞を移植し、シクロオキシゲナーゼ-2(COX-2)阻害剤セレコキシブを、単独または樹状細胞ベースの免疫療法と組み合わせて投与した。
結果:がん細胞の増殖が起こる領域には、多数のMDSCが浸潤し、COX-2発現が亢進していた。セレコキシブは、in vitroおよびin vivoでプロスタグランジンE2レベルを低下させた。 担がんマウスにセレコキシブを経口投与すると、すべてのMDSCサブタイプの局所および全身の拡大を抑制した。
MDSCからの活性酸素種および一酸化窒素の産生低下およびT細胞寛容性の低下で示されたように、MDSCの機能は障害された。 その結果、免疫療法の効果を高めた。
結論:セレコキシブは樹状細胞ベースの免疫療法を改善する強力な治療法であり、MDSCの数および免疫抑制機能を抑制する。 これらのデータは、免疫療法を行なう時に、同時にシクロオキシゲナーゼ-2活性を阻害することが有用であることを示唆している。
つまり、COX-2阻害剤のセレコキシブは、がん細胞に対する免疫細胞の攻撃活性を高めることができるという報告です。
【低用量のシクロホスファミドは骨髄由来抑制細胞を阻害する】
シクロホスファミド(商品名:エンドキサン)はナイトロジェンマスタードの流れをくむアルキル化剤で、DNAをアルキル化してがん細胞(分裂している細胞)を死滅させます。
がん治療の場合は、1日100~200mgの服用で、自己免疫疾患の場合は1日50mg程度の低用量を服用します。
低用量の場合は、免疫細胞や炎症細胞の働きを抑制して炎症反応を抑える作用(抗炎症作用)によって自己免疫疾患を治療します。
シクロホスファミドの低用量投与ががんワクチンの効果を高めることが報告されています。以下のような報告があります。
Metronomic cyclophosphamide enhances HPV16E7 peptide vaccine induced antigen-specific and cytotoxic T-cell mediated antitumor immune response.(メトロノミック投与のシクロホスファミドはHPV16E7ペプチド・ワクチンで誘導した抗原特異的な細胞傷害性T細胞による抗腫瘍免疫を増強する)Oncoimmunology. 2014 Nov 14;3(8):e953407.
【要旨】
本研究では、ヒトパピローマウイルス(HPV16)で誘導した腫瘍モデルにおけるHPV16E7をターゲットにしたペプチドワクチンとメトロノミックなシクロホスファミド投与との併用の効果を検討した。
C3 腫瘍を移植したマウスに隔週でシクロホスファミドのメトロノミック投与を行い、HPV16E749-57ペプチド抗原を含むDepoVaxワクチンを3週ごとに投与した。
ワクチンとシクロホスファミドの併用群で腫瘍増殖の顕著な抑制を認めた。
メトロノミックなシクロホスファミド投与はリンパ節のリンパ球を顕著に減らす作用を示したが、ワクチンで誘導される抗原特異的なCD8+T細胞(キラーT細胞)の増殖は抑制しなかった。
ワクチンとメトロノミックなシクロホスファミド投与を受けたマウスの脾臓のリンパ球は腫瘍細胞を死滅させる活性を亢進していた。
この抗腫瘍活性は、ワクチンとメトロノミックなシクロホスファミド投与を受けた腫瘍を移植したマウスから採取したCD8+キラーT細胞によって、別のマウスに移行できた。
腫瘍を移植したマウスの実験系で、メトロノミックなシクロホスファミドは免疫機能が正常なマウスでは抗腫瘍効果を示し、免疫不全マウス(ヌードマウス)で抗腫瘍効果が認められなかったという実験結果が報告されています。
これは、シクロホスファミドを低用量で用いた場合の抗腫瘍効果は、がん細胞に対する直接的な作用や血管新生阻害作用とは関係なく、免疫細胞による作用であることを示唆しています。
腫瘍組織には制御性T細胞(Treg)や骨髄由来抑制細胞(MDSC)が増えており、これらの細胞がCD8陽性のキラーT細胞(細胞傷害性T細胞)の働きを阻害するので、がんワクチンを使ってがん抗原特異的なキラーT細胞が増えても、がん細胞を死滅させることができません。
そこで、TregやMDSCを減らす方法が抗腫瘍免疫を高める上で大切になってきます。
シクロホスファミドは投与量が多いと、キラーT細胞やナチュラルキラー(NK)細胞などエフェクター細胞も抑制されますが、適度な量だとキラーT細胞やNK細胞は抑制せず、制御性T細胞や骨髄由来抑制細胞の働きを抑制して、抗腫瘍免疫を高めることができます。
ただ、この「適度な量」というのが問題です。
自己免疫疾患の治療で使われる量は細胞傷害性T細胞の活性を抑制する量であるため、それよりも少ない量が良いのかもしれません。
【低用量のシクロホスファスファミド単独で大きな腫瘍が消滅する】
低用量のシクロホスファミドの間歇的投与が、抗腫瘍免疫を活性化して、大きな腫瘍を消滅できるという実験結果も報告されています。以下のような報告があります。
Metronomic cyclophosphamide eradicates large implanted GL261 gliomas by activating antitumor Cd8+ T-cell responses and immune memory.(シクロホスファミドのメトロノミック投与は、抗腫瘍性のCD8陽性T細胞応答と免疫記憶を活性化することによって、大きなGL261グリオーマ移植腫瘍を消滅させる)Oncoimmunology. 2015 Feb 18;4(4):e1005521. eCollection 2015.
【要旨の抜粋】
免疫系が正常なマウスにGL261グリオーマ細胞を移植した実験系を用い、6日おきのシクロホスファミドのメトロノミック投与の効果を検討した。
シクロホスファミドの6日おきのメトロノミック投与の2サイクルの治療で、腫瘍細胞特異的なCD8陽性細胞傷害性T細胞(CTL)とナチュラルキラー(NK)細胞、マクロファージ、その他の免疫細胞を増やし、活性化した。
このようなCTLやNK細胞といったエフェクター細胞はシクロホスファミド投与の6日後にピークになりその後減少した。制御性T細胞の数はCTLやNK細胞と逆の動きを示した。
間歇的なシクロホスファミドを数回繰り返すことによって腫瘍は縮小し、消滅した。
腫瘍の消滅にはCD8陽性キラーT細胞(CTL)が必要であった。GL261細胞の再移植に対して、末梢血中のCTLの増加と腫瘍組織でのCTLの浸潤が認められ、抗原特異的な免疫記憶が成立していた。
以上の結果から、抗がん剤のシクロホスファミドの単独の投与でも、その投与量と投与スケジュールを適切化すれば、大きな腫瘍を縮小させ、さらに消滅させ、免疫記憶を成立させることも可能であることが示された。
この研究グループは、がん抗原特異的なキラーT細胞の活性化と移植腫瘍の縮小に、シクロホスファミドの間歇的な投薬スケジュールが有効だと報告しています。
シクロホスファミドで死滅すると免疫細胞が認識しやすい免疫原性細胞死を誘導します。
高用量だと、免疫原性細胞死を誘導しますが、免疫系も抑制されます。また、がん組織がダメージを受けると血管新生が促進され、がん組織の増大を招く場合もあります。
一方、低用量のメトロノミック投与の場合、免疫原性細胞死は起こりにくいのですが、血管新生が起こらず、骨髄由来抑制細胞(MDSC)と制御性T細胞(Treg)の活性は抑制され、細胞傷害性T細胞(CTL)やナチュラルキラー(NK)細胞は抑制されないので、抗原特異的な抗腫瘍免疫を活性化することができます。
つまり、シクロホスファミドの低用量のメトロノミック投与は、最大耐用量を投与する通常の抗がん剤治療とは異なるメカニズムで腫瘍縮小効果を発揮します。
しかも、免疫記憶が成立するので、再発を予防できることになります。
低用量頻回(メトロノミック)あるいは間歇的なシクロホスファミド投与と、樹状細胞の活性化による自然免疫の発動(イミキモド、ピドチモド)と、抗原特異的な細胞傷害性T細胞の活性化をサポートする方法(COX-2阻害剤、シメチジン、漢方薬など)を組み合わせると、免疫機序での腫瘍の排除ができるかもしれません。
この場合、シクロホスファミドは自己免疫疾患の治療に使用する量(50mg/日)を週に1回服用するくらいが良いと思われます。
【ホスホジエステラーゼ5阻害剤は骨髄由来抑制細胞を阻害する】
勃起不全治療薬のバイアグラやシアリスといったホスホジエステラーゼ5阻害剤は抗腫瘍免疫を増強することが報告されています。以下のような報告があります。
Phosphodiesterase-5 inhibition reduces postoperative metastatic disease by targeting surgery-induced myeloid derived suppressor cell-dependent inhibition of Natural Killer cell cytotoxicity.(ホスホジエステラーゼ-5阻害は、外科手術によって誘導される骨髄由来抑制細胞依存性のメカニズムによるナチュラルキラー細胞の細胞傷害活性の阻害を標的化することによって手術後の転移を減少する)Oncoimmunology. 2018 Mar 1;7(6):e1431082.
この研究では、マウスの実験モデルを使って、外科手術によって骨髄由来抑制細胞(MDSC)が誘導され、ナチュラルキラー(NK)細胞機能の低下を引き起こすことを示しています。そして、手術前後のホスホジエステラーゼ5(PDE5)阻害剤のシルデナフィル(バイアグラ)の投与は、アルギナーゼ1とIL4Raの発現および活性酸素種の産生を抑制することによって、手術で誘発された顆粒球性の骨髄由来抑制細胞の機能を減少させ、NK細胞の抗腫瘍活性を高め、手術後の再発を減少させることを報告しています。
つまり、PDE5阻害剤が手術誘発性の骨髄由来抑制細胞の働きを阻害することにより手術後の転移や再発を減少させることを示唆しています。
Tadalafil Augments Tumor Specific Immunity in Patients with Head and Neck Squamous Cell Carcinoma(タダラフィルは頭頚部扁平上皮がん患者における腫瘍特異的免疫を増強する)Clin Cancer Res; 21(1); 30–38.
頭頚部扁平上皮がん患者の免疫機能に対するホスホジエステラーゼ5(PDE5)阻害の生体内(in vivo)での効果を測定するために、無作為化前向き二重盲検プラセボ対照第II相臨床試験を行った報告です。
タダラフィル(シアリス)は免疫応答を増強し、ex vivoにおけるT細胞の増殖は、対照患者が1.1倍に対してタダラフィル投与群は2.4倍に増加させました。末梢MDSC数は、コントロール群が1.26倍の変化に対してタダラフィル投与群は0.81倍の変化で有意に減少させました。頭頚部扁平上皮がん細胞の細胞溶解物に対する腫瘍特異的免疫応答はタダラフィル投与患者において増強されました。
この論文の結論は「これらの試験結果は、タダラフィルが頭頚部扁平上皮がん患者の一般的および腫瘍特異的免疫を増強し、頭頚部扁平上皮がんの治療における有効性を示唆している。がん細胞の免疫監視機構からの回避、および全身および腫瘍特異的免疫の抑制は、頭頚部扁平上皮がん発症の重要な特徴である。この研究は、PDE5阻害剤であるタダラフィルが頭頚部扁平上皮がん患者の腫瘍特異的免疫抑制を阻止し、治療に適用可能であることを示している。」となっています。
ホスホジエステラーゼ5(PDE5)阻害剤の免疫調整作用とがんとの関連が最初に指摘されたのは2006年です。
Phosphodiesterase-5 inhibition augments endogenous antitumor immunity by reducing myeloid-derived suppressor cell function(ホスホジエステラーゼ5阻害剤は骨髄由来抑制細胞の機能を低下させることによって生体内の抗腫瘍免疫を増強する)J Exp Med. 2006 Nov 27; 203(12): 2691–2702.
腫瘍組織内のキラーT細胞が数が多いほど、がん患者の生存期間が長いという報告がありますが、骨髄由来抑制細胞はキラーT細胞の数と働きを低下させます。
シルデナフィル(バイアグラ)やタダラフィル(シアリス)は骨髄由来抑制細胞の働きを抑制して、免疫監視機構を正常化します。
骨髄由来抑制細胞はがん細胞由来のGM-CSFやVEGFやIL6によって誘導され、アルギナーゼ-1(arginase-1)と誘導性一酸化窒素合成酵素の産生を亢進してT細胞機能を抑制します。ホスホキエステラーゼ5阻害剤は一酸化窒素とアルギナーゼ-1の両方の産生を阻害してT細胞機能を正常化します。
【レチノイドとビタミンDによる骨髄由来抑制細胞の分化誘導療法】
オールトランス・レチノイン酸(All-trans retinoic acid:ATRA)はビタミンA誘導体で核内受容体のレチノイン酸受容体やレチノイドX受容体に作用して遺伝子発現を誘導します。
ATRAが骨髄球の分化を誘導することはよく知られています。ATRAがMDSCの分化を誘導して成熟させ、免疫抑制活性を低下させることが報告されています。
以下のような報告があります
All-trans-retinoic acid eliminates immature myeloid cells from tumor-bearing mice and improves the effect of vaccination.(オールトランス・レチノイン酸は担がんマウスの未熟な骨髄細胞を除去してワクチンの効果が高める)Cancer Res. 63(15):4441-9.2003年
【要旨】
がん組織による免疫抑制においては、未熟な骨髄細胞が重要な役割を果たしている。これらの未熟骨髄由来抑制細胞は担がんマウスにおいて増加し、様々なメカニズムでT細胞の機能を阻害する。
本研究では、抗腫瘍効果を高める目的で、骨髄由来抑制細胞を除去する実験を行った。
担がんマウスにオールトランス・レチノイン酸(all-trans-retinoic acid ;ATRA)を投与すると、全ての実験モデルにおいて腫瘍内の骨髄由来抑制細胞を減少することが示された。
この作用はATRAの直接的な殺細胞作用やがん細胞からの増殖因子の産生抑制とは関係なかった。
ATRAは未熟な骨髄由来抑制細胞を成熟樹状細胞やマクロファージや顆粒球に分化誘導した。
担がんマウスにおいて骨髄由来抑制細胞が除去されるとT細胞による腫瘍特異的な免疫応答が改善した。
2種類の異なるがんワクチンの実験モデルで、ATRAを併用すると、抗腫瘍免疫の効果が顕著に増強した。
以上の結果から、ATRAを使った未熟な骨髄由来抑制細胞を分化誘導によって除去する方法は、がんワクチンの治療効果を高める方法として役立つ可能性が示された。
以下のような報告があります。
Targeting myeloid-derived suppressor cells using all-trans retinoic acid in melanoma patients treated with Ipilimumab. (イピリムマブで治療したメラノーマ患者におけるオールトランスレチノイン酸を用いた骨髄由来抑制細胞の標的化)Int Immunopharmacol. 2018 Oct;63:282-291.
【要旨の抜粋】
メラノーマにおける免疫療法の有効性を制限する腫瘍関連メカニズムの一つは、骨髄由来抑制細胞(myeloid-derived suppressor cells :MDSC)の動員および増殖である。 したがって、免疫療法と組み合わせて骨髄由来抑制細胞を標的とすることは、奏効率および有効性を改善する魅力的な戦略である。
進行性黒色腫患者を対象にして、イピリムマブ単剤またはイピリムマブ+オールトランスレチノイン酸(ATRA)による治療法を比較する無作為化第II相臨床試験を実施した。
混合リンパ球反応によるin vitroの実験系で、ATRAはMDSCの免疫抑制機能を低下させることを示した。
さらに、ATRAは、MDSCによるPD-L1、IL-10、およびインドールアミン2,3ジオキシゲナーゼ(indoleamine 2,3‑dioxygenase)を含む免疫抑制遺伝子の発現を減少させた。
さらに、ATRAはグレード3または4の有害事象の頻度を増加させなかったため、イピリブマブを使った標準的治療にATRAを併用する上での安全性には問題ないと思われた。
進行黒色腫患者におけるイピリムマブ単独の治療と比較して、イピリムマブ+ATRA併用治療は、循環するMDSCの頻度を有意に減少させた。
イピリムマブ(Ipilimumab)はCTLA-4を標的としたモノクローナル抗体で、商品名はヤーボイです。
細胞傷害性T細胞(CTL)はがん細胞を認識し破壊する能力を持ちますが、それを抑制するメカニズムが存在します。イピリムマブはそのメカニズムを解除して、CTLの機能を発揮させます。CTLA-4は細胞傷害性T細胞の働きを抑制するスイッチのようなもので、がん細胞がCTLA-4のスイッチを入れるタンパク質を持っていて、CTLの働きを阻止しています。抗CTLA-4抗体はCTLA-4のスイッチが入らないようにして、CTLの働きを増強します。
担がんマウスにオールトランス・レチノイン酸(ATRA)を投与するとMDSCは成熟した樹状細胞、好中球、単球に分化し、CTLによる免疫応答を増強できることが報告されています。
マウスの複数の実験モデルで、ATRAがワクチン治療の効果を高めることが報告されています。
移植腫瘍を使ったがんワクチンの実験でも、ATRAを投与すると腫瘍増殖の抑制効果が増強することが報告されています。
がんワクチンや抗がん剤治療との併用におけるATRAの効果に関する臨床試験が行われています。
ATRAの代わりにニキビの治療薬のイソトレチノインも同様の効果が期待できます。(370話参照)
イソトレチノインは体内でATRAに変換されて遺伝子発現に作用するプロドラッグです。
また、ビタミンD3も骨髄細胞の成熟を促進することが報告されています。
ビタミンD3とレチノイドは未熟な骨髄由来細胞の成熟を促進し、抗腫瘍免疫を高めることが報告されています。
例えば、頭頚部扁平上皮がん患者を対象にした臨床試験で、1日60μgのビタミンD3の投与によって骨髄細胞のHLA-DRの発現が亢進し、血中のIL-12とIFN-γの濃度が増加したという報告があります。
MDSCはマクロファージからのIL-12産生を抑制し、IL-10の産生を亢進し、Th1免疫を抑制します。
以上のように、シメチジン、パルミトイルエタノールアミド、celecoxib、低用量のシクロホスファミド、レチノイド、ビタミンD3は骨髄由来抑制細胞の働きを抑制して抗腫瘍免疫を高めることができます。(トップの図)
「腫瘍組織における免疫抑制性の微小環境(TumorImmunosuppressive Microenvironment)」を改善する治療法は、がんの免疫療法の効果を高めることができます。
さらに、自然免疫や獲得免疫を刺激し活性化するピドチモド、ピシバニール、漢方薬などを併用すると、免疫力によってがん組織を縮小することもできます。

図:①ピドチモドは樹状細胞の成熟とIL-12産生を促進して1型ヘルパーT細胞(Th1)を増やす。②ピシバニールもIL-12の産生を高め樹状細胞の成熟を促進する。③プロスタグランジンE2(PGE2)はIL-12の産生を抑制して2型ヘルパーT細胞(Th2)への分化を誘導するので、COX-2阻害剤のCelecoxibはPGE2の産生を阻害してTh2への分化誘導を阻止する。④PGE2は骨髄由来抑制細胞(MDSC)の増殖を促進するので、CelecoxibはMDSCの増殖を阻止する。⑤漢方薬(紅参、黄耆、川芎など)はTh1サイトカインの産生を高めて細胞性免疫を活性化する。⑥シメチジンとシクロフォスファミドはMDSCの活性や生存を阻害する。⑦レチノイドとビタミンD3は未熟なMDSCを成熟させ分化誘導によって免疫抑制活性を低下させる。
以上のような方法を組み合せて骨髄由来抑制細胞の働きを抑制し、樹状細胞やナチュラルキラー細胞や抗原特異的キラーT細胞の活性を高めて、抗腫瘍免疫を積極的に高める治療法を併用するとより効果が期待できそうに思います。例えば次のような治療法が考えられます。
1)シクロフォスファミドを低用量(50mg/日または週3~4回)投与してがん細胞に免疫原性細胞死を誘導する。低用量のシクロフォスファミドは血管新生を抑制する作用もある。
2)免疫原性細胞死を促進するため、2−デオキシ-D-グルコース(2-DG)を内服する(体重1kg当たり1日40~60mg)
3)IL-12の産生を増やし、樹状細胞の成熟を促進するためにピドチモドを1日400~800mgを服用。
4)ナイーブヘルパーT細胞のTh1への分化を抑制し、骨髄由来抑制細胞を誘導するプロスタグランジンE2の産生を抑制するCOX-2阻害剤のセレコックスを1日200~400mg服用(朝と夕の食後)
5)骨髄由来抑制細胞を抑制し、抗腫瘍免疫を増強するシメチジンを1日800mg服用する。
6)T細胞からTh1サイトカイン産生を増やし、キラーT細胞やナチュラルキラー細胞の働きを高める漢方薬(特に紅参、黄耆、川芎などを多く使用)を服用する。
7)さらに、オプションとして骨髄由来抑制細胞を分化誘導して抑制活性を減らすレチノイド(イソトレチノイン 10~20mg/日)とビタミンD3(2000~4000 IU/日)を併用する。
| « 689)骨髄由来... | 690)新型コロ... » |



