がんの予防や治療における漢方治療の存在意義を考察しています。がん治療に役立つ情報も紹介しています。
「漢方がん治療」を考える
854)ケトン体療法(その4):ミトコンドリアを活性化するとケトン体生成が増える

図:絶食とケトン食(①)はPPARα(ペルオキシソーム増殖因子活性化受容体α)を活性化してFGF21の発現を亢進する(②)。FGF21はLKB1を活性し(③)、LKB1はAMPK(AMP活性化プロテインキナーゼ)を活性化(④)、AMPKはサーチュイン1(Sirtuin1)を活性化する(⑤)。サーチュイン1はPGC-1αを活性化し(⑥)、PGC-1αはミトコンドリア新生を亢進し、脂肪酸β酸化を亢進し(⑦)、ケトン体合成を高める(⑧)。PPARαアゴニストのフェノフィブラート、ベザフィブラートはPPARαを活性化してケトン体合成を亢進する(⑨)。水素ガスはFGF21を活性化する(⑩)。メトホルミン、ビタミンD3はAMPKを活性化する(⑪)。NAD前駆体のNMN(ニコチンアミド・モノヌクレオチド)とNR(ニコチンアミド・リボシド)はサーチュイン1を活性化する(⑫)。ケトン食にこれらを組み合わせれば内因性ケトーシスを高めることができる。
854)ケトン体療法(その4):ミトコンドリアを活性化するとケトン体生成が増える
【絶食やカロリー制限はサーチュインを活性化する】
体内のエネルギー不足を感知するメカニズムとしてAMP/ATP比の上昇によって活性化されるAMP活性化プロテインキナーゼの他に、NAD+/NADH比の上昇を感知して活性化されるサーチュインがあります。
ミトコンドリアのTCA回路によりNADHやFADH2の形で捕捉された水素は、ミトコンドリアのクリステに存在する一連の酵素系(呼吸鎖複合体 I~IV)とATP合成酵素(呼吸鎖複合体Vとも言う)の連鎖を経て、最終受容体である酸素(O2)に渡されて水 H2Oになります。 複合体 I~IVの段階は、ミトコンドリア内膜のタンパク質や補酵素間で電子のやり取りが起こる過程であるため電子伝達系(呼吸鎖)と呼ばれます。
電子伝達系によってミトコンドリアマトリックスから膜間空間にプロトン(水素イオン)がくみ出され、輸送されたプロトンによってミトコンドリア内膜の内外にΔΨと呼ばれる電気化学的ポテンシャル(プロトンによって生じるpH差および電荷の差)が作り出されます。マトリックス側に戻るプロトンの駆動力を利用してATP合成酵素がADPと無機リン酸からATPを合成します。これを酸化的リン酸化と言います。

図:ミトコンドリアのTCA回路によりNADHやFADH2の形で捕捉された水素は,電子伝達系(呼吸鎖複合体 I~IV)によって、ミトコンドリア・マトリックスから膜間空間にプロトン(水素イオン)がくみ出され、ミトコンドリア内膜の内外に電気化学的ポテンシャル(プロトンによって生じる電荷の差)が作り出される。マトリックス側に戻るプロトンの駆動力を利用してATP合成酵素がADPと無機リン酸からATPを合成する。これを酸化的リン酸化と言う。
グルコース(ブドウ糖)や脂肪酸の分解によって産生したアセチルCoAがTCA回路(クエン酸回路)で段階的に代謝される過程で、エネルギーの元になる電子が発生し、NADH(還元型ニコチンアミドアデニンジヌクレオチド)とFADH2(還元型フラビンアデニンジヌクレオチド)として捕捉されます。
このTCA回路ではATPは1分子も生成されませんが、TCA回路で生成されたNADHとFADH2は、ミトコンドリア内膜に埋め込まれた酵素複合体に電子を渡し、この電子は最終的に酸素に渡され、まわりにある水素イオンと結合して水を生成します。
このようにTCA回路で産生されたNADHやFADH2の持っている高エネルギー電子をATPに変換する一連の過程を酸化的リン酸化と呼び、ミトコンドリア内膜の蛋白質や補酵素間で電子のやり取りを行うシステムを電子伝達系と呼びます。
電子伝達系は呼吸鎖とも呼ばれ、酸素の存在下に電子伝達体(NADHとFADH2)の再酸化によって大量のATPが合成されます。こうしてつくられたATPはミトコンドリアから細胞質へ出て行き、そこで細胞の活動に使われます。
NAD+の構造の中で酸化還元反応に関与しているのはニコチンアミドの部分です。酸化型のNAD+が水素と電子を受け取って還元型のNADHになります。(下図)

図;NAD+が水素(H+)と電子(e-)を受け取ってNADHになる(①)。NAD+は還元型基質から水素を受け取り(②)、その基質を酸化し、還元型のNADHとH+を生成する(③)。NADH+H+は、他の物質の還元に使われる(④)。
NAD+は、全ての真核生物と多くの古細菌、真正細菌で用いられる電子伝達体です。さまざまな脱水素酵素の補酵素として機能し、酸化型 (NAD+) および還元型 (NADH) の2つの状態を取ります。
NAD+は生物の酸化還元反応の多くにおいて必須成分(補酵素)であり、好気呼吸(酸化的リン酸化)の中心的な役割を担っています。
以上の化学反応から分かるように、絶食や飢餓で食物が入ってこないと、NADHの産生が減少し、NAD+/NADH比が上昇します。NAD+/NADH比の上昇を感知して活性化するのがサーチュインです。
サーチュイン(sirtuin)は長寿遺伝子として、酵母からヒトまで進化的によく保存された遺伝子です。サーチュイン(サーチュインファミリー)は食物不足(飢餓状態)の時に活性化される遺伝子群で、NAD依存性脱アセチル化酵素です。哺乳類では七つのサーチュイン(SIRT1~7)が存在し、SIRT1、 6、7は核内、SIRT3、4、5はミトコンドリア、SIRT2は細胞質に局在します。

これらのサーチュインは NAD(nicotinamide adenine dinucleotide)依存性の脱アセチル化酵素としての活性をもっています。つまり、細胞内のNAD+量が増えるとサーチュインの活性は更新します。
サーチュインによって活性が制御されているタンパク質としてヒストン、P53、FOXO、PGC1α、LKB1などがあり、細胞周期、代謝、抗酸化システム、オートファジーなどの細胞機能に影響します。
その結果、細胞老化や発がんを抑制し、寿命を延長する効果を発揮するのです。(下図)

図:サーチュインはNAD+/NADHの比率の変動を感知することによって、細胞内の栄養素の供給状況や物質代謝の状況を把握している(①)。絶食やカロリー制限などによって栄養素、特に糖が減少すると、NAD+が増え、サーチュイン(SIRT)が活性化する(②)。サーチュインは細胞質や核に存在するSIRT1(③)やミトコンドリアに存在するSIRT3(④)など7種類が知られている。サーチュインはタンパク質の脱アセチル化(アセチル基を除去する)によって様々な転写因子や酵素などの活性を調整する(⑤)。サーチュインによって活性が制御されているタンパク質としてヒストン、P53、FOXO、PGC1α、LKB1などがあり、細胞周期、代謝、抗酸化システム、オートファジーなどの細胞機能に影響する(⑥)。その結果、細胞老化や発がんを抑制し、寿命を延長する効果を発揮する(⑦)。
【AMP活性化プロテインキナーゼはエネルギー低下を感知して活性化される】
AMP活性化プロテインキナーゼ(AMPK)は細胞のエネルギー代謝を調節する因子として重要な役割を担っています。
AMPKは低グルコースや低酸素や虚血など細胞のATP供給が枯渇するようなストレスに応答して活性化されます。AMPKはmTORC1の活性を抑制することによってがん細胞の増殖を抑制する作用や寿命を延ばす作用があります。LKB1はセリン・スレオニンキナーゼで、AMP活性化プロテインキナーゼ(AMPK)をリン酸化して活性化します。
AMPKは触媒作用を持つαサブユニットと、調節作用を持つβサブユットとγサブユニットから構成されるヘテロ三量体として存在します。γサブユニットにはATPが結合していますが、ATPが枯渇してAMP/ATP比が上昇すると、γサブユニットに結合していたATPがAMPに置き換わります。その結果、アロステリック効果(酵素の立体構造が変化すること)によってこの複合体は中等度(2~10倍程度)に活性化され、上流に位置する主要なAMPKキナーゼ(AMPKをリン酸化して活性化する酵素)であるLKB1に対して親和性が高くなり、LKB1によってαサブユニットのスレオニン-172(Thr-172)がリン酸化されると、酵素活性は最大に活性化されます。
活性化したAMPKは異化を亢進してエネルギー産生を亢進し、物質合成を抑制するように代謝をシフトします。(図)
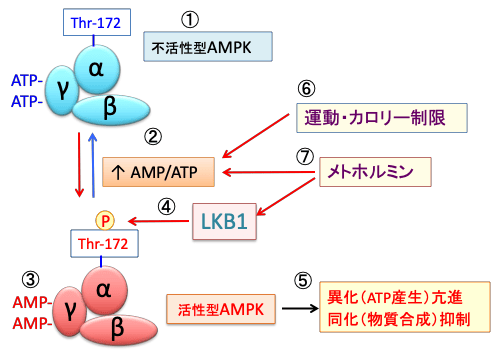
図:AMP活性化プロテインキナーゼ(AMPK)はα、β、γの3つサブユニットからなる(①)。細胞内のATPが減少しAMP/ATP比が上昇すると(②)、γサブユニットに結合していたATPがAMPに置換する(③)。これによってAMPKの構造変化が起こると、LKB1というリン酸化酵素の親和性が高まり、αサブユニットのスレオニン172がリン酸化されると、さらにAMPKの活性が高まる(④)。活性化したAMPKは異化を亢進してエネルギー産生を亢進し、物質合成を抑制するように代謝をシフトする(⑤)。運動やカロリー制限はATPを消費してAMP/ATP比を上昇してAMPKを活性化する。糖尿病治療薬のメトホルミンはミトコンドリアのATP産生を阻害する作用とLKB1を活性化する機序でAMPKを活性化する。
AMP活性化プロテインキナーゼ(AMPK)はミトファジー(ミトコンドリアの分解)を誘導し、ミトコンドリア新生を促進します。AMPKを活性化する薬として糖尿病治療薬のメトホルミンやブルーベリーに含まれるレスベラトロールやプテロスチルベンがあります。これらはミトコンドリアの品質を良くする効果が期待できます。運動やカロリー制限やケトン食や魚油(DHAやEPA)やビタミンD3もAMPKを活性化します。
AMPKとサーチュインを活性化すると体の老化を抑制し、寿命を延ばす効果があります。
【AMPKとサーチュインはPGC1-αを活性化してミトコンドリアを増やす】
ケトン食を実践するとき、ケトン体は肝臓や腎臓のミトコンドリアで作られます。従って、肝臓や腎臓のミトコンドリアの数を増やしたり、ミトコンドリアの活性を高めると、ケトン体産生量を増やすことができます。
細胞内でミトコンドリアが新しく発生することをミトコンドリア新生(Mitochondria Biogenesis)といいます。通常、既存のミトコンドリアが増大して分かれて増えていきます。
ミトコンドリア新生で最も重要な働きを担っているのが、PGC-1α(Peroxisome Proliferative activated receptor gamma coactivator-1α)です。日本語訳は「ペルオキシソーム増殖因子活性化受容体γコアクチベーター1α」です。
PGC-1αは転写因子のPPAR-γと結合して、PPAR-γの転写活性を高める因子として見つかりました。PGC-1αは核内受容体を中心とするさまざまな転写因子と結合し標的遺伝子の発現を制御する転写コアクチベーターです。骨格筋、心筋、脂肪、脳などの臓器においてミトコンドリアの生合成および酸化的リン酸化を促進するなど細胞のエネルギー産生を制御する役割が知られています。
運動すると骨格筋のPGC-1α量が増えます。運動や絶食やメトホルミンがAMP活性化プロテインキナーゼ(AMPK)を活性化し、AMPKはサーチュインを活性化して転写因子のPGC-1αとFOXOファミリータンパク質を活性化し、ミトコンドリア機能や代謝を制御することが知られています(下図)。

図:絶食やカロリー制限や運動は体内のエネルギー低下によってAMP/ATP比とNAD+/NADH比を高める(①)。AMP/ATP比の上昇はAMP活性化プロテインキナーゼ(AMPK)を活性化し(②)、NAD+/NADH比の上昇はサーチュイン1(Sirtuin 1)を活性化する(③)。サーチュイン1はセリン・スレオニン・キナーゼのLKB1を活性化し、LKB1はAMPKを活性化する(④)。LKB1はAMPKを活性化し(⑤)、AMPKはサーチュイン1を活性化する(⑥)。サーチュイン1はPGC-1αの活性を亢進する(⑦)。PGC-1αは、ミトコンドリア新生を亢進して数を増やし、脂肪酸β酸化やTCA回路や酸化的リン酸化などミトコンドリア機能を亢進する(⑧)。その結果、抗老化と寿命延長の効果を発揮する。
カロリー制限(栄養不良を伴わない低カロリー食事療法)で、霊長類を含む多岐にわたる生物種において老化を遅延させ、寿命を延長させることが知られていますが、このカロリー制限のときに活性化されて寿命延長と抗老化作用に関与するのがサーチュイン遺伝子です。
サーチュイン1はPGC-1αを脱アセチル化することによって活性化します。活性化したPGC-1αはミトコンドリア新生を亢進します。
サーチュイン1はAMPK(AMP活性化プロテインキナーゼ)やPPAP(ペルオキシソーム増殖因子活性化受容体)によって活性化されます。さらに絶食時に発現が亢進するFGF21というホルモンによっても活性化されます。
絶食やカロリー制限がミトコンドリアを増やす目的は、エネルギーが低下したので、細胞はエネルギー産生器官のミトコンドリアを増やそうとするためです。本当は食物摂取を増やすことが最善の解決策なのですが、食糧が手に入らなければ、自分でできることはエネルギー消費を減らし、エネルギー産生工場を増やすことが当面の対応というわけです。
ミトコンドリアを増やすために、AMP/ATP比の低下を感知して活性化されるAMP活性化プロテインキナーゼ(AMPK)と、NAD+/NADH比の増加を感知して活性化されるサーチュイン1の2つのメカニズムが作動し、PGC1-αが活性化されてミトコンドリアの数を増やし、機能を高めるのです。
このメカニズムを理解すれば、絶食やカロリー制限をしなくても、ミトコンドリアを増やせます。つまり、AMPKとサーチュインを活性化し、PGC-1αを活性化する化合物を使うと、それを達成できます。(下図)

図:絶食やカロリー制限や運動は体内のエネルギー低下によってAMP/ATP比とNAD+/NADH比を高める(①)。AMP/ATP比の上昇はAMP活性化プロテインキナーゼ(AMPK)を活性化し(②)、NAD+/NADH比の上昇はサーチュイン1(Sirtuin 1)を活性化する(③)。AMPKはサーチュイン1を活性化する(④)。サーチュイン1はPGC-1αの活性を亢進し(⑤)、PGC-1αはミトコンドリア新生を亢進して数を増やし、脂肪酸β酸化やTCA回路や酸化的リン酸化などミトコンドリア機能を亢進する(⑥)。その結果、抗老化と寿命延長の効果を発揮する(⑦)。メトホルミン、プテロスチルベン、ビタミンD3はAMPKを活性化する(⑧)。ニコチンアミド・モノヌクレオチド、ニコチンアミド・リボシドはサーチュイン1を活性化する(⑨)。ケトン体のβヒドロキシ酪酸とベザフィブラートはPGC1-αを活性化する(⑩)。これらを組み合わせて服用すると、絶食やカロリー制限をしなくてもミトコンドリアの数を増やし、機能を高めることができる。
【線維芽細胞増殖因子21(FGF21)は寿命を延ばす】
FGF21(Fibroblast growth factor 21;線維芽細胞増殖因子21)は他の線維芽細胞増殖因子と構造上の相同性を持っていますが、細胞増殖を促進する「増殖因子」としての活性はなく、糖や脂質代謝を制御するホルモン様作用を示すタンパク質です。肝臓・脂肪・筋肉・膵臓などで産生され、FGF21の主要な標的組織は肝・膵・脂肪組織と考えられています。
FGF21の生理的役割は、飢餓に対する適応と考えられています。空腹に反応して肝臓の脂質代謝が亢進し、さらにケトン体が産生されると、FGF21が放出されます。
FGF21を全身的に投与すると、血糖・中性脂肪が低下し、膵臓β細胞の機能が改善し、肥満と脂肪肝が改善し、アディポネクチンが増加し、心血管リスクファクターマーカーが減少するなどの効果が見られます。
FGF21はカロリー制限と同様の健康作用を発揮し、マウスの実験では寿命延長効果も認められています。FGF21は有望なカロリー制限類似薬と言えます。FDF21を過剰に発現するように遺伝子改変したトランスジェニックマウスは寿命が30%(オス)〜40%(メス)延びたという実験結果が報告されています。
FGF21は成長ホルモン(GH)/インスリン様増殖因子-1(IGF-1)シグナル伝達系を抑制します。成長ホルモン/インスリン様成長因子-1(IGF-1)シグナル伝達系の活性化は寿命を短縮することが明らかになっています。FGF21はこのシグナル伝達系を阻害することによって、健康作用を発揮し、寿命を延長する効果を発揮します。
ケトン食では血中FGF21が増加します。ケトン食が様々な健康作用を持つことは、FGF21を介してAMP活性化プロテインキナーゼ(AMPK)とサーチュイン1を活性化し、さらにサーチュイン1がPGC-1αを活性化して、ミトコンドリアを増やし、脂肪酸β酸化や酸化的リン酸化を亢進するというメカニズムが関与しています。(下図)

図:絶食とケトン食はPPARα(ペルオキシソーム増殖因子活性化受容体α)を活性化してFGF21の発現を亢進する。FGF21はLKB1を活性し、LKB1はAMPK(AMP活性化プロテインキナーゼ)を活性化、AMPKはサーチュイン1(Sirtuin1)を活性化する。サーチュイン1はPGC-1αを活性化し、PGC-1αはミトコンドリア新生を亢進し、ミトコンドリア機能を高める。
つまり、飢餓 → PPARα → FGF21 →LKB1 → AMPK → サーチュイン1 → PGC-1α→ ミトコンドリア新生という経路になります。この経路を活性化するものはミトコンドリア新生を亢進します。
【分子状水素はFGF21を誘導する】
分子状水素(水素ガス)がFGF21を活性化して、肥満や糖尿病を改善することが報告されています。以下のような報告があります。
Molecular hydrogen improves obesity and diabetes by inducing hepatic FGF21 and stimulating energy metabolism in db/db mice.(分子状水素は、db / dbマウスにおいて肝臓のFGF21を誘導し、エネルギー代謝を刺激することにより、肥満および糖尿病を改善する)Obesity (Silver Spring). 2011 Jul;19(7):1396-403.
【要旨】
水素ガスの吸入や水素を含有する水の飲用や注射によって分子状水素を体内に摂取することが、酸化ストレス関連疾患を改善する大きな可能性を有することが、最近の多くの研究で明らかになっている。しかしながら、体内での水素の動的な動きについてはほとんど知られていない。
まず、水素含有水の経口投与後に肝グリコーゲンが水素を蓄積し、短期間にわたる少量の水素の摂取でも様々な疾患モデルを効率的に改善する理由を説明する。
この知見は、グリコーゲン溶液が水素を保持するというインビトロ実験によって支持された。
次に、機能的レプチン受容体を欠くdb / db肥満モデルマウスを用いて2型糖尿病への水素含有水の随意飲水の効果を調べた。
水素含有水を飲むと肝臓の酸化ストレスが減少し、db / dbマウスの脂肪肝、および野生型マウスの高脂肪食誘導脂肪肝の実験モデルで、脂肪肝が有意に軽減された。
水素含有水の長期間の飲用は、食事と水の消費量が増加していないにもかかわらず、体重を有意に抑制した。
さらに、水素含有水を飲むと、血糖値、インスリン、中性脂肪値が低下した。この高血糖に対する効果は食事制限と同様であった。
水素含有水の飲用による肥満および代謝パラメータの改善効果の分子メカニズムを調べるために、遺伝子発現プロファイルを解析し、脂肪酸とグルコースの消費を促進する肝臓のホルモンである線維芽細胞成長因子21(FGF21)の発現亢進を認めた。
実際に、水素がエネルギー代謝を亢進することは、酸素消費量の測定で確認された。
今回の結果は、肥満と糖尿病とメタボリックシンドロームの改善における分子状水素の潜在的有益性を示唆している。
分子状水素(水素ガス)がFGF21の発現を亢進するのであれば、そのシグナル伝達系の下流に存在するサーチュイン1を活性化し、PGC-1αの発現を誘導する作用があるはずです。実際に分子状水素はPGC-1αの遺伝子発現を刺激して脂肪酸代謝を促進することが報告されています。
Molecular hydrogen stimulates the gene expression of transcriptional coactivator PGC-1α to enhance fatty acid metabolism(分子状水素は転写活性化因子PGC-1αの遺伝子発現を刺激して脂肪酸代謝を促進する)NPJ Aging Mech Dis. 2016; 2: 16008.
メカニズムは複雑でまだ不明な点も多いのですが、水素ガスはPPARα/FGF21/PGC-1αシグナル伝達系に作用してミトコンドリア新生を亢進し、ミトコンドリア機能を高める効果があるようです。これは、肥満と糖尿病とメタボリックシンドロームの改善における分子状水素の潜在的有益性を示唆しています。

図:水素ガスは肝臓のFGF21を介する機序でサーチュインを活性化し、PGC-1α(PPARγコアクチベーター1α)を活性化することが報告されている。PGC1αの活性化はミトコンドリアの数を増やし、機能を高めることができる。その結果、老化を抑制し、寿命を延ばす効果を発揮する。
【ミトコンドリア新生を亢進するとミトコンドリア機能異常を改善できる】
高脂血症治療薬のベザフィブラートはPPARを活性化し、ミトコンドリア新生を亢進するPPARγコアクチベーター-1α(PGC-1α)の発現を増強します。ベザフィブラートでミトコンドリア新生を亢進し、ミトコンドリア機能を活性化すると、ミトコンドリアの機能異常を是正できるという報告があります。
ミトコンドリアDNAの変異などでミトコンドリアの酸化的リン酸化の活性が低下した細胞にベザフィブラートを添加すると、ミトコンドリアの量が増え、ミトコンドリアのタンパク質の合成が亢進し、酸化的リン酸化活性が上昇し、ミトコンドリアにおけるATP産生能を亢進することが培養細胞や動物実験で報告されています。
ベザフィブラートはミトコンドリア新生を亢進するだけでなく、さらに異常なミトコンドリアの分解(ミトファジー)を亢進して、ミトコンドリアの品質を良くできます。
スペルミジンはオートファジーを亢進し、古くなったミトコンドリアの分解を促進します。
PGC-1αの発現と活性を高める方法として、カロリー制限や断食、メトホルミン、プテロスチルベン、ケトン体のβヒドロキシ酪酸、PPARのリガンドのベザフィブラート、NAD+を増やしサーチュイン1を活性化するニコチンアミド・モノヌクレオチドとニコチンアミド・リボシドなどがあります。
この様な方法を組み合わせてミトコンドリア新生とミトファジーを亢進すると、ミトコンドリアの品質をよくできます。その結果、体の老化を抑制し、寿命を延ばすことができます。(図) 
図:PPARの汎アゴニストのベザフィブラートや、AMP活性化プロテインキナーゼやサーチュイン1を活性化するカロリー制限、断食、メトホルミン、プテロスチルベン、ケトン体のβヒドロキシ酪酸、ニコチンアミド・リボシド、ニコチンアミド・モノヌクレオチドはPGC-1α(ペルオキシソーム増殖因子活性化受容体γコアクチベーター1α)を活性化する。PGC-1αはミトコンドリア新生を亢進して新しいミトコンドリアを増やし、ミトファジーを亢進して異常なミトコンドリアの分解を亢進する。スペルミジンはミトファジーを亢進する。これらを組み合わせると、ミトコンドリアの品質を良好に維持し、老化を抑制し寿命を延長できる。
以上のようなミトコンドリア新生を亢進する方法は、ミトコンドリアにおけるケトン体生成を促進して、ケトン体療法において内因性ケトーシスを高めることに役立ちます。
| « 853)ケトン体... | 855)ケトン体... » |



